《1.引言》
1.引言
在最近几十年中,与生物材料相关的组织工程研的羟基磷灰石生物陶瓷因为生物相容性和骨传导性好,被广泛用于人体植入物涂层[10–12]。羟基磷灰石(HA)是骨和牙组织的关键矿物成分,并且在晶格中具有多个究已取得了重要进展,多种形式的骨替代产品能够恢离子取代,包括CO32-、F-、Mg2+和Na+。这些取代不仅复、维持或改善器官功能[1]。预期寿命的增加促使科学家们将目光投向天然骨愈合过程和相关并发症。由于组织工程化骨组织具有无限供应和无疾病传播风险的特性,其已有望替代常规骨移植物用于骨修复[2,3]。骨组织工程主要是结合细胞治疗和生物材料(包括陶瓷以及具有不同机械性能、降解速度和化学功能的不可降解和可生物降解的聚合物),诱导功能性骨再生[4–9]。合成改变羟基磷灰石结构的空间群、形态、稳定性和机械性能,而且对于骨细胞的生物反应也很重要。例如,碳酸盐(CO32-)促进磷灰石晶体的生长,而镁(Mg)通过在成骨早期阶段刺激成骨细胞增殖来促进骨代谢,这一点可通过观察到因Mg缺失导致骨脆性和骨损失加以证实[13]。Mg含量低的磷灰石和磷酸钙植入材料[即掺镁羟基磷灰石(MgHA)]以及具有Mg和B型碳酸盐共取代的仿生材料(即磷酸盐的取代)可增强羟基磷灰石结构的生物活性[14]。对这些纳米生物材料支架结构的纳米级控制使我们能更好地了解各种细胞类型对生物材料形态构造的特异敏感性,从而使这些生物材料在蛋白质和生长因子的修饰下,诱导复杂的多组织再生[15]。
干细胞归巢法涉及间充质干细胞定向趋化迁移(募集)至受伤组织,利于体内骨再生,从而吸引了基于支架的组织工程研究者的兴趣。归巢因子,如共价结合或吸收到生物陶瓷或聚合物支架中的趋化因子、选择素和整合素实际上可以促进间充质干细胞作为骨祖细胞参与骨再生过程[16–18]。纤连蛋白(I、II、III型)是细胞外基质中的主要糖蛋白和细胞表面分子整合素家族的成员,其参与多种细胞事件,如细胞黏附、生长、迁移和成骨细胞的分化。III型纤连蛋白具有含Arg-Gly-Asp(RGD)基序的中心细胞结合结构域,这个特定域赋予细胞黏附[19]。含有RGD基序的特定肽序列通常用于增强整合素介导的细胞黏附。
在本研究中,我们报道了用两种趋化/趋触因子人纤连蛋白片段III1-C(FFIII1-C)或肽序列Gly-Arg-Gly-Asp-Ser-Pro-Lys(一种能够结合整合素跨膜受体的纤连蛋白类似物)涂覆掺镁羟基磷灰石盘的初步研究结果。通过双功能间隔区氨基丙基三乙氧基硅烷(APTES)共价锚定这些因子,防止它们代谢和从植入部位迁移出来,并且能够对这些生物分子的空间定向进行严格控制。为了探索这些模拟肽序列接枝掺镁羟基磷灰石是否能调节间充质干细胞的归巢,从而诱导细胞迁移到特定部位,我们进行了初步体外研究。
《2.材料和方法》
2.材料和方法
研究所用商业溶剂和试剂未进一步纯化。FFIII1-C和Gly-Arg-Gly-Asp-Ser-Pro-Lys肽序列来自Sigma Aldrich。按照先前报道的方法合成掺镁羟基磷灰石[14]。应用2.5×105 kPa的等静压将掺镁羟基磷灰石粉末压成盘状(直径:8.0 mm;高度:3.0 mm;质量:300 mg),并在室温下储存于真空干燥器中。以镍过滤的CuKα辐射,使用Bruker D8 Advance衍射仪进行X射线衍射(XRD)分析。将得到的衍射峰值与粉末衍射标准联合委员会(JCPDS)数据库中的衍射峰值进行对比。在运行于15 kV的FEI Quanta FEG 450仪器上进行扫描电子显微镜分析。使用JEOL JEM 2010透射电子显微镜(LaB6电子枪)在200 kV下进行透射电子显微镜分析。使用Gatan 794多扫描CCD照相机获得数字图像。使用TA Q500仪器在100~1000℃的温度下,在氮气环境中以10℃·min–1 的速度进行热重分析。应用傅里叶变换红外光谱仪(Perkin-Elmer 2000)进行基于KBr的粒料的红外分析。以Thermo Nicolet Evolution 500分光光度计分析UV光谱。以双功能化盘和非功能化盘中的所有掺镁羟基磷灰石功能化合成物作为对照。
所有细胞处理程序在无菌层流罩中进行。培养的细胞在37℃下用5%CO2孵育。
《2.1.掺镁羟基磷灰石–氨基丙基三乙氧基硅烷(MgHA-APTES)盘的合成》
2.1.掺镁羟基磷灰石–氨基丙基三乙氧基硅烷(MgHA-APTES)盘的合成
将APTES用无水己烷溶解制成浓度为1mol·L–1的溶液,然后将掺镁羟基磷灰石盘浸入该溶液中,同时在室温下搅拌3 h以完成MgHA-APTES盘的合成。用己烷洗涤样品,并进一步在40℃真空干燥24 h。通过分析暴露在MgHA-APTES盘表面上的游离氨基(—NH2)的浓度(Kaiser试验)来评价接枝到盘上的APTES的量。
《2.2.MgHA-APTES-CFF 盘的合成》
2.2.MgHA-APTES-CFF 盘的合成
合成方法与上述功能化处理程序相似,用溶有FFIII1-C(10 μmol·L–1或100 μmol·L–1)的磷酸盐缓冲溶液(PBS,50 μL或500 μL)处理MgHA-APTES盘,用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl,0.0014 μmol或0.014 μmol)和N-羟基琥珀酰亚胺(NHS,0.0014 μmol或0.014 μmol)在37℃下活化3 h。功能化MgHA-APTES-CFF盘后,用磷酸缓冲盐溶液(PBS)洗涤MgHA-APTES-CFF10(趋化因子:纤连蛋白,纤连蛋白浓度为10 μmol·L–1)和MgHA-APTES-CFF100(纤连蛋白浓度为100 μmol·L–1)10 min,并进一步在37℃下真空干燥24 h。应用核磁共振(NMR)光谱评估结合到MgHA-APTES表面上的纤连蛋白的量。
《2.3.MgHA-APTES-CFP盘的合成》
2.3.MgHA-APTES-CFP盘的合成
MgHA-APTES盘与PBS溶液中的Gly-Arg-Gly-Asp-Ser-Pro-Lys肽序列(10 μmol·L–1或100 μmol·L–1,50μL或500μL)相互作用,用EDC·HCl(0.0138 μmol或0.138 μmol)和NHS(0.0138 μmol或0.138 μmol)在37℃下活化3h。样品功能化后,用PBS洗涤MgHA-APT-ES-CFP10(趋化因子:肽,肽序列浓度为10 μmol·L–1)和MgHA-APTES-CFP100(肽序列浓度为100 μmol·L–1)样品10 min,并进一步在37℃下真空干燥24h。通过应用NMR光谱测量洗涤溶液中的有机功能团,评估结合到MgHA-APTES表面上的肽量差异。
《2.4.初步体外实验》
2.4.初步体外实验
将小鼠间充质干细胞(C57BL/6,Gibco)培养于含有10%胎牛血清(FBS)和1%青霉素–链霉素(100 μg·mL–1/100 U·mL–1)的Dulbecco改良Eagle培养基(DMEM)(Gibco,GlutaMAX细胞培养添加剂)中,细胞在37℃、5%CO2的条件下培养。使用Tripsinization从培养瓶中分离细胞,并将分离的细胞进一步离心、重悬浮。以台盼蓝染色法检测细胞数量和活力。
每个掺镁羟基磷灰石盘用PBS洗涤3次,每次10min。空气干燥的样品在层流罩中通过UV灭菌20min。将个体样品置于24孔板的单独孔中。将间充质干细胞(5.0×103)接种在与掺镁羟基磷灰石盘直接接触的8.0 μm孔径(聚对苯二甲酸乙二醇酯膜,Corning)的24孔插入式细胞培养板中。
我们在PBS中制备了5 mg·mL–1的3-(4,5-二甲基-2-噻唑基)-2,5-二苯基溴化四唑(MTT,Invitrogen)试剂。培养3d后,将插入式细胞培养板移至新培养板,并在37℃下500 μg·mL–1MTT中温育2 h。收集培养基,将细胞与1 mL二甲基亚砜孵育15 min。在MTT试剂中,代谢活性细胞与四唑盐发生反应形成蓝紫色结晶甲瓒。使用MultiskanFC微孔板光度计(Thermo Scientific公司生产,λmax=570 nm)检测与代谢活性细胞的数量相关的吸光度值[20]。
《3.结果与讨论》
3.结果与讨论
《3.1.MgHA-APTES盘的合成》
3.1.MgHA-APTES盘的合成
掺镁羟基磷灰石盘上的趋化/趋触因子对间充质干细胞归巢能力的影响涉及APTES在无水己烷中的接枝。通过表面—OH基团与从水解的APTES获得的硅烷醇之间发生偶联反应,完成APTES表面功能化,从而允许插入本研究使用的肽固化所需的氨基(图1)。
《图1》
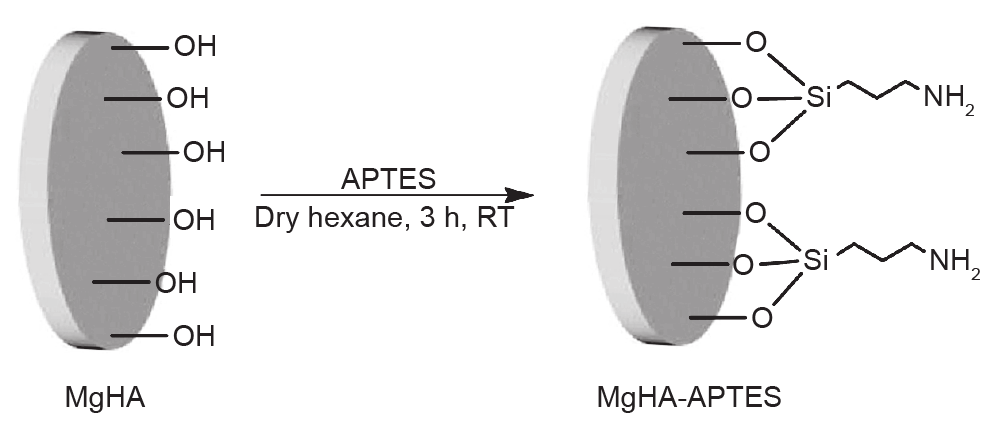
图1. MgHA-APTES盘的合成。
在茚三酮反应(Kaiser试验)后,通过分光光度法定量评价在硅烷化过程之后插入的氨基量。MgHA-APTES盘经己烷洗涤并干燥后的—NH负载量为0.11 mmol·g–1。直接在掺镁羟基磷灰石和MgHA-APTES盘上完成X射线衍射分析。如图2所示,掺镁羟基磷灰石样品的结晶度由两个样品在26°、30°~34°、40°和46°~53°(2θ)出现的特征衍射峰确定,其对应于(002)、(211)、(112)、(300)、(202)、(310)、(222)、(213)和(004)羟基磷灰石结晶的反射面(PDF 09-0432)。
《图2》

图2. 掺镁羟基磷灰石和MgHA-APTES盘的X射线衍射(XRD)光谱。
使用扫描电子显微镜和透射电子显微镜表征掺镁羟基磷灰石样品的表面形态;在表面硅烷化化学处理之后,掺镁羟基磷灰石未发生明显的形态改变(图3和图4)。
《图3》

图3. 掺镁羟基磷灰石(a)和MgHA-APTES(b)样品的扫描电子显微镜图。
《图4》

图4. 掺镁羟基磷灰石(a)和MgHA-APTES(b)样品的透射电子显微镜图。
《3.2.MgHA-APTES盘与间充质干细胞归巢因子的相关性》
3.2.MgHA-APTES盘与间充质干细胞归巢因子的相关性
通过暴露于MgHA-APTES盘表面的氨基与肽序列羧基功能化之间的经典偶联反应(该反应以EDC/NHS作为偶联剂),完成了接枝于掺镁羟基磷灰石上的细胞归巢因子FFIII1-C或Gly-Arg-Gly-Asp-Ser-Pro-Lys肽序列的固化(图5)。为了检测细胞归巢因子浓度对细胞归巢行为的影响,实验用FFIII1-C和肽序列的负载浓度为10 μmol·L–1或100 μmol·L–1,从而制备出两种肽接枝样品MgHA-APTES-CFP10和MgHA-APTES-CFP100,以及两种纤连蛋白/羟基磷灰石复合物样品MgHA-APTES-CFF10和MgHA-APTES-CFF100。
《图5》
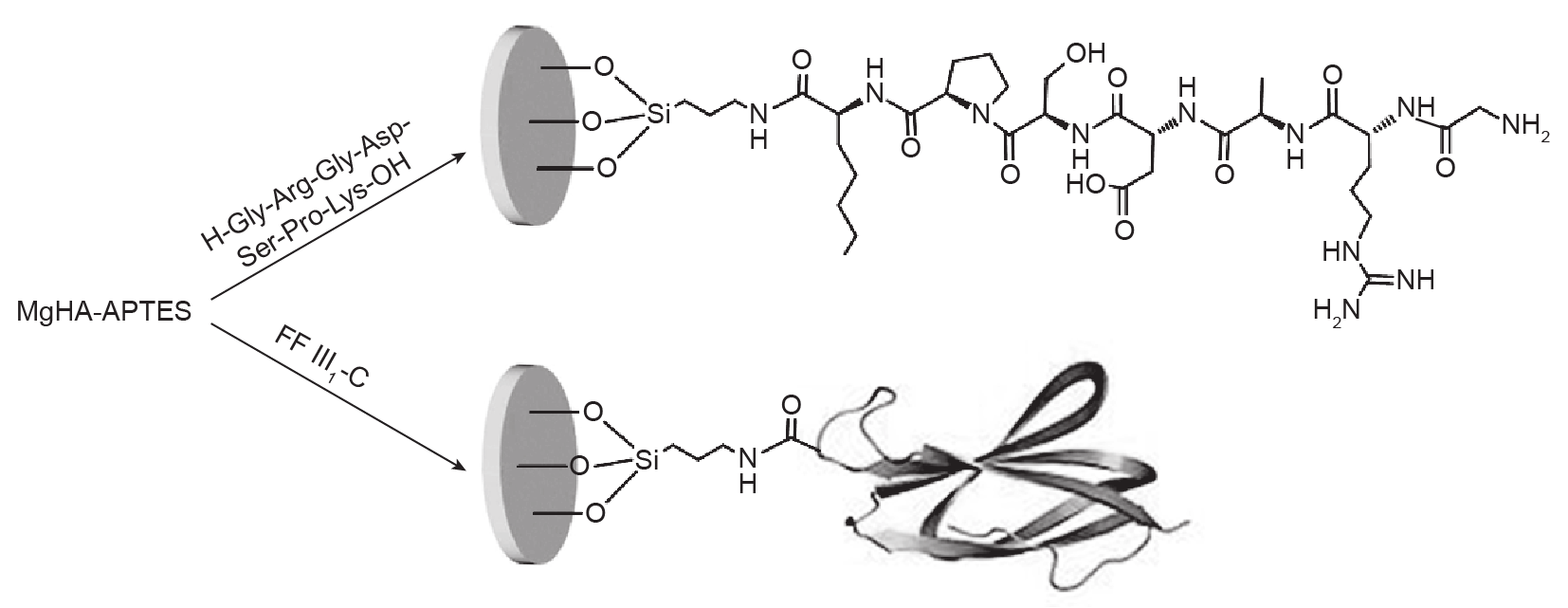
图5. MgHA-APTES-CFP 与MgHA-APTES-CFF的合成。
应用热重分析确定在功能化材料上的额外有机基团,从而检测功能化反应的有效性。图6展示了掺镁羟基磷灰石、MgHA-APTES、MgHA-APTES-CFP100和MgHA-APTES-CFF100样品的质量与温度变化关系的热重分析结果。在500℃惰性气氛下质量损失百分比反映的每个样品的功能化程度揭示了掺镁羟基磷灰石盘表面有机质的增加。与前体掺镁羟基磷灰石样品相比,MgHA-APTES有5%的质量损失,而肽接枝样品的质量损失更高,MgHA-APTES-CFP100为8%、MgHA-APT-ES-CFF100为10%。
《图6》
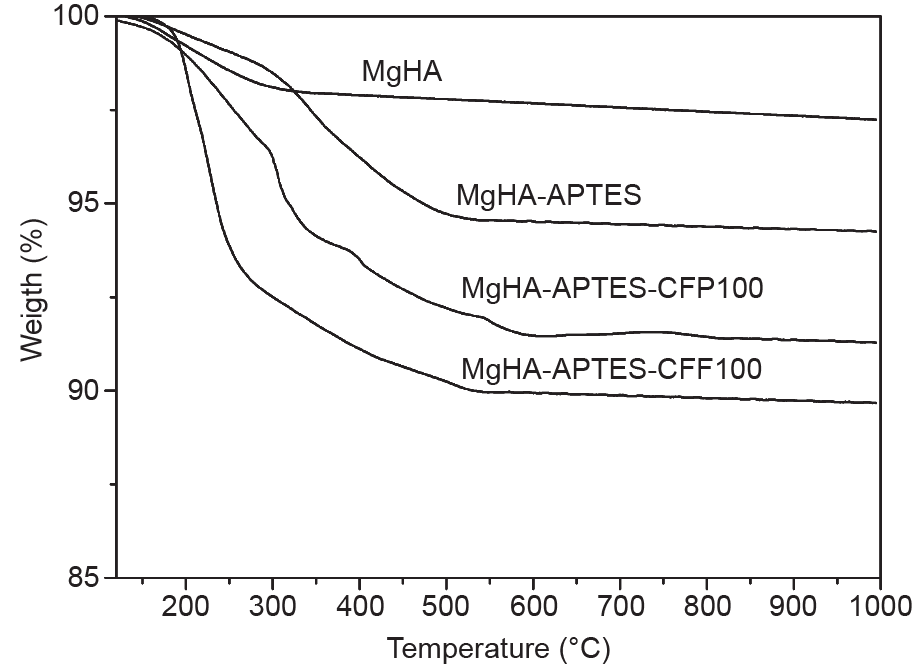
图6. 掺镁羟基磷灰石、MgHA-APTES、MgHA-APTES-CFP100和MgHA-APTES-CFF100样品的热重分析曲线。
应用傅里叶变换红外光谱分析进一步表征掺镁羟基磷灰石盘与肽序列的共价生物功能化。图7为非功能化掺镁羟基磷灰石、MgHA-APTES和MgHA-APTES-CFF100样品的傅里叶变换红外光谱。傅里叶变换红外光谱显示了556 cm–1、596 cm–1和1017 cm–1的磷酸盐基质吸收峰。在MgHA-APTES样品中,在2930 cm–1(来自—CH2伸缩)及1560 cm–1和1460 cm–1(由于脂肪族伯胺的N—H弯曲)处有额外的新光谱带。在MgHA-APTES-CFF100样品中,可观察到在1640 cm–1处的额外吸收峰(由于C=O振动)。此外,在3440 cm–1存在吸收峰的原因在于肽部分的功能团的O—H振动和N—H伸缩。
《图7》
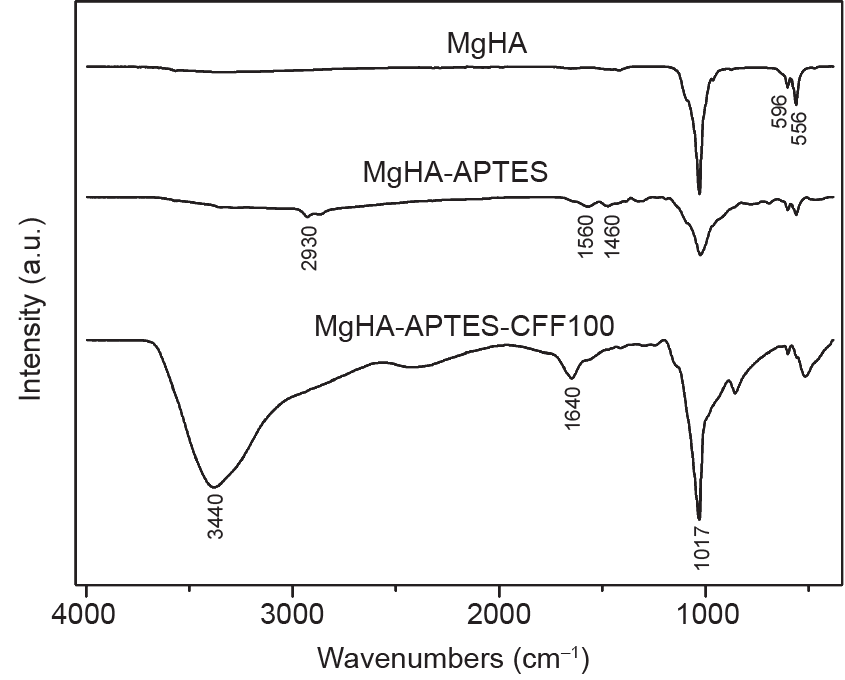
图7. 掺镁羟基磷灰石、MgHA-APTES和MgHA-APTES-CFF100的傅里叶变换红外光谱。
《3.3. 体外生物学初步评价结果》
3.3. 体外生物学初步评价结果
接种后3d,应用MTT法检测小鼠间充质干细胞活力(图8)。接种到插入式细胞培养板中,并与MgHA-CFP和MgHA-CFF盘直接接触的代谢活性间充质干细胞的细胞数量,较未功能化的掺镁羟基磷灰石盘和只进行细胞培养的2组有所降低,从而表明间充质干细胞在趋化/趋触因子的作用下,产生插入式细胞培养板迁移至掺镁羟基磷灰石盘的归巢行为。
《图8》
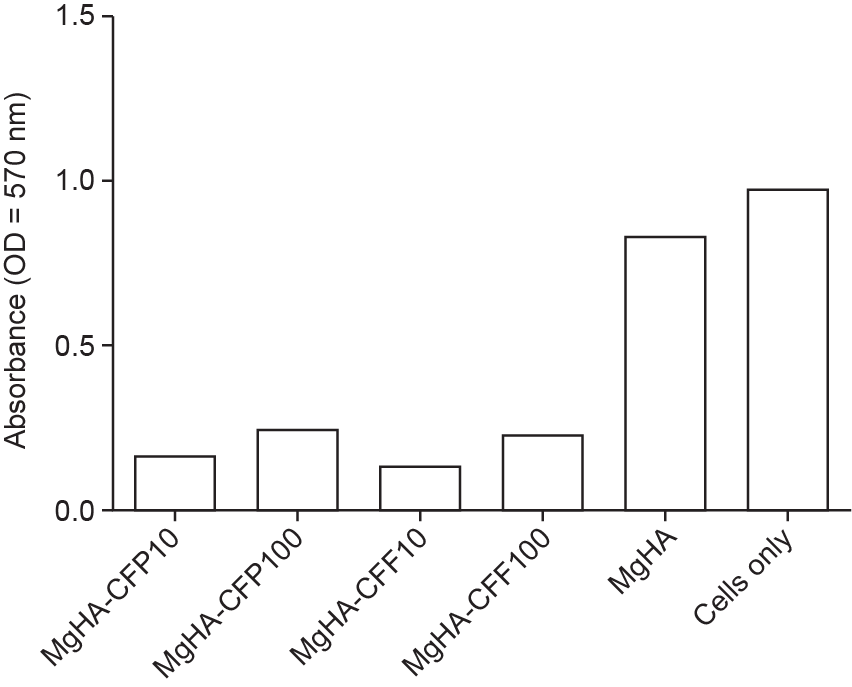
图8. 接种后3d,应用MTT法检测接种到插入式细胞培养板中,并与MgHA-CFP和MgHA-CFF盘直接接触的小鼠间充质干细胞活力。仅细 胞培养组为对照组。
这项研究聚焦于众所周知的骨传导性掺镁羟基磷灰石和细胞的归巢刺激。目前公认的是,在特定的病理条件下,特别是与衰老相关的变化(如骨质疏松部位),内源性间充质干细胞的数量急剧减少。因此,有必要将间充质干细胞吸引到特定的、需要修复的解剖部位。无论是否结合生物材料(如水泥、颗粒和3D支架),目前的药物治疗仍不能完成恢复患者的活动能力和生活质量,且社会成本较高。本研究所提出的骨组织工程使移植特定基序,从而促进间充质干细胞向掺镁羟基磷灰石归巢,成为可能。本研究制备的功能化生物材料在促进内源性间充质干细胞迁移,为特定骨细胞(即成骨细胞)的黏附、增殖、分化提供合适的环境,从而更好地应用于骨科疾病的复杂治疗提供了坚实基础。
《4. 结论》
4. 结论
为了探讨掺镁羟基磷灰石上接枝模拟肽序列是否可以调节间充质干细胞归巢,我们研究了两种趋化/趋触因子(FFIII1-C或Gly-Arg-Gly-Asp-Ser-Pro-Lys肽序列)的掺镁羟基磷灰石盘的接枝/复合。研究应用APTES,将细胞归巢因子以10 μmol·L–1或100 μmol·L–1的浓度共价连接到掺镁羟基磷灰石盘表面。MTT法检测小鼠间充质干细胞活力的初步生物学评价表明,在细胞归巢刺激因子的作用下,干细胞从插入式细胞培养板迁移至掺镁羟基磷灰石盘。虽然本研究未进行间充质干细胞归巢相关生物分子通路的研究,但此次初步研究成果为实现骨组织再生治疗的临床转化提供了新机会。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Alessandro Pistone, Daniela Iannazzo, Claudia Espro, Signorino Galvagno, Anna Tampieri, Monica Montesi, Silvia Panseri, and Monica Sandri declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




