参考文献
[ 1 ]
Klein G. The extracellular matrix of the hematopoietic microenvironment. Experientia 1995;51(9):914–26
链接1
[ 2 ]
Shirato I, Tomino Y, Koide H, Sakai T. Fine structure of the glomerular basement membrane of the rat kidney visualized by high-resolution scanning electron microscopy. Cell Tissue Res 1991;266(1):1–10
链接1
[ 3 ]
Hironaka K, Makino H, Yamasaki Y, Ota Z. Renal basement membranes by ultrahigh resolution scanning electron microscopy. Kidney Int 1993;43(2):334–45
链接1
[ 4 ]
Abrams GA, Schaus SS, Goodman SL, Nealey PF, Murphy CJ. Nanoscale topography of the corneal epithelial basement membrane and Descemet’s membrane of the human. Cornea 2000;19(1):57–64
链接1
[ 5 ]
Liliensiek SJ, Nealey P, Murphy CJ. Characterization of endothelial basement membrane nanotopography in rhesus macaque as a guide for vessel tissue engineering. Tissue Eng Part A 2009;15(9):2643–51
链接1
[ 6 ]
Kim J, Kim HN, Lim KT, Kim Y, Seonwoo H, Park SH, et alDesigning nanotopographical density of extracellular matrix for controlled morphology and function of human mesenchymal stem cells. Sci Rep 2013;3:3552
链接1
[ 7 ]
Suki B, Sato S, Parameswaran H, Szabari MV, Takahashi A, Bartolák-Suki E. Emphysema and mechanical stress-induced lung remodeling. Physiology 2013;28(6):404–13
链接1
[ 8 ]
Shvedova AA, Kisin ER, Mercer R, Murray AR, Johnson VJ, Potapovich AI, et alUnusual inflammatory and fibrogenic pulmonary responses to single-walled carbon nanotubes in mice. Am J Physiol Lung Cell Mol Physiol 2005;289(5):L698–708
链接1
[ 9 ]
Mwenifumbo S, Stevens MM. ECM interactions with cells from the macro- to nanoscale. In: Gonsalves KE, Halberstadt CR, Laurencin CT and Nair LS, editors Biomedical nanostructures. New York: John Wiley & Sons, Inc.; 2008. p. 225–60.
[10]
Silver FH, Freeman JW, Seehra GP. Collagen self-assembly and the development of tendon mechanical properties. J Biomech 2003;36(10):1529–53
链接1
[11]
Gon?alves CA, Figueiredo MH, Bairos VA. Three-dimensional organization of the elastic fibres in the rat lung. Anat Rec 1995;243(1):63–70
链接1
[12]
Ma Z, Ramakrishna S. Nanostructured extracellular matrix. Enc Nanosci Nanotechnol 2004;7:641–55.
[13]
Discher DE, Mooney DJ, Zandstra PW. Growth factors, matrices, and forces combine and control stem cells. Science 2009;324(5935):1673–7
链接1
[14]
Nemir S, West JL. Synthetic materials in the study of cell response to substrate rigidity. Ann Biomed Eng 2010;38(1):2–20
链接1
[15]
Cox TR, Erler JT. Remodeling and homeostasis of the extracellular matrix: implications for fibrotic diseases and cancer. Dis Model Mech 2011;4(2):165–78
链接1
[16]
Gong H, Freddo TF, Johnson M. Age-related changes of sulfated proteoglycans in the normal human trabecular meshwork. Exp Eye Res 1992;55(5):691–709
链接1
[17]
Orr AW, Helmke BP, Blackman BR, Schwartz MA. Mechanisms of mechanotransduction. Dev Cell 2006;10(1):11–20
链接1
[18]
Wozniak MA, Chen CS. Mechanotransduction in development: a growing role for contractility. Nat Rev Mol Cell Biol 2009;10(1):34–43
链接1
[19]
Moore SW, Sheetz MP. Biophysics of substrate interaction: influence on neural motility, differentiation, and repair. Dev Neurobiol 2011;71(11):1090–101
链接1
[20]
Liu J, Tan Y, Zhang H, Zhang Y, Xu P, Chen J, et al. Soft fibrin gels promote selection and growth of tumorigenic cells. Nat Mater 2012;11(8):734–41
链接1
[21]
Paszek MJ, Zahir N, Johnson KR, Lakins JN, Rozenberg GI, Gefen A, et alTensional homeostasis and the malignant phenotype. Cancer Cell 2005;8(3):241–54
链接1
[22]
Parameswaran H, Majumdar A, Suki B. Linking microscopic spatial patterns of tissue destruction in emphysema to macroscopic decline in stiffness using a 3D computational model. PLOS Comput Biol 2011;7(4):e1001125
链接1
[23]
Booth AJ, Hadley R, Cornett AM, Dreffs AA, Matthes SA, Tsui JL, et alAcellular normal and fibrotic human lung matrices as a culture system for in vitro investigation. Am J Resp Crit Care 2012;186(9):866–76
链接1
[24]
Liu F, Mih JD, Shea BS, Kho AT, Sharif AS, Tager AM, et alFeedback amplification of fibrosis through matrix stiffening and COX-2 suppression. J Cell Biol 2010;190(4):693–706
链接1
[25]
Marinkovi? A, Mih JD, Park JA, Liu F, Tschumperlin DJ. Improved throughput traction microscopy reveals pivotal role for matrix stiffness in fibroblast contractility and TGF-β responsiveness. Am J Physiol Lung Cell Mol Physiol 2012;303(3):169–80
链接1
[26]
Alenghat FJ, Ingber DE. Mechanotransduction: all signals point to cytoskeleton, matrix, and integrins. Sci STKE 2002;2002(119):pe6
链接1
[27]
Pelham RJ, Wang Y. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci USA 1997;94(25):13661–5
链接1
[28]
Engler AJ, Sen S, Sweeney HL, Discher DE. Matrix elasticity directs stem cell lineage specification. Cell 2006;126(4):677–89
链接1
[29]
Chowdhury F, Na S, Li D, Poh Y, Tanaka T, Wang F, et alMaterial properties of the cell dictate stress-induced spreading and differentiation in embryonic stem cells. Nat Mater 2010;9(1):82–8
链接1
[30]
Huebsch N, Arany PR, Mao AS, Shvartsman D, Ali OA, Bencherif SA, et alHarnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat Mater 2010;9(6):518–26
链接1
[31]
Holst J, Watson S, Lord MS, Eamegdool SS, Bax DV, Nivison-Smith LB, et alSubstrate elasticity provides mechanical signals for the expansion of hemopoietic stem and progenitor cells. Nat Biotechnol 2010;28(10):1123–8
链接1
[32]
Gilbert PM, Havenstrite KL, Magnusson KE, Sacco A, Leonardi NA, Kraft P, et alSubstrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science 2010;329(5995):1078–81
链接1
[33]
Engler AJ, Griffin MA, Sen S, Boennemann CG, Sweeney HL, Discher DE. Myotubes differentiate optimally on substrates with tissue-like stiffness: pathological implications for soft or stiff microenvironments. J Cell Biol 2004;166(6):877–87
链接1
[34]
Silva GA, Czeisler C, Niece KL, Beniash E, Harrington DA, Kessler JA, et alSelective differentiation of neural progenitor cells by high-epitope density nanofibers. Science 2004;303(5662):1352–5
链接1
[35]
Yim EKF, Pang SW, Leong KW. Synthetic nanostructures inducing differentiation of human mesenchymal stem cells into neuronal lineage. Exp Cell Res 2007;313(9):1820–9
链接1
[36]
Dalby MJ, Gadegaard N, Tare R, Andar A, Riehle MO, Herzyk P, et alThe control of human mesenchymal cell differentiation using nanoscale symmetry and disorder. Nat Mater 2007;6(12):997–1003
链接1
[37]
Oh S, Brammer KS, Li YSJ, Teng D, Engler AJ, Chien S, et alStem cell fate dictated solely by altered nanotube dimension. Proc Natl Acad Sci USA 2009;106(7):2130–5
链接1
[38]
Brunetti V, Maiorano G, Rizzello L, Sorce B, Sabella S, Cingolani R, et alNeurons sense nanoscale roughness with nanometer sensitivity. Proc Natl Acad Sci USA 2010;107(14):6264–9
链接1
[39]
McMurray R, Gadegaard N, Tsimbouri P, Burgess K, McNamara L, Tare R, et alNanoscale surfaces for the long-term maintenance of mesenchymal stem cell phenotype and multipotency. Nat Mater 2011;10(8):637–44
链接1
[40]
Lee MR, Kwon KW, Jung H, Kim HN, Suh KY, Kim K, et alDirect differentiation of human embryonic stem cells into selective neurons on nanoscale ridge/groove pattern arrays. Biomaterials 2010;31(15):4360–6
链接1
[41]
Moe AAK, Suryana M, Marcy G, Lim SK, Ankam S, Goh JZW, et alMicroarray with micro- and nano-topographies enables identification of the optimal topography for directing the differentiation of primary murine neural progenitor cells. Small 2012;8(19):3050–61
链接1
[42]
Dang JM, Leong KW. Myogenic induction of aligned mesenchymal stem cell sheets by culture on thermally responsive electrospun nanofibers. Adv Mater 2007;19(19):2775–9
链接1
[43]
Discher DE, Janmey P, Wang Y. Tissue cells feel and respond to the stiffness of their substrate. Science 2005;310(5751):1139–43
链接1
[44]
Guilak F, Cohen DM, Estes BT, Gimble JM, Liedtke W, Chen CS. Control of stem cell fate by physical interactions with the extracellular matrix. Cell Stem Cell 2009;5(1):17–26
链接1
[45]
Flemming RG, Murphy CJ, Abrams GA, Goodman SL, Nealey PF. Effects of synthetic micro- and nano-structured surfaces on cell behavior. Biomaterials 1999;20(6):573–88
链接1
[46]
Stevens MM, George JH. Exploring and engineering the cell surface interface. Science 2005;310(5751):1135–8
链接1
[47]
Yang Y, Leong KW. Nanoscale surfacing for regenerative medicine. Wiley Interdiscip Rev Nanomed Nanobiotechnol 2010;2(5):478–95
链接1
[48]
Kim DH, Provenzano PP, Smith CL, Levchenko A. Matrix nanotopography as a regulator of cell function. J Cell Biol 2012;197(3):351–60
链接1
[49]
Dalby MJ, Gadegaard N, Oreffo RO. Harnessing nanotopography and integrin-matrix interactions to influence stem cell fate. Nat Mater 2014;13(6):558–69
链接1
[50]
Nguyen AT, Sathe SR, Yim EK. From nano to micro: topographical scale and its impact on cell adhesion, morphology and contact guidance. J Phys Condens Matter 2016;28(18):183001
链接1
[51]
Janson IA, Putnam AJ. Extracellular matrix elasticity and topography: material-based cues that affect cell function via conserved mechanisms. J Biomed Mater Res A 2015;103(3):1246–58
链接1
[52]
Elastic moduli data for polycrystalline ceramics [Internet].Gaithersburg: National Institute of Standards and Technology. c2017 [cited 2017 Jan 8]. Available from: https://srdata.nist.gov/CeramicDataPortal/elasticity/TiO2.
[53]
Halliday D, Resnick R, Walker J. Fundamentals of physics. 6th ed.New York: John Wiley & Sons, Inc.; 2000.
[54]
Sahin O, Magonov S, Su C, Quate CF, Solgaard O. An atomic force microscope tip designed to measure time-varying nanomechanical forces. Nat Nanotechnol 2007;2(8):507–14
链接1
[55]
Leung L, Chan C, Baek S, Naguib H. Comparison of morphology and mechanical properties of PLGA bioscaffolds. Biomed Mater 2008;3(2):025006
链接1
[56]
Yang Y, Kulangara K, Lam RTS, Dharmawan R, Leong KW. Effects of topographical and mechanical property alterations induced by oxygen plasma modification on stem cell behavior. ACS Nano 2012;6(10):8591–8
链接1
[57]
Kong HJ, Polte TR, Alsberg E, Mooney DJ. FRET measurements of cell-traction forces and nano-scale clustering of adhesion ligands varied by substrate stiffness. Proc Natl Acad Sci USA 2005;102(12):4300–5
链接1
[58]
Guo W, Frey MT, Burnham NA, Wang Y. Substrate rigidity regulates the formation and maintenance of tissues. Biophys J 2006;90(6):2213–20
链接1
[59]
Khatiwala CB, Peyton SR, Putnam AJ. Intrinsic mechanical properties of the extracellular matrix affect the behavior of pre-osteoblastic MC3T3-E1 cells. Am J Physiol Cell Physiol 2006;290(6):C1640–50
链接1
[60]
Solon J, Levental I, Sengupta K, Georges PC, Janmey PA. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophys J 2007;93(12):4453–61
链接1
[61]
Wang H, Dembo M, Wang Y. Substrate flexibility regulates growth and apoptosis of normal but not transformed cells. Am J Physiol Cell Physiol 2000;279(5):C1345–50.
[62]
Engler AJ, Richert L, Wong JY, Picart C, Discher DE. Surface probe measurements of the elasticity of sectioned tissue, thin gels and polyelectrolyte multilayer films: correlations between substrate stiffness and cell adhesion. Surf Sci 2004;570(1–2):142–54
链接1
[63]
Yeung T, Georges PC, Flanagan LA, Marg B, Ortiz M, Funaki M, et alEffects of substrate stiffness on cell morphology, cytoskeletal structure, and adhesion. Cell Motil Cytoskeleton 2005;60(1):24–34
链接1
[64]
Brown XQ, Ookawa K, Wong JY. Evaluation of polydimethylsiloxane scaffolds with physiologically-relevant elastic moduli: interplay of substrate mechanics and surface chemistry effects on vascular smooth muscle cell response. Biomaterials 2005;26(16):3123–9
链接1
[65]
Collin O, Tracqui P, Stephanou A, Usson Y, Clément-Lacroix J, Planus E. Spatiotemporal dynamics of actin-rich adhesion microdomains: influence of substrate flexibility. J Cell Sci 2006;119(9):1914–25
链接1
[66]
Reinhart-King CA, Dembo M, Hammer DA. Cell-cell mechanical communication through compliant substrates. Biophys J 2008;95(12):6044–51
链接1
[67]
Rowlands AS, George PA, Cooper-White JJ. Directing osteogenic and myogenic differentiation of MSCs: interplay of stiffness and adhesive ligand presentation. Am J Physiol Cell Physiol 2008;295(4):C1037–44
链接1
[68]
Georges PC, Miller WJ, Meaney DF, Sawyer ES, Janmey PA. Matrices with compliance comparable to that of brain tissue select neuronal over glial growth in mixed cortical cultures. Biophys J 2006;90(8):3012–8
链接1
[69]
Wong JY, Velasco A, Rajagopalan P, Pham Q. Directed movement of vascular smooth muscle cells on gradient-compliant hydrogels. Langmuir 2003;19(5):1908–13
链接1
[70]
Ghosh K, Pan Z, Guan E, Ge S, Liu Y, Nakamura T, et alCell adaptation to a physiologically relevant ECM mimic with different viscoelastic properties. Biomaterials 2007;28(4):671–9
链接1
[71]
Mih JD, Marinkovic A, Liu F, Sharif AS, Tschumperlin DJ. Matrix stiffness reverses the effect of actomyosin tension on cell proliferation. J Cell Sci 2012;125(24):5974–83
链接1
[72]
Hsiong SX, Carampin P, Kong HJ, Lee KY, Mooney DJ. Differentiation stage alters matrix control of stem cells. J Biomed Mater Res A 2008;85(1):145–56
链接1
[73]
Gu Y, Ji Y, Zhao Y, Liu Y, Ding F, Gu X, et alThe influence of substrate stiffness on the behavior and functions of Schwann cells in culture. Biomaterials 2012;33(28):6672–81
链接1
[74]
DiMilla PA, Stone JA, Quinn JA, Albelda SM, Lauffenburger DA. Maximal migration of human smooth-muscle cells on fibronectin and type-IV collagen occurs at an intermediate attachment strength. J Cell Biol 1993;122(3):729–37
链接1
[75]
Peyton SR, Putnam AJ. Extracellular matrix rigidity governs smooth muscle cell motility in a biphasic fashion. J Cell Physiol 2005;204(1):198–209
链接1
[76]
Calve S, Simon HG. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J 2012;26(6):2538–45
链接1
[77]
Boontheekul T, Hill EE, Kong HJ, Mooney DJ. Regulating myoblast phenotype through controlled gel stiffness and degradation. Tissue Eng 2007;13(7):1431–42
链接1
[78]
Saha K, Keung AJ, Irwin EF, Li Y, Little L, Schaffer DV, et alSubstrate modulus directs neural stem cell behavior. Biophys J 2008;95(9):4426–38
链接1
[79]
Boonen KJM, Rosaria-Chak KY, Baaijens FPT, van der Schaft DWJ, Post MJ. Essential environmental cues from the satellite cell niche: optimizing proliferation and differentiation. Am J Physiol Cell Physiol 2009;296(6):C1338–45
链接1
[80]
Huang C, Butler PJ, Tong S, Muddana HS, Bao G, Zhang S. Substrate stiffness regulates cellular uptake of nanoparticles. Nano Lett 2013;13(4):1611–5
链接1
[81]
Balestrini JL, Chaudhry S, Sarrazy V, Koehler A, Hinz B. The mechanical memory of lung myofibroblasts. Integr Biol 2012;4(4):410–21
链接1
[82]
Yang C, Tibbitt MW, Basta L, Anseth KS. Mechanical memory and dosing influence stem cell fate. Nat Mater 2014;13(6):645–52
链接1
[83]
Lee J, Abdeen AA, Kilian KA. Rewiring mesenchymal stem cell lineage specification by switching the biophysical microenvironment. Sci Rep 2014;4:5188
链接1
[84]
Li CX, Talele NP, Boo S, Koehler A, Knee-Walden E, Balestrini JL, et alMicroRNA-21 preserves the fibrotic mechanical memory of mesenchymal stem cells. Nat Mater 2016. Epub 2016 Oct 31
链接1
[85]
Trappmann B, Gautrot JE, Connelly JT, Strange DG, Li Y, Oyen ML, et alExtracellular-matrix tethering regulates stem-cell fate. Nat Mater 2012;11(7):642–9
链接1
[86]
Houseman BT, Mrksich M. The microenvironment of immobilized Arg-Gly-Asp peptides is an important determinant of cell adhesion. Biomaterials 2001;22(9):943–55
链接1
[87]
Keselowsky BG, Collard DM, García AJ. Integrin binding specificity regulates biomaterial surface chemistry effects on cell differentiation. Proc Natl Acad Sci USA 2005;102(17):5953–7
链接1
[88]
Li B, Moshfegh C, Lin Z, Albuschies J, Vogel V. Mesenchymal stem cells exploit extracellular matrix as mechanotransducer. Sci Rep 2013;3:2425
链接1
[89]
Wen J, Vincent LG, Fuhrmann A, Choi YS, Hribar KC, Taylor-Weiner H, et alInterplay of matrix stiffness and protein tethering in stem cell differentiation. Nat Mater 2014;13(10):979–87
链接1
[90]
Lovett DB, Shekhar N, Nickerson JA, Roux KJ, Lele TP. Modulation of nuclear shape by substrate rigidity. Cell Mol Bioeng 2013;6(2):230–8
链接1
[91]
Maloney JM, Walton EB, Bruce CM, van Vliet KJ. Influence of finite thickness and stiffness on cellular adhesion-induced deformation of compliant substrata. Phys Rev E 2008;78(4):041923
链接1
[92]
Merkel R, Kirchgeβner N, Cesa CM, Hoffmann B. Cell force microscopy on elastic layers of finite thickness. Biophys J 2007;93(9):3314–23
链接1
[93]
Buxboim A, Rajagopal K, Brown AEX, Discher DE. How deeply cells feel: methods for thin gels. J Phys Condens Matter 2010;22(19):194116
链接1
[94]
Franck C, Maskarinec SA, Tirrell DA, Ravichandran G. Three-dimensional traction force microscopy: a new tool for quantifying cell-matrix interactions. PLoS One 2011;6(3):e17833
链接1
[95]
Roco MC. Nanotechnology: convergence with modern biology and medicine. Curr Opin Biotechnol 2003;14(3):337–46
链接1
[96]
Park J, Bauer S, Von der Mark K, Schmuki P. Nanosize and vitality: TiO2 nanotube diameter directs cell fate. Nano Lett 2007;7(6):1686–91
链接1
[97]
Wang K, Bruce A, Mezan R, Kadiyala A, Wang L, Dawson J, et alNanotopographical modulation of cell function through nuclear deformation. ACS Appl Mater Interfaces 2016;8(8):5082–92
链接1
[98]
Lim JY, Hansen JC, Siedlecki CA, Runt J, Donahue HJ. Human foetal osteoblastic cell response to polymer-demixed nanotopographic interfaces. J R Soc Interface 2005;2(2):97–108
链接1
[99]
Lim JY, Hansen JC, Siedlecki CA, Hengstebeck RW, Cheng J, Winograd N, et alOsteoblast adhesion on poly(L-lactic acid)/polystyrene demixed thin film blends: effect of nanotopography, surface chemistry, and wettability. Biomacromolecules 2005;6(6):3319–27
链接1
[100]
Dalby MJ, Riehle MO, Johnstone H, Affrossman S, Curtis ASG. In vitro reaction of endothelial cells to polymer demixed nanotopography. Biomaterials 2002;23(14):2945–54
链接1
[101]
Dalby MJ, Marshall GE, Johnstone HJH, Affrossman S, Riehle MO. Interactions of human blood and tissue cell types with 95-nm-high nanotopography. IEEE Trans Nanobioscience 2002;1(1):18–23
链接1
[102]
Frey MT, Tsai IY, Russell TP, Hanks SK, Wang YL. Cellular responses to substrate topography: role of myosin II and focal adhesion kinase. Biophys J 2006;90(10):3774–82
链接1
[103]
Dalby MJ, Yarwood SJ, Riehle MO, Johnstone HJ, Affrossman S, Curtis AS. Increasing fibroblast response to materials using nanotopography: morphological and genetic measurements of cell response to 13-nm-high polymer demixed islands. Exp Cell Res 2002;276(1):1–9
链接1
[104]
Csaderova L, Martines E, Seunarine K, Gadegaard N, Wilkinson CDW, Riehle MO. A biodegradable and biocompatible regular nanopattern for large-scale selective cell growth. Small 2010;6(23):2755–61
链接1
[105]
Chen W, Villa-Diaz LG, Sun Y, Weng S, Kim JK, Lam RHW, et alNanotopography influences adhesion, spreading, and self-renewal of human embryonic stem cells. ACS Nano 2012;6(5):4094–103
链接1
[106]
Thakar RG, Ho F, Huang NF, Liepmann D, Li S. Regulation of vascular smooth muscle cells by micropatterning. Biochem Biophys Res Commun 2003;307(4):883–90
链接1
[107]
Charest JL, Eliason MT, García AJ, King WP, Talin AA, Simmons BA. Polymer cell culture substrates with combined nanotopographical patterns and micropatterned chemical domains. J Vac Sci Technol B 2005;23(6):3011–4
链接1
[108]
Zhu B, Zhang Q, Lu Q, Xu Y, Yin J, Hu J, et alNanotopographical guidance of C6 glioma cell alignment and oriented growth. Biomaterials 2004;25(18):4215–23
链接1
[109]
Yim EKF, Reano RM, Pang SW, Yee AF, Chen CS, Leong KW. Nanopattern-induced changes in morphology and motility of smooth muscle cells. Biomaterials 2005;26(26):5405–13
链接1
[110]
Gerecht S, Bettinger CJ, Zhang Z, Borenstein JT, Vunjak-Novakovic G, Langer R. The effect of actin disrupting agents on contact guidance of human embryonic stem cells. Biomaterials 2007;28(28):4068–77
链接1
[111]
Bettinger CJ, Zhang Z, Gerecht S, Borenstein JT, Langer R. Enhancement of in vitro capillary tube formation by substrate nanotopography. Adv Mater 2008;20(1):99–103
链接1
[112]
Teixeira AI, Abrams GA, Bertics PJ, Murphy CJ, Nealey PF. Epithelial contact guidance on well-defined micro- and nanostructured substrates. J Cell Sci 2003;116(10):1881–92
链接1
[113]
Ranucci CS, Moghe PV. Substrate microtopography can enhance cell adhesive and migratory responsiveness to matrix ligand density. J Biomed Mater Res 2001;54(2):149–61
链接1
[114]
Prina-Mello A, Volkov Y, Kelleher D, Prendergast PJ. Comparative locomotory behavior of T lymphocytes versus T lymphoma cells on flat and grooved surfaces. Ann Biomed Eng 2003;31(9):1106–13
链接1
[115]
Brammer KS, Oh S, Gallagher JO, Jin S. Enhanced cellular mobility guided by TiO2 nanotube surfaces. Nano Lett 2008;8(3):786–93
链接1
[116]
Liliensiek SJ, Wood JA, Yong J, Auerbach R, Nealey PF, Murphy CJ. Modulation of human vascular endothelial cell behaviors by nanotopographic cues. Biomaterials 2010;31(20):5418–26
链接1
[117]
Tan J, Saltzman WM. Topographical control of human neutrophil motility on micropatterned materials with various surface chemistry. Biomaterials 2002;23(15):3215–25
链接1
[118]
Kim DH, Han K, Gupta K, Kwon KW, Suh KY, Levchenko A. Mechanosensitivity of fibroblast cell shape and movement to anisotropic substratum topography gradients. Biomaterials 2009;30(29):5433–44
链接1
[119]
Lenhert S, Meier MB, Meyer U, Chi L, Wiesmann HP. Osteoblast alignment, elongation and migration on grooved polystyrene surfaces patterned by langmuir-blodgett lithography. Biomaterials 2005;26(5):563–70
链接1
[120]
Sun X, Driscoll MK, Guven C, Das S, Parent CA, Fourkas JT, et alAsymmetric nanotopography biases cytoskeletal dynamics and promotes unidirectional cell guidance. Proc Natl Acad Sci USA 2015;112(41):12557–62
链接1
[121]
Wang PY, Thissen H, Tsai WB. The roles of RGD and grooved topography in the adhesion, morphology, and differentiation of C2C12 skeletal myoblasts. Biotechnol Bioeng 2012;109(8):2104–15
链接1
[122]
Patel S, Kurpinski K, Quigley R, Gao H, Hsiao BS, Poo MM, et alBioactive nanofibers: synergistic effects of nanotopography and chemical signaling on cell guidance. Nano Lett 2007;7(7):2122–8
链接1
[123]
Yang F, Murugan R, Wang S, Ramakrishna S. Electrospinning of nano/micro scale poly(L-lactic acid) aligned fibers and their potential in neural tissue engineering. Biomaterials 2005;26(15):2603–10
链接1
[124]
Bryant DM, Mostov KE. From cells to organs: building polarized tissue. Nat Rev Mol Cell Biol 2008;9(11):887–901
链接1
[125]
Petrie RJ, Doyle AD, Yamada KM. Random versus directionally persistent cell migration. Nat Rev Mol Cell Biol 2009;10(8):538–49
链接1
[126]
Biggs MJP, Richards RG, Gadegaard N, Wilkinson CDW, Dalby MJ. Regulation of implant surface cell adhesion: characterization and quantification of S-phase primary osteoblast adhesions on biomimetic nanoscale substrates. J Orthop Res 2007;25(2):273–82
链接1
[127]
Wang S, Wang H, Jiao J, Chen K, Owens GE, Kamei K, et alThree-dimensional nanostructured substrates toward efficient capture of circulating tumor cells. Angew Chem Int Ed 2009;48(47):8970–3
链接1
[128]
Wang S, Liu K, Liu J, Yu Z, Xu X, Zhao L, et alHighly efficient capture of circulating tumor cells by using nanostructured silicon substrates with integrated chaotic micromixers. Angew Chem Int Ed 2011;50(13):3084–8
链接1
[129]
Liu X, Chen L, Liu H, Yang G, Zhang P, Han D, et alBio-inspired soft polystyrene nanotube substrate for rapid and highly efficient breast cancer-cell capture. NPG Asia Mater 2013;5:e63
链接1
[130]
Chen W, Weng S, Zhang F, Allen S, Li X, Bao L, et alNanoroughened surfaces for efficient capture of circulating tumor cells without using capture antibodies. ACS Nano 2013;7(1):566–75
链接1
[131]
Shi L, Wang K, Yang Y. Adhesion-based tumor cell capture using nanotopography. Colloids Surf B Biointerfaces 2016;147:291–9
链接1
[132]
Kulangara K, Adler AF, Wang H, Chellappan M, Hammett E, Yasuda R, et alThe effect of substrate topography on direct reprogramming of fibroblasts to induced neurons. Biomaterials 2014;35(20):5327–36
链接1
[133]
Huang C, Ozdemir T, Xu L, Butler PJ, Siedlecki CA, Brown JL, et alThe role of substrate topography on the cellular uptake of nanoparticles. J Biomed Mater Res Part B 2016;104(3):488–95
链接1
[134]
Iyer S, Gaikwad RM, Subba-Rao V, Woodworth CD, Sokolov I. Atomic force microscopy detects differences in the surface brush of normal and cancerous cells. Nat Nanotechnol 2009;4(6):389–93
链接1
[135]
Fischer KE, Alemán BJ, Tao SL, Hugh Daniels R, Li EM, Bünger MD, et alBiomimetic nanowire coatings for next generation adhesive drug delivery systems. Nano Lett 2009;9(2):716–20
链接1
[136]
Jeon H, Koo S, Reese WM, Loskill P, Grigoropoulos CP, Healy KE. Directing cell migration and organization via nanocrater-patterned cell-repellent interfaces. Nat Mater 2015;14(9):918–23
链接1
[137]
Teo BKK, Goh KJ, Ng ZJ, Koo S, Yim EKF. Functional reconstruction of corneal endothelium using nanotopography for tissue-engineering applications. Acta Biomater 2012;8(8):2941–52
链接1
[138]
Watari S, Hayashi K, Wood JA, Russell P, Nealey PF, Murphy CJ, et alModulation of osteogenic differentiation in hMSCs cells by submicron topographically-patterned ridges and grooves. Biomaterials 2012;33(1):128–36
链接1
[139]
Wood JA, Ly I, Borjesson DL, Nealey PF, Russell P, Murphy CJ. The modulation of canine mesenchymal stem cells by nano-topographic cues. Exp Cell Res 2012;318(19):2438–45
链接1
[140]
Janson IA, Kong YP, Putnam AJ. Nanotopographic substrates of poly(methyl methacrylate) do not strongly influence the osteogenic phenotype of mesenchymal stem cells in vitro. PLoS One 2014;9(3):e90719
链接1
[141]
Clements LR, Wang PY, Tsai WB, Thissen H, Voelcker NH. Electrochemistry-enabled fabrication of orthogonal nanotopography and surface chemistry gradients for high-throughput screening. Lab Chip 2012;12(8):1480–6
链接1
[142]
Yang J, Rose FRAJ, Gadegaard N, Alexander MR. A high-throughput assay of cell-surface interactions using topographical and chemical gradients. Adv Mater 2009;21(3):300–4
链接1
[143]
Ohara PT, Buck RC. Contact guidance in vitro: a light, transmission, and scanning electron microscopic study. Exp Cell Res 1979;121(2):235–49
链接1
[144]
Kim DH, Lipke EA, Kim P, Cheong R, Thompson S, Delannoy M, et alNanoscale cues regulate the structure and function of macroscopic cardiac tissue constructs. Proc Natl Acad Sci USA 2010;107(2):565–70
链接1
[145]
Ahn EH, Kim Y, Kshitiz, An SS, Afzal J, Lee S, et alSpatial control of adult stem cell fate using nanotopographic cues. Biomaterials 2014;35(8):2401–10
链接1
[146]
Pan HA, Hung YC, Sui YP, Huang GS. Topographic control of the growth and function of cardiomyoblast H9c2 cells using nanodot arrays. Biomaterials 2012;33(1):20–8
链接1
[147]
You MH, Kwak MK, Kim DH, Kim K, Levchenko A, Kim DY, et alSynergistically enhanced osteogenic differentiation of human mesenchymal stem cells by culture on nanostructured surfaces with induction media. Biomacromolecules 2010;11(7):1856–62
链接1
[148]
Crouch AS, Miller D, Luebke KJ, Hu W. Correlation of anisotropic cell behaviors with topographic aspect ratio. Biomaterials 2009;30(8):1560–7
链接1
[149]
Hu W, Yim EKF, Reano RM, Leong KW, Pang SW. Effects of nanoimprinted patterns in tissue-culture polystyrene on cell behavior. J Vac Sci Technol B 2005;23(6):2984–9
链接1
[150]
Fraser SA, Ting YH, Mallon KS, Wendt AE, Murphy CJ, Nealey PF. Sub-micron and nanoscale feature depth modulates alignment of stromal fibroblasts and corneal epithelial cells in serum-rich and serum-free media. J Biomed Mater Res A 2008;86A(3):725–35
链接1
[151]
Uttayarat P, Toworfe GK, Dietrich F, Lelkes PI, Composto RJ. Topographic guidance of endothelial cells on silicone surfaces with micro- to nanogrooves: orientation of actin filaments and focal adhesions. J Biomed Mater Res A 2005;75A(3):668–80
链接1
[152]
Wong ST, Teo SK, Park S, Chiam KH, Yim EKF. Anisotropic rigidity sensing on grating topography directs human mesenchymal stem cell elongation. Biomech Model Mechanobiol 2014;13(1):27–39
链接1
[153]
Chen CS, Mrksich M, Huang S, Whitesides GM, Ingber DE. Geometric control of cell life and death. Science 1997;276(5317):1425–8
链接1
[154]
McBeath R, Pirone DM, Nelson CM, Bhadriraju K, Chen CS. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Dev Cell 2004;6(4):483–95
链接1
[155]
Dembo M, Wang Y. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophys J 1999;76(4):2307–16
链接1
[156]
Calvo F, Ege N, Grande-Garcia A, Hooper S, Jenkins RP, Chaudhry SI, et alMechanotransduction and YAP-dependent matrix remodelling is required for the generation and maintenance of cancer-associated fibroblasts. Nat Cell Biol 2013;15(6):637–46
链接1
[157]
Ma X, Schickel ME, Stevenson MD, Sarang-Sieminski AL, Gooch KJ, Ghadiali SN, et alFibers in the extracellular matrix enable long-range stress transmission between cells. Biophys J 2013;104(7):1410–8
链接1
[158]
Harris A, Wild P, Stopak D. Silicone rubber substrata: a new wrinkle in the study of cell locomotion. Science 1980;208(4440):177–9
链接1
[159]
Chalut KJ, Kulangara K, Giacomelli MG, Wax A, Leong KW. Deformation of stem cell nuclei by nanotopographical cues. Soft Matter 2010;6(8):1675–81
链接1
[160]
Yim EKF, Darling EM, Kulangara K, Guilak F, Leong KW. Nanotopography-induced changes in focal adhesions, cytoskeletal organization, and mechanical properties of human mesenchymal stem cells. Biomaterials 2010;31(6):1299–306
链接1
[161]
Tzvetkova-Chevolleau T, Stéphanou A, Fuard D, Ohayon J, Schiavone P, Tracqui P. The motility of normal and cancer cells in response to the combined influence of the substrate rigidity and anisotropic microstructure. Biomaterials 2008;29(10):1541–51
链接1
[162]
Forrest JA, Dalnoki-Veress K. The glass transition in thin polymer films. Adv Colloid Interface Sci 2001;94(1–3):167–95
链接1
[163]
Van Workum K, de Pablo JJ. Computer simulation of the mechanical properties of amorphous polymer nanostructures. Nano Lett 2003;3(10):1405–10
链接1
[164]
Stafford CM, Harrison C, Beers KL, Karim A, Amis EJ, Vanlandingham MR, et alA buckling-based metrology for measuring the elastic moduli of polymeric thin films. Nat Mater 2004;3(8):545–50
链接1
[165]
Stafford CM, Vogt BD, Harrison C, Julthongpiput D, Huang R. Elastic moduli of ultrathin amorphous polymer films. Macromolecules 2006;39(15):5095–9
链接1
[166]
Fu J, Wang YK, Yang MT, Desai RA, Yu X, Liu Z, et alMechanical regulation of cell function with geometrically modulated elastomeric substrates. Nat Methods 2010;7(9):733–6
链接1
[167]
Park J, Kim HN, Kim DH, Levchenko A, Suh KY. Quantitative analysis of the combined effect of substrate rigidity and topographic guidance on cell morphology. IEEE Trans Nanobioscience 2012;11(1):28–36
链接1
[168]
Balaban NQ, Schwarz US, Riveline D, Goichberg P, Tzur G, Sabanay I, et alForce and focal adhesion assembly: a close relationship studied using elastic micropatterned substrates. Nat Cell Biol 2001;3(5):466–72
链接1
[169]
Tan JL, Tien J, Pirone DM, Gray DS, Bhadriraju K, Chen CS. Cells lying on a bed of microneedles: an approach to isolate mechanical force. Proc Natl Acad Sci USA 2003;100(4):1484–9
链接1
[170]
du Roure O, Saez A, Buguin A, Austin RH, Chavrier P, Siberzan P, et alForce mapping in epithelial cell migration. Proc Natl Acad Sci USA 2005;102(7):2390–5
链接1
[171]
Ghassemi S, Meacci G, Liu S, Gondarenko AA, Mathur A, Roca-Cusachs P, et alCells test substrate rigidity by local contractions on submicrometer pillars. Proc Natl Acad Sci USA 2012;109(14):5328–33
链接1
[172]
Yang M, Sniadecki NJ, Chen C. Geometric considerations of micro- to nanoscale elastomeric post arrays to study cellular traction forces. Adv Mater 2007;19(20):3119–23
链接1
[173]
Saez A, Ghibaudo M, Buguin A, Silberzan P, Ladoux B. Rigidity-driven growth and migration of epithelial cells on microstructured anisotropic substrates. Proc Natl Acad Sci USA 2007;104(20):8281–6
链接1
[174]
Sun Y, Yong KM, Villa-Diaz LG, Zhang X, Chen W, Philson R, et alHippo/YAP-mediated rigidity-dependent motor neuron differentiation of human pluripotent stem cells. Nat Mater 2014;13(6):599–604
链接1
[175]
Han SJ, Bielawski KS, Ting LH, Rodriguez ML, Sniadecki NJ. Decoupling substrate stiffness, spread area, and micropost density: a close spatial relationship between traction forces and focal adhesions. Biophys J 2012;103(4):640–8
链接1
[176]
Saez A, Buguin A, Silberzan P, Ladoux B. Is the mechanical activity of epithelial cells controlled by deformations or forces? Biophys J 2005;89(6):L52–4
链接1
[177]
Hynes RO. Integrins: bidirectional, allosteric signaling machines. Cell 2002;110(6):673–87
链接1
[178]
Ridley AJ, Schwartz MA, Burridge K, Firtel RA, Ginsberg MH, Borisy G, et alCell migration: integrating signals from front to back. Science 2003;302(5651):1704–9
链接1
[179]
Zaidel-Bar R, Cohen M, Addadi L, Geiger B. Hierarchical assembly of cell-matrix adhesion complexes. Biochem Soc Trans 2004;32(3):416–20
链接1
[180]
Galbraith CG, Yamada KM, Sheetz MP. The relationship between force and focal complex development. J Cell Biol 2002;159(4):695–705
链接1
[181]
Besser A, Safran SA. Force-induced adsorption and anisotropic growth of focal adhesions. Biophys J 2006;90(10):3469–84
链接1
[182]
Riveline D, Zamir E, Balaban NQ, Schwarz US, Ishizaki T, Narumiya S, et alFocal contacts as mechanosensors. J Cell Biol 2001;153(6):1175–86
链接1
[183]
Nobes CD, Hall A. Rho, Rac, and Cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia. Cell 1995;81(1):53–62
链接1
[184]
DeMali KA, Burridge K. Coupling membrane protrusion and cell adhesion. J Cell Sci 2003;116(12):2389–97
链接1
[185]
Choi CK, Vicente-Manzanares M, Zareno J, Whitmore LA, Mogilner A, Horwitz AR. Actin and α-actinin orchestrate the assembly and maturation of nascent adhesions in a myosin II motor-independent manner. Nat Cell Biol 2008;10(9):1039–50
链接1
[186]
Plotnikov SV, Pasapera AM, Sabass B, Waterman CM. Force fluctuations within focal adhesions mediate ECM-rigidity sensing to guide directed cell migration. Cell 2012;151(7):1513–27
链接1
[187]
Coyer SR, Singh A, Dumbauld DW, Calderwood DA, Craig SW, Delamarche E, et alNanopatterning reveals an ECM area threshold for focal adhesion assembly and force transmission that is regulated by integrin activation and cytoskeleton tension. J Cell Sci 2012;125(21):5110–23
链接1
[188]
Stricker J, Aratyn-Schaus Y, Oakes PW, Gardel ML. Spatiotemporal constraints on the force-dependent growth of focal adhesions. Biophys J 2011;100(12):2883–93
链接1
[189]
Cary LA, Chang J, Guan J. Stimulation of cell migration by overexpression of focal adhesion kinase and its association with Src and Fyn. J Cell Sci 1996;109(Pt 7):1787–94.
[190]
Xu B, Song G, Ju Y, Li X, Song Y, Watanabe S. RhoA/ROCK, cytoskeletal dynamics, and focal adhesion kinase are required for mechanical stretch-induced tenogenic differentiation of human mesenchymal stem cells. J Cell Physiol 2012;227(6):2722–9
链接1
[191]
Salasznyk RM, Klees RF, Williams WA, Boskey A, Plopper GE. Focal adhesion kinase signaling pathways regulate the osteogenic differentiation of human mesenchymal stem cells. Exp Cell Res 2007;313(1):22–37
链接1
[192]
Wang H, Dembo M, Hanks SK, Wang Y. Focal adhesion kinase is involved in mechanosensing during fibroblast migration. Proc Natl Acad Sci USA 2001;98(20):11295–300
链接1
[193]
Pasapera AM, Schneider IC, Rericha E, Schlaepfer DD, Waterman CM. Myosin II activity regulates vinculin recruitment to focal adhesions through FAK-mediated paxillin phosphorylation. J Cell Biol 2010;188(6):877–90
链接1
[194]
Provenzano PP, Inman DR, Eliceiri KW, Keely PJ. Matrix density-induced mechanoregulation of breast cell phenotype, signaling and gene expression through a FAK-ERK linkage. Oncogene 2009;28(49):4326–43
链接1
[195]
Humphrey JD, Dufresne ER, Schwartz MA. Mechanotransduction and extracellular matrix homeostasis. Nat Rev Mol Cell Biol 2014;15(12):802–12
链接1
[196]
Teo BK, Wong ST, Lim CK, Kung TY, Yap CH, Ramagopal Y, et alNanotopography modulates mechanotransduction of stem cells and induces differentiation through focal adhesion kinase. ACS Nano 2013;7(6):4785–98
链接1
[197]
Kulangara K, Yang Y, Yang J, Leong KW. Nanotopography as modulator of human mesenchymal stem cell function. Biomaterials 2012;33(20):4998–5003
链接1
[198]
Geiger B, Spatz JP, Bershadsky AD. Environmental sensing through focal adhesions. Nat Rev Mol Cell Biol 2009;10(1):21–33
链接1
[199]
Burridge K, Wennerberg K. Rho and Rac take center stage. Cell 2004;116(2):167–79
链接1
[200]
Tomasek JJ, Gabbiani G, Hinz B, Chaponnier C, Brown RA. Myofibroblasts and mechano-regulation of connective tissue remodelling. Nat Rev Mol Cell Biol 2002;3(5):349–63
链接1
[201]
Treiser MD, Yang EH, Gordonov S, Cohen DM, Androulakis IP, Kohn J, et alCytoskeleton-based forecasting of stem cell lineage fates. Proc Natl Acad Sci USA 2010;107(2):610–5
链接1
[202]
Murphy WL, McDevitt TC, Engler AJ. Materials as stem cell regulators. Nat Mater 2014;13(6):547–57. Erratum in: Nat Mater 2014;13(7):756
链接1
[203]
Wang N, Toli?-N?rrelykke IM, Chen J, Mijailovich SM, Butler JP, Fredberg JJ, et alCell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. Am J Physiol 2002;282(3):C606–16
链接1
[204]
Kilian KA, Bugarija B, Lahn BT, Mrksich M. Geometric cues for directing the differentiation of mesenchymal stem cells. Proc Natl Acad Sci USA 2010;107(11):4872–7
链接1
[205]
Wang JH, Lin JS. Cell traction force and measurement methods. Biomech Model Mechanobiol 2007;6(6):361–71
链接1
[206]
Ghibaudo M, Saez A, Trichet L, Xayaphoummine A, Browaeys J, Silberzan P, et al. Traction forces and rigidity sensing regulate cell functions. Soft Matter 2008;4(9):1836–43
链接1
[207]
Lo C, Wang H, Dembo M, Wang Y. Cell movement is guided by the rigidity of the substrate. Biophys J 2000;79(1):144–52
链接1
[208]
Klein EA, Yin L, Kothapalli D, Castagnino P, Byfield FJ, Xu T, et alCell-cycle control by physiological matrix elasticity and in vivo tissue stiffening. Curr Biol 2009;19(18):1511–8
链接1
[209]
Jay PY, Pham PA, Wong SA, Elson EL. A mechanical function of myosin II in cell motility. J Cell Sci 1995;108(Pt 1):387–93.
[210]
Keung AJ, de Juan-Pardo EM, Schaffer DV, Kumar S. Rho GTPases mediate the mechanosensitive lineage commitment of neural stem cells. Stem Cells 2011;29(11):1886–97
链接1
[211]
Wang K, He X, Linthicum W, Mezan R, Wang L, Rojanasakul Y, et alCarbon nanotubes induced fibrogenesis on nanostructured substrates. Environ Sci Nano 2017
链接1
[212]
Ankam S, Lim CK, Yim EK. Actomyosin contractility plays a role in MAP2 expression during nanotopography-directed neuronal differentiation of human embryonic stem cells. Biomaterials 2015;47:20–8
链接1
[213]
Kulangara K, Yang J, Chellappan M, Yang Y, Leong KW. Nanotopography alters nuclear protein expression, proliferation and differentiation of human mesenchymal stem/stromal cells. PLoS One 2014;9(12):e114698
链接1
[214]
Maniotis AJ, Chen CS, Ingber DE. Demonstration of mechanical connections between integrins, cytoskeletal filaments, and nucleoplasm that stabilize nuclear structure. Proc Natl Acad Sci USA 1997;94(3):849–54
链接1
[215]
Wormer DB, Davis KA, Henderson JH, Turner CE. The focal adhesion-localized CdGAP regulates matrix rigidity sensing and durotaxis. PLoS One 2014;9(3):e91815
链接1
[216]
Thomas CH, Collier JH, Sfeir CS, Healy KE. Engineering gene expression and protein synthesis by modulation of nuclear shape. Proc Natl Acad Sci USA 2002;99(4):1972–7
链接1
[217]
McBride SH, Knothe Tate ML. Modulation of stem cell shape and fate A: the role of density and seeding protocol on nucleus shape and gene expression. Tissue Eng Part A 2008;14(9):1561–72
链接1
[218]
Pajerowski JD, Dahl KN, Zhong FL, Sammak PJ, Discher DE. Physical plasticity of the nucleus in stem cell differentiation. Proc Natl Acad Sci USA 2007;104(40):15619–24
链接1
[219]
Sims JR, Karp S, Ingber DE. Altering the cellular mechanical force balance results in integrated changes in cell, cytoskeletal and nuclear shape. J Cell Sci 1992;103(Pt 4):1215–22.
[220]
Dahl KN, Ribeiro AJ, Lammerding J. Nuclear shape, mechanics, and mechanotransduction. Circ Res 2008;102(11):1307–18
链接1
[221]
Dalby MJ, Riehle MO, Yarwood SJ, Wilkinson CDW, Curtis ASG. Nucleus alignment and cell signaling in fibroblasts: response to a micro-grooved topography. Exp Cell Res 2003;284(2):274–80
链接1
[222]
Roca-Cusachs P, Alcaraz J, Sunyer R, Samitier J, Farré R, Navajas D. Micropatterning of single endothelial cell shape reveals a tight coupling between nuclear volume in G1 and proliferation. Biophys J 2008;94(12):4984–95
链接1
[223]
Vogel V, Sheetz M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol 2006;7(4):265–75
链接1
[224]
Yang Y, Kulangara K, Sia J, Wang L, Leong KW. Engineering of a microfluidic cell culture platform embedded with nanoscale features. Lab Chip 2011;11(9):1638–46
链接1
[225]
Dupont S, Morsut L, Aragona M, Enzo E, Giulitti S, Cordenonsi M, et alRole of YAP/TAZ in mechanotransduction. Nature 2011;474(7350):179–83
链接1
[226]
Wada K, Itoga K, Okano T, Yonemura S, Sasaki H. Hippo pathway regulation by cell morphology and stress fibers. Development 2011;138(18):3907–14
链接1
[227]
Zhao B, Tumaneng K, Guan KL. The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal. Nat Cell Biol 2011;13(8):877–83
链接1
[228]
Aragona M, Panciera T, Manfrin A, Giulitti S, Michielin F, Elvassore N, et alA mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors. Cell 2013;154(5):1047–59
链接1
[229]
Liu F, Lagares D, Choi KM, Stopfer L, Marinkovic A, Vrbanac V, et alMechanosignaling through YAP and TAZ drives fibroblast activation and fibrosis. Am J Physiol Lung C 2015;308(4):L344–57
链接1
[230]
Tremblay AM, Camargo FD. Hippo signaling in mammalian stem cells. Semin Cell Dev Biol 2012;23(7):818–26
链接1
[231]
Lian I, Kim J, Okazawa H, Zhao J, Zhao B, Yu J, et alThe role of YAP transcription coactivator in regulating stem cell self-renewal and differentiation. Genes Dev 2010;24(11):1106–18
链接1
[232]
Mosqueira D, Pagliari S, Uto K, Ebara M, Romanazzo S, Escobedo-Lucea C, et alHippo pathway effectors control cardiac progenitor cell fate by acting as dynamic sensors of substrate mechanics and nanostructure. ACS Nano 2014;8(3):2033–47
链接1
[233]
Zhao B, Li L, Wang L, Wang C, Yu J, Guan K. Cell detachment activates the Hippo pathway via cytoskeleton reorganization to induce anoikis. Genes Dev 2012;26(1):54–68
链接1
[234]
Song L, Wang K, Li Y, Yang Y. Nanotopography promoted neuronal differentiation of human induced pluripotent stem cells. Colloids Surf B 2016;148:49–58
链接1
[235]
Musah S, Wrighton PJ, Zaltsman Y, Zhong X, Zorn S, Parlato MB, et alSubstratum-induced differentiation of human pluripotent stem cells reveals the coactivator YAP is a potent regulator of neuronal specification. Proc Natl Acad Sci USA 2014;111(38):13805–10
链接1
[236]
Biggs MJP, Richards RG, Gadegaard N, Wilkinson CDW, Dalby MJ. The effects of nanoscale pits on primary human osteoblast adhesion formation and cellular spreading. J Mater Sci–Mater Med 2007;18(2):399–404
链接1
[237]
Gray DS, Tien J, Chen CS. Repositioning of cells by mechanotaxis on surfaces with micropatterned Young’s modulus. J Biomed Mater Res A 2003;66A(3):605–14
链接1
[238]
Trichet L, Le Digabel J, Hawkins RJ, Vedula SR, Gupta M, Ribrault C, et alEvidence of a large-scale mechanosensing mechanism for cellular adaptation to substrate stiffness. Proc Natl Acad Sci USA 2012;109(18):6933–8
链接1
[239]
Sunyer R, Jin AJ, Nossal R, Sackett DL. Fabrication of hydrogels with steep stiffness gradients for studying cell mechanical response. PLoS One 2012;7(10):e46107
链接1
[240]
Zaari N, Rajagopalan P, Kim SK, Engler AJ, Wong JY. Photopolymerization in microfluidic gradient generators: microscale control of substrate compliance to manipulate cell response. Adv Mater 2004;16(23–24):2133–7
链接1
[241]
Park J, Kim DH, Kim HN, Wang CJ, Kwak MK, Hur E, et alDirected migration of cancer cells guided by the graded texture of the underlying matrix. Nat Mater 2016;15(7):792–801
链接1
[242]
Kim DH, Seo CH, Han K, Kwon KW, Levchenko A, Suh KY. Guided cell migration on microtextured substrates with variable local density and anisotropy. Adv Funct Mater 2009;19(10):1579–86
链接1
[243]
Khung YL, Barritt G, Voelcker NH. Using continuous porous silicon gradients to study the influence of surface topography on the behaviour of neuroblastoma cells. Exp Cell Res 2008;314(4):789–800
链接1
[244]
Arnold M, Hirschfeld-Warneken VC, Lohmüeller T, Heil P, Blüemmel J, Cavalcanti-Adam EA, et alInduction of cell polarization and migration by a gradient of nanoscale variations in adhesive ligand spacing. Nano Lett 2008;8(7):2063–9
链接1
[245]
Arnold M, Cavalcanti-Adam EA, Glass R, Blüemmel J, Eck W, Kantlehner M, et alActivation of integrin function by nanopatterned adhesive interfaces. Chemphyschem 2004;5(3):383–8
链接1
[246]
Arnold M, Schwieder M, Blüemmel J, Cavalcanti-Adam EA, López-Garcia M, Kessler H, et alCell interactions with hierarchically structured nano-patterned adhesive surfaces. Soft Matter 2009;5(1):72–7
链接1
[247]
Xiong J, Stehle T, Diefenbach B, Zhang R, Dunker R, Scott DL, et alCrystal structure of the extracellular segment of integrin αVβ3. Science 2001;294(5541):339–45
链接1
[248]
Gautrot JE, Malmstr?m J, Sundh M, Margadant C, Sonnenberg A, Sutherland DS. The nanoscale geometrical maturation of focal adhesions controls stem cell differentiation and mechanotransduction. Nano Lett 2014;14(7):3945–52
链接1
[249]
Bischofs IB, Safran SA, Schwarz US. Elastic interactions of active cells with soft materials. Phys Rev E 2004;69(2):021911
链接1
[250]
Bischofs IB, Schwarz US. Cell organization in soft media due to active mechanosensing. Proc Natl Acad Sci USA 2003;100(16):9274–9
链接1
[251]
Dalby MJ, Biggs MJ, Gadegaard N, Kalna G, Wilkinson CD, Curtis AS. Nanotopographical stimulation of mechanotransduction and changes in interphase centromere positioning. J Cell Biochem 2007;100(2):326–38
链接1
[252]
Kilian KA, Mrksich M. Directing stem cell fate by controlling the affinity and density of ligand–receptor interactions at the biomaterials interface. Angew Chem Int Ed 2012;51(20):4891–5
链接1
[253]
Razafiarison T, Silván U, Meier D, Snedeker JG. Surface-driven collagen self-assembly affects early osteogenic stem cell signaling. Adv Healthc Mater 2016;5(12):1481–92
链接1
[254]
Siegel RW. Creating nanophase materials. Sci Am 1996;275(6):74–9
链接1
[255]
Webster TJ, Schadler LS, Siegel RW, Bizios R. Mechanisms of enhanced osteoblast adhesion on nanophase alumina involve vitronectin. Tissue Eng 2004;7(3):291–301
链接1
[256]
Puckett SD, Lee PP, Ciombor DM, Aaron RK, Webster TJ. Nanotextured titanium surfaces for enhancing skin growth on transcutaneous osseointegrated devices. Acta Biomater 2010;6(6):2352–62
链接1
[257]
Yang Y, Liu D, Xie Y, Lee LJ, Tomasko DL. Low-temperature fusion of polymeric nanostructures using carbon dioxide. Adv Mater 2007;19(2):251–4
链接1
[258]
Yang Y, Cheng MMC, Hu X, Liu D, Goyette RJ, Lee LJ, et alLow-pressure carbon dioxide enhanced polymer chain mobility below the bulk glass transition temperature. Macromolecules 2007;40(4):1108–11
链接1
[259]
den Braber ET, de Ruijter JE, Ginsel LA, von Recum AF, Jansen JA. Orientation of ECM protein deposition, fibroblast cytoskeleton, and attachment complex components on silicone microgrooved surfaces. J Biomed Mater Res 1998;40(2):291–300
链接1
[260]
Andersson AS, Brink J, Lidberg U, Sutherland DS. Influence of systematically varied nanoscale topography on the morphology of epithelial cells. IEEE Trans Nanobioscience 2003;2(2):49–57
链接1
[261]
Choudhary S, Haberstroh KM, Webster TJ. Enhanced functions of vascular cells on nanostructured Ti for improved stent applications. Tissue Eng 2007;13(7):1421–30
链接1
[262]
Koh LB, Rodriguez I, Venkatraman SS. Conformational behavior of fibrinogen on topographically modified polymer surfaces. Phys Chem Chem Phys 2010;12(35):10301–8
链接1
[263]
Norde W, Horbett TA, Brash JL. Proteins at interfaces III: introductory overview. In: Horbett T, Brash JL, Norde W, editors Proteins at interfaces III state of the art. Washington, DC: American Chemical Society; 2012. p. 1–34
链接1
[264]
Chirasatitsin S, Engler AJ. Detecting cell-adhesive sites in extracellular matrix using force spectroscopy mapping. J Phys Condens Matter 2010;22(19):194102
链接1
[265]
Berning S, Willig KI, Steffens H, Dibaj P, Hell SW. Nanoscopy in a living mouse brain. Science 2012;335(6068):551
链接1
[266]
Grashoff C, Hoffman BD, Brenner MD, Zhou R, Parsons M, Yang M, et alMeasuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature 2010;466(7303):263–6
链接1
[267]
Heil P, Spatz JP. Lateral shear forces applied to cells with single elastic micropillars to influence focal adhesion dynamics. J Phys Condens Matter 2010;22(19):194108
链接1
[268]
Thompson MT, Berg MC, Tobias IS, Lichter JA, Rubner MF, Van Vliet KJ. Biochemical functionalization of polymeric cell substrata can alter mechanical compliance. Biomacromolecules 2006;7(6):1990–5
链接1
[269]
Lee M, Kang DK, Yang HK, Park KH, Choe SY, Kang C, et alProtein nanoarray on ProlinkerTM surface constructed by atomic force microscopy dip-pen nanolithography for analysis of protein interaction. Proteomics 2006;6(4):1094–103
链接1
[270]
Sahin O, Erina N. High-resolution and large dynamic range nanomechanical mapping in tapping-mode atomic force microscopy. Nanotechnology 2008;19(44):445717
链接1
[271]
Ankam S, Suryana M, Chan LY, Moe AA, Teo BK, Law JB, et alSubstrate topography and size determine the fate of human embryonic stem cells to neuronal or glial lineage. Acta Biomater 2013;9(1):4535–45
链接1
[272]
Tan KK, Tann JY, Sathe SR, Goh SH, Ma D, Goh EL, et alEnhanced differentiation of neural progenitor cells into neurons of the mesencephalic dopaminergic subtype on topographical patterns. Biomaterials 2015;43:32–43
链接1
[273]
Unadkat HV, Hulsman M, Cornelissen K, Papenburg BJ, Truckenmuller RK, Carpenter AE, et al. An algorithm-based topographical biomaterials library to instruct cell fate. Proc Natl Acad Sci USA 2011;108(40):16565–70
链接1
[274]
Gu Y, Zhu J, Xue C, Li Z, Ding F, Yang Y, et alChitosan/silk fibroin-based, Schwann cell-derived extracellular matrix-modified scaffolds for bridging rat sciatic nerve gaps. Biomaterials 2014;35(7):2253–63
链接1
[275]
Liu X, Zhang F, Wang Q, Gao J, Meng J, Wang S, et alPlatelet-inspired multiscaled cytophilic interfaces with high specificity and efficiency toward point-of-care cancer diagnosis. Small 2014;10(22):4677–83
链接1
[276]
Zhao L, Mei S, Chu P, Zhang Y, Wu Z. The influence of hierarchical hybrid micro/nano-textured titanium surface with titania nanotubes on osteoblast functions. Biomaterials 2010;31(19):5072–82
链接1
[277]
Kubo K, Tsukimura N, Iwasa F, Ueno T, Saruwatari L, Aita H,et alCellular behavior on TiO2 nanonodular structures in a micro-to-nanoscale hierarchy model. Biomaterials 2009;30(29):5319–29
链接1
[278]
Gittens R, McLachlan T, Olivares-Navarrete R, Cai Y, Berner S, Tannenbaum R, et alThe effects of combined micron-/submicron-scale surface roughness and nanoscale features on cell proliferation and differentiation. Biomaterials 2011;32(13):3395–403
链接1
[279]
Tsukimura N, Yamada M, Iwasa F, Minamikawa H, Att W, Ueno T, et alSynergistic effects of UV photofunctionalization and micro-nano hybrid topography on the biological properties of titanium. Biomaterials 2011;32(19):4358–68
链接1
[280]
Tocce EJ, Smirnov VK, Kibalov DS, Liliensiek SJ, Murphy CJ, Nealey PF. The ability of corneal epithelial cells to recognize high aspect ratio nanostructures. Biomaterials 2010;31(14):4064–72
链接1
[281]
Jia Z, Xiu P, Li M, Xu X, Shi Y, Cheng Y, et alBioinspired anchoring AgNPs onto micro-nanoporous TiO2 orthopedic coatings: trap-killing of bacteria, surface-regulated osteoblast functions and host responses. Biomaterials 2016;75:203–22
链接1
[282]
Moffa M, Sciancalepore AG, Passione LG, Pisignano D. Combined nano- and micro-scale topographic cues for engineered vascular constructs by electrospinning and imprinted micro-patterns. Small 2014;10(12):2439–50
链接1
[283]
López-Bosque MJ, Tejeda-Montes E, Cazorla M, Linacero J, Atienza Y, Smith KH, et alFabrication of hierarchical micro-nanotopographies for cell attachment studies. Nanotechnology 2013;24(25):255305
链接1
[284]
Kim J, Bae WG, Choung HW, Lim KT, Seonwoo H, Jeong HE, et alMultiscale patterned transplantable stem cell patches for bone tissue regeneration. Biomaterials 2014;35(33):9058–67
链接1
[285]
Yang K, Jung H, Lee HR, Lee JS, Kim SR, Song KY, et alMultiscale, hierarchically patterned topography for directing human neural stem cells into functional neurons. ACS Nano 2014;8(8):7809–22
链接1
[286]
Bao L, Cheng X, Huang X, Guo L, Pang S, Yee A. Nanoimprinting over topography and multilayer three-dimensional printing. J Vac Sci Technol B 2002;20(6):2881–6
链接1
[287]
Eliason MT, Charest JL, Simmons BA, García AJ, King WP. Nanoimprint fabrication of polymer cell substrates with combined microscale and nanoscale topography. J Vac Sci Technol B 2007;25(4):L31–4
链接1
[288]
Cukierman E, Pankov R, Stevens DR, Yamada KM. Taking cell-matrix adhesions to the third dimension. Science 2001;294(5547):1708–12
链接1
[289]
Bryant SJ, Chowdhury TT, Lee DA, Bader DL, Anseth KS. Crosslinking density influences chondrocyte metabolism in dynamically loaded photocrosslinked poly(ethylene glycol) hydrogels. Ann Biomed Eng 2004;32(3):407–17
链接1
[290]
Park Y, Lutolf MP, Hubbell JA, Hunziker EB, Wong M. Bovine primary chondrocyte culture in synthetic matrix metalloproteinase-sensitive poly(ethylene glycol)-based hydrogels as a scaffold for cartilage repair. Tissue Eng 2004;10(3–4):515–22
链接1
[291]
Fouchard J, Bimbard C, Bufi N, Durand-Smet P, Proag A, Richert A, et alThree-dimensional cell body shape dictates the onset of traction force generation and growth of focal adhesions. Proc Natl Acad Sci USA 2014;111(36):13075–80
链接1
[292]
Hogrebe NJ, Gooch KJ. Direct influence of culture dimensionality on human mesenchymal stem cell differentiation at various matrix stiffnesses using a fibrous self-assembling peptide hydrogel. J Biomed Mater Res A 2016;104(9):2356–68
链接1
[293]
Fischbach C, Chen R, Matsumoto T, Schmelzle T, Brugge JS, Polverini PJ, et alEngineering tumors with 3D scaffolds. Nat Methods 2007;4(10):855–60
链接1
[294]
Aljitawi OS, Li D, Xiao Y, Zhang D, Ramachandran K, Stehno-Bittel L, et alA novel three-dimensional stromal-based model for in vitrochemotherapy sensitivity testing of leukemia cells. Leuk Lymphoma 2014;55(2):378–91
链接1
[295]
Talukdar S, Kundu SC. A non-mulberry silk fibroin protein based 3D in vitro tumor model for evaluation of anticancer drug activity. Adv Funct Mater 2012;22(22):4778–88
链接1
[296]
Bruce A, Evans R, Mezan R, Shi L, Moses BS, Martin KH, et alThree-dimensional microfluidic tri-culture model of the bone marrow microenvironment for study of acute lymphoblastic leukemia. PLoS One 2015;10(10):e0140506. Erratum in: PLoS One 2015;10(12):e0146203
链接1
[297]
Lutolf MP, Hubbell JA. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat Biotechnol 2005;23(1):47–55
链接1
[298]
Sun Y, Jallerat Q, Szymanski JM, Feinberg AW. Conformal nanopatterning of extracellular matrix proteins onto topographically complex surfaces. Nat Methods 2015;12(2):134–6
链接1
[299]
Perschmann N, Hellmann JK, Frischknecht F, Spatz JP. Induction of malaria parasite migration by synthetically tunable microenvironments. Nano Lett 2011;11(10):4468–74
链接1
[300]
Aydin D, Louban I, Perschmann N, Blümmel J, Lohmüller T, Cavalcanti-Adam EA, et al Polymeric substrates with tunable elasticity and nanoscopically controlled biomolecule presentation . Langmuir 2010;26(19):15472–80
链接1
[301]
Li S, Wang X, Cao B, Ye K, Li Z, Ding J. Effects of nanoscale spatial arrangement of arginine-glycine-aspartate peptides on dedifferentiation of chondrocytes. Nano Lett 2015;15(11):7755–65
链接1
[302]
Kruss S, Erpenbeck L, Sch?n MP, Spatz JP. Circular, nanostructured and biofunctionalized hydrogel microchannels for dynamic cell adhesion studies. Lab Chip 2012;12(18):3285–9
链接1
[303]
Chaudhuri O, Koshy ST, Branco da Cunha C, Shin JW, Verbeke CS, Allison KH, et alExtracellular matrix stiffness and composition jointly regulate the induction of malignant phenotypes in mammary epithelium. Nat Mater 2014;13(10):970–8
链接1
[304]
Madl CM, Katz LM, Heilshorn SC. Bio-orthogonally crosslinked, engineered protein hydrogels with tunable mechanics and biochemistry for cell encapsulation. Adv Funct Mater 2016;26(21):3612–20
链接1
[305]
White ES. Lung extracellular matrix and fibroblast function. Ann Am Thorac Soc 2015;12(Suppl 1):S30–3
链接1
[306]
Kisseleva T, Brenner DA. Mechanisms of fibrogenesis. Exp Biol Med 2008;233(2):109–22
链接1
[307]
Burdick JA, Murphy WL. Moving from static to dynamic complexity in hydrogel design. Nat Commun 2012;3:1269
链接1
[308]
Tibbitt MW, Anseth KS. Dynamic microenvironments: the fourth dimension. Sci Transl Med 2012;4(160):160ps24
链接1
[309]
Guvendiren M, Burdick JA. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nat Commun 2012;3:792
链接1
[310]
Young JL, Engler AJ. Hydrogels with time-dependent material properties enhance cardiomyocyte differentiation in vitro. Biomaterials 2011;32(4):1002–9
链接1
[311]
Khetan S, Guvendiren M, Legant WR, Cohen DM, Chen CS, Burdick JA. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat Mater 2013;12(5):458–65
链接1
[312]
Le DM, Kulangara K, Adler AF, Leong KW, Ashby VS. Dynamic topographical control of mesenchymal stem cells by culture on responsive poly(ε-caprolactone) surfaces. Adv Mater 2011;23(29):3278–83
链接1
[313]
Kloxin AM, Kasko AM, Salinas CN, Anseth KS. Photodegradable hydrogels for dynamic tuning of physical and chemical properties. Science 2009;324(5923):59–63
链接1
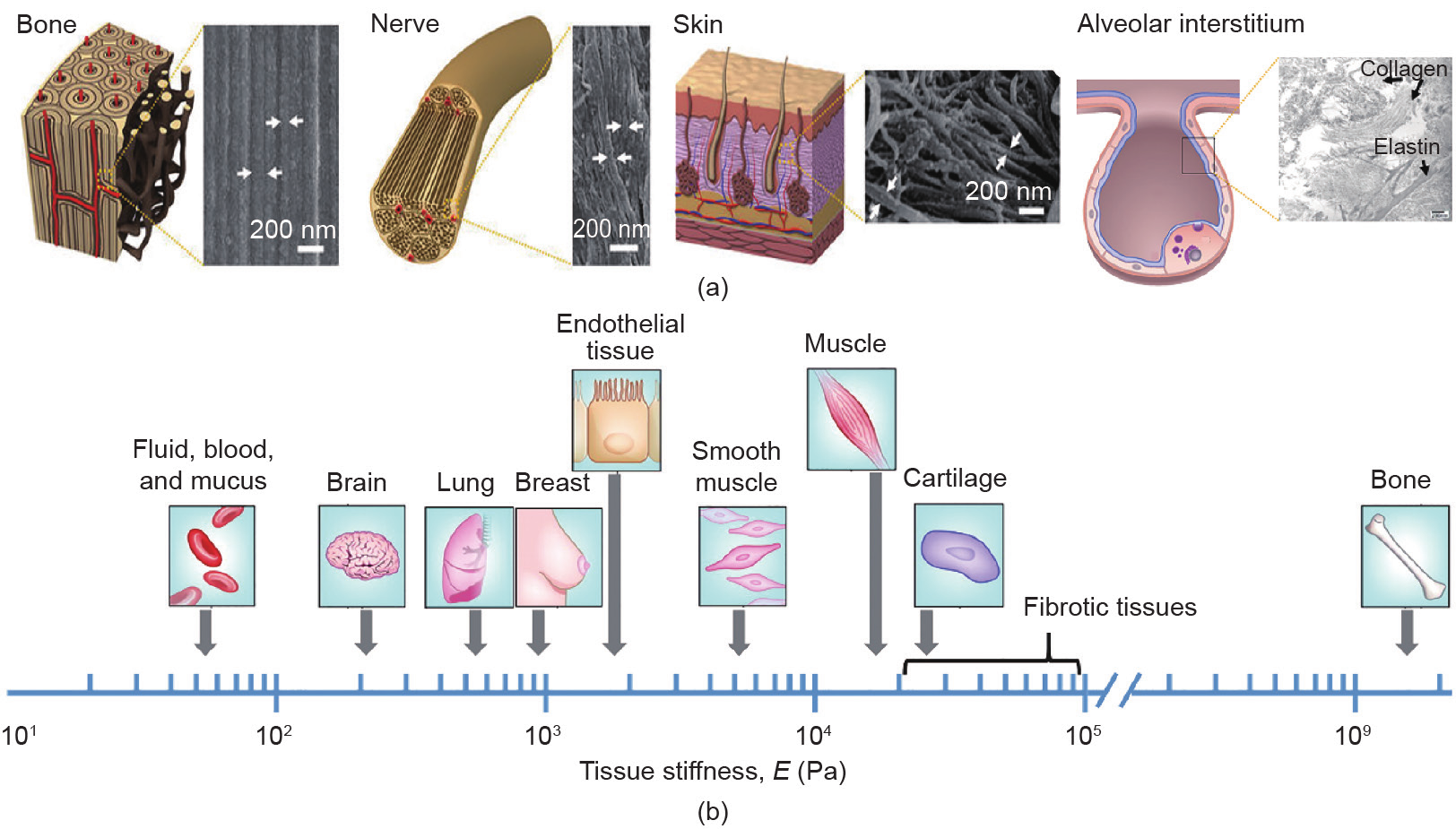
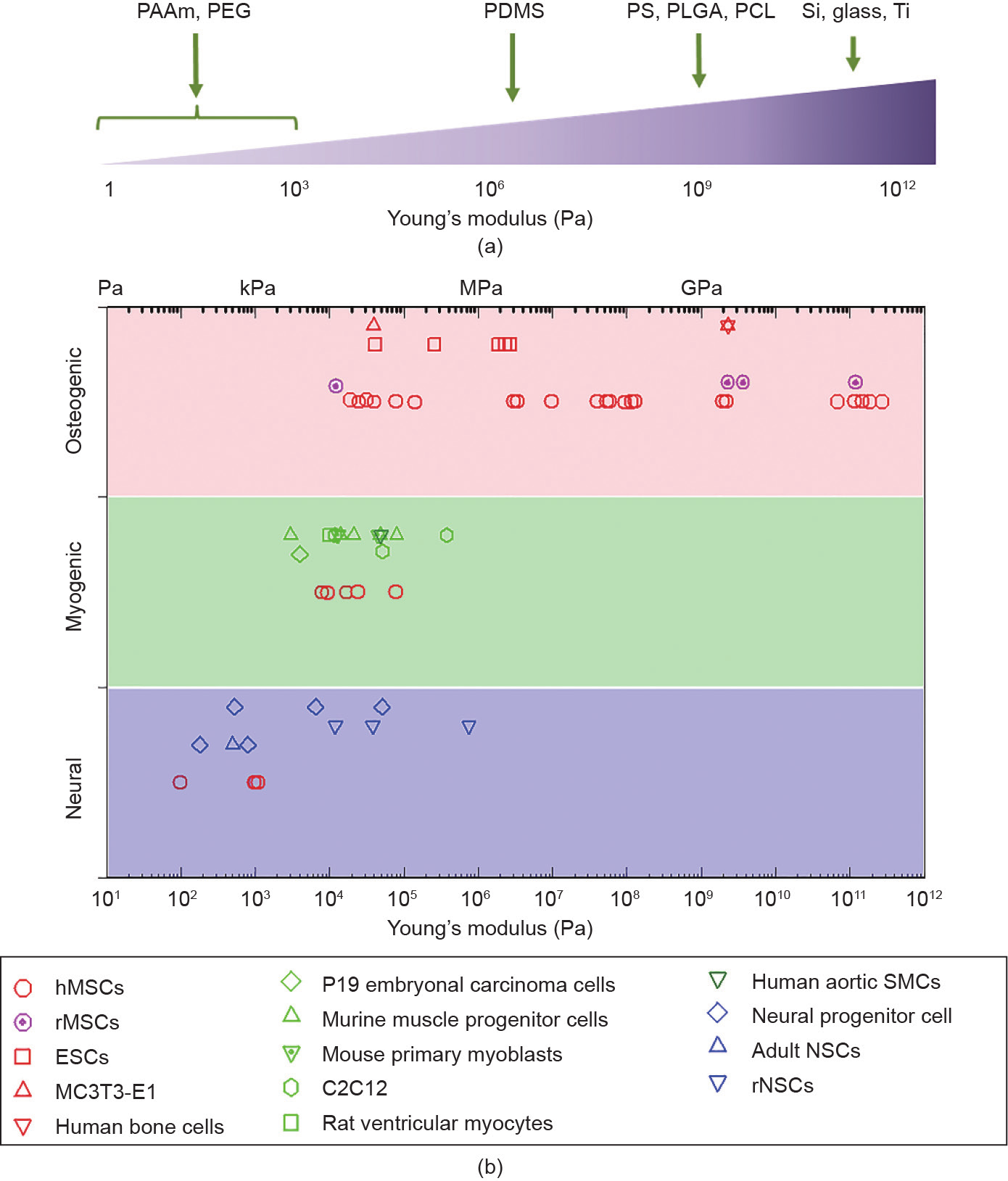
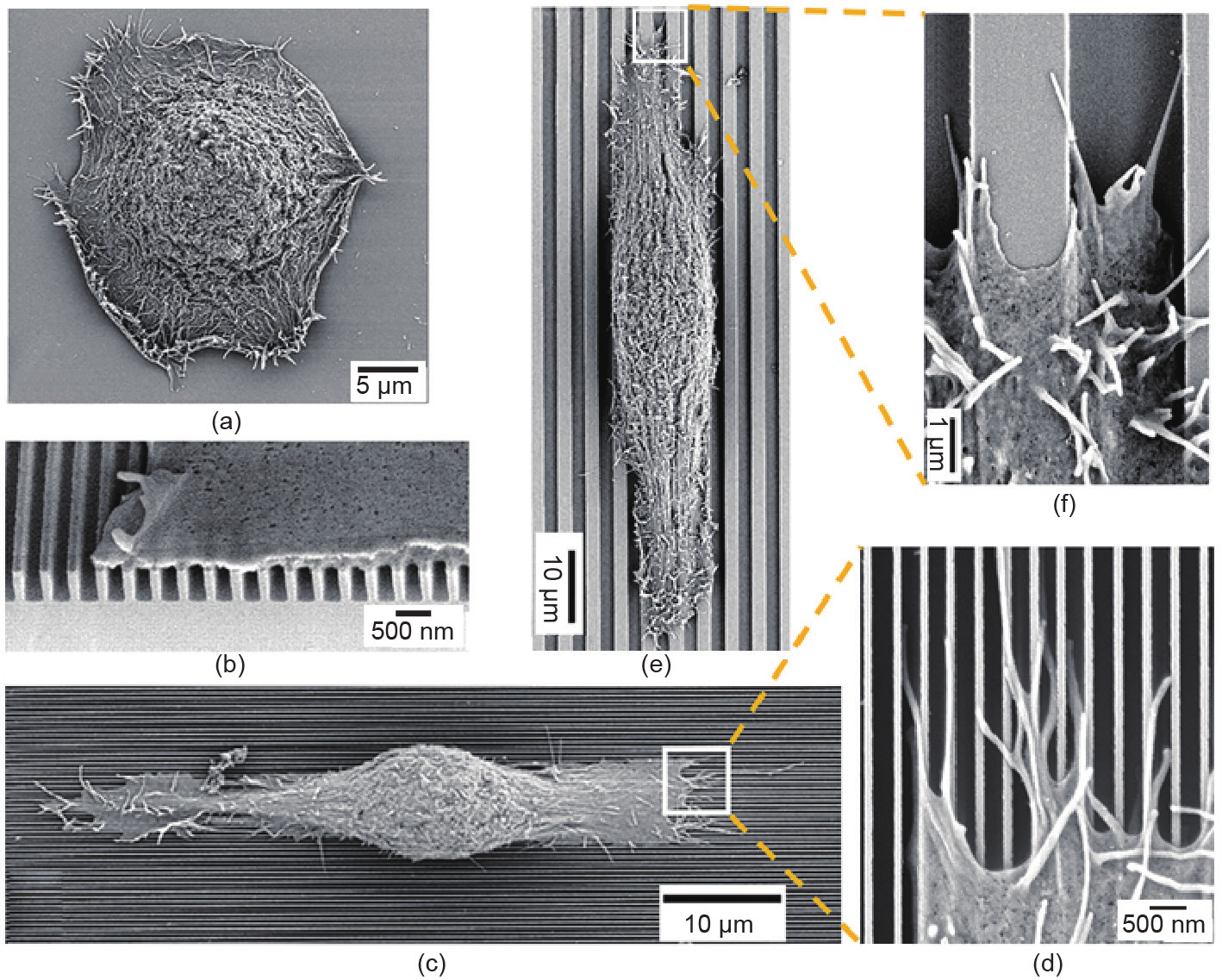
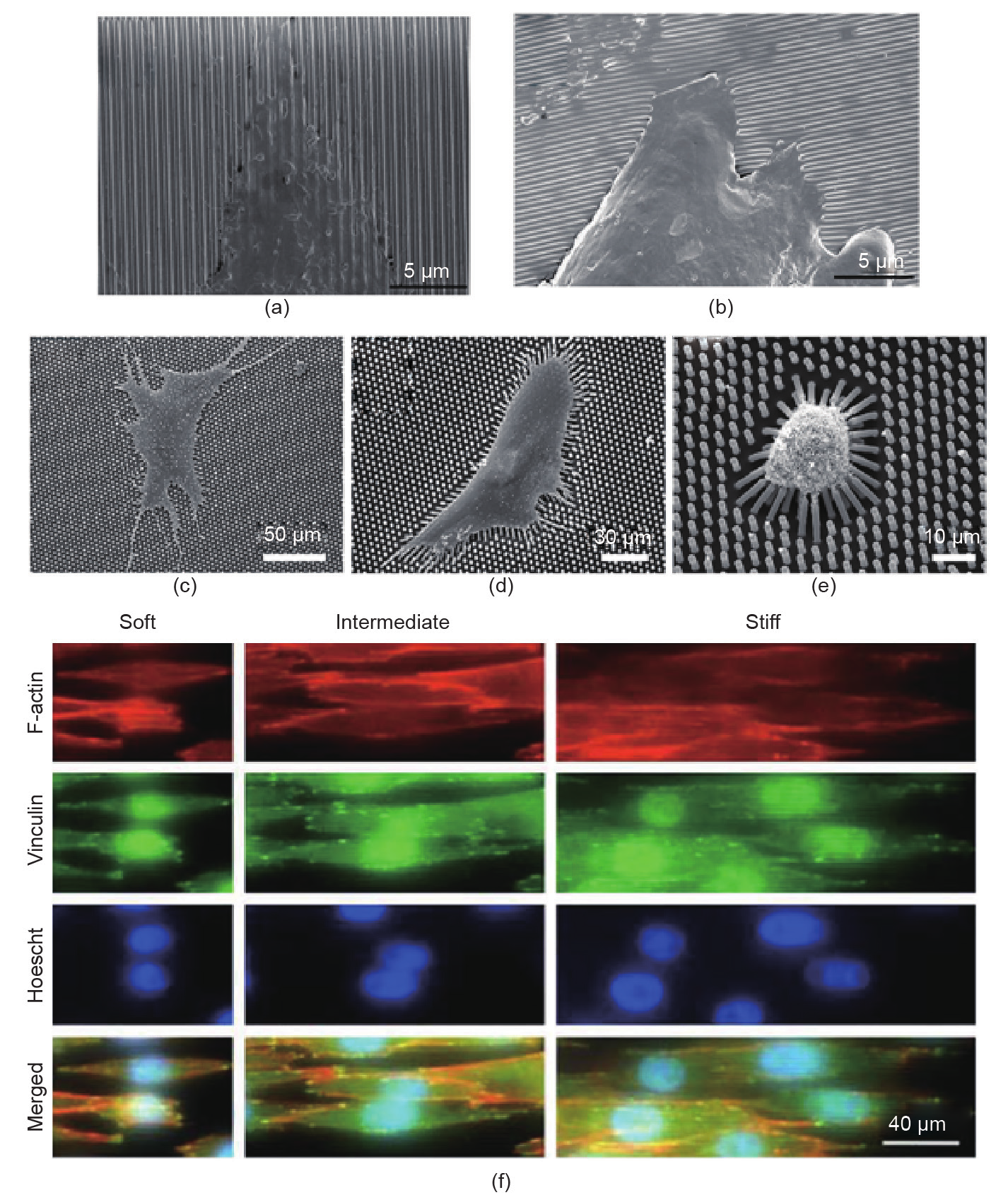
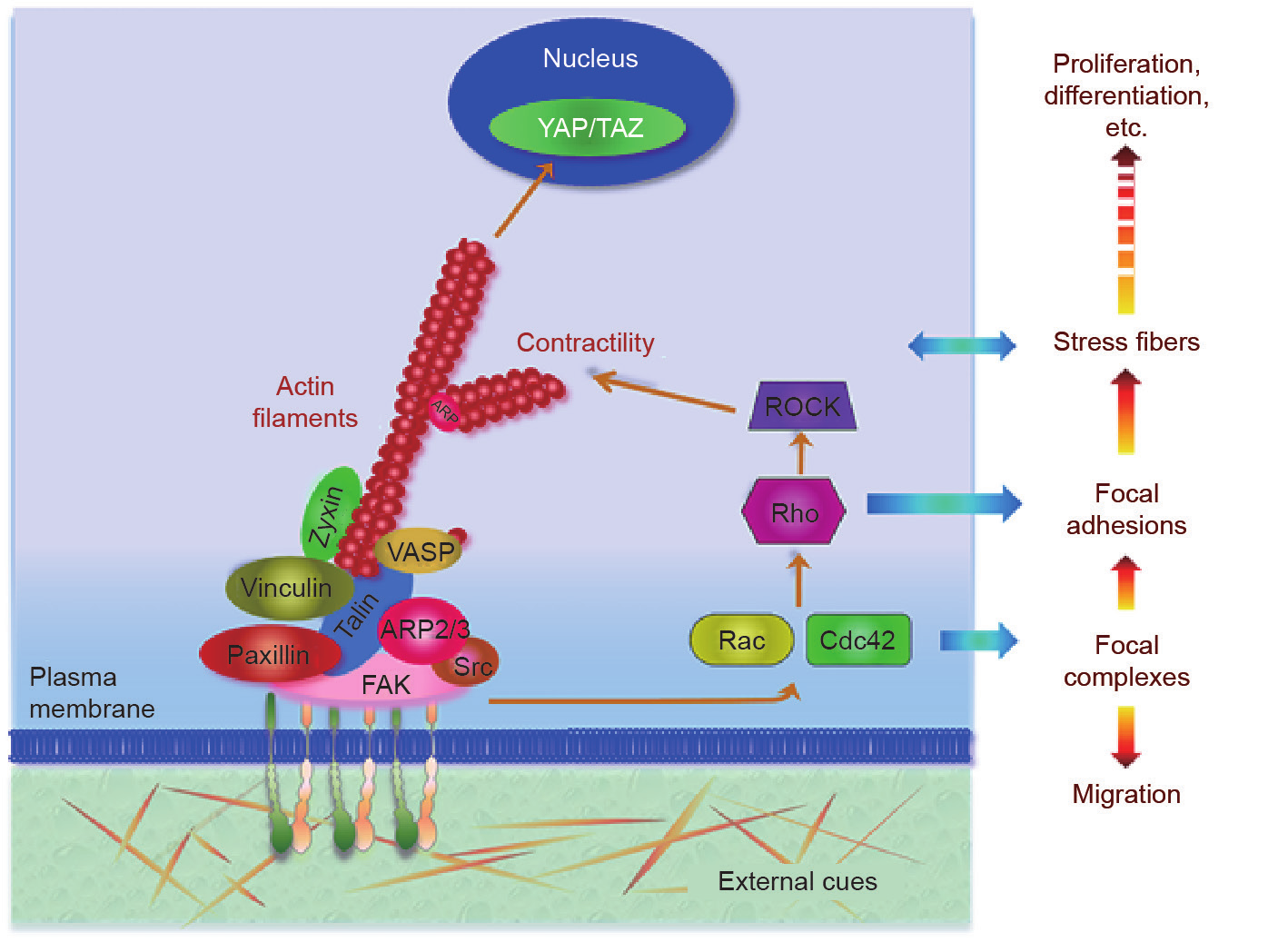
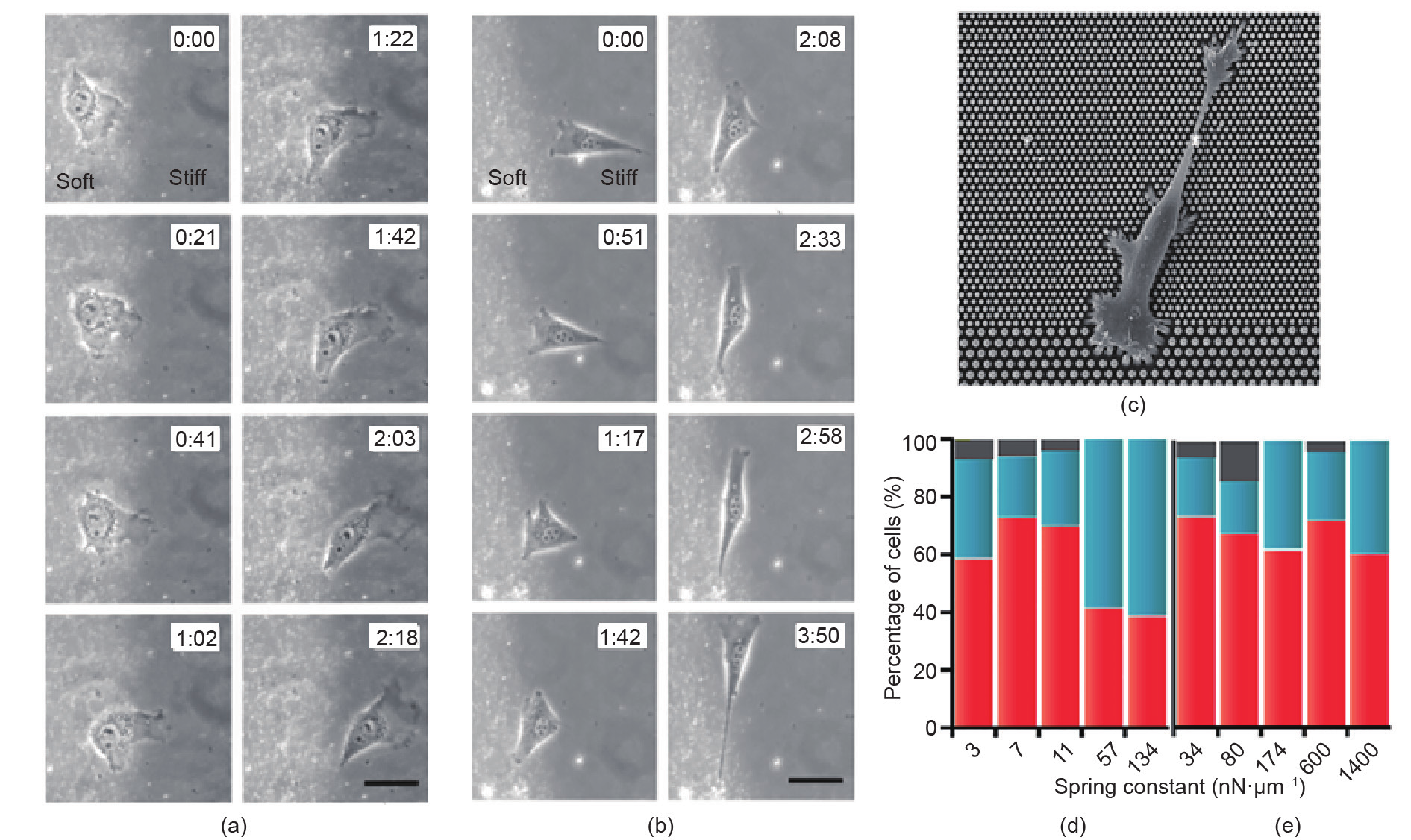
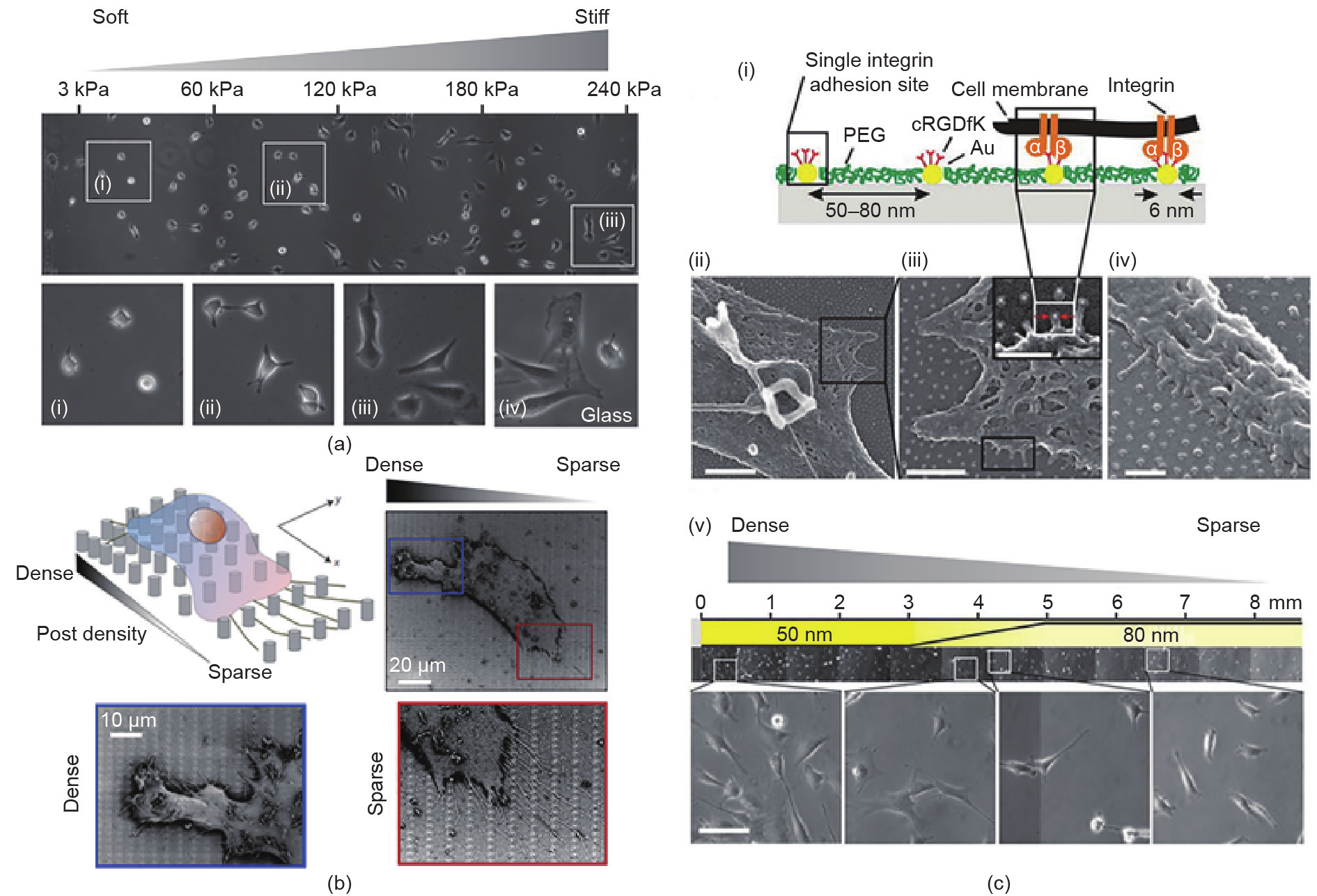
 成正比:
成正比:













 京公网安备 11010502051620号
京公网安备 11010502051620号




