《1.引言》
1.引言
1,5-戊二胺(尸胺)是一种具有多种活性的天然多胺,广泛存在于原核生物和真核生物中,在生物体中由L-赖氨酸经赖氨酸脱羧酶直接脱羧生成。1,5-戊二胺在保护细胞免受低pH环境中H+的伤害,维持菌体在酸性环境及在缺乏磷酸盐和氧气的环境中存活方面起着重要作用[1,2]。而且1,5-戊二胺在植物生长发育、细胞信号传递、胁迫响应及抗虫等多个方面发挥作用[3]。此外,1,5-戊二胺与动物的生长[4]和癌细胞的增生[5,6]有密切的关联。因而,1,5-戊二胺在农业、食品和医药领域有着广泛的应用。此外,由于其结构和性质与石油化工来源的己二胺类似,可替代己二胺用于聚酰胺、聚氨酯、重金属结合剂等产品的生产中[7,8],因此1,5-戊二胺正日益成为一种重要的工业化学品,特别是在利用1,5-戊二胺与生物来源的二元酸聚合制备完全生物基聚酰胺方面有广阔的应用前景。目前,1,5-戊二胺可以通过微生物发酵或全细胞催化生产两种途径获得。由于L-赖氨酸是1,5-戊二胺的前体,因此在微生物发酵生产方面,传统的赖氨酸生产菌种谷氨酸棒状杆菌(C.glutamicum)[9]和大肠杆菌(E.coli)[10]是主要的基因工程技术改造出发菌。而在全细胞催化研究方面则较多使用过表达赖氨酸脱羧酶的E.coli作为催化剂[11,12]。本文将对1,5-戊二胺在细菌中的合成及代谢调控机制、生理学功能、生物合成方法和应用现状进行详细论述,并对生物法生产1,5-戊二胺的研究进行展望。
《2.细菌中1,5-戊二胺的代谢》
2.细菌中1,5-戊二胺的代谢
《2.1.1,5-戊二胺的代谢》
2.1.1,5-戊二胺的代谢
1,5-戊二胺是L-赖氨酸的脱羧产物,因而其生物合成与L-赖氨酸的合成密切相关。在生物体中存在两种赖氨酸合成途径:一种是二氨基庚二酸(DAP)途径,主要存在于细菌和植物中;另一种是α-氨基己二酸(AAA)途径,主要存在于高等真菌和古生菌中,两个途径间没有直接的进化关系[13,14]。其中,DAP途径存在三条不同的合成DAP路径[15–17],如图1所示。
《图1》
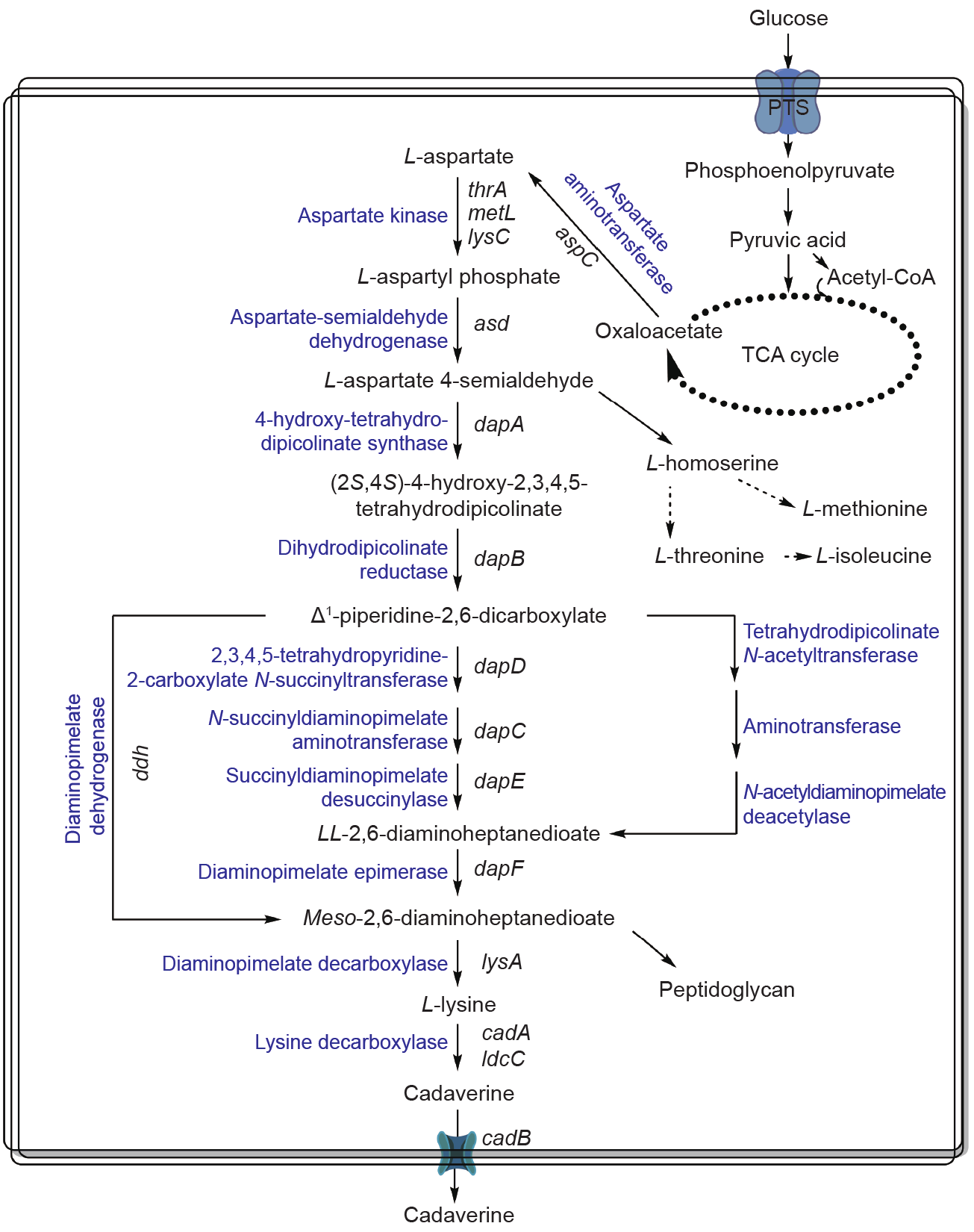
图1.二氨基庚二酸(DAP)途径合成1,5-戊二胺。
第一条路径生成琥珀酰化的中间代谢物,是DAP途径中使用最多的一条路径,广泛分布在真细菌(eubac-teria)[18]、低等真菌[19]、植物[20]及古细菌中[14,21]。第二条路径生成乙酰化的中间代谢物,目前仅在一些芽孢杆菌中发现,如巨大芽孢杆菌(Bacillus megaterium)[18,22]。第三条路径利用二氨基庚二酸脱氢酶由Δ1-哌啶-2,6-二羧酸一步合成消旋-2,6-二氨基庚二酸,该路径分布较少,目前已知在一部分细菌,如C.glutamicum、球形芽孢杆菌(Bacillus sphaericus)、假单胞菌属(Pseu-domonas spp.)和短杆菌属(Brevibacterium spp.),以及一些植物,如大豆、玉米和小麦中使用[13,18]。
目前对于微生物中1,5-戊二胺的合成调控机制在E.coli中已有深入的研究。E.coli中存在两种赖氨酸脱羧酶,一种为组成型表达的LdcC蛋白[23],另一种为诱导型表达的CadA蛋白[24],它们的DNA和氨基酸序列相似度分别为68%和69%,但最适pH分别为7.6(LdcC)和5.6(CadA)[25]。此外,CadA具有更好的热稳定性和催化脱羧活力[25,26]。
CadA蛋白是E.coli Cad系统中的重要组成部分,Cad系统在环境为低pH及有高浓度L-赖氨酸存在时被诱导表达,从而应对酸胁迫对菌体的伤害[27]。Cad系统主要包括负责合成赖氨酸脱羧酶(CadA)和赖氨酸/戊二胺双向转运蛋白(CadB)的cadBA操纵子以及调控蛋白CadC两部分[28,29]。CadC蛋白是一个多功能的内膜蛋白,它由一个位于胞质的含有螺旋-转角-螺旋DNA结合结构域的N端、一个跨膜结构域(TM)和一个位于周质的C端组成[30]。其中,N端可以与cadBA启动子上游的Cad1和Cad2区域结合,激活cadBA起始转录[31];C端具有pH感测功能,负责感应环境中的pH变化[32],而跨膜结构域(TM)和其位于周质的部分氨基酸可以与赖氨酸透过酶(LysP)通过形成盐桥或二硫键等方式特异性结合[30]。LysP是L-赖氨酸特异性的透过酶,其在Cad系统通过响应胞外L-赖氨酸浓度及调控激活蛋白CadC方面起到重要作用[30,33,34]。另外,组蛋白样蛋白H-NS也参与了调控cadBA操纵子的转录,起到在非诱导环境下抑制细胞CadA和CadB蛋白合成的作用[35,36]。
Cad系统的表达调控如图2所示,在正常的生长环境下,E.coli中H-NS蛋白结合到操纵子cadBA的启动子上游–144~–112bp的Cad1区和–89~–59bp的Cad2区,抑制了基因cadBA的表达[31,35,36]。同时,激活蛋白CadC因为与LysP结合而固定在细胞内膜上,无法行使其转录激活功能,因而此时操纵子cadBA无法表达,胞内没有1,5-戊二胺的积累[37]。当菌体处于酸胁迫(pH<6.8)且环境中有充足的L-赖氨酸(>5mmol•L–1)时,过量的H+与CadC蛋白和LysP蛋白结合,会使两者构象发生改变,并使两者间的二硫键断裂,从而减弱了两者间的相互作用,这种减弱现象会随环境中pH的降低而增强[32,37]。此外,LysP蛋白因结合和转运L-赖氨酸而发生构象的进一步改变,从而与CadC蛋白彼此分离[30,38]。激活的CadC蛋白随即取代H-NS蛋白,与cadBA启动子上游Cad1和Cad2区域结合,并激活cadBA的转录和表达[36,38]。随着1,5-戊二胺的含量增加,过量的1,5-戊二胺(>235μmol•L–1[37])通过结合到CadC蛋白的二聚体界面使其失活,从而关闭cadBA操纵子的转录[28,39]。此外,L-赖氨酸脱羧酶的活性被ppGpp所抑制,ppGpp是菌体应急应答的效应物,在细胞氮源缺乏条件下大量合成,这种调控方式可以减少L-赖氨酸的过度消耗[40]。
除E.coli中的Cad系统外,在乳酸菌Lactobacillus saerimneri30a中发现另一1,5-戊二胺合成系统——KDC系统,其包含一个L-赖氨酸专一性的脱羧酶和一个双功能的双向转运蛋白,该蛋白既可以双向转运鸟氨酸/丁二胺,又可以双向转运赖氨酸/戊二胺[41]。
《图2》
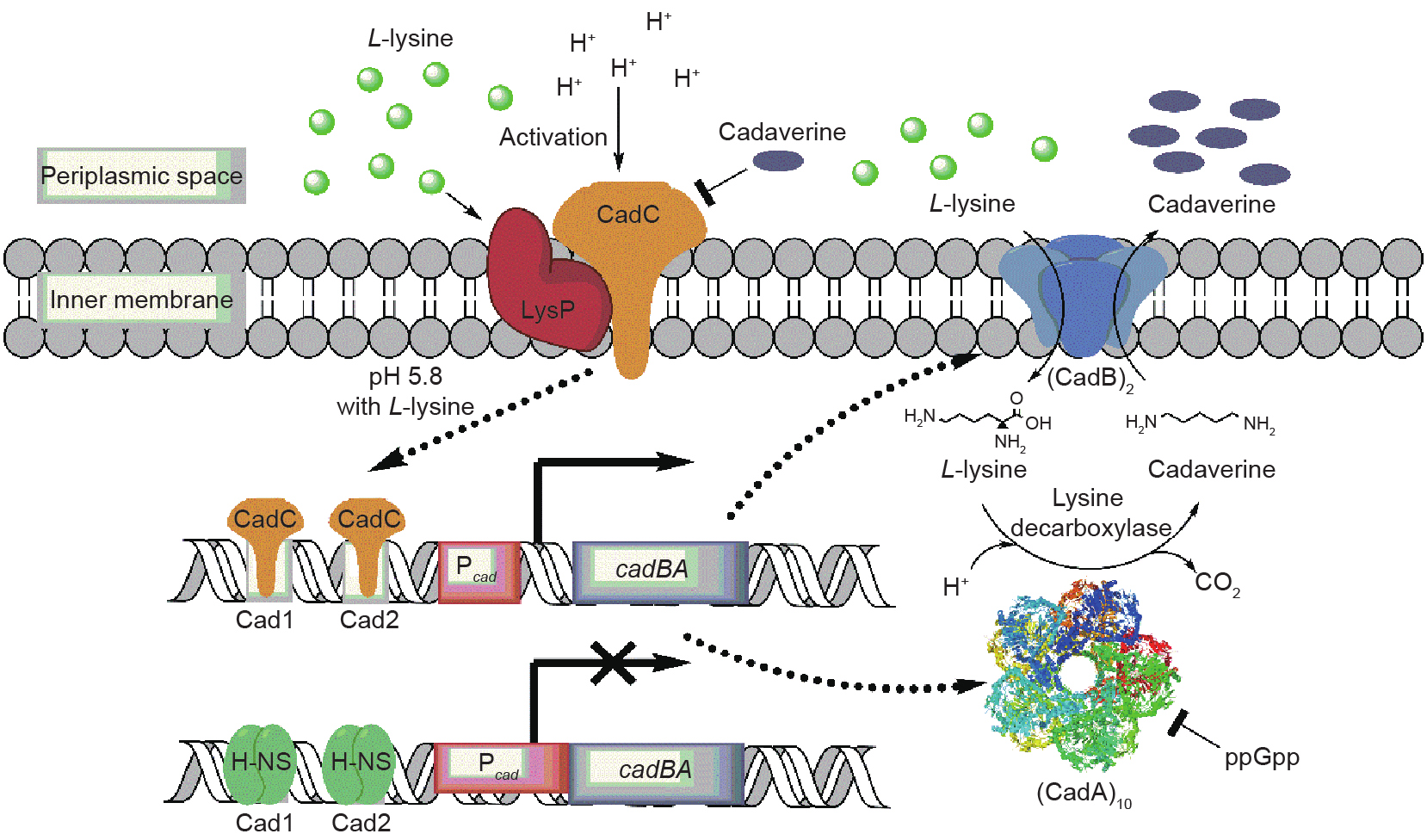
图2.E.coli中1,5-戊二胺的合成调控。
《2.2.1,5-戊二胺的中间代谢》
2.2.1,5-戊二胺的中间代谢
在1,5-戊二胺的胞内分解和利用方面,尚没有证据表明在E.coli中存在相关路径[8],但在其他一些微生物中存在以1,5-戊二胺为中间代谢物的代谢路径。戊二胺的乙酰化已经在C.glutamicum中被深入研究。C.glutamicum的NCgl1469基因产物被发现具有戊二胺乙酰转移酶功能,负责合成N-乙酰戊二胺。缺失试验表明,敲除NCgl1469的菌株不能合成N-乙酰-戊二胺且1,5-戊二胺生成量提高了11%[42]。在嗜热古菌(Pyrococcus furiosus)中发现胍丁胺/戊二胺氨丙基转移酶(ACAPT),可以将1,5-戊二胺转化为N-(3-氨丙基)-戊二胺(APC)[43]。在一些假单胞菌(Pseudomonas)中,推测1,5-戊二胺能被转氨酶催化生成α-哌啶,进而氧化生成δ-氨基戊酸(AMV)[44]。
此外,在一些严格厌氧菌中,1,5-戊二胺是细胞壁的重要组成成分之一,在连接外膜和肽聚糖方面起到重要作用[45]。这一现象最早由Kamio等[46,47]在反刍月形单胞菌(Selenomonas ruminantium)的细胞壁肽聚糖中发现。而后在产碱韦荣球菌(Veillonella alcalescens)[48]、小韦荣球菌(Veillonella parvula)[49]和解脂厌氧弧菌(An-aerovibrio lipolytica)[50]中陆续发现,它们都有相同的肽聚糖重复单位结构[45,50],如图3所示。
《图3》
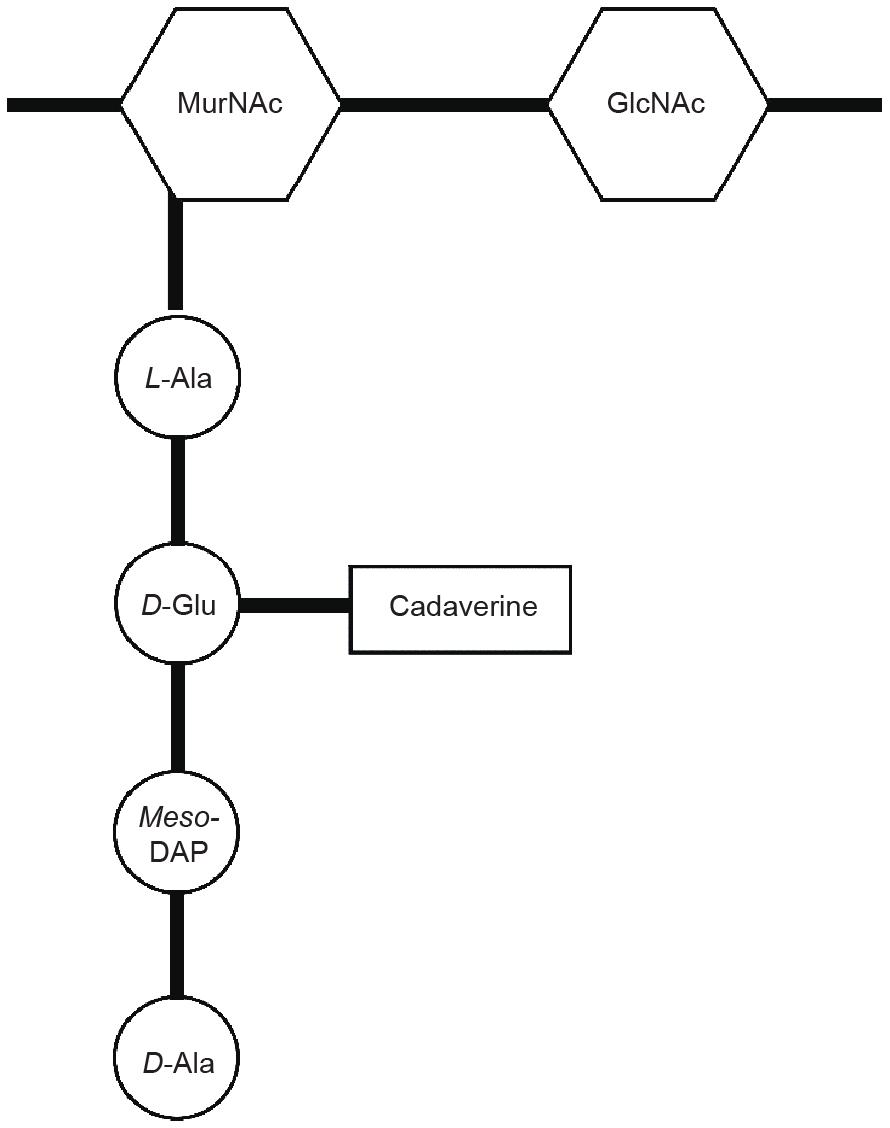
图3.含有1,5-戊二胺的肽聚糖结构。
1,5-戊二胺还参与铁载体的合成,铁载体被分泌到环境中,并以高亲和力结合环境中的Fe3+[51,52]。目前已知的1,5-戊二胺参与合成的铁载体(图4)包括:arthrobactin[51,53]、bisucaberin B[54]、bisucaberin[55]、desferrioxamine B[56–58]、desferrioxamine E[57,59]、desferrioxamine G1[60]等。
《图4》
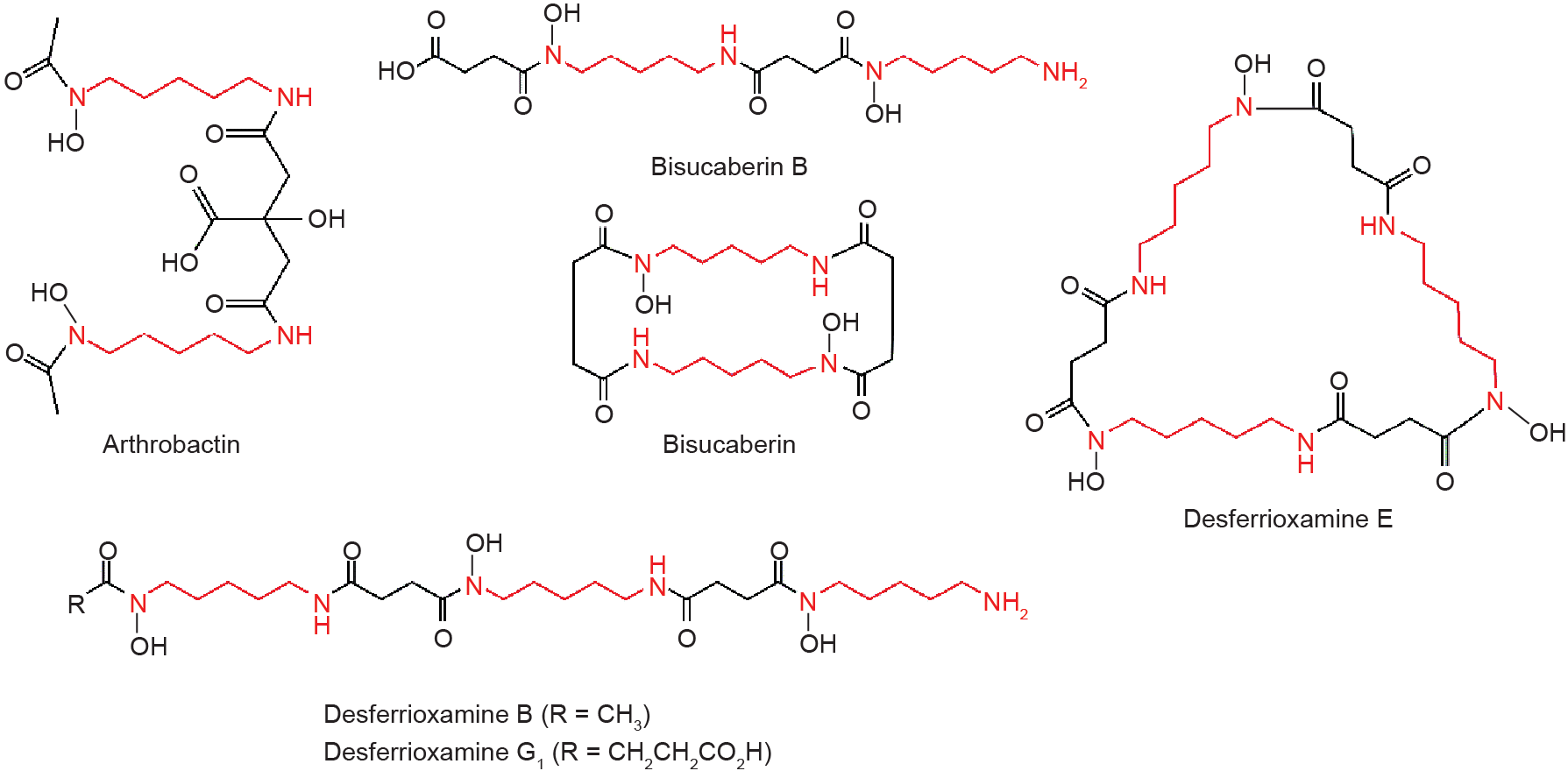
图4.含有1,5-戊二胺的铁载体。
《3.1,5-戊二胺的生物合成》
3.1,5-戊二胺的生物合成
在生物体中,1,5-戊二胺是由赖氨酸脱羧酶直接脱羧L-赖氨酸生成。然而应用酶催化直接生产1,5-戊二胺的研究却较少报道,由于赖氨酸脱羧酶存在产物抑制现象,其在3g•L–1的1,5-戊二胺溶液中,活力会降低50%[61]。仅在近期一篇研究中,作者尝试利用戊二醛交联法固定化赖氨酸脱羧酶进行催化生产,然而其固定化后的产率和酶活性仅剩余30.5%和8.04%[62]。因此目前仍无法直接利用游离酶或固定化酶直接催化生产1,5-戊二胺。但在利用代谢工程菌直接发酵生产或添加前体L-赖氨酸通过全细胞催化生产两个方面取得了较大的突破。
《3.1.代谢工程改造菌株合成戊二胺》
3.1.代谢工程改造菌株合成戊二胺
在微生物发酵生产方面,由于L-赖氨酸是1,5-戊二胺的直接前体,因而1,5-戊二胺的生产菌株构建主要以广泛研究的赖氨酸生产菌种C.glutamicum为出发菌。谷氨酸棒状杆菌自1957年由Kinoshita等筛选出至今已60多年的时间[63],作为L-赖氨酸的主要生产菌的研究也已经超过50年的历史[7]。特别是近年来的代谢工程改造[64–69],大大提升了菌株的L-赖氨酸生产能力,现已实现经过30h分批补料发酵可产出120g•L–1的L-赖氨酸,生产强度达到4g•L–1•h–1,糖转化率达到0.55g(L-赖氨酸)•g(葡萄糖)–1[7,70]。目前利用C.glutam-icum每年生产近2×106t的L-赖氨酸[71]。
C.glutamicum因具有高效合成L-赖氨酸的能力而最早被改造为1,5-戊二胺生产菌株。Mimitsuka等[72]通过在C.glutamicum的高丝氨酸脱氢酶基因(hom)位点敲入来自E.coli的赖氨酸脱羧酶基因cadA,构建了一株L-高丝氨酸营养缺陷型C.glutamicum菌株,经过18h发酵产出1,5-戊二胺2.6g•L–1。但试验同时也发现有2.3g•L–1的L-赖氨酸残余,因而推测由于C.glutamicum缺少1,5-戊二胺的外排蛋白,导致胞内高浓度的1,5-戊二胺积累,进而抑制了赖氨酸脱羧酶的活力。这一推测经Li等[73]的试验得以证实,Li等通过在C.glutamicum中过表达E.coli的赖氨酸/戊二胺双向转运蛋白(CadB)和蜂房哈夫尼菌(Hafnia alvei)的赖氨酸脱羧酶(Ldc),使1,5-戊二胺的外排速率增加了22%,总产量及发酵液中1,5-戊二胺的含量分别增加了30%和73%[73]。类似的调控细胞通透性的研究还有Matsushima等[74]通过在发酵的对数中期添加吐温-40使1,5-戊二胺的收率比不添加吐温-40提高1.5倍。
在C.glutamicum生产1,5-戊二胺研究方面取得重大突破的是Kind等[42],他们在系统地研究了C.glutam-icum的L-赖氨酸生产的基础上,通过转录组研究发现了与1,5-戊二胺转运相关的一个转运蛋白超家族透过酶cg2893,其在C.glutamicum中的过表达可使1,5-戊二胺的葡萄糖收率提高20%、产率提高40%[61]。
其后以L-赖氨酸高产菌株C.glutamicumLYS-12[70]为出发菌,将经密码子优化的E.coliLdcC基因整合在基因组中表达,并缺失N-乙酰转移酶NCgl1469和L-赖氨酸外排蛋白(LysE),并将染色体上cg2893的启动子替换为强启动子Psod,构建得到1,5-戊二胺生产菌C.glutam-icumDAP-16,经过50h的补料发酵,1,5-戊二胺的产量达到了88g•L–1、生产强度达到2.2g•L–1•h–1、葡萄糖转化率达到0.29g(1,5-戊二胺)•g(葡萄糖)–1[75]。而后,Buschke等[76]通过对比C.glutamicum利用葡萄糖和木糖在代谢流和转录组的差异,找到影响C.glutamicum利用木糖发酵生产1,5-戊二胺的关键基因,从而构建了过表达果糖二磷酸酶(fbp)和tkt操纵子,抑制异柠檬酸脱氢酶(icd)的表达及敲除赖氨酸转运蛋白(lysE)和N-乙酰戊二胺合成基因cg1722,并异源表达了E.coli中的木糖异构酶基因xylA和木酮糖激酶基因xylB,成功构建了一株利用木糖作为碳源的基因工程菌,经补料分批发酵,最终1,5-戊二胺的产量达到103g•L–1、木糖转化率达到32%。
除C.glutamicum外,E.coli也具有高效合成L-赖氨酸的能力。基于E.coli和C.glutamicum有类似的L-赖氨酸合成途径及代谢调控方式,对其也进行了类似的代谢途径改造和发酵条件优化以合成L-赖氨酸[77–80],现已实现L-赖氨酸产量为136g•L–1、生产强度达到2.8g•L–1•h–1、糖转化率达到0.56g(1,5-戊二胺)•g(葡萄糖)–1[81]。然而,利用E.coli发酵生产1,5-戊二胺的研究尚未深入展开,目前最高产量仅为9.61g•L–1、生产强度为0.32g•L–1•h–1、葡萄糖转化率为0.12g(1,5-戊二胺)•g(葡萄糖)–1[10]。E.coli中1,5-戊二胺转化率低可能有两个原因:一是E.coli对1,5-戊二胺的低耐受,0.3~0.5mol•L–11,5-戊二胺处理8h即会抑制E.coli的生长并造成细胞裂解[10];其二是1,5-戊二胺影响E.coli细胞膜的通透性。研究表明1,5-戊二胺作用于细菌膜孔蛋白OmpC和OmpF,并呈现出浓度依赖性的膜孔关闭现象[82,83],且周质中,1,5-戊二胺关闭膜孔的能力强于胞外[84]。因而,E.coli的能量摄取和毒害产物外排效率都将降低,从而阻碍了L-赖氨酸转化为1,5-戊二胺。由于E.coli具有合成高浓度L-赖氨酸的能力,且具有高的赖氨酸脱羧酶活力[12],因而,E.coli是非常有潜力的1,5-戊二胺生产菌种,但其合成1,5-戊二胺的能力还没有得到充分开发。
在拓宽1,5-戊二胺发酵的底物谱方面也有部分研究报道,如Tateno等[85]在C.glutamicum中过表达牛链球菌(Streptococcus bovis 148)α-淀粉酶基因(amyA)和赖氨酸脱羧酶基因(cadA),以可溶性淀粉为碳源发酵生产1,5-戊二胺,发酵21h,1,5-戊二胺的产量可以达到2.24g•L–1。通过将E.coli的赖氨酸脱羧酶基因在甲醇芽孢杆菌(Bacillus methanolicus)中进行异源表达,实现了以甲醇为碳源发酵生产1,5-戊二胺,经过高密度补料分批发酵,1,5-戊二胺产量达到11.3g•L–1[86]。
《3.2.全细胞催化合成戊二胺》
3.2.全细胞催化合成戊二胺
全细胞催化法生产1,5-戊二胺是一种非常有前景的生产方法,因其操作相对简单、生产效率高、目标产物浓度高且成分较为单一,降低了下游分离纯化的成本。此外,由于全细胞催化法生产1,5-戊二胺的前体L-赖氨酸的商业化生产已经非常成熟,L-赖氨酸年产量达到百万吨[8]。
与以C.glutamicum为主发酵生产1,5-戊二胺不同,全细胞催化剂的构建通常以E.coli为主。最早应用全细胞催化法生产1,5-戊二胺的报道是Nishi等[87]通过利用过表达赖氨酸脱羧酶CadA的E.coli菌株,经过6h的补料转化生产得到69g•L–1的1,5-戊二胺溶液,生产强度达到了11.5g•L–1•h–1[87]。
在全细胞催化法生产过程中,细胞通透性是主要的制约因素之一,细胞壁和细胞膜的天然属性限制了底物进入胞内以及产物的快速外排[88,89],因此一个高效的底物/产物转运系统对全细胞催化法的应用至关重要。虽然细胞通透性可以通过化学法(如加入表面活性剂或溶剂)或物理法(如热激细胞)等方式进行调控[90],但这些处理会造成细胞损伤,并导致后续分离纯化的困难[88]。因而,利用分子生物学技术对全细胞催化剂的细胞结构进行微调则更具优势。对于1,5-戊二胺的转运,E.coli中存在一个赖氨酸/戊二胺双向转运蛋白(CadB),可以同步将胞内1,5-戊二胺外排和将胞外L-赖氨酸转至胞内,且这一过程并不需要消耗能量[29,91],因而非常适合1,5-戊二胺全细胞催化系统。Ma等[11]最先研究了过表达CadB对全细胞催化剂活力的影响,结果表明共同过表达赖氨酸脱羧酶(CadA)和N端融合了来源于Erwinia carotovora果胶酸裂解酶的pelB信号肽的赖氨酸/戊二胺双向转运蛋白(CadB),可有效改善菌株细胞通透性,利用构建得到的菌株BL-DAB可催化得到221±6g•L–1的1,5-戊二胺转化液,L-赖氨酸的摩尔转化率达到92%以上。
此外,磷酸吡哆醛(PLP)作为赖氨酸脱羧酶的辅酶,对静息细胞的催化活力影响较大。研究表明,赖氨酸脱羧酶的酶活与PLP含量呈正相关,1mol的赖氨酸脱羧酶蛋白需要1.0~1.2mol的PLP才能达到最大酶活性[24]。Kim等[92]的研究表明,使用静息细胞在不添加PLP的条件下,1mol•L–1的底物L-赖氨酸仅有20%转化为1,5-戊二胺,而在转化体系中添加0.025mmol•L–1PLP后,L-赖氨酸转化率可提升到80%。转化所需的PLP也可以由菌体自身合成供给,如Ma等[93]在一株过表达CadA/CadB的菌株BL-DAB中,异源表达了来源于枯草芽孢杆菌(B.subtilis)的PLP从头合成途径(R5P途径)基因,从而构建得到一株强化了胞内PLP合成的全细胞催化菌AST3。经优化蛋白表达的调控方式和培养条件,使菌体中胞内PLP含量达到1051nmol•g(DCW)–1(DCW:菌体干重),且菌体在不外源添加PLP条件下的1,5-戊二胺产率达到28g•g(DCW)–1•h–1,是菌株BL-DAB在添加0.1mmol•L–1PLP条件下的1.2倍,是菌株BL-DAB在不添加PLP条件下的2.9倍。
除PLP供给外,底物浓度对全细胞催化剂活力也有显著的影响,Oh等[12]的研究表明,在含菌量OD600为10的转化体系中,当初始底物L-赖氨酸浓度增加到150g•L–1时,细胞催化活性有显著的降低,说明在全细胞催化过程中存在较明显的底物抑制现象。这种底物抑制现象可以通过优化底物L-赖氨酸的补料方式得以解除[11]。
菌体活力的保持也是全细胞催化生产1,5-戊二胺的研究热点之一。在1,5-戊二胺的全细胞催化生产过程中,随着1,5-戊二胺浓度增加,菌体活力显著下降,Oh等[12]的研究结果表明,催化起始时的L-赖氨酸消耗速率可达40.42mmol•L–1•h–1,但整个催化生产周期的平均转化速率仅10mmol•L–1•h–1。菌体活力下降的其中一个原因是转化过程中细胞破裂,因而应用固定化细胞催化生产1,5-戊二胺的工艺在近期被广泛研究。Bhatia等[94]检测了固定化细胞和游离细胞的失活能,结果表明固定化细胞比游离细胞的失活能高10%,分别为66.7kJ•mol–1和56.9kJ•mol–1,说明固定化细胞更加稳定;菌体循环使用试验也表明游离细胞循环使用10次活力已全部丧失,而固定化细胞循环使用18次后仍保留56%的活力,表明应用固定化技术对稳定静息细胞的催化能力有一定的作用。
在1,5-戊二胺全细胞生产菌株构建中使用的赖氨酸脱羧酶除来源于E.coli诱导型蛋白CadA外,Oh等[12]在E.coli菌株中过表达了ldcC基因编码的组成型赖氨酸脱羧酶,并以含192.6g•L–1L-赖氨酸的发酵液为原料经120h催化生产出133.7g•L–1的1,5-戊二胺转化液,L-赖氨酸的转化率达到99.90%,但转化过程中的最高生产强度仅为4.1g•L–1•h–1。Li等[95]在E.coliMG1655中过表达来自产酸克雷伯氏菌(Klebsiella oxytoca)的赖氨酸脱羧酶(Ldc),并对蛋白转录的启动子进行了筛选,试验表明使用Ptac启动子调控Ldc表达的方式构建的菌株LN24具有最好的催化活力,L-赖氨酸的转化率可达92%、单位菌体的L-赖氨酸转化效率可达0.133%min–1•g–1。此外,Wang等[96]通过易错PCR(聚合酶链式反应)技术,对来自蜂房哈夫尼菌(H.alveiAS1.1009)的赖氨酸脱羧酶进行突变,获得活力提高了1.48倍的LDCE583G突变体,将该突变体导入到E.coli中,通过全细胞催化5h,L-赖氨酸的转化率为93.4%、1,5-戊二胺的最终浓度达到63.9g•L–1。
《3.3.1,5-戊二胺分离纯化》
3.3.1,5-戊二胺分离纯化
1,5-戊二胺的分离纯化主要借鉴其他二元胺的分离纯化方法,目前,比较常用的分离方法主要以溶剂萃取法为主,溶剂萃取法具有能耗低、选择性高、分离效果好、设备简单、操作方便等优点。
在萃取剂选择方面,对比了发酵液中1,5-戊二胺在正丁醇、仲丁醇、仲辛醇和环己醇中的分配系数,结果表明,正丁醇可以较好地萃取1,5-戊二胺[75]。此外,对比了4-壬基酚、2-乙基己基磷酸酯(D2EHPA)、新葵酸(Versatic acid1019)、2-壬基萘磺酸(DNNSA)和4-辛基苯甲醛作为1,5-戊二胺萃取剂的分配系数,结果表明4-壬基酚的萃取效果最好,通过一步萃取及反萃取后,1,5-戊二胺的萃取率超过了90%[97]。
经溶剂萃取后,1,5-戊二胺可以通过色谱法、精馏或加酸成盐沉淀等方式分离回收[9,98]。其中,精馏是较适合工业化中1,5-戊二胺萃取液分离纯化的方法,但其具体条件需要依据萃取液中1,5-戊二胺的浓度、萃取剂的物性等因素的变化而确定。
为避免由于精馏过程中高温造成的1,5-戊二胺分解,文献[99]中的专利公开了一种在精馏过程中添加高沸点溶剂的方法。该方法通过添加高沸点溶剂,如C14烷或C11/C14混合烷,以提高在减压精馏过程中物料的流动性。结果表明,仅100%的1,5-戊二胺可以在低于1,5-戊二胺的沸点50℃,即130℃下被回收。
1,5-戊二胺的分离纯化方法虽取得了一定进展,但还没有达到商业化生产的要求。由于使用1,5-戊二胺单体进行的聚合反应中,要求1,5-戊二胺的纯度至少要达到99.5%,因此开发出满足工业化生产需求的生物基1,5-戊二胺的分离纯化工艺对1,5-戊二胺的产业化具有重要的意义。
《4.1,5-戊二胺在生物基聚酰胺制备中的应用》
4.1,5-戊二胺在生物基聚酰胺制备中的应用
《4.1.生物基聚酰胺研究进展》
4.1.生物基聚酰胺研究进展
生物基聚酰胺(尼龙)研究从20世纪40年代开始,近年来,由于经济和环境的因素,生物基聚酰胺成为研究的热点。据欧洲生物塑料协会统计,全球生物基塑料在2014年的产量约为1.7×106t,预计到2019年,将达到7.8×106t[100]。
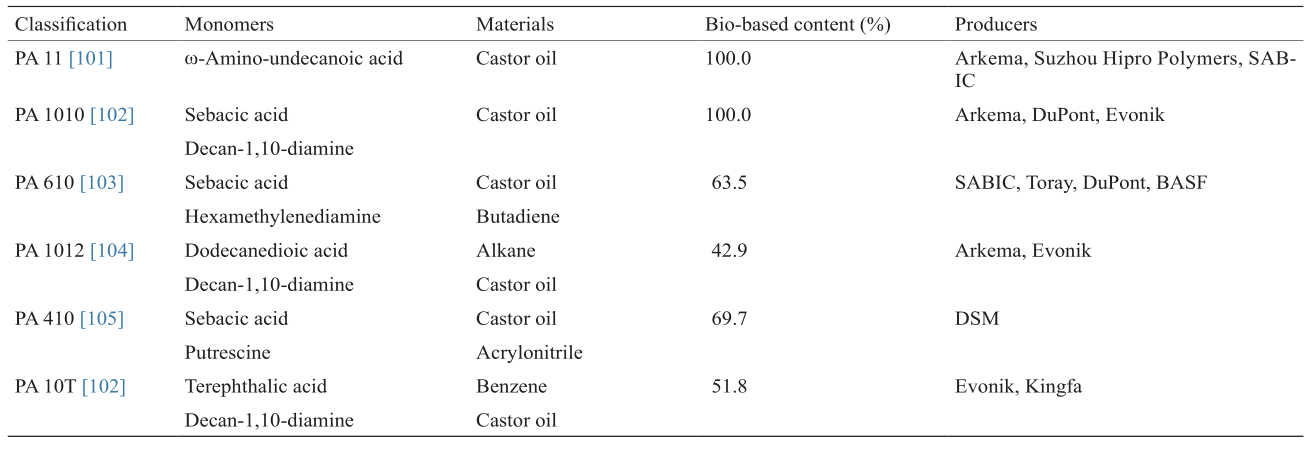
现已商品化的生物基聚酰胺主要有完全生物基聚酰胺(如PA11、PA1010)和部分生物基聚酰胺(如PA610、PA1012、PA410、PA10T等),其分类及生产商见表1[101–105]。目前规模化生产的生物基聚酰胺单体主要是以蓖麻油为原料制备的癸二酸、癸二胺和ω-氨基十一烷酸,其制备路线如图5所示[106–108]。
《表1》
表1 已商品化的生物基聚酰胺的分类及生产商
《图5》
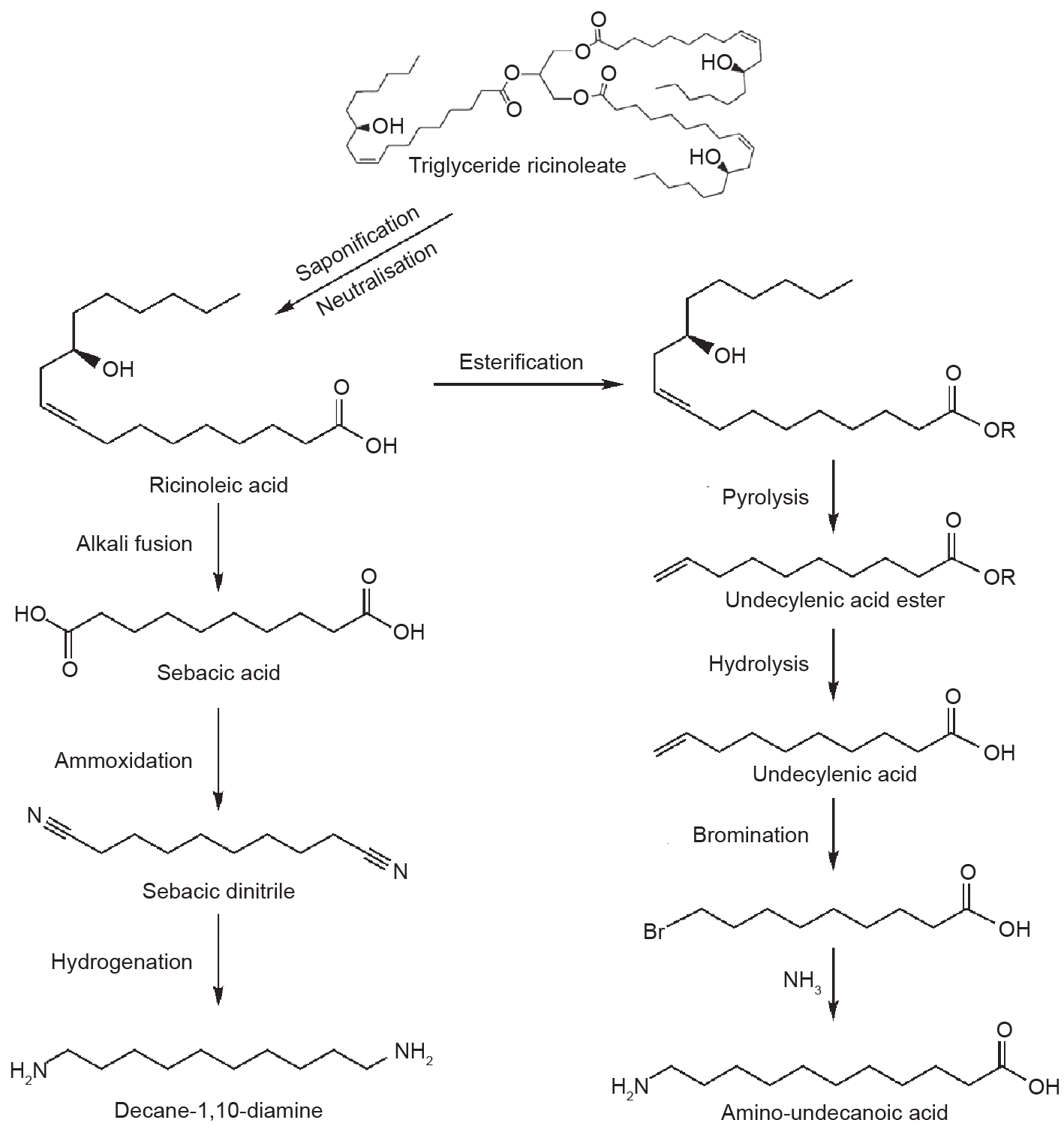
图5.蓖麻油制备癸二酸、癸二胺和ω-氨基十一烷酸。
除上述已商品化的生物基聚酰胺外,一些新型完全生物基聚酰胺也正在广泛研究,如生物基PA46、PA6和PA5X等。完全生物基PA46是基于生物基己二酸和丁二胺聚合而成。生物基己二酸的生产研究已经非常深入,使用不同可再生原料的生产路线已被开发出来,例如,Draths等[109]和van Duuren等[110]分别利用酶转化法和发酵法以D-葡萄糖为原料生成顺,顺-己二烯二酸,而后通过加氢还原得到己二酸;Lange等[111]将纤维素酸解得到乙酰丙酸,再经氢化、脱水,生成γ-戊内酯,其后经酯交换、加成、水解等反应获得己二酸;Boussie等[112]以纤维素为原料催化氧化葡萄糖二酸,经过催化加氢得到己二酸。1,4-丁二胺的生物法合成研究也有所进展,Schneider等[113]利用基因工程C.glutamicum通过34h的分批补料发酵得到19g•L–1丁二胺,生产强度达到0.55g•L–1•h–1、葡萄糖转化率达到0.16g•g–1。Qian等[114]利用基因工程E.coli发酵得到丁二胺24.2g•L–1,生产强度达到0.75g•L–1•h–1。
另外,PA6的单体己内酰胺的生产研究也取得阶段性成果,其可以从L-赖氨酸催化获得[115]或由纤维素生物质水解中间产物γ-戊内酯经酸解等途径制得[116]。此外,由己二酸、己二腈、1,3-丁二烯、6-氨基己酸、己二酰胺及粘康酸等起始催化生产己内酰胺的工艺也有报道[117]。
《4.2.生物基聚酰胺5X的研究现状》
4.2.生物基聚酰胺5X的研究现状
近年来,利用生物来源的1,5-戊二胺替代石油化工来源的己二胺合成生物基聚酰胺的研究也逐步展开。使用1,5-戊二胺与生物来源的二元酸,如丁二酸、己二酸或癸二酸,聚合即可得到完全生物基聚酰胺PA54、PA56或PA510。与石油化工来源的PA66相比,基于1,5-戊二胺合成的生物基聚酰胺同样具有较好的机械强度、较高的熔点及耐各种有机溶剂的特性,在部分领域可以替代PA66使用。表2对生物基聚酰胺PA6、PA66、PA56及PA510的部分性能进行了对比[75,105,118]。
《表2》
表2 生物基聚酰胺PA6、PA66、PA56及PA510性能对比
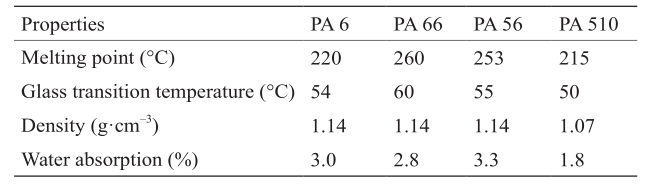
PA56因具有高的吸水率和较低的玻璃化温度,在制备纺织类纤维方面优势显著。高的吸收率使PA56纤维具有好的吸湿排汗性能,大大提高了穿着舒适度,并起到减少了静电的作用。其低玻璃化温度有利于在高寒区域穿着使用时不脆不硬,大大提高材料的耐低温性能。此外,PA56有极好的强度、牢度和耐磨性,从而提高了衣服的使用寿命[118]。
PA510是由戊二胺和癸二酸合成而来,具有低吸水率、良好的低温抗冲击性和尺寸稳定性[75],因而可以进入因一般聚酰胺吸水性大而不能胜任的领域,在机械、电子电器、无线电技术等工业领域及生活用品中有广泛的应用前景,可用于制造各种工业结构件、减摩件、电绝缘件。此外,PA510的密度低,因而非常适合应用到汽车、飞机等运输工具上,可以减轻运输工具的重量,实现更好的节能、环保功能。
但由于化学法生产的戊二胺价格昂贵,目前还没有高纯度的工业规模的戊二胺产品,高性能的PA5X尚未能实现商业化。其他以1,5-戊二胺为单体的完全生物基聚酰胺生产研究尚处于起步阶段[119]。由于生物基聚酰胺5X具有优良的性能且环保,因而基于1,5-戊二胺的生物基聚酰胺具有广阔的应用前景。
《5.展望》
5.展望
1,5-戊二胺的生物合成研究尚处于起步阶段,还有诸多因素制约其大规模产业化生产。在发酵法生产过程中,1,5-戊二胺对生产菌株的毒害作用是制约其工业化生产的主要因素之一。这需要对其损伤细胞的机制进行深入研究,从而针对性地对生产菌株进行改造或对发酵条件进行优化。在全细胞催化法生产过程中,物质在胞内外的转运和对催化反应的影响机制等理论研究还需进一步深入。此外,L-赖氨酸脱羧过程释放一分子的CO2,从发酵经济学角度看,全细胞催化过程存在碳资源的浪费和生产成本的增加问题。因此脱羧产生的CO2的循环利用研究是降低全细胞催化法生产成本的突破方向之一。
赖氨酸脱羧酶的筛选及改造是降低1,5-戊二胺生产成本的另一个研究方向。目前使用的赖氨酸脱羧酶大多为E.coli的CadA蛋白,该酶虽然较其他来源的赖氨酸脱羧酶有更高的脱羧活性,但同时存在显著的底物和产物抑制现象,且仅在弱酸性(pH5~6.8)条件下有催化活力,制约了其生产高浓度的碱性1,5-戊二胺。并且生产过程需要调控体系的pH在弱酸性,而在1,5-戊二胺分离纯化时通常又需要将发酵液(或转化液)调至碱性(pH>12)以便萃取分离,整个过程需消耗大量的酸和碱,不仅增加生产成本,同时不利于清洁生产。因而可以尝试筛选耐碱性的赖氨酸脱羧酶,或采用定点突变、定向进化等分子生物学及合成生物学方法对赖氨酸脱羧酶进行改造,以减轻其底物和产物的抑制现象,增强其酸碱稳定性,这对进一步提升1,5-戊二胺的产量和产率、减少酸碱用量、降低生产成本都有重要的意义。
《致谢》
致谢
感谢国家重点研发计划(2016YFA0204300)、国家自然科学基金(批准号:21390200,31440024)、甘肃省科技支撑计划项目(1304FKCE106)的支持。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Weichao Ma,Kequan Chen,Yan Li,Ning Hao,XinWang,and Pingkai Ouyang declare that they have no con-flict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




