《1 前言》
1 前言
子宫肌瘤是育龄期女性最常见的盆腔肿瘤,45 岁女性的发病率超过60 %,可导致月经过多、盆腔痛、习惯性流产及不孕等一系列临床症状,严重威胁女性的身心健康[1] 。最近研究表明,miRNAs对子宫肌瘤细胞的增殖、凋亡及受类固醇激素的调控在子宫肌瘤的发病机制中起到重要的作用[2] ,研究发现,hsa-miR-197在多种肿瘤中(肝癌、肺癌、胃癌、乳腺癌及子宫肌瘤等)表达具有差异 [3~7] 。本研究拟探讨 hsa-miR-197 在子宫肌瘤组织中的表达,并通过在线数据库、运用生物信息学软件对hsa-miR-197 生物学特征以及功能进行预测分析,从而为深入研究 hsa-miR-197 在子宫肌瘤发生、发展过程中的分子机制提供理论依据和实验基础。
《2 材料与方法》
2 材料与方法
《2.1 临床样本》
2.1 临床样本
12 例子宫肌瘤组织和配对正常子宫肌组织标本来源于南京市妇幼保健院行子宫肌瘤剔除术的患者,年龄为36~49 岁,所有患者均无内科合并症,月经规律,术前3个月内未服用激素类药物。采取标本均得到患者的同意,并签署了知情同意书,术后病理学诊断为子宫肌瘤。
《2.2 试剂及仪器》
2.2 试剂及仪器
miRNeasy 总核糖核酸(RNA)抽提试剂盒(德国QIAGEN公司),反转录试剂盒,TaqMan MicroRNA Assay,ABI7500 荧光定量 PCR 仪及 ABI 7900 PCR仪(美国ABI公司)。
《2.3 组织处理及RNA抽提、反转录》
2.3 组织处理及RNA抽提、反转录
样品在离体后应迅速冷冻在液氮中,把组织剪切成约100 mg大小,使液氮迅速渗透到组织内部而防止组织内部的RNA降解;将剪切好的样品放入匀浆管中加入1 mL TRIzol后用组织匀浆器将其在冰上匀浆 3~5 min,转移至 1.5 mL 离心管,而后进行 RNA抽提。RNA操作中所需玻璃和金属器材均经过 180 ℃处理 2 h;塑料器材均用含 0.1 %焦碳酸二乙酯(DEPC)的水中浸泡过夜后高压灭菌;溶液均用DEPC水配制或配制好后用DEPC处理过夜后高压灭菌,令RNA酶灭活。将离心管中的液体在室温下放置 5 min;加入 200 μL 氯仿,盖紧管口,剧烈振荡 15 s后,静置2 min;12 000×g 4 ℃离心15 min;吸取上清液于另一 Eppendorf 离心管中;加入 0.5 mL 异丙醇,颠倒数次,室温静置 10 min;12 000×g 4 ℃离心 10 min,可见白色胶样 RNA沉淀;轻轻吸去上清液,加入 1 mL 75 %乙醇,混匀,漩涡振荡洗涤,7 500×g 4 ℃离心 5 min;吸去上清液后干燥沉淀 5~10 min;用 50 μL DEPC 处理的水重新溶解 RNA,必要时55~60 ℃水浴10 min助于溶解;保存于-80 ℃。分光光度仪定量选择OD260/OD280比值为 1.9~2.1的RNA样品,浓度均在1.5 μg/μL以上。
按照 TaqMan MicroRNA Reverse Transcription Kit 说明书加入逆转录反应所需试剂,miR-197 引物、总 RNA 等进行反应。逆转录条件:16 ℃、 30 min;42 ℃、30 min;85 ℃、4 min。将逆转录好的 cDNA于-20 ℃贮存备用。
《2.4 Real-time PCR》
2.4 Real-time PCR
使用探针法检测miR-197的表达量。使用逆转录生成的cDNA作为模版进行qPCR扩增,根据Premix ExTaq 试剂盒说明加入 premix、TaqMan MicroRNA Assays 提供的 miR-197 探针进行反应。 Real-time PCR条件为:95 ℃、2 min→(95 ℃、15 s→ 60 ℃、30 s)循环40次,采集荧光值。每个样本均设复孔,并以U6作为内参,独立实验重复3次。计算平均CT值,以目的和内参基因为对照,应用相对定量法(ΔΔCT法)进行半定量分析,用2-ΔΔCT值表示目的基因相对对照的miRNA表达量。
《2.5 生物信息学分析》
2.5 生物信息学分析
笔者通过Pubmed (http://www.ncbi.nlm.nih.gov/ pubmed/)查阅已发表的hsa-miR-197相关文献支持的已有功能。利用 miRBase(http://www.mirbase. org/)、UCSC(http://genome.ucsc.edu/cgi-bin/hgGateway)数据库查找hsa-miR-197碱基序列、染色体定位、物种保守性等基本信息。选择miRanda(http:// www.microrna.org/)、MirTarget2(http://mirdb.org/ miRDB/)及 TargetScan(http://www.targetscan.org/)三个主流数据库预测 hsa-miR-197 的靶基因,取三者的交集并结合已经证实的靶标基(FUS1),采用 BINGO进行GO注释的显著性分析[8] 。选择所有蛋白编码基因作为背景基因,使用超几何分布计算P 值,以P<0.05为显著性阈值,得到基因集合相对于背景具有统计意义的注释,即基因集合在GO类别上的分布信息;选择 DAVID 数据库对 hsa-miR-197 预测的靶基因集合进行基于京都基因与基因组百科全书(KEGG)的Pathway分析,通过Fisher Exact Test计算P值,以P<0.05为显著性阈值得到基因集合相对背景具有统计意义的信号转导及疾病通路。
《3 结果》
3 结果
《3.1 子宫肌瘤组织中miR-197的表达特点》
3.1 子宫肌瘤组织中miR-197的表达特点
为了确定miR-197在子宫肌瘤组织中的表达异常,笔者从临床采集了12对不同子宫肌瘤患者的新鲜子宫肌瘤和其配对正常的子宫肌组织,通过Realtime PCR 的方法检测子宫肌瘤组织和子宫肌层组织中 miR-197 的表达量。如图 1 所示,与正常子宫肌组织相比,miR-197的表达在子宫肌瘤组织中显著降低(P<0.05)。在12例病人中,除去8号病人,其他 11 例病人子宫肌瘤组织中的 miR-197 表达水平均明显低于其在相应子宫肌组织中的表达。上述实验结果表明,miR-197在子宫肌瘤组织中表达下调,为进一步研究其生物学功能提供了初步依据。
《图1》

图1 miR-197在12例子宫肌瘤组织及配对正常子宫肌组织中的相对表达
Fig. 1 Relative miR-197 expression in the uterine leiomyomas tissues and paired normal myometrium
《3.2 hsa-miR-197基因分析》
3.2 hsa-miR-197基因分析
参考 NCBI 数据库笔者发现 hsa-miR-197 基因位于人类1号染色体p13.3区域,基因大小为75 bp,转录产物 pre- miR- 197 的序列 5′- GGCUGUGCCGGGUAGAGAGGGCAGUGGGAGGUAAG AGCUCUUCACCCUUCACCAC CUUCUCCACCCAGCAUGGCC-3′;miRbase数据库显示hsa-miR-197基因的序列在多个物种间高度保守,其转录成熟体为 hsa-miR-197-5p(5′- cggguagaga gggcagugggagg-3′)及hsa-miR-197-3p(5′-uucaccaccuucuccacccagc-3′)两个剪切体,其中以 hsa-miR-197-3p 为主。通过 UCSC在线数据库发现,hsa-miR-197在人、恒河猴、狗、大象等物种间高度保守(见图2),提示hsa-miR-197 具有潜在的重要生物学功能。
《图2》

图2 hsa-miR-197保守性分析
Fig. 2 Conservative analysis of hsa-miR-197
《3.3 hsa-miR-197的靶基因预测》
3.3 hsa-miR-197的靶基因预测
MiRanda、MirTarget2及TargetScan 预测的靶基因数量分别为7 644个、320个和217个,3种数据库的计算结果取交集,合并已证实的靶标,共获得 75 个候选靶基因,部分预测的hsa-miR-197靶基因见表1。
《表1》
表1 部分预测hsa-miR-197靶基因
Table 1 Predicted target-genes of hsa-miR-197

《3.4 hsa-miR-197预测靶基因集合的GO注释分析》
3.4 hsa-miR-197预测靶基因集合的GO注释分析
及信号转导通路富集分析功能富集分析预测的结果显示,hsa-miR-197调控的靶基因功能分别富集在DNA依赖的转录调控、突触传递的调控、胚胎器官发育、细胞周期正调控、细胞间通信等生物学过程,部分结果见图3。
《图3》
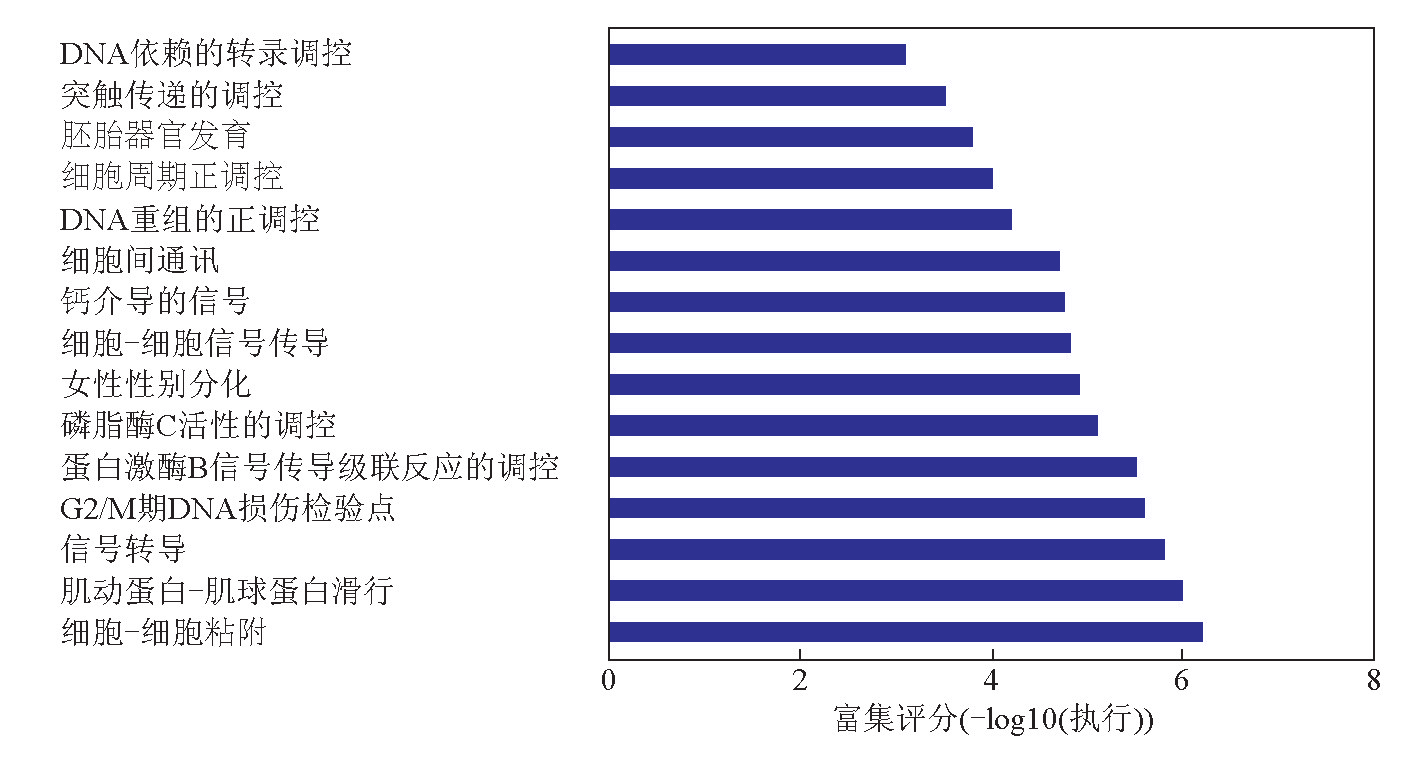
图3 hsa-miR-197预测靶基因集合的GO分析结果
Fig. 3 GO analysis of candidate target genes of hsa-miR-197
注:-lgP 值为P 的负对数值,值越大代表富集越显著
信号转导通路富集分析的结果显示,hsa-miR197靶基因显著富集于涉及JAK-STAT、Toll样受体、Caspase凋亡等信号转导通路,部分结果见图4。
《图4》
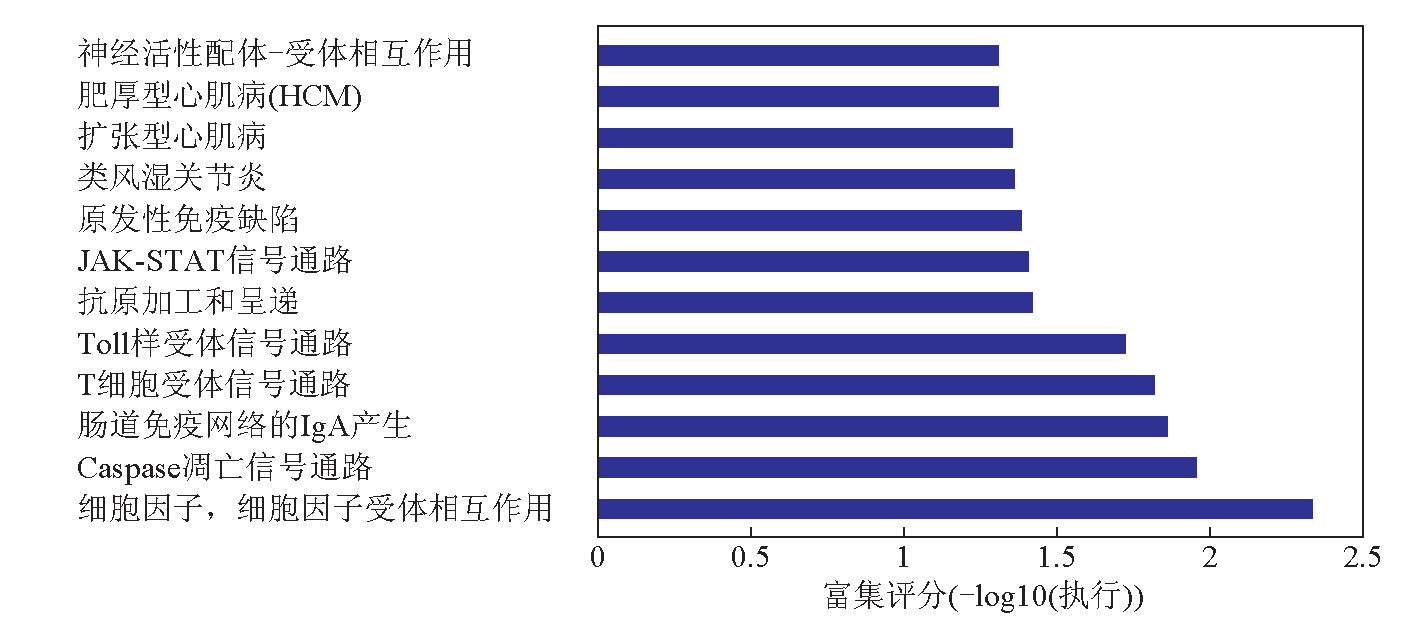
图4 hsa-miR-197靶基因集合的信号转导通路富集分析结果
Fig. 4 Pathway analysis of candidate target genes of hsa-miR-197
注:-lgP 值为P 的负对数值,值越大代表富集越显著
《4 讨论》
4 讨论
近年来子宫肌瘤的发病率迅速上升,虽然治疗技术有了很大的提高,但仍是育龄期妇女子宫切除的重要原因之一。最新研究表明子,子宫是内分泌器官[9] ,过早切除会严重影响女性健康。迄今为止,人类对子宫肌瘤仍然没有令人满意的治疗手段,预防并控制其发展是子宫肌瘤治疗中尚待解决的问题。
进入新世纪后,肿瘤的基因治疗越来越受到人们的关注,也取得了不小的突破与成就。目前的基因治疗绝大部分是针对肿瘤发生发展过程中单个目标基因进行干预,以达到治疗的效果。但是肿瘤的发生发展涉及多条信号通路与多种关键基因蛋白变化,因此针对单独靶点的基因治疗有其明显的缺陷[10] 。MicroRNA (miRNA)的发现与深入研究有望填补这一空白。miRNA是一类长度约22 nt 的具有在转录后水平调控基因表达的内源性非编码小分子RNA[11] ,通过与mRNA 3′端非翻译区完全或不完全互补配对从而剪切 mRNA 或抑制翻译起始。 miRNAs通过调节靶向基因的表达广泛参与几乎所有的细胞过程中,因此,miRNAs在发育、细胞增殖、凋亡和分化等重要生物学过程中起重要作用,并与肿瘤发生等人类的疾病密切相关[12] 。
已有报道发现,多个miRNAs在子宫平滑肌瘤及子宫肌层组织平滑肌细胞中表达并发挥调节作用[13] 。 miR-197是miRNA大家族中的一员,近年来的研究表明,miR-197参与多种生物学过程并与多种肿瘤的发生密切相关[3~7] 。相关功能研究表明:miR-197 在肿瘤发生中细胞增殖与凋亡异常[14] 、基因多态性及信号传递通路[15] 中都有所表现,但miR-197与子宫肌瘤发病机制之间的相关研究未见报道。已有文献证实,miRNAs 在子宫肌瘤细胞与正常子宫肌细胞之间存在差异表达(包括miR-197)[7] ,因此,笔者将miR-197作为进一步研究的对象。本文应用实时荧光定量PCR技术检测组织miR-197的表达,结果证实子宫肌瘤组织和相应子宫肌层组织具有显著性差异,并呈现出在子宫肌瘤组织中低表达的特征。结果提示,相对于正常子宫肌层组织,miR-197 的表达在子宫肌瘤组织中显著降低,很可能与子宫肌瘤的发生相关。这一结果与国外报道的子宫肌瘤细胞中 miR-197 的表达较子宫肌细胞显著下调一致[16] ,均提示miR-197很可能参与子宫肌瘤的发生,但具体机制还不清楚,因此首先借助生物信息学在线分析工具对 hsa-miR-197 进行分析,预测其可能的靶基因,正确认识靶基因之间的相互作用,对具体研究其生物学功能有着重要意义。
鉴于目前实验鉴定成功的靶向关系远不能满足在系统水平上实现对miRNAs相关功能的全面认识。生物信息学的迅速发展为全面研究miRNAs相关功能提供了方便。利用数据库技术,将miRNAs、靶基因和各种生物信息数据库连接起来,可以对单个或多个miRNAs的相关功能进行直接预测,为实验研究提供方向性指导。本研究发现,hsa-miR-197 序列在人、恒河猴、狗、大象等物种间具有高度保守性,提示其可能具有较为强大的生物学功能。miRNAs既可作为抑癌基因,下调原癌基因的活性;也可作为致癌基因,下调抑癌基因的活性,从而形成错综复杂的调控网络,参与肿瘤的发生发展[17] 。最近一些研究证实,hsa-miR-197在多种肿瘤中表达异常,具有抑癌基因的作用,与肿瘤细胞增殖、侵袭、迁移和凋亡密切相关,对于肿瘤的诊断、治疗和预后具有十分重大的意义[18] 。miRanda、MirTarget2及 TargetScan 是目前信息学中应用较广泛的 miRNA 靶基因预测在线软件。miRanda是最早的一种预测算法,有较好的检出率,预测的靶基因数量较多,但假阳性率也较高,在 miRanda 数据库中检索出 hsamiR-197有7 644个靶基因。TargetScan和PicTar作为第二代预测算法,其预测靶基因的数量相对减少,但同时也增加了预测的精确度,降低了假阳性率[19] ,利用这两个数据库预测的hsa-miR-197靶基因分别为320个和217个。虽然这3种不同的软件预测的结果不一样,但同时采用这3种预测算法进行预测,然后取其交集部分(共75个靶基因),就能提高预测结果的可靠性,减少假阳性率。
本研究针对3个数据库的预测结果,采用生物信息学方法对基因集合进行GO功能注释、GO富集分析和信号转导通路富集分析,多层次、多角度对 hsa-miR-197 的预测基因进行描述。笔者发现 hsamiR-197 靶基因的功能主要涉及 DNA 依赖的转录调控、突触传递的调控、细胞周期正调控、细胞间通信等与肿瘤发生密切相关的生物学过程(P<0.05);同时,信号通路富集分析发现miR-197的靶基因主要参与JAK-STAT、Toll样受体、Caspase凋亡等信号转导通路(P<0.05)。由于这些生物学功能涉及肿瘤发生发展的多个阶段,据此可推测 hsa-miR-197 在多种肿瘤中表达异常,并通过调控其靶基因的表达引起多种生物学特征的变化。本次研究对 hsamiR-197在子宫肌瘤组织中的表达进行了验证,并采用生物信息学方法对hsa-miR-197生物学特性及其功能进行初步分析,拟通过实验进一步认识子宫肌瘤的发病机制和对mi-RNAs异常表达识别,从而定义其自身的功能和治疗靶点,为子宫肌瘤的诊断、治疗和预后提供理论依据和试验基础。














 京公网安备 11010502051620号
京公网安备 11010502051620号




