《1 前言》
1 前言
大菱鲆(Scophthalmus maximus)是20世纪90年代由欧洲引进我国的名贵鱼种,在突破繁育、创建 “温室大棚+深井海水”养殖模式的基础上,如今历经20年风雨的大菱鲆养殖产业已经展现出强大的生命力和发展潜力,并成为我国工厂化养殖的样板工程,带动了沿海其他养殖鱼类产业的提升与转型。然而在其工业化发展进程中,循环水、高密度的养殖模式对疾病防控技术的要求亟待提升。在当前日益增长的环保理念和食品安全意识的要求下,以疫苗等为主要代表的免疫病害防控技术受到重视,通过免疫防控途径能有效增强鱼体主动防御能力,减少疾病的发生概率[1] 。然而对大菱鲆免疫学的研究报道有限,Kofod等[2] 分离纯化了大菱鲆免疫球蛋白M(immunoglobulin M,IgM),Estévez等[3] 制备了大菱鲆免疫球蛋白单克隆抗体,王贤丽等[4] 从大菱鲆脾脏cDNA 文库中筛选得到了免疫球蛋白 L轻链的全长cDNA片段,冯守明等[5] 对大菱鲆免疫相关组织中免疫球蛋白阳性细胞进行了检测,丁冰洁等[6] 首次得到了大菱鲆多聚免疫球蛋白受体完整的cDNA序列。未见大菱鲆IgM单克隆抗体相关研制和应用的报道。
单克隆抗体具有均一性、高效性、特异性、生物活性单一性及可无限供应等特点,将单克隆抗体技术应用于大菱鲆免疫球蛋白结构和功能分析、病原和抗体检测、疫苗研制及免疫应答规律研究等方面具有科学理论意义和生产应用价值。因此,本研究将纯化的大菱鲆IgM免疫BALB/C小鼠,利用细胞工程技术生产融合的杂交瘤细胞,筛选分泌大菱鲆 IgM的单克隆抗体杂交瘤细胞,制备并生产大菱鲆 IgM单克隆抗体。
《2 材料与方法》
2 材料与方法
《2.1 免疫原制备》
2.1 免疫原制备
纯化的大菱鲆血清 IgM 由本实验室制备并保存[7] 。将纯化的大菱鲆IgM分别与等体积的弗氏完全佐剂和弗氏不完全佐剂(Pierce,USA)混匀乳化后免疫小鼠。
《2.2 免疫动物》
2.2 免疫动物
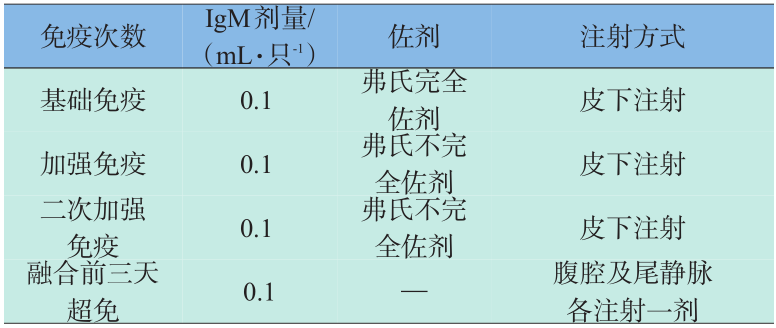
选用 6 周龄 BALB/C 雌性小鼠进行免疫,免疫程序见表1。
《表1》
表1 免疫程序
Table 1 The immunization schedule
《2.3 饲养细胞制备》
2.3 饲养细胞制备
脱颈椎处死正常BALB/C小鼠,无菌条件下剪开腹部皮毛,用注射器吸取5 mL RPMI-1640培养基(含10 %新生牛血清和1 %次黄嘌呤和胸腺嘧啶核苷溶液)后注射到小鼠腹膜内,同时轻压小鼠腹腔,然后将培养基吸入注射器内并移出;将吸出的腹腔液转移到24孔细胞培养板中,放入二氧化碳培养箱中培养,待用。
《2.4 细胞融合》
2.4 细胞融合
1)脱颈椎处死免疫小鼠,无菌取出脾脏,过100 目筛网后用 GNK(葡萄糖、NaCl、KCl、酚红及磷酸盐)溶液洗涤2次,然后溶于10 mL GNK溶液,吹打形成单细胞悬液。
2)取105 个处于对数生长期的NS0骨髓瘤细胞(由英国国家动物健康研究院惠赠),1 000 r/min,离心 10 min,弃上清液,用 40 mL GNK 溶液重悬沉淀物。
3)将脾细胞悬液和骨髓瘤细胞悬液混合均匀后,1 000 r/min,离心10 min,完全吸除上清液,轻弹离心管底,打散细胞,放入 37 ℃水浴中;加入 37 ℃预热好的聚乙二醇溶液1 mL,在1 min内滴加完,然后在37 ℃水浴中缓慢转动90 s。
4)加入已经预热到37 ℃的GNK溶液15 mL(开始缓慢滴加,后来逐渐加快速度),然后继续缓慢滴加GNK溶液至40 mL,并在37 ℃水浴中静置5 min。
5)1 000 r/min,离心10 min,用预热好的RPMI1640 培养基(含 10 %新生牛血清和 1 %次黄嘌呤、氨基喋呤和胸腺嘧啶核苷溶液)稀释沉淀的细胞,然后加到96孔含饲养细胞的细胞培养板中。
6)将培养板放入二氧化碳培养箱(二氧化碳 5 %,37 ℃)中培养,并在倒置显微镜下观察细胞生长情况,大概 5~7 天后进行换液,吸出 100 μL 培养液,更换等量含次黄嘌呤、氨基喋呤和胸腺嘧啶核苷溶液的培养液。
《2.5 阳性杂交瘤细胞株的筛选》
2.5 阳性杂交瘤细胞株的筛选
细胞融合后10天左右,观察细胞生长状态良好并开始检测筛选,将筛选的阳性杂交瘤细胞转移到 24孔细胞培养板中进行扩大培养。酶联免疫吸附实验(ELISA)法检测筛选步骤如下:以 0.05 mol/L (pH=9.6)碳酸盐溶液稀释大菱鲆免疫球蛋白至 2 µg/mL,取 50 µL 稀释液加入酶标板孔中,置于 4 ℃冰箱中过夜包被,次日以 0.01 mol/L(pH=7.4)磷酸盐-吐温溶液(PBST,0.05 % Tween-20)洗涤 3 次,每次3 min;用5 %猪血清于37 ℃封闭1 h,封闭结束后以 PBST 同法洗涤;加入杂交瘤细胞培养上清,每孔加入 50 µL,阴性对照为细胞培养基,阳性对照为免疫小鼠血清,于 37 ℃反应 15 min 后以 PBST 同法洗涤;然后每孔加入 50 µL 羊抗鼠 IgGHRP(1∶1 000稀释),于37 ℃反应30 min后洗涤;每孔加入新配制的 50 µL 显色液 TMB(四甲基联苯胺)显色5 min后,加入2 mol/L硫酸溶液50 µL终止反应;结果判定用自动酶标仪读取OD450值(P/N 2.1时判定为阳性)。
2.1时判定为阳性)。
《2.6 阳性杂交瘤细胞系的建立与克隆》
2.6 阳性杂交瘤细胞系的建立与克隆
采用有限稀释法对筛选出的阳性杂交瘤细胞进行克隆:在96孔细胞培养板各孔中加入100 µL的饲养细胞;然后把要克隆的阳性杂交瘤细胞孔中的细胞用血球计数板进行计数,用培养液以10倍梯度进行稀释,取出100个杂交瘤细胞;将取出的杂交瘤细胞混匀后,滴加到铺满饲养细胞的96孔板中,每孔加入 100 µL,平均每孔含有一个杂交瘤细胞;然后放入二氧化碳培养箱中培养。期间,定期观察细胞生长状况并记录,并通过上述ELISA法检测各培养孔的上清液(确保阳性率100 %),把所得阳性克隆孔的杂交瘤细胞按上述方法再克隆一次,以保证形成单克隆。
《2.7 腹水制备(单抗大量生产)》
2.7 腹水制备(单抗大量生产)
1)小鼠预处理:在接种杂交瘤细胞前 1 周,用 0.5 mL液体石蜡腹腔注射正常BALB/C小鼠。
2)接种杂交瘤细胞:将培养的杂交瘤细胞离心,弃去上清,杂交瘤细胞用无血清培养液悬浮,并将细胞数调至106 /mL,每只小鼠腹腔注射0.5 mL。
3)采集腹水:接种杂交瘤细胞后约7~12天,小鼠腹部可见明显膨大。用75 %酒精棉球消毒腹部皮肤后,用注射器抽取腹水。每只小鼠抽取腹水 2 mL,间隔5天后,待腹水再生积聚后,同法抽取。
4)腹水处理:收集的腹水 3 000 r/min 离心 20 min,收集上清,-20 ℃保存备用。
《2.8 单抗特性鉴定》
2.8 单抗特性鉴定
2.8.1 ELISA法测定单抗效价
以 2 μg/mL 纯化大菱鲆免疫球蛋白包被酶标板,每孔50 μL,4 ℃过夜,封闭后加细胞上清液和腹水抗体,细胞上清液从1∶100倍比稀释到1∶12 800,腹水从 1∶1 000 倍比稀释到 1∶2 048 000,每孔 50 μL,其余步骤同2.5节。
2.8.2 单抗灵敏度的测定
纯化的大菱鲆 IgM 起始浓度为 2 μg/mL,倍比稀释至 2 ng/mL,每孔 50 μL,4 ℃过夜包被,封闭洗涤后滴加单抗(1∶25 000),每孔 50 μL,其余步骤同 2.5节。
2.8.3 单抗Western blot分析
SDS-PAGE分离纯化的大菱鲆免疫球蛋白(凝胶由10 %分离胶和3 %浓缩胶组成),将电泳凝胶转印到硝酸纤维素膜(孔径0.22 μm)上,转印完毕将硝酸纤维素膜用脱脂奶粉封闭1 h,PBST洗涤后将硝酸纤维素膜置于腹水稀释液中(1∶250 000)缓慢摇动 1 h,同法洗涤后,将硝酸纤维素膜置于羊抗鼠 IgG-HRP(1∶500稀释)缓慢摇动1 h,同法洗涤后,将硝酸纤维素膜放入 HRP-DAB 底物显色液中,至颜色清晰为止,然后将硝酸纤维素膜用去离子水冲洗干净后,置于滤纸间干燥,拍照记录后暗处保存。
2.8.4 单抗特异性的测定
收集大菱鲆、褐牙鲆、半滑舌鳎、红鳍东方鲀、鲤鱼、鲫鱼、草鱼、鳙鱼、许氏平鲉、六线鱼、鲈鱼血清,待检鱼血清用包被液以1:100倍稀释后包被于酶标板,每孔 50 μL,4 ℃过夜,封闭洗涤后加单抗(1∶25 000),每孔50 μL,其余步骤同2.5节。
《3 结果》
3 结果
《3.1 单抗的筛选》
3.1 单抗的筛选
采用上述免疫和细胞融合方法,用直接ELISA 法对培养的杂交瘤细胞进行筛选,获得4株阳性杂交瘤细胞,编号分别为 B1D1、D5C2、E1B2、F4A1。杂交瘤细胞经过 3 次亚克隆筛选,保证 100 %的阳性率,经连续传代培养后依然能够稳定分泌抗体。
《3.2 单抗特性鉴定》
3.2 单抗特性鉴定
经直接 ELISA 法检测,4 株单抗的细胞培养上清效价为 1∶1 280~1∶2 560,其中 E1B2 的细胞上清及腹水效价分别为1∶2 560和1∶1.024×106 。
用不同浓度的大菱鲆IgM包被96孔板,ELISA 法测定单抗E1B2的敏感性,结果表明E1B2腹水对大菱鲆IgM的检测灵敏度为32 ng/mL。
应用 SDS-PAGE 技术,对获得单抗进行 Western blot分析,结果表明单抗能与大菱鲆IgM发生特异性结合,特异识别IgM重链区(见图1)。
《图1》
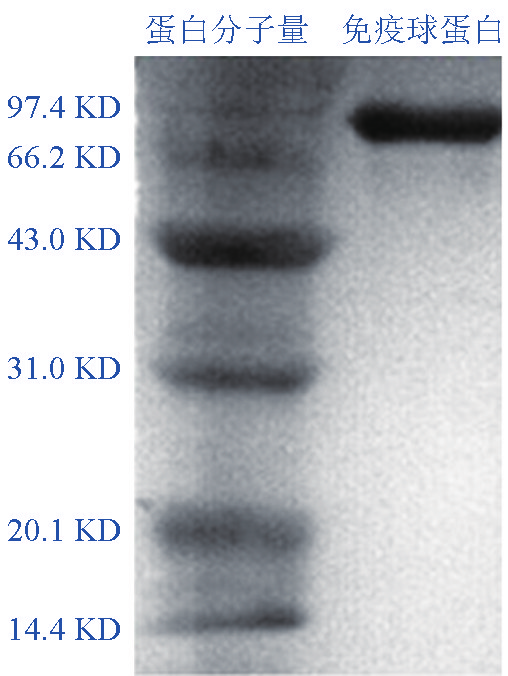
图1 单抗的Western blot图谱
Fig. 1 Western blot analysis of monoclonal antibody against IgM of turbot
《3.3 单抗特异性测定》
3.3 单抗特异性测定
将单抗与不同种类的鱼血清进行ELISA反应,结果表明单抗与大菱鲆血清呈强阳性反应,与褐牙鲆、红鳍东方鲀、许氏平鲆、六线鱼、鲈鱼均呈微弱阳性反应,而与半滑舌鳎、鲤鱼、鲫鱼、草鱼、鳙鱼的血清无交叉反应(见图2)。
《图2》
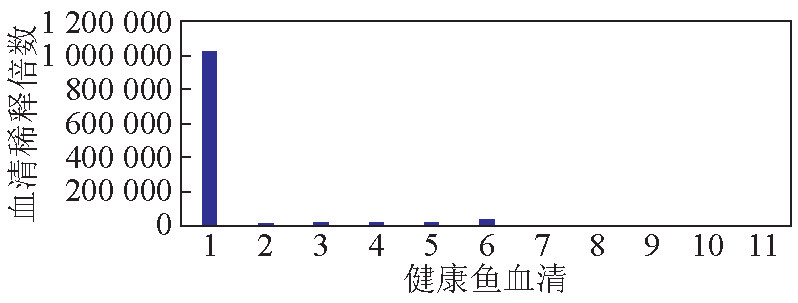
1-大菱鲆;2-褐牙鲆;3-红鳍东方鲀;4-许氏平鲉;5-六线鱼;6-鲈鱼;7-半滑舌鳎;8-鲤鱼;9-鲫鱼;10-草鱼;11-鳙鱼
图2 ELISA法检测单抗与各种鱼血清的交叉反应
Fig. 2 The reaction of monoclonal antibody against serum from eleven species of fish by ELISA
《4 讨论》
4 讨论
单克隆抗体能够特异性识别单一抗原决定簇,且经过多次克隆和筛选获得,从而避免交叉反应带来的假阳性,提高检测的准确性,检测灵敏度可达到纳克水平,是免疫学和血清学研究的重要工具。鱼类是具有细胞免疫和体液免疫系统的最低等的脊椎动物,已报道在鱼类免疫系统中存在4 种主要的免疫球蛋白(IgM、IgD、IgT和IgZ)[8] ,其中IgM 发现最早、研究最多。鱼类免疫球蛋白的单抗不仅可以用于鱼类免疫细胞的鉴定、发生和活性研究,也可用于监测病原感染或疫苗接种过程中的免疫应答反应,是鱼类免疫机理和鱼病免疫防治研究的有力工具。
在大菱鲆IgM单抗制备过程中,免疫原IgM的提纯是关键的一步。通常免疫原越纯,单抗效果越佳。在本研究中,大菱鲆IgM的提取和纯化是建立在实验室已经完成的相关工作基础上进行的,获得的IgM纯度高,经SDS-PAGE检验,大菱鲆血清IgM 有两条带,分子质量分别是76 kD和27 kD,代表免疫球蛋白的重链和轻链,条带清晰,无杂带[7] 。在此基础上,将其免疫小鼠,通过细胞融合及多次克隆和筛选,获得了稳定分泌大菱鲆IgM的杂交瘤细胞株。生产的单抗效价高(1∶1.024×106 )、检测灵敏度高(32 ng/mL),有效保证其在大菱鲆相关免疫学研究中的应用。
本研究通过 Western blot 方法对制备单抗的特性鉴定分析表明,单抗能特异识别大菱鲆IgM的重链。在草鱼、欧洲鳗、花鲈、南方鲇等鱼血清IgM单抗研究中也发现,大部分单抗仅识别IgM重链[9~12] 。这可能是由于 IgM 分子重链恒定区的氨基酸序列多、结构复杂,可提供多个抗原表位;而轻链相对简单,其上免疫表位少,所以筛选到的强阳性细胞株大部分是抗重链的,而在筛选过程中抗轻链的杂交瘤细胞很容易被放弃和丢失。
在交叉实验中,研制的单抗与半滑舌鳎及草鱼、鲤鱼、鳙鱼、鲫鱼4种淡水鱼类的血清无交叉反应,与鲈鱼、六线鱼、许氏平鲉、红鳍东方鲀、牙鲆五种海水鱼类血清有微弱的交叉反应,而与大菱鲆的血清反应是最强烈的,表明该单抗具有较好的特异性。同时,也可以看出,不同鱼类的免疫球蛋白存在特异性抗原位点,但也存在相同的抗原决定簇,这种共同的抗原决定簇会存在于亲缘关系较近的品种之间。
《5 结语》
5 结语
单克隆抗体技术在人类及畜牧业的疾病控制与预防中发挥着重要作用,是疾病的检测、预防和治疗的有力武器。单克隆抗体能够在实验室通过细胞培养而得到批量生产,在应用上具有专一性强、重复性好、操作简便等优点,有较高的科研应用价值和生产实际应用前景。本研究制备的大菱鲆 IgM单克隆抗体效价高、灵敏度高、特异性强,适合用于大菱鲆免疫学相关研究和生产实际应用。














 京公网安备 11010502051620号
京公网安备 11010502051620号




