《1.引言》
1.引言
乳腺癌是全球女性中最常见的癌症[1],也是日本女性中最常见的癌症[2]。因此,它对生活质量构成了重大威胁。
高强度聚焦超声(high-intensity focused ultrasound,HIFU)是一种非介入式超声治疗技术,它可以将精确聚焦的超声波束作用于身体内的某一小部分。HIFU波束中的能量可以导致靶组织的热坏死。最有利的是,该技术可以选择性地破坏深层恶性组织,而对波束路径上的表面组织及其周围的组织几乎没有损伤。HIFU是一种很有前景的治疗乳腺癌和其他癌症的方法[3−5]。HIFU治疗乳腺癌的概念图如图1所示。
《图1》
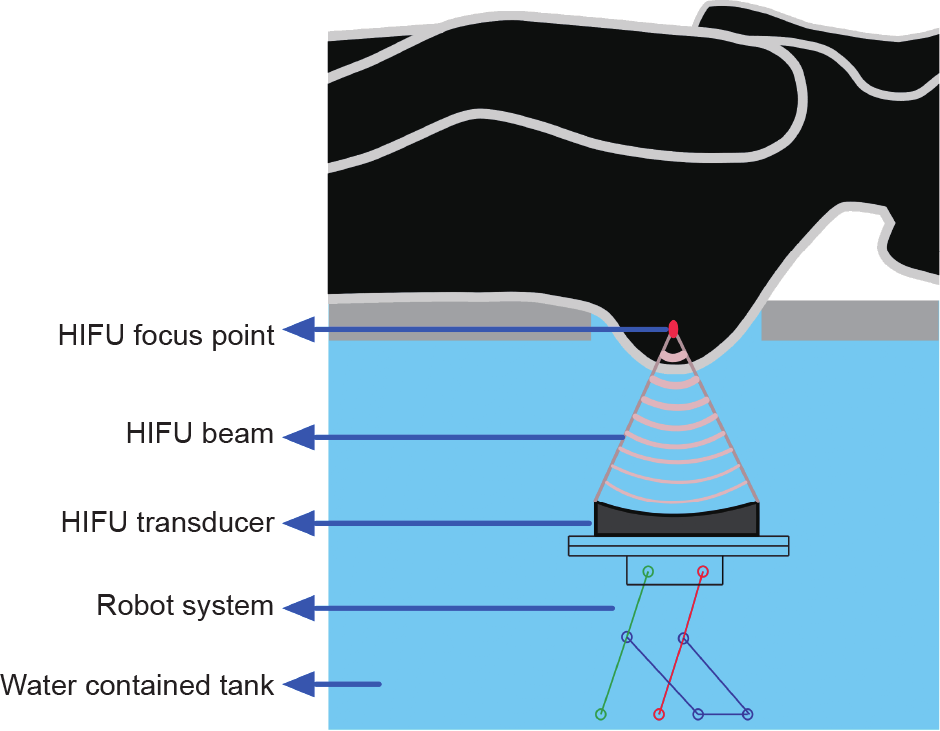
图1.HIFU治疗乳腺癌的概念图。
为充分利用HIFU的非介入性,将HIFU技术融入现代图像引导的机器人辅助手术系统模式中。通常图像引导机器人辅助系统包括三个主要部分:医学成像系统、机器人治疗系统和医疗导航系统。成像系统与治疗系统分别扩展了外科医生眼睛和手的功能,导航系统与手眼系统的坐标系相关联。因此,导航系统在精准的外科治疗中至关重要。
目前,HIFU导航任务由磁共振成像(magnetic resonance imaging,MRI)引导。MRI具有很高的空间分辨率,并且可以通过温度对质子谐振频率的依赖效应来监测组织温度[6,7]。然而,MRI引导的HIFU有几个缺点:第一,MRI的帧刷新率低,阻碍了实时导航;第二,MRI的体积大小影响了系统集成;第三,MRI台架的有限空间限制了机器人系统接近目标区域的可能角度,从而影响了治疗的实施并增加了皮肤烧伤的风险;第四,MRI产生的强磁场对机器人系统增加了额外的约束,由于常见的大多数机器人部件不能在靠近磁铁的地方使用,因此在MRI附近操作需要特殊的策略,这增加了系统的复杂性[8];第五,HIFU治疗的高成本限制了自身的普及。
相比之下,超声成像技术是一种简洁、廉价和具有快速的帧刷新率的技术。由于这些特点,除了其多功能性和易获得性特点之外,超声成像已成为图像引导手术中越来越流行的方式。然而,传统的超声诊断系统仅提供目标区域的二维图像。为了给HIFU治疗方案创建精确的三维图像集,最好利用机器人系统来收集一系列二维超声图像,并从堆栈中重建出三维超声图像。为此,我们团队提出了基于超声引导的机器人辅助HIFU系统,这是一种精确、低成本的乳腺癌治疗解决方案,最终的目标是促进HIFU治疗,并且提高患者的生活质量。
本文重点介绍了导航系统的规划治疗功能。为了实现高效准确的HIFU治疗,导航系统应该引导患者完成治疗流程,从图像采集到执行治疗。内部功能块包括超声图像的三维重建、目标定义和生成治疗路径。为了获得超声图像空间和机器人工作空间之间的正确空间关系,还需要手眼标定。这些功能作为子任务执行,从而实现主要目标。最后,对整个治疗系统的准确性进行评估。
本文的其他章节安排如下:第2节概述了系统的构成,第3节详细介绍了基于超声引导的HIFU治疗导航系统开发及其评估方法,第4节介绍实验结果,第5节分析实验结果,第6节总结。
《2.系统概述》
2.系统概述
《2.1.HIFU系统的硬件组件》
2.1.HIFU系统的硬件组件
该系统主要由三个部分组成:一是具有控制器单元的HIFU换能器,为治疗提供所需要的能量;二是超声成像系统(Prosound®F75,Hitachi,Ltd.,Tokyo,Japan),为导航系统提供必要的诊断信息;三是定制的五自由度并联机器人系统,可操纵HIFU换能器和改进的超声成像换能器。
这两个换能器固定安装在机器人系统的末端执行器上,其规格如表1所示。改进的成像换能器的高程焦距为60mm,比普通商用换能器可以获得更好的深度图像分辨率。五自由度机器人系统精准操纵HIFU换能器和成像换能器,进行诊断扫描和治疗定位。在常规的超声诊断中,成像探头通常接触皮肤表面,并且通过耦合凝胶来阻止超声衰减以确保良好的成像效果。因为本系统中的成像探头是由机器人系统控制,而不是由医生控制,所以用探头接触皮肤做定期的痕量扫描是不方便的。此外,如果成像探头与皮肤接触,则阻碍了HIFU波束的聚焦。因此,在我们的系统设计中,成像探头保持与患者皮肤保持分离。通过为机器人系统设计水下工作空间,解决了耦合问题。由于水的声衰减系数非常低(约0.0022dB·MHz–1·cm–1[9]),即便在120mm(超声图像边界和成像探头表面之间的最大距离)处也可以获得了较好的超声图像。不使用探头与皮肤表面接触的另一个好处是在扫描过程中乳房不会变形。由于乳房组织非常柔软,但是,在处理过程中如果探头始终保持与皮肤分离并且可以随时获得二维实时超声图像,则在我们系统中不需要考虑变形问题。在治疗过程中,患者俯卧在水箱上方的床上,待治疗的乳房嵌在工作区内,乳房和水箱之间的橡胶膜可防止患者与水直接接触,而不会妨碍超声波束的传播。
《表1》
表1 HIFU换能器和成像换能器的规格

系统的整体组件和连接关系如图2所示。第一台个人计算机(PC1)为HIFU换能器驱动器配置焦点数据,通过通用串行总线(universal serial bus,USB)—通用异步接收器/发送器(universal asynchronous receiver/transmitter,UART)电缆来发送命令。第二台个人计算机(PC2)协调整个HIFU系统,PC2通过通用串行总线(USB)—模拟输入输出(analog input–output,AIO)单元(provided by Contec Co.,Ltd.,Osaka,Japan)设置HIFU换能器的输出电平,并且利用具有数字视频接口(digital visual interface,DVI)—串口总线(USB3.0)接口的视频采集器(provided by Epiphan Systems Inc.,Ottawa,ON,Canada)接收来自超声成像系统的二维超声图像。PC2还通过局域网(local area network,LAN)电缆与机器人控制器通信,来设置和跟踪机器人的姿态。机器人控制器使用USB转RS232C电缆连接到控制旋转角度的电机(见3.1节),其他4个电机通过USB—控制器LAN(controller area network,CAN)电缆连接到机器人控制器。
《图2》

图2.硬件系统组件及其连接关系。
《2.2.导航系统软件部分》
2.2.导航系统软件部分
在超声引导的前提下,成功的HIFU治疗需要多个处理步骤:第一,根据机器人的扫描结果重建三维超声图像,为了将每个体素(三维空间中定义一个点的图像信息的基本单位)与相对于机器人工作空间的位置信息相关联,将机器人的姿态信息与二维图像一并收集;第二,外科医生检测和分割出目标区域(即肿瘤/恶性组织);第三,根据分割结果来确定HIFU治疗点的分布,并计算出机器人到每个治疗点的工作路径;第四,将路径信息和其他设置发送给机器人,机器人执行处理。图3是导航系统软件框图,其工作流程总结如下。
(1)三维超声图像重建(及可视化);
(2)目标定义:①三维超声图像探索(通过用户交互);②分割(通过用户交互);
(3)路径生成(机器人姿态序列);
(4)向机器人系统输出路径规划信息和向HIFU换能器驱动器输出HIFU激励信息。
《图3》

图3.导航系统软件框图。
《3.材料与方法》
3.材料与方法
《3.1.机器人系统控制》
3.1.机器人系统控制
如图4(a)和(b)所示,分别定义了五自由度机器人系统的输入和输出空间。机器人系统有五个输入轴,其规格如表2所示。轴J1和J2分别控制旋转角度φ和沿y轴的平移,轴J3、J4和J5共同控制沿x轴和z轴的平移和旋转角度θ。因此,输入参数J1和J2一对一映射到输出参数φ和y,而输入参数J3、J4和J5多对多映射到输出参数x、z和θ。
《图4》

图4.(a)输入空间;(b)输出空间。
《表2》
表2 机器人系统的输入轴规格

现在我们描述机器人系统的设计原理。第一,机器人系统的设计要使整体尺寸最小化(包括水箱),同时保持各种接近治疗目标角度的灵活性。第二,在乳腺癌的实际治疗中,通常优先选择将治疗区域放置在旋转轴z附近,并设定θ使得HIFU波束垂直于皮肤表面,这种安排可降低皮肤烧伤的风险。通过使用专用电机(J1)控制绕z轴的旋转,将HIFU焦点固定在z轴上,同时使接近的HIFU波束绕其旋转。这可以实现有效的治疗,并且进一步降低皮肤烧伤的风险[10]。第三,正如实际治疗要求一样,并联控制x、z和θ可以保证从竖直位置和从左右两侧位置进行照射时,分别对应HIFU换能器z坐标的低和高。
机器人系统的关节和连杆如图5所示。关节J34和J35分别位于连杆A-J4和B-J5的中心位置。根据给定的设计参数(表3),我们计算出J3和关节A及J'3和关节B具有相同的x坐标。轴J3控制关节J3和J'3的位置,轴J4和J5分别控制关节J4和J5的位置。
《图5》

图5.机器人系统的关节和连杆。
《表3》
表3 机器人系统设计参数

机器人系统通过操纵HIFU换能器来控制HIFU焦点的位置和方向。输出空间中的焦点(在图5中表示为F)位置由参数集(θ,x,y,z,φ)确定,HIFU波束方向和连杆A-C之间的角度表示为Ω,系统的逆运动学(即根据期望的输出参数确定输入参数)由式(1)给出:
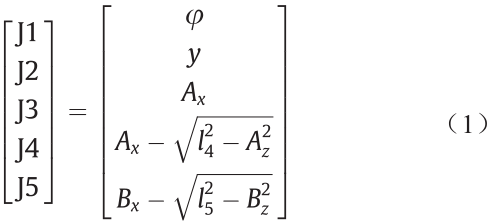
其中

式中,输出空间中的点A、B或C的下标x和z分别表示坐标轴x和z;式(1)中的J1、J2、J3、J4和J5是5个轴的输入值;式(2)中∠FAC由tan∠FAC=fy/fx确定,fx和fy是已知的设计参数(表3)。
《3.2.校准》
3.2.校准
在超声成像技术引导下,校准对精准HIFU治疗非常重要。为了从诊断图像中确定HIFU治疗系统工作区中的目标区域,我们需要建立超声图像空间与机器人工作空间之间的空间关系。{U}表示超声图像的坐标系(以像素为单位),{B}表示机器人基座的坐标系(以mm为单位),确定{U}相对于{B}的相对姿态描述BξU。该关系由式(5)给出:

式中,Bp~[Bx,By,Bz,1]T指在坐标系{B}中成像平面上任意点的位置齐次坐标表示;Up~[u,υ,0,1]T指相同的点在坐标系{U}中的位置齐次坐标表示。变换矩阵BξU由以下步骤求解。
(1)为了简化计算,将原始图像坐标系{U}(以像素为单位)变换为新的图像坐标系{I}(以mm为单位),IξU变换表示将坐标系{U}分别沿u和v方向进行Su和Sv因子的缩放,平移变换移动坐标原点,通过旋转变换调整轴方向。
(2)在三维空间中,将图像坐标系{I}变换为相对于世界坐标系固定的参考坐标系。该变换是通过具有已知几何特性的模型坐标系来实现的,模型坐标系用{P}表示。
(3)图像坐标系{I}相对于机器人末端执行器坐标系{E}表示。从机器人编码器的输出读取出机器人基座{B}中末端执行器的姿态。{I}和{E}通过{P}与提供世界坐标系{G}的外部跟踪系统进行关联。
因此,问题解决如下:
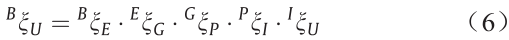
IξU中的缩放因子Su和Sv是根据超声诊断仪器的显示信息确定的,具体来说,是通过计算沿着u和v方向的像素数量,分别对应于比例尺指示的长度。平移变换和旋转变换只是为了计算方便,因此这些参数是已知的。因此,我们可以获得IξU。由于末端执行器的姿态是从编码器输出读取的,BξE也是已知的。然后问题简化为

PξI由参考文献[11]和[12]中描述的N-基准模型法确定。定制的模型如图6所示,N形是由一根直径0.2mm的钓鱼线围成的。世界坐标系(参考){G}由外部光学跟踪系统(Polaris Spectra,Northern Digital Inc.,Waterloo,ON,Canada)提供。GξP的求解是利用光学跟踪系统的节点工具对定制模型上的标记点进行定位,从而得到定制模型上的标记点。GξP是通过将采样点定位在定制探头支架的多个面上来求解,该探头支架将超声成像换能器固定在末端执行器上,由求逆运算解出EξG,最终参数在等式(6)中确定。
《图6》

图6.用于校准的N-基准模型法。
《3.3.校准精度评估》
3.3.校准精度评估
通过对另一根已知几何形状的线模型进行线性扫描,并通过比较三维重建的超声图像特征与物理测量来评估校准精度,参考文献[13]和[14]描述了相关方法。如图7(a)所示,在由两层导线组成的模型上进行校准精度评估。图7(b)是线栅的超声图像。{Q}表示模型坐标系,沿xQ轴线间距为6.0mm,沿yQ轴线间距为5.0mm,其中每一层导线形成一个11×9的网格,共有99个交叉点。该模型中有多个孔,其位置定位在光学跟踪系统的世界坐标系{G}中,可以使用节点工具来获得空间关系GξQ。因此,模型模坐标系{Q}与机器人基座坐标系{B}的关系BξQ=BξE·EξG·GξQ,并且所有交叉点的位置在{B}中已知;接下来,通过阈值来分割模型的三维超声图像,对每根线进行数据梳分析[图8(a)],每组拉线数据在三维欧氏空间中由直线独立拟合,ℝ3[图8(b)];然后计算交叉点的位置;最后,为了验证校准的正确性,我们将从三维超声图像获得的交叉点的绝对位置与通过光学跟踪系统测量获得的实际位置进行比较。
《图7》

图7.(a)照片;(b)应用于校准评估中的线栅超声图像。
《图8》

图8.超声图像的处理。(a)线模型的数据梳分类,其中,蓝点表示不同线之间按照阈值划分,红点表示同一条线的梳形数据;(b)对分类数据进行直线拟合。
《3.4.三维超声图像重建》
3.4.三维超声图像重建
三维超声图像显示出目标及其周围的背景,从而可以直观地观察诊断区域。有多种方法可以从二维图像集中重建三维超声图像[15]。与人工三维超声重建不同,由于已知手眼关系,基于机器人的导航系统可以精确地规划扫描路径,而不需要外部跟踪设备。在我们的系统中,当机器人沿y轴线性扫描时,图像由一个帧抓取器收集,然后传送到个人计算机,最后用基于体素的方法完成重建。三维图像中每个体素的索引号为(i,j,k),二维图像集中的任意像素的位置用(u,v,f)表示,其中,f是帧索引。重建及其算法分别如图9(a)和附录所示。图9(b)为机器人基座坐标系{B}中体积网格的相对方向,每个体素从几个合适的二维图像像素之间的插值中分配一个值。
《图9》
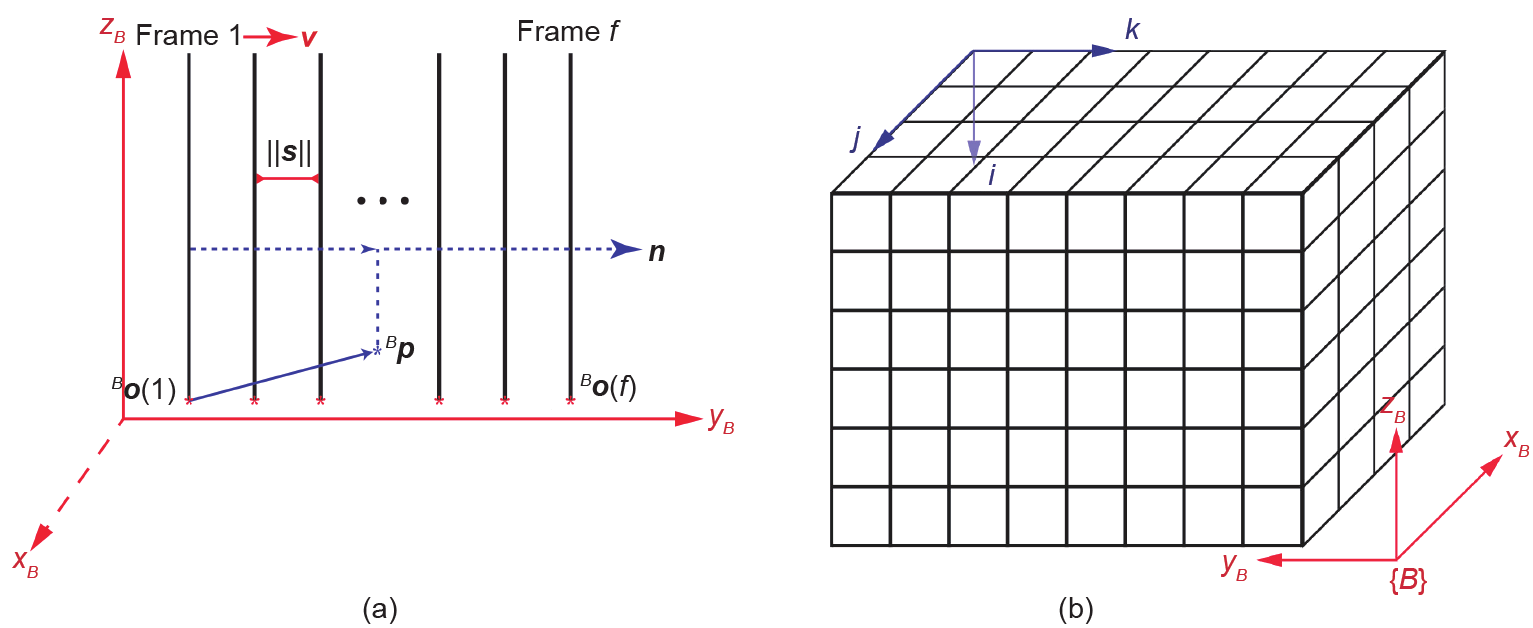
图9.(a)线性扫描过程中三维超声图像重建[v是扫描的速度矢量;n是二维超声图像框架的法向量;||s||是连续帧之间的距离;Bo(1)为第一帧的原点,Bo(f)为第f帧的原点];(b)三维超声图像的体元数据网格。
重建的三维超声图像在三个正交面中可视化(即冠状面、横向面和矢状面),使用鼠标可以很容易地对重建进行探索。
《3.5.分割》
3.5.分割
为了确定HIFU治疗的靶区,必须将肿瘤区域与其周围环境分开。因为超声图像是由散斑效应颗粒构成的,所以自动分割很困难。虽然在任何条件下都可以进行人工分割,但大量的图像会给外科医生带来不合理的工作量。为了减轻二维平面的分割负担,本系统采用了交互式辅助工具Livewire[16]。当外科医生将光标移动到灰度超声图像上时,在此过程中计算相邻像素的本地成本;当用户点击鼠标时,将确定用于计算新的本地成本的锚点,并且确定先前自动生成的本地路径;几次点击后,目标区域被分割。在实际治疗中,必须分割多个平面提取肿瘤的三维体积。本文对二维平面上的治疗精度进行了评价。
《3.6.生成治疗路径》
3.6.生成治疗路径
在分割出目标区域之后,我们必须生成机器人操纵HIFU换能器完成治疗的路径。为此,需要两种参数:首先,必须确定在机器人基座坐标系中HIFU治疗的规划点位置;其次,必须确定每个点上HIFU波束的方向。与MRI引导系统相比,台架中的定向限制了HIFU治疗。本系统首次消除了这种空间限制,实现了从多个方向进行高度灵活的HIFU治疗。
每个规划治疗点的空间信息包括点的位置和到该点的波束方向。这些信息由机器人(θ,x,y,z,φ)参数描述,参数(θ,φ)分别表示波束的方位角和仰角(即光束方向),而(x,y,z)表示HIFU焦点的位置。因此,完成治疗需要一系列机器人姿态ξi~(θi,xi,yi,zi,φi)(i=1,2,3,…,n)和HIFU照射条件(即功率、持续时间和冷却时间设置)。
为了治疗根据分割结果描绘的靶区域,外科医生首先确定治疗平面,即在二维治疗平面上放置治疗点。治疗平面的数量(一个或几个)取决于靶区域体积。作为一种安全裕度,可以通过扩展或缩小靶区轮廓来改变靶区周围组织的数量。首先,将靶区域均匀网格化并在其中填充治疗点;然后,用户设置波束方向。对于在单一治疗点的多功能治疗,机器人系统可以从不同方向照射HIFU。在机器人系统的预期使用中,患者将俯卧在水箱上方。因此,我们将治疗平面与冠状面平行,并将波束方向与冠状面垂直,从而简化了治疗过程。实验装置如图10所示(乳房形状模型放置在系统工作区的适当位置)。
《图10》

图10.基于固定方向的路径生成,其中蓝线、红点和灰盒分别表示治疗平面、HIFU焦点和超声成像探头。
《3.7.系统评估方法》
3.7.系统评估方法
在模拟临床治疗的实验中,对超声引导的机器人辅助HIFU治疗系统进行了评估。我们设计了一个异构模型,包括模拟肿瘤、周围正常组织和标记点。图11(a)和(b)分别是模型设计示意图和已制备模型的照片,该模型由透明的丙烯酰胺凝胶构成,该凝胶含有脱气的鸡肉丁和猪肝片,其中,鸡肉代表待治疗的肿瘤区域,而周围猪肝代表正常组织。四个参考标记点为评估治疗优劣提供了一个物理坐标系。在治疗规划过程中,该标记位置在超声图像和治疗后分析过程中的图像上都是确定的。这些标记为超声图像、光学照片和物理空间的不同区域关联提供了空间参考。
《图11》

图11.用于系统评估的(a)示意图和(b)异构模型的照片,(a)中的标记提供了一个笛卡尔坐标系{R}。
通过规划治疗区域与实际治疗区域的绝对偏差、治疗完成度和规划区域周围的超调量三个指标进行量化评估。实验步骤总结如下:
(1)从机器人线性扫描时采集的二维超声图像重建出该模型的三维超声图像;
(2)设置治疗平面靠近鸡肉的底面(即该平面靠近HIFU换能器表面);
(3)从周围组织(即猪肝)分离出目标区域(即鸡肉);
(4)用规划好的HIFU治疗点填充目标区域。单个HIFU治疗点的消融面积是直径为5mm的圆,每个治疗点之间的间隔是3.5mm;
(5)将治疗路径信息导出到机器人系统,进行HIFU照射;
(6)通过比较实际和规划治疗区域评估基于超声引导HIFU治疗系统。
评估方法详见参考文献[17]。
《4.结果》
4.结果
《4.1.校验结果》
4.1.校验结果
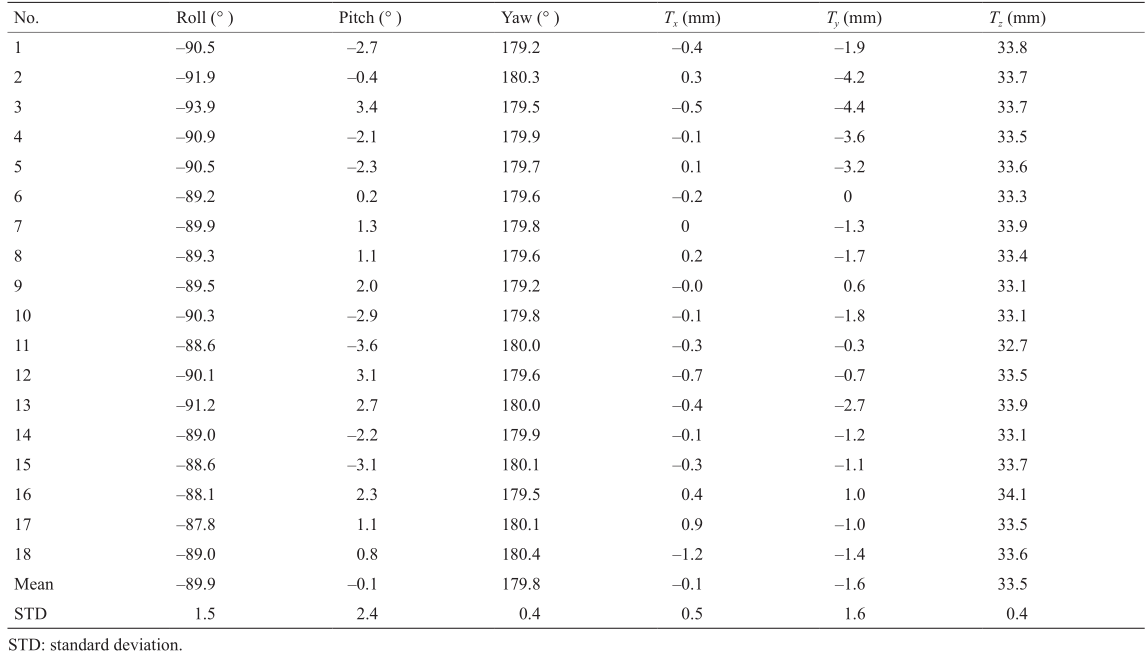
校准实验包括18项独立实验,这些实验具有不同的末端执行器或N-基准模型的绝对姿态。表4给出了校验后的变换矩阵EξI。每一行数据表示在单次试验中计算的相对位姿,该位姿是基于超声图像坐标系{I}相对于机器人末端执行器坐标系{E}得到的。变换矩阵的旋转部分采用滚动角、俯仰角和偏航角度表示(即围绕x、y和z轴的连续转动),并且平移部分是沿指定轴x、y和z平移(相应表示为Tx、Ty和Tz)。最终结果是18次实验的平均值。
《表4》
表4 18项独立实验的校验结果
《4.2.校验精度》
4.2.校验精度
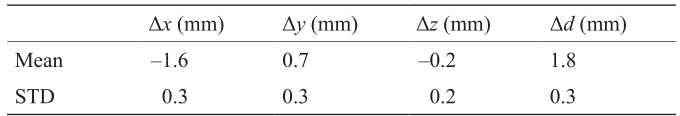
由于成像宽度有限,系统在模型底层的99个交叉点中成像77个(该模型靠近成像换能器),并且在上层中的99个交叉点成像出88个。表5给出了从三维超声图像获得的交叉点位置与基于光学跟踪系统的测量值获得的交叉点位置之间的平均差值,其中,Δx、Δy和Δz分别表示沿xB、yB和zB方向上的位移。绝对偏差由公式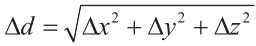 计算。以实际的交叉点为基准,就平均值而言,从三维超声图像获得的位置与基准位置的误差在2mm以内。
计算。以实际的交叉点为基准,就平均值而言,从三维超声图像获得的位置与基准位置的误差在2mm以内。
《表5》
表5 校验评估结果
《4.3.系统评估结果》
4.3.系统评估结果
接下来,在异构模型上对基于超声引导的HIFU治疗进行三次评估,三次实验结果如图12所示,(a)、(b)和(c)中的子图分别表示基于超声图像的规划方案、HIFU照射后的实际处理区域以及由参考标记提供的相同坐标系{R}上规划治疗区域与实际治疗区域的比较。
《图12》
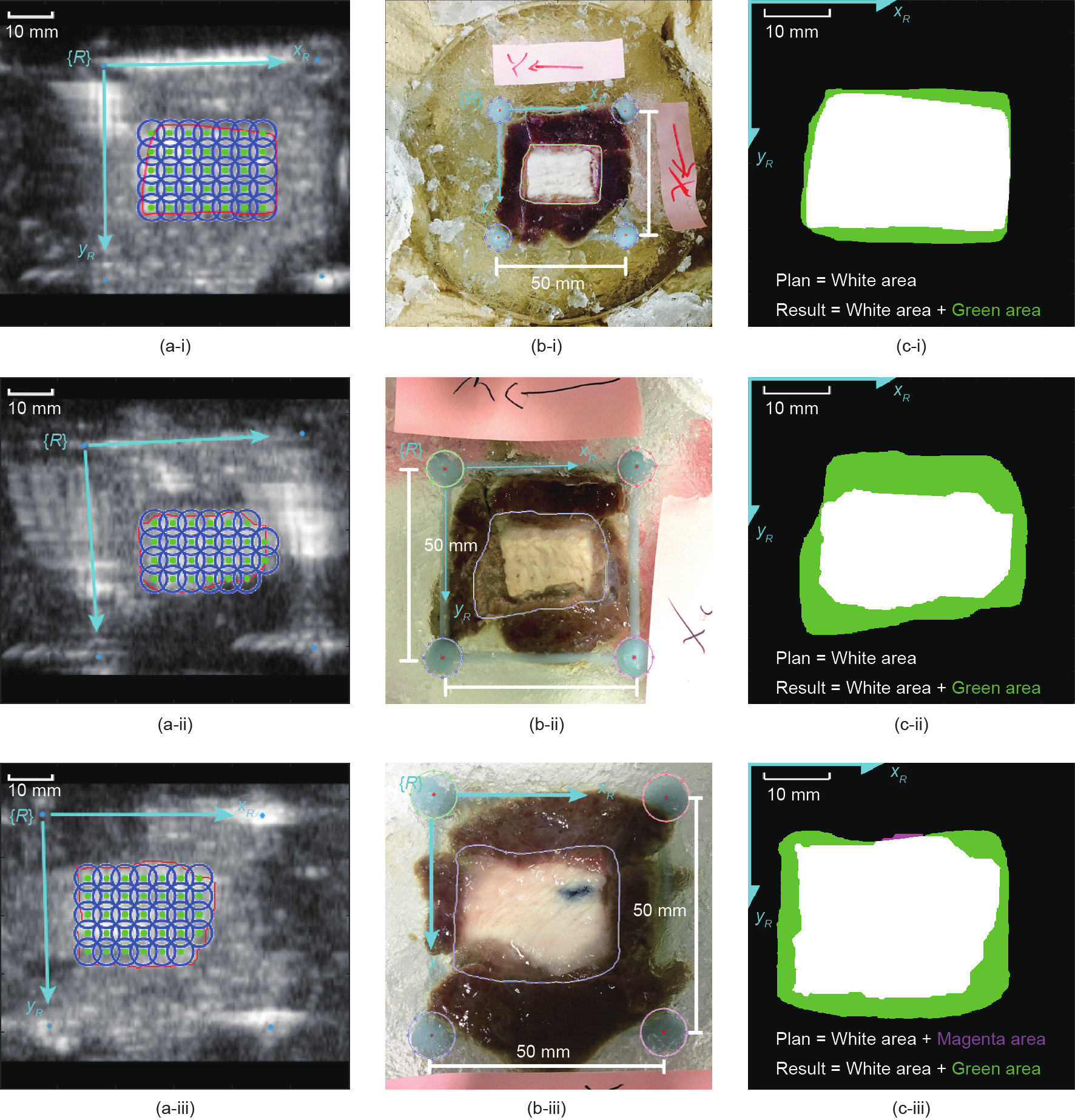
图12.系统评价实验的结果。第(i)、(ii)和(iii)行分别对应于实验1、2和3。在(a)列中,红线代表HIFU治疗的规划区域;蓝色的圆圈和绿色的点分别表示估计的消融区域和每个HIFU治疗点的位置;在(b)列中,以鸡肉为边界的闭合曲线勾勒出视觉识别的实际处理区域,每个图像上的四个圆圈用来计算图像空间中标记点的中心;在(c)列中,每条路径的规划区域用白色表示,超调处理区域用绿色表示,未处理区域用洋红色表示。
表6列出了拟治疗区域和实际治疗区域的统计情况。用假阴率(false-negative rate,FNR)量化了未治疗区域与拟治疗区域的面积比,定义如下:

式中,|P|和|A|分别表示拟治疗区域与实际治疗区域。通过将拟治疗区和实际治疗区域转换为相同的极坐标系和径向差异计算来求解超调治疗区域,超调治疗区域结果用它们的均值和标准差表示。
《表6》
表6 准确评估的统计数据

在实验1和实验2中,HIFU的实际消融区域完全覆盖了拟规划区域。在实验1中,拟治疗区域和实际消融区域的中心相差0.3mm,超调治疗区域位于拟治疗区域的(1.5±1.0)mm附近;在实验2中,中心偏差是0.9mm,超调治疗区域位于拟治疗区域的(4.2±1.9)mm附近;在实验3中,其中0.5%的拟治疗区域未被实际消融区域覆盖,拟治疗区域与实际消融区域的中心相差1.1mm,并且超调治疗区域位于拟治疗区域的(2.6±1.5)mm附近。这些结果将在下一节讨论。
《5.讨论》
5.讨论
在上述系统的开发中,我们构建并集成了三维超声图像重建、图像分割和治疗路径生成等功能块,但是有几个功能块需要改进。目前的三维重建方法仅执行一次扫描。由于成像探头的视野有限,部分靶区可以省略。视图区域可以通过进行多次扫描的批量复合方法进行扩展。调整波束方向、调整治疗点的分布和其他的功能细化将使治疗计划更加详细。
在系统评估实验中,拟治疗区域的中心偏离HIFU-消融区域的中心小于2mm。在实验2中,模拟制备过程中部分肝组织损伤可能导致相对较大的超调治疗区域,因为凝胶的凝固释放大量的热量。这三个实验中不同的超调治疗区域可能反映了模拟制备过程的变化,这可能产生气泡(形成气洞);在实验3中,拟治疗区域的不完全覆盖表明缺少边界安全设置。在实验中,假设拟治疗区域等于鸡肉的分割区域(即相当于安全裕度为0mm),这个区域充满了HIFU治疗点,该点用来估计消融区域。
然而,单个HIFU治疗点的实际消融区域可能因病例而异。在临床治疗应用中,外科医生通常允许10mm的安全裕度来保证完全治疗[18]。从这个角度来看,目前的超调值远低于允许值,并且我们的系统是足够准确的。在今后的研究中,应在进一步的实验中确定合适的安全裕度,并对模拟制备工艺的要求更加严格。
评估实验的模拟系统设计确定了在二维平面上超声引导的HIFU治疗精度,但不能精确地评估沿HIFU波束轴向的精度。然而,在我们的实验条件下,单个HIFU治疗点在该方向上的波长大于10mm,这意味着单个治疗平面将治疗厚度在10mm左右的体积。因此,在实际的乳腺癌治疗中,只需要几个治疗平面,该方法可以扩展到多个治疗平面。
此外,目前评估实验中使用的系统缺少乳房皮肤模拟成分。因此,当波束非正交照射到皮肤表面时,我们无法测量HIFU治疗点的折射率偏差。在今后的工作中,将会用含有乳房皮肤模拟成分的模拟系统来评估治疗点偏差。
目前的实验假设声速恒定。当改变波束的接近方向时,本系统可以保持HIFU治疗点在空间中位置固定,这种新约束条件可以降低皮肤烧伤的风险。然而,生物组织的不均匀性会导致声速分布不均匀,所以实际的HIFU治疗点会偏离规划位置。我们预测该异构模拟系统将揭示由非均匀声速造成的误差,因为实际治疗区域总是可以与规划区域直接进行比较。
在目前的评估实验中,HIFU照射的功率和时间都是恒定的。在进一步的研究中,每次辐射的功率和时间将会根据靶区域的形状进行调整,这将提高治疗的准确性和减少对正常组织的损伤。此外,在本文中HIFU治疗点的位置仅由机器人系统控制,在今后的工作中,我们计划将对HIFU波束进行电子化聚焦来微调聚焦点的位置。
《6.总结》
6.总结
我们提出了一种基于超声引导的五自由度机器人辅助HIFU治疗乳腺癌系统,搭建了一个功能齐全的样机系统,可以方便地对超声图像进行三维超声图像重建、目标分割、治疗路径生成和HIFU自动照射。该系统在异构组织模型上进行了评估,拟治疗区和HIFU消融区中心偏离2mm,拟治疗区超调值远低于临床使用的允许值,考虑到外科医生设置了治疗超调的界限,这种准确性被认为足以完成治疗。在今后的工作中,通过增加治疗方案的灵活性来改进系统,并在三维空间中评估治疗的准确性,还应考虑组织不均匀性引起的非均匀声速的影响。
《Acknowledgments》
Acknowledgments
This work was partially supported by the Translational Systems Biology and Medicine Initiative (TSBMI) from the Ministry of Education, Culture, Sports, Science and Technology (MEXT) of Japan. The authors would also like to thank the China Scholarship Council and Otsuka Toshimi Scholarship Foundation.
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Tianhan Tang, Takashi Azuma, Toshihide Iwahashi, Hideki Takeuchi, Etsuko Kobayashi, and Ichiro Sakuma declare that they have no conflict of interest or financial conflicts to disclose.
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data associated with this article can be found in the online version, at https://doi.org/10.1016/j.eng.2018.07.008.














 京公网安备 11010502051620号
京公网安备 11010502051620号




