《1. 背景介绍》
1. 背景介绍
为了实现对复杂生物过程的解析,研究人员需要使用一系列的工具对各种参与生物过程的蛋白质分子加以调控,以获得相关重要参数的信息。光遗传学模块是基于遗传信息编码的工具,通过将光敏蛋白元件在细胞中的表达,使得研究人员可通过光来对特定生物过程实现时间与空间上的精准操控[1]。因此,光遗传学为细胞生物学家提供了一种前所未有的调控细胞活动的新方法。在过去几年中,光遗传学技术在细胞生物学和合成生物学研究中的应用有了长足的发展[2−4]。
《2. 利用光来控制细胞活动》
2. 利用光来控制细胞活动
与利用化学物质来调控细胞活动相比,光控有其独特的优势,如使用方便、可实现可逆性及精准调控。更重要的是,使用光不会影响细胞的正常生命活动。为了实现对细胞的光遗传学操控,用于激活的光源需要与光敏感蛋白的激活光谱保持一致。截至目前,已有各种用于光遗传学实验的光源,包括标准汞灯光源[5]、激光[6]和发光二极管(LED)[7]等。
单细胞或亚细胞水平的光遗传学操控通常在配备有激光光源和相应光学控制模块(如Galvo扫描振镜)的显微镜下进行,以实现精准的光照控制[6,8]。然而,在其他某些生物学研究中,比如需要调控大批量细胞的活动(如在培养皿中的成千上万个细胞)并加以分析,或者需要以不同的光控模式同时刺激细胞以实现高通量筛选,为应对这样的研究场景,极其需要一种实用的、可调控的、便携的光源激活系统。
《3. 用于光遗传学研究的无线程控 LED 阵列的设计》
3. 用于光遗传学研究的无线程控 LED 阵列的设计
本研究设计并实现了一种全新的无线程控LED阵列系统,该系统通过无线通信实现对光照亮度的调节,能精确调节光照亮度和频率以满足光遗传学的研究。本系统包含上位机、一个蓝牙通信模块和下位机。下位机是一块PCB板,在上面搭载集成各种电路元件,包括微处理器、12个移位寄存器、8×12阵列排布的LED灯珠,以及相应的96个电阻[如图1(a)~(c)及Appendix A所示]。PCB板的大小为124.46 mm×86.36 mm,各个LED灯珠间的距离为9 mm,以适应96孔细胞培养板的大小与灯珠分布[图1(b)]。LED灯珠的发射波长为(470±10)nm,因此本系统能应用于蓝光波段激发的光遗传学研究[6]。
《图1》

图1. 无线程控LED阵列系统的设计。
此外,本系统以脉冲宽度调制(PWM)(详见Appendix A所示)的方式实现对LED灯珠开关以及亮度的精准调控,如图1(d)所示为每个灯珠以不同的亮度实现“ZJU”(浙江大学英文缩写)字样的显示。我们计算并校准了每个LED灯珠的光照强度,其中最大功率为60 mW,其相应的照度为2500 mcd,梯度光照强度符合线性特性[图1(e)],这证明了本系统可用于精确调控光强的能力。自行开发的可精确控制该LED阵列系统的光照模式与光照强度的软件在Visual Studio2015 C#环境下完成,并且实现了用户友好界面的优化(详见Appendix A)。
《4. 细胞中磷酸肌醇 3- 激酶活性激活的定量光控》
4. 细胞中磷酸肌醇 3- 激酶活性激活的定量光控
虽然大多数先前的光遗传学研究已表明可使用光来打开或关闭特定信号分子,但是极少数研究能够实现对细胞中信号通路激活的定量操控。我们的下述实验证明本研究开发的无线程控LED阵列系统能够用于远程调控细胞中的磷酸肌醇3-激酶(PI3K)信号。如果缺少这种精准的光控照明系统,那么对细胞内PI3K信号的远程调控将无法实现。
我们使用的光遗传学元件基于蓝光诱导下隐花色素2蛋白(CRY2)和CIB1蛋白的N端片段(CIBN)之间的蛋白二聚化[9]。我们通过对这一光控系统的改造,使其能用来控制PI3K信号通路[6]。在蓝光的刺激下,CRY2-iSH2融合表达蛋白被募集到带有CAAX标记的CIBN配体上,从而引起PI3K在细胞膜上的聚积,进而激活下游的Akt信号[图2(a)、(b)]。我们在HeLa细胞中转染CIBN-CAAX和CRY2-iSH2这两个质粒,再通过蛋白免疫印迹的手段来研究蓝光刺激后细胞中Akt的磷酸化情况(具体实验方法详见Appendix A)。我们使用不同开关频率的蓝光来对培养箱中的细胞加以刺激,实验的时间均为30 min,但使用不同的照明频率,分别为5 s/1 min(即LED亮5 s后关闭1 min,在30 min内循环)、1 min /1 min(即LED亮1 min后关闭1 min,在30 min内循环)和30 min全亮。基于生化实验结果[图2(b)]和相对应的定量分析[图2(c)],在用蓝色LED光刺激后,Akt在Thr308和Ser473两个位点的磷酸化有显著增加,且Akt磷酸化的程度随着蓝光照射强度的增加而增加,且Akt磷酸化的程度随着蓝光照射强度的增加而增加,2(c)]。因此,该实验证实使用本研究开发的无线程控LED阵列光照系统,能实现对细胞中内源性PI3K信号通路激活的定量光操控。
《图2》
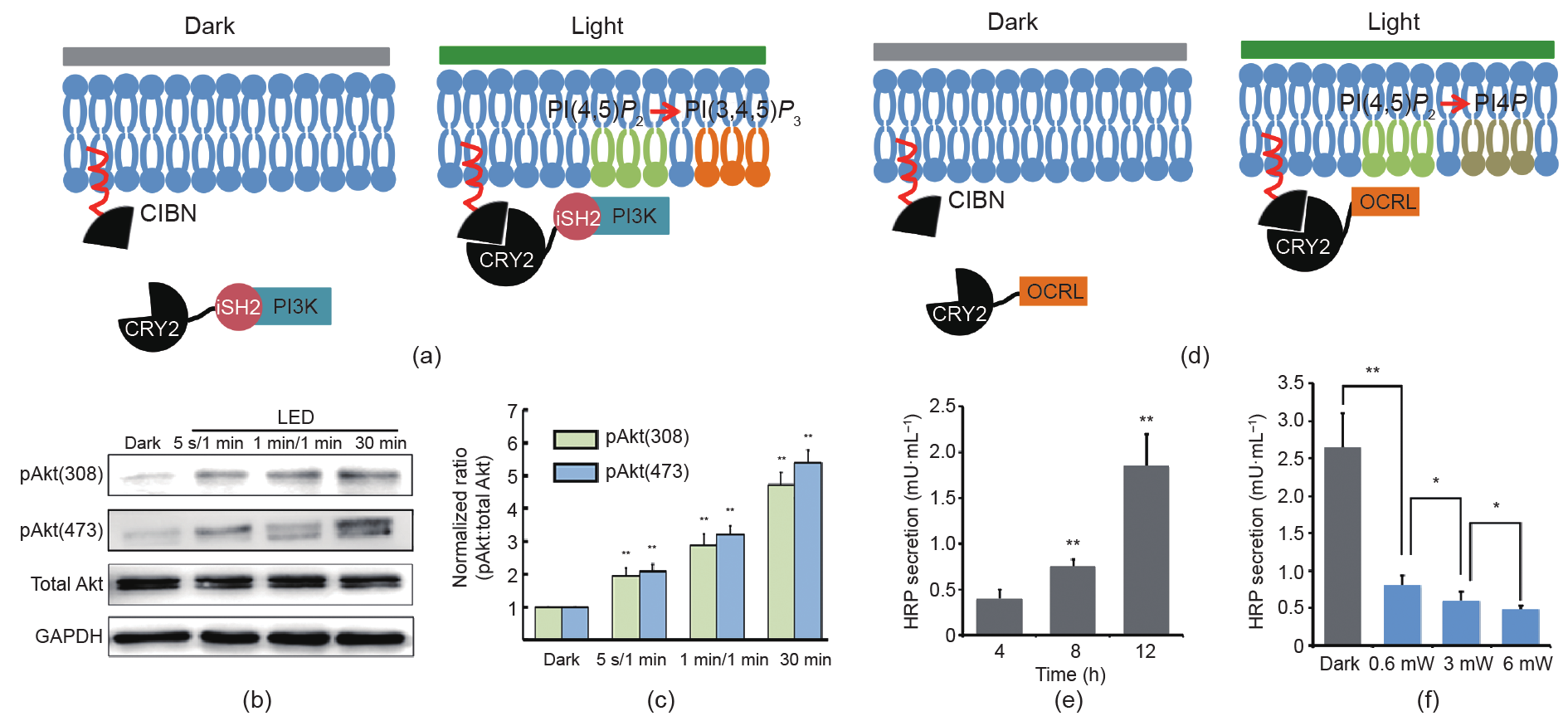
图2. 使用无线程控LED阵列系统实现对细胞内PI3K信号通路激活的定量光操控,以及在96孔细胞培养板系统中进行的基于光遗传学的细胞功能 筛选研究,探究胞内磷脂PI(4,5)P2含量的改变对细胞辣根过氧化物酶(HRP)分泌造成的影响。
《5. 光遗传学辅助的高通量细胞分泌筛选》
5. 光遗传学辅助的高通量细胞分泌筛选
我们已证明本研究开发的新型LED光照系统能够在96孔细胞培养板中开展光遗传学辅助的基于细胞的体外筛选研究。我们使用CRY2-OCRL融合蛋白来调控细胞内磷酸肌醇的代谢,并分析其对细胞中辣根过氧化物酶(HRP)分泌的影响[8,10]。在蓝光刺激下,CRY2-OCRL会被募集到表达有CAAX-CIBN的细胞膜上,这将导致PI(4,5)P2这一磷酸肌醇的肌醇环上5号位的去磷酸化,从而降低细胞膜上PI(4,5)P2的含量[图2(d)]。
我们通过在HeLa细胞中表达HRP-GFP来进行HRP分泌的检测。HRP-GFP在细胞中的分泌途径已经被证实是通过囊泡的分泌途径发生[11]。HeLa细胞转染CAAXCIBN、CRY2-OCRL和HRP-GFP这些质粒后,进行细胞HRP分泌的定量测量(详见Appendix A)。在没有蓝光激活的条件下,我们检测到培养液中HRP的分泌量有时间依赖性的增加[图2(e)]。接着,我们对这些转染的细胞开展光遗传学实验,在96孔细胞培养板中每孔对应一个LED灯珠,并给予不同强度的蓝光刺激,研究结果发现OCRL对HRP分泌的抑制作用与照射蓝光的强度相关。我们证实3 mW的光照比0.6 mW的光照具有更强的抑制作用,而与3 mW和0.6 mW的光照效果相比,6 mW的光照具有最强的抑制作用[图2(f)]。对照实验表明,蓝光LED刺激本身所引起的HeLa细胞中HRP分泌的影响可忽略不计,这进一步表明该抑制作用是由光遗传学操控所引起的(详见Appendix A)。因此,该研究表明无线程控LED阵列光源能实现对细胞原位高精度的定量光操控,并对细胞功能开展高通量筛选。
《6. 结论》
6. 结论
近年来,合成生物学已成功地实现细胞信号传导通路的重构,以及设计新的信号通路来调控细胞功能。光遗传学技术是对现有方法的良好扩展与补充,因为它具有使用光作为可调式和非侵入性介质来控制光敏感蛋白功能的独特优势。在一特定的光遗传学研究中,光能被用作对细胞的信号输入或虚拟的刺激,从而触发细胞中表达的光敏蛋白元件的反应。因此,光被用于调节细胞内分子网络和细胞信号传导通路的研究[1]。对于研究细胞如何感知复杂且随时间变化的输入信号,以及试图理解细胞中的信号输入及其诱导的功能输出之间的定量关系时,对于光源的可调式控制就显得极其重要。
我们建立的这套新型的无线程控LED阵列光源系统可实现在细胞内进行可调式的光遗传学操控研究。应用这一系统,我们能够在细胞中定量地激活PI3K信号通路,并且建立基于光遗传学的细胞筛选方法来剖析PI(4,5)P2磷酸肌醇在细胞分泌中的重要作用。我们预期本研究建立的这一新型光照系统会在未来细胞生物学和合成生物学研究中有广泛的应用,用于解决复杂的基础研究难题,为基于光学的生物医学应用提供定量操控的方法。
《致谢》
致谢
本课题由浙江省自然科学基金(LR18H180001)、国家自然科学基金(31611130037、31571480和31811530055)以及科技部国家重点研发计划(2016YFF0101406)等项目资助。
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data associated with this article can be found, in the online version, at https://doi.org/10.1016/j.eng.2018.08.005.













 京公网安备 11010502051620号
京公网安备 11010502051620号




