《1.引言》
1.引言
聚酯塑料是日常生活中应用最为广泛的塑料制品之一[1–5]。仅2013年全球就生产了5.6×106t聚酯塑料,但仅有不到30%被回收使用[6]。目前,针对塑料的回收主要采用化学和生物两种方法进行。化学回收塑料需要在高温[7–9]和高压[10–12]下进行,会消耗大量的能量,而且化学回收塑料的过程中会产生很多对环境有毒或有害的物质,容易造成二次污染[7,13]。相反,生物法回收塑料往往在较为温和的条件下进行,是一种环境友好的方法[7,14]。在先前的研究中已发现来自Thermobifida fusca(T.fusca)[15]、Fusarium solani pisi[16]和T.cellulosilytica[17]的角质酶,这些酶可以在50℃下降解PET塑料,但是在室温下的降解效率极低。如何能在常温下高效降解塑料是一个亟待解决的问题。2016年,Yoshida等[18]在垃圾处理站分离出一种新型细菌Ideonella sakaiensis 201-F6,它可以在常温下利用PET作为能量和碳源。I.sakaiensis黏附于PET表面,并分泌一种独特的角质酶PETase来降解PET。PETase能将PET降解为单(2-羟乙基)对苯二甲酸(MHET)和乙二醇(EG)。随后这种细菌将降解的小分子产物摄入体内,在一种名为MHETase的酶的作用下,降解为对苯二甲酸(TPA)和EG,并最终进入该细菌的三羧酸循环,为细菌生长提供碳源和能量。PETase的氨基酸序列与几种具有PET水解活性的角质酶和脂肪酶高度同源,相比先前报道的LCC、TfH和THc_Cut1而言,PETase降解对硝基苯酚脂肪族酯化合物时表现出较低的活性,然而这种化合物却是脂肪酶和角质酶的优选底物。先前发现的酶降解PET的最适温度是50℃,相反,PETase在常温下具有比先前报道的酶降解PET的能力更强[18]。因此,PETase的发现使得PET在常温条件下被降解成为可能。但是野生型PETase的活性太低,故需要对PETase进行改造。通过理性设计来提高PETase的活性是一种最有效的策略。同时,研究表明,对角质酶和脂肪酶的改造是有效的。例如,Acero等通过定点改造T.cellulosilytica的角质酶使其活性提高了两倍[19];Ren等利用定点突变技术使T.fusca的角质酶的活性提高了2.7倍[20];Silva等修饰了Tfu_0883的活性位点以增加疏水性拓宽底物结合位点的口袋大小提高酶与底物的接触面积,该方法使Tfu_0883降解PET的能力提高了近两倍[21]。
与随机突变和定向进化相比,蛋白质的理性设计需要较少的筛选量。然而,理性设计往往需要对蛋白质进行饱和突变[22,23]。由于PETase在细胞内表达,不能与固体PET直接接触,故而较难建立高通量筛选方法。若所有突变体都在大肠杆菌中表达并分离,则非常耗时[22]。通过简单高效的高通量技术进行初步筛选对研究人员来说是一个巨大的挑战[23,24]。无细胞蛋白质表达系统的出现,为酶的理性设计提供了有效且方便的方法。与传统的大肠杆菌胞内表达相比,无细胞蛋白质表达系统显著缩短了表达时间,并减少了反应体积,从而使高通量筛选成为可能[25]。Murthy等[25]使用50μL的无细胞蛋白质系统在4h内实现铜绿假单胞菌63种蛋白质的高通量合成,并成功表达了51种蛋白质。Sawasaki等[26]开发了一种基于小麦种子的无细胞蛋白质表达系统,可以平行翻译至少50个基因。该系统避免了传统表达系统耗时的克隆步骤,使其适用于蛋白质。由Goshima等[27]开发的高通量无细胞蛋白质表达系统,表达13364种人类蛋白质,其中,77%具有生物活性。因此,无细胞蛋白质表达系统为高通量蛋白质表达提供了平台。无细胞蛋白质合成突破了细胞壁的限制,表达的蛋白质可以与固体PET直接接触,从而实现了高通量筛选PET水解酶的可能性。
本研究以一种能够在常温下高效水解PET的角质酶PETase为对象,通过PETase和2PET的分子对接,构建酶与底物反应的相互作用模型;找出活性位点周围的活跃氨基酸,利用定点突变的方法对这些氨基酸进行突变,并利用无细胞蛋白质表达体系对得到的突变体蛋白质进行高通量表达和筛选,来定性分析酶的活性;为了进一步验证酶的活性,对初筛得到的酶活性提升的突变体蛋白质,利用大肠杆菌进行表达和纯化,来进一步确认其活性。
《2.材料和方法》
2.材料和方法
《2.1.突变位点设计原则》
2.1.突变位点设计原则
PET酶的三维模型、活性位点以及与催化活性相关的关键氨基酸已有报道[28]。本研究根据模型对PETase的活性位点进行改造以减少活性位点周围的空间位阻并增强活性位点和聚酯塑料之间的亲和力,从而使PETase更有效地与PET结合并反应。角质酶和脂肪酶的活性位点是高度保守的序列-G-X1-S-X2-G-,这个保守序列已经在LCC[29]、TfCut2[30]和TfH[31]中发现。通过比较PETase和TfCut2的序列,我们发现PETase的催化三联体由S131、H208和D177组成。对PETase的催化三联体进行突变,利用疏水性较好的氨基酸取代原始氨基酸以扩宽底物结合沟壑,增加活性位点周围氨基酸的疏水性,或改善PET活性位点周围氨基酸的亲和力,以期增加PETase的催化活性。
《2.2.PETase的点突变》
2.2.PETase的点突变
首先,根据大肠杆菌的密码子偏好性对PETase基因进行密码子优化。在合成过程中将柔性肽(GGGGS)3引入PETase的C端,将BamHI/NcoI限制酶位点添加到PETase的两端,使用BamHI/NcoI将PETase连接到pRSET-CFP载体中并与青色荧光蛋白(CFP)融合。构建pRSET-PETase-CFP作为PETase的定点诱变的模板。使用快速定点诱变试剂盒(TIANGEN Biotech,KM101)对PET酶进行定点诱变,然后通过测序验证。用于位点突变PETase的引物列于Appendix A的Table S1中。
《2.3.无细胞蛋白质表达体系中的蛋白质合成》
2.3.无细胞蛋白质表达体系中的蛋白质合成
将重组PETase突变体在基于大肠杆菌的无细胞蛋白质合成系统中表达[30−32]。根据Shin等[33]报道的方法进行粗提物制备和分批模式无细胞反应。将pRSET-CFP(每个反应系统50μL)用作无细胞蛋白质合成的载体,在37℃下保持12h;使用酶标仪实时监测反应,荧光检测器的激发波长为435nm,发射波长为479nm。
《2.4.突变体活性初筛》
2.4.突变体活性初筛
向每个无细胞蛋白质表达系统中加入缓冲液(50mmol·L–1bicine-NaOH,pH8.5),将荧光强度稀释至1000;然后取10μL所得溶液移液至1990μL(50mmol·L–1bicine-NaOH,pH8.5)反应系统中。接下来,添加1.5cm×1.0cm的PET膜(Goodfellow,577-529-50)并在30℃下反应48h。用1mol·L–1氢氧化钠(NaOH)稀释水溶液然后热处理(50℃,10min)终止反应。在12000r·min–1离心1min后,将200μL上清液移液到96孔板中,用酶标仪测量240nm处的吸光度[15]。在添加之前,将PET膜用1%十二烷基硫酸钠(SDS)、乙醇和蒸馏水在50℃预洗涤30min,然后在50℃下干燥48h。所有实验设计三个生物学平行。用CFP(代替用PETase-CFP融合蛋白)作为对照。
《2.5.大肠杆菌中蛋白质的表达与纯化》
2.5.大肠杆菌中蛋白质的表达与纯化
将所有野生型和突变蛋白质克隆到pET28a载体中,并转化到大肠杆菌BL21(DE3)细胞中,在37℃的LB培养基中生长至OD600为0.6~0.8,将培养基冷却至16℃,并在16℃和160r·min–1下使用终浓度为0.1mmol·L–1的IPTG诱导20h,使大肠杆菌表达蛋白质,高速离心(25min,10℃,4000r·min–1)收集细胞。将200mL的细胞沉淀重悬于10mL Ni-NTA裂解缓冲液(50mmol·L–1NaH2PO4,300mmol·L–1NaCl,10mmol·L–1咪唑,pH8.0)中。冰上超声破碎细胞,离心收集细胞裂解液(30min,4℃,4000r·min–1)。将上清液加入到His-Accept镍柱(Beyotime)中。用10mL裂解缓冲液洗涤未结合的蛋白质,用1mL的洗脱缓冲液(50mmol·L–1Tris-HCl,pH7.5,300mmol·L–1NaCl,200mmol·L–1咪唑)洗脱结合的蛋白质,使用PD-10凝胶过滤柱(GE Healthcare)将蛋白质洗脱缓冲液交换为50mmol·L–1Na2HPO4-HCl(pH7.0)和100mmol·L–1NaCl。
《2.6.米氏常数分析》
2.6.米氏常数分析
使用乙酸对硝基苯酯(PNPA)作为底物进行测量,以分析米氏动力学参数[29,33,34]。动力学参数在30℃和pH7.0的条件下测定,底物浓度范围为0.5~8.0mmol·L–1。所有实验一式三份进行。使用Sigma Plot 11.0软件(Systat Software GmbH,Erkrath,Germany)利用Double-Reciprocal Plot计算动力学数据。动力学参数和计算过程显示在补充材料(Appendix A中的Fig.S1和Table S2)中。
《2.7.酶水解PET》
2.7.酶水解PET
在PET水解之前,将所有膜在三个连续步骤中洗涤:首先在1%SDS溶液中,然后用乙醇,并最后用去离子水洗涤。每一步持续30min。将PET膜(1.5cm×1.0cm,约36mg)置于含有50μg的PETase和1.5mL50mmol·L–1 Bicine-NaOH(pH8.5)的反应溶液中,在30℃下反应48h。用1.0mol·L–1NaOH稀释水溶液,然后热处理(50℃,10min)终止反应。最终产物通过反相HPLC分析。将PET膜洗涤并干燥,随后进行预洗涤,进行重量损失测定。所有实验设计三个生物学平行。使用1.5mL不含酶的Bicine-NaOH(pH8.5)作为阴性对照。
《2.8.扫描电镜分析》
2.8.扫描电镜分析
反应后,将实验组和对照组的PET洗涤并干燥,然后用扫描电子显微镜观察。使用电子显微镜以2500×放大率扫描样品中的相关位置。
《3.结果》
3.结果
《3.1.用于选择突变位点的PETase的结构模型》
3.1.用于选择突变位点的PETase的结构模型
PETase的活性位点和与其催化活性相关的氨基酸已有报道[28]。PETase中由Y58和M132组成的氧负离子空穴以及S131、D177和H208构成的催化三联体也已经被证实。所有实验均基于PETase的三维模型(蛋白质数据库代码:5XG0)设计。
PETase与底物2PET构成的酶与底物相互作用模型如图1所示。由Y58和M132形成的含氧阴离子孔是PETase的催化核心位点。S131作为亲核试剂参与酯键的裂解,并且含有芳族基团的Y58是结合底物所必需的。位于底物结合位点的W156和W130氨基酸也参与底物结合。根据与PETase和底物分子之间的结合相关的结构部分的分析,选择活性位点周围六个氨基酸:R61、L88、S178、I179、S209和A211,所有这些位点都参与底物结合。
《图1》

图1.PETase与2PET的分子对接复合物的结构。灰色表示表面结构,绿色表示对接分子2PET,黑色虚线表示底物2PET结合口袋,黄色表示底物结合沟壑中涉及的关键残基。
R61位于底物结合位点的末端,该位点的氨基酸疏水性影响蛋白质与底物的结合。同时,该位点的氨基酸的大小也会影响降解产物的释放。因此,将该位点的精氨酸突变为具有更高疏水性和低相对分子质量的丙氨酸可能提高酶的活性,同时增加酶与底物之间的接触,并促进底物的释放。由于L88和S209位于底物结合通道的外侧,增加该位点氨基酸的疏水性可能增加PETase对底物的亲和力,使蛋白质与PET更容易接触。因此L88突变为苯丙氨酸时,其与PET的亲和力可能更强。将S209分别突变为疏水更强的缬氨酸和苯丙氨酸,可能增强酶的活性。I179邻近催化活性位点,空间位阻和该位点氨基酸的疏水性都会影响酶的催化活性。因而,将该位点异亮氨酸突变为苯丙氨酸可以增加酶对底物的亲和力。此外,异亮氨酸突变为缬氨酸不会降低蛋白质的疏水性,但会降低底物结合位点的空间位阻。由于A211位于产物释放通道,疏水性太强或氨基酸的空间位阻太大都将导致降解产物难以释放。因此,将该位点精氨酸突变为空间位阻更小的亲水性氨基酸脯氨酸以促进底物的释放。S178位于底物结合位点中心,增加氨基酸的疏水性可以增加酶与底物的亲和力,因此将该位点的丝氨酸突变成更疏水的苯丙氨酸以增加该位点的疏水性。
《3.2.用无细胞蛋白质表达体系筛选PETase及其突变体》
3.2.用无细胞蛋白质表达体系筛选PETase及其突变体
PETase在无细胞系统中表达(Appendix A中的Fig.S2),融合在PETase末端的CFP的荧光强度如图2(a)所示。蛋白质的CFP荧光强度分布于1400~12000,其中,L88F、I179V和I179F的荧光强度最低,相对荧光强度小于2000。S178T和S209V的表达水平相对较高,其相对荧光强度达到10000。
将PET膜加入无细胞蛋白质表达体系中,并在30℃下反应48h。稀释后,测量240nm处的吸光度。通过TPA浓度与OD240关系的标准曲线确定TPA的浓度。如图2(b)所示,在突变体中,突变体I179F具有最强的酶活性,相比野生型PET酶的活性提高了1.5倍,TPA的释放浓度达到了6.38mmol·L–1。与野生型PETase相比,L88F释放量为野生型PETase的2.1倍,达到了5.38mmol·L–1。R61A突变体的活性是野生型的1.6倍。相反,S178T和S209V突变体的活性分别降低至野生型PET酶活性的29.7%和38.2%。剩余的突变体的酶活没有发生显著的变化。
《图2》
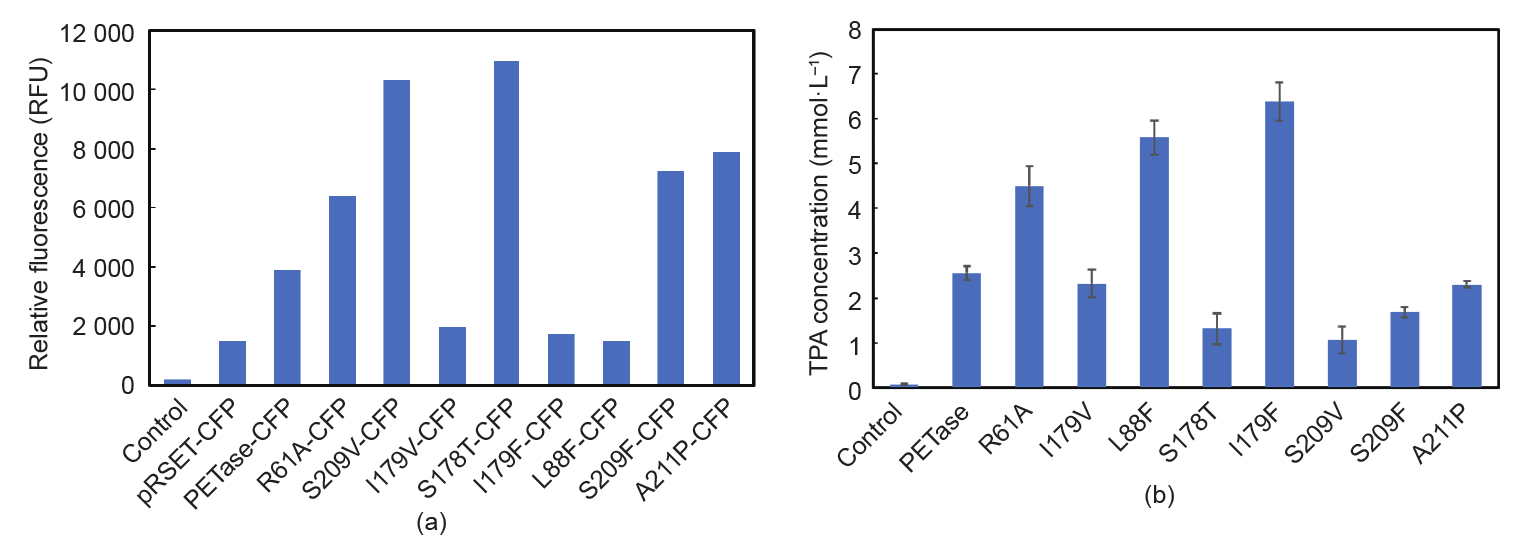
图2.使用无细胞蛋白质合成筛选PETase变体。(a)在无细胞蛋白质合成中表达12h后CFP的相对荧光强度;(b)在相同的蛋白质浓度下,PETase及其变体在30℃下与PET反应48h后的TPA浓度。
《3.3.验证PETase及其突变体降解PET膜的活性》
3.3.验证PETase及其突变体降解PET膜的活性
为了进一步验证突变体R61A、L88F和I179F降解PET的能力,从大肠杆菌中纯化出这三种突变体,并利用纯化后的酶与PET膜反应,通过分析PET膜的重量变化来表征酶的活性。PETase及其变体在30℃下降解48h后PET膜的降解速率如图3所示。突变体L179F显示出最强的催化活性,PET薄膜的失重率达到22.5mg·(μmol·L–1)–1·d–1。与野生型PETase相比,L88F和R61A突变体的催化活性也得到了提高:野生型PETase的降解率为8.2mg·(μmol·L–1)–1·d–1,而L88F和R61A的降解率分别为17.5mg·(μmol·L–1)–1·d–1和13.5mg·(μmol·L–1)–1·d–1。
《图3》
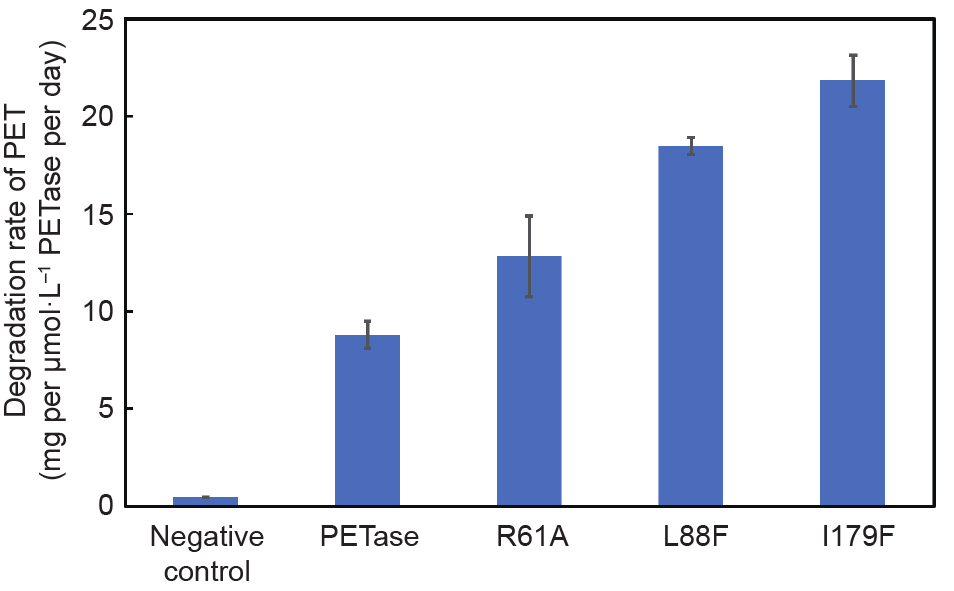
图3.PETase及其变体的PET薄膜的重量损失率。误差线基于三次测定的标准偏差。
为了进一步验证酶和底物相互作用,将野生型PETase与三个突变体蛋白质进行了完整的体外酶活的动力学研究。用可溶性底物乙酸对硝基苯酯(PNPA)来表征和比较每种变体与野生型PET酶之间的米氏常数之间的差异(Appendix A中的Fig.S1、表1)。在最初筛选出的酶活增加的三种突变体中,L88F和R61A的KM值与野生型PETase相似,分别为3.8mmol·L–1和4.5mmol·L–1。然而,突变体I179F的PETase的KM下降到1.2mmol·L–1。
《表1》
表1 野生型PETase和突变体的米氏常数

用于催化PNPA水解的野生型PETase的kcat值仅为27s–1。选自初筛的所有突变体的kcat值均高于野生型PET酶,其中,I179F的kcat值增加近4倍,从27s–1增加到107.7s–1。同时,I179F的kcat/KM增加到89.8,比野生型酶提高了15倍。虽然与野生型PETase相比,L88F和R61A在KM值上的变化不太显著,但这两种突变体的kcat值比野生型PET酶高约50%。
由于I179F在酶活性方面显示出非常显著的优势,本研究使用扫描电子显微镜(SEM)观察PET膜表面形态的变化(图4)。当I179F在30℃下与PET膜反应48h后,与阴性对照物反应的表面相比,PET膜的形态变化显著,表面明显粗糙和腐蚀,观察到大量的孔洞,并伴有大量的脱落。
《图4》

图4.扫描电镜观察I179F在30℃下降解48h后PET表面形态学变化(放大倍数2500×)。(a)对照;(b)I179F降解后样品。
《4.讨论》
4.讨论
通过无细胞蛋白质合成,本研究成功筛选了三种具有增加的酶活性的变体R61、L88和I179。通过三种突变体PETase与2PET分子的对接,增加了对酶活性机制的理解(图5)。
《图5》
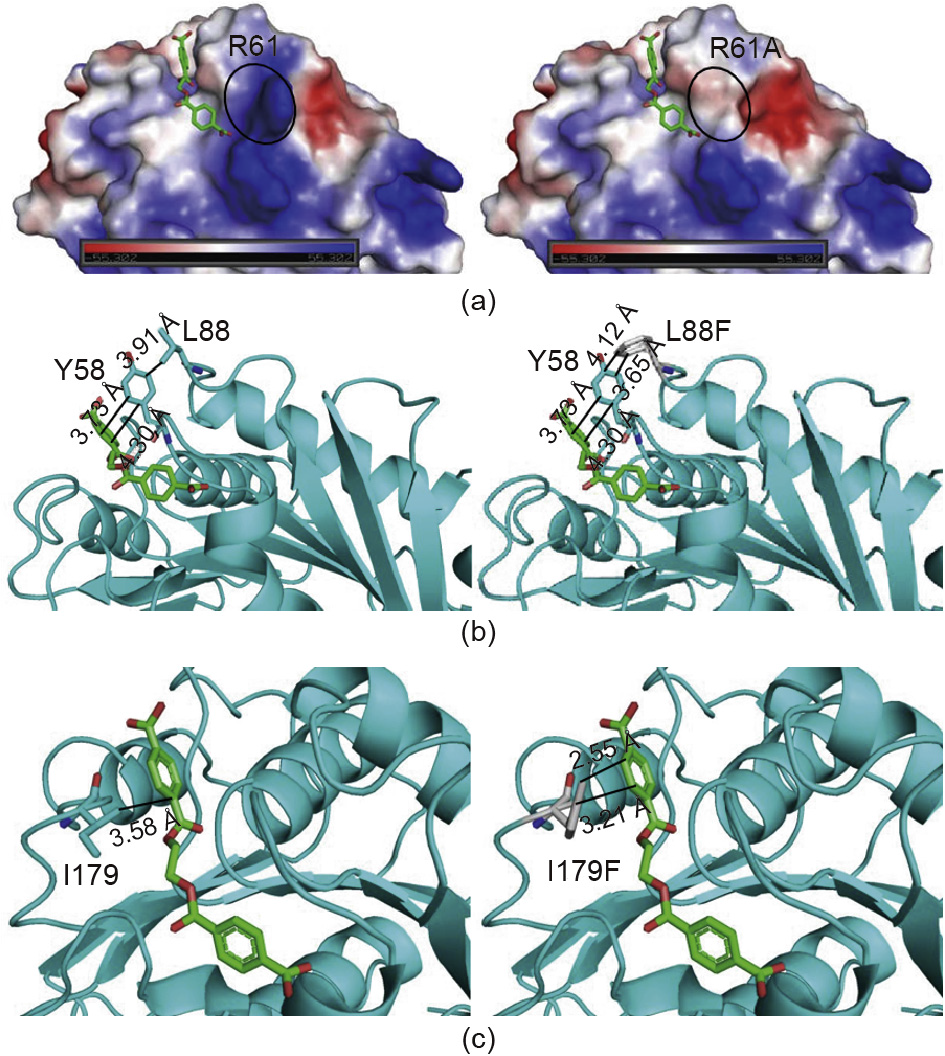
图5.不同突变体PETase的比较和分析。(a)野生型R61和突变型R61A的静电表面电位分析(红色、蓝色和白色分别代表负值、正值和中性值);(b)与对接的2PET结合的复合体中的野生型L88和突变体L88F的结构;(c)与对接的2PET结合的复合体中的野生型I179和突变体I179F的结构。红色和绿色的棍棒形表示2PET。
R61位于底物结合沟壑的末端,突变体R61A改变了底物结合沟壑周围的表面电荷,使其更加疏水,使底物更容易在底物结合沟壑附近聚集[图5(a)],从而导致R61A的kcat比野生型PETase的kcat高1.7倍(表1)。一方面,突变体R61A消除了底物释放通道的空间位阻;另一方面,由于R61本身不与底物相互作用,突变不会改变酶与底物的相互作用,因此R61A的KM值也没有发生显著的变化(表1)。
L88F可以稳定Y58的状态,在PETase的底物结合沟中起重要作用[28]。由于L88F与Y58之间的相互作用力增强,使得Y58和底物之间的相互作用增强[图5(b)]。因此,L88F的KM值低于PETase。同时,突变体L88F增强了酶与底物之间的相互作用,因此该酶的催化PET降解率达到17.5mg·(μmol·L–1)–1·d–1,是野生型的2.1倍(图3)。
通过对PETase和2PET之间相互作用模型的分析,发现底物结合沟壑中的I179与2PET之间由于疏水性存在直接的相互作用(图1)。这种相互作用归因于酶和底物分子之间的结合[图5(c)]。已有研究表明,当I179突变为丙氨酸时,疏水性的降低使酶和底物分子的相互作用减弱,导致酶活性几乎丧失[28]。在本研究中,将I179突变为具有较大支链且疏水性更强的苯丙氨酸,可增加酶活性。这种突变体的氨基酸残基可以固定PET分子中的苯环。这种氨基酸的功能可能与PETase结构研究中报道的两种固有的底物苯环结合残基(W156/W130)相似[28,35]。突变体I179F对底物具有很强的定位作用,因而显著提高了催化效率。根据体外酶反应测定结果,与野生型PET酶相比,I179F突变体的KM值降低了3.8倍,kcat/KM值增加了15.6倍(表1)。为了进一步提高PETase的催化效率,我们下一步将侧重研究多点突变和饱和突变。
《致谢》
致谢
本工作由国家重点基础研究发展计划(2014CB745100)、国家自然科学基金(21676190、21621004)、天津市科技计划项目(创新平台与人才专项)(16PTGCCX00140、16PTSYJC00050)支持。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Yuan Ma, Mingdong Yao, Bingzhi Li, Mingzhu Ding, Bo He, Si Chen, Xiao Zhou, and Yingjin Yuan declare that they have no conflict of interest or financial conflicts to disclose.
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2018.09.007.














 京公网安备 11010502051620号
京公网安备 11010502051620号




