《1. 引言》
1. 引言
由于器官移植需求的快速增长和器官供体供应不足,器官短缺成为一场全球性的危机[1,2]。在美国,器官移植等候名单上每年只有不到三分之一的患者能够接受器官移植[3];而在中国,数百万到数千万终末期器官衰竭患者中,每年只有不到百分之一可以接受器官移植[4]。组织工程由Langer和Vacanti [5]首次提出,并已成功应用于研究和临床领域,如构建人工膀胱[6]。尽管组织工程已经取得了许多进展,但功能化的人造组织器官的构建仍需更复杂的空间结构、更好的细胞间相互作用和血管化,这是传统组织工程方法无法实现的。
在过去的几十年中,动物模型和二维细胞培养验证方法已被广泛用于疾病研究和药物开发[7]。然而,动物模型很难准确地反映人类疾病的真实情况,并可能导致伦理问题,而二维培养方法则不能再现细胞微环境和器官水平的生理学特性[7]。因此,更精确的三维体外模型的构建成为一种新思路,并由此产生了器官芯片的概念[8]。
生物三维打印技术已经显示出解决上述问题的能力。该技术已被应用于制造实体组织[9–12]、中空组织[13–16]和器官芯片[17–20],如图1所示[12,14,20,21]。通过生物三维打印,细胞、生物材料和生物活性分子以逐层的方式被定位在精确的空间位置[22]。采用该技术,可以设计具有特定几何形状和异质性的三维组织,以模仿其相应人体组织的结构和功能[23]。
《图1》

图1. 生物三维打印的应用领域。(a)生物三维打印机(由Christopher Barnatt提供,©2011);(b)三维打印实体组织;(c)三维打印中空组织; (d)三维打印器官芯片[(b)经Springer Nature许可转载自Ref. [12],© 2016;(d)经Springer Nature许可转载自Ref. [20], © 2016]。
本文综述了生物三维打印的应用。首先,我们概述了最常见的生物三维打印方法和“生物墨水”;其次,我们概括了生物三维打印技术在构建实体组织和中空组织以及开发器官芯片中的应用;最后,我们总结了本领域的重大挑战,并展望了生物三维打印技术未来应用的前景。
《2. 生物三维打印方法及生物墨水》
2. 生物三维打印方法及生物墨水
《2.1. 生物三维打印方法》
2.1. 生物三维打印方法
喷墨打印[24,25]、挤出打印[10,12]和基于光的打印[16,26]是三种最常用的生物三维打印方法[21],如图2所示[21,27–29]。表1比较了三种方法的优缺点,并列出了这些方法的应用领域[10,12,16,18,24–26,30–33]。
《图2》

图2. 生物三维打印方法。(a)喷墨打印,由热作动器或压电作动器驱动产生液滴;(b)、(c)挤出打印,(b)用于沉积热熔性聚合物的熔融沉积成型(FDM), (c)用于打印与细胞相容的水凝胶的墨水直写(DIW); (d)~(f)基于光的打印, (d)激光辅助打印(LAP), (e)立体光刻(SLA), (f)双光子聚合(2PP)[(a)~(c)经American Chemical Society许可转载自Ref. [27], © 2016;(d)经Springer Nature许可转载自Ref. [21], © 2014;(e)经John Wiley and Sons许可转载自Ref. [28], © 2013;(f)经Springer Nature许可转载自Ref. [29], © 2013]。
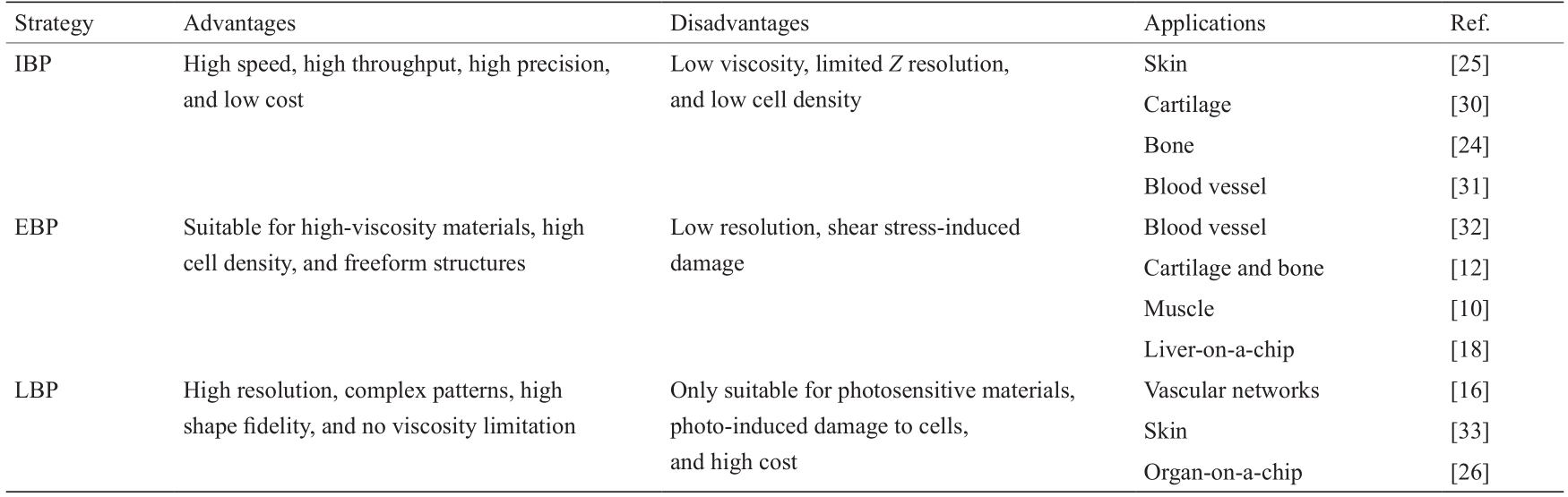
《表1》
表1 三种生物三维打印方法的比较
2.1.1. 喷墨打印
喷墨打印,也称为按需喷墨打印[34],是通过将热[35]或声[34]产生的力施加到喷嘴,从而将液滴喷射到电控平台上[图2(a)]。第一批喷墨生物打印机是由商用惠普喷墨打印机改造而成的[36,37]。喷墨打印的一个缺点是生物墨水必须是液相,之后固化形成特定结构[21]。因此,该方法只能打印低黏度(3.5~12 mPa·s)和低细胞密度的生物墨水[21]。由于在喷射液滴之后的延迟固化,喷墨打印在竖直方向(Z轴)上的分辨率受到限制。然而,喷墨打印因其高印刷速度、高通量、高精度和相对低的成本而被广泛用于制造皮肤[25]、软骨[30]、骨[38,39]和血管[31,40]。
2.1.2. 挤出打印
挤出打印构建组织的原材料是膏状而非液滴。与喷墨打印相比,挤出打印更适用于具有较高黏度[41]和较高细胞密度(>108 个细胞·mL–1 )的生物墨水[21]。因此,挤出打印有助于构建具有与天然组织相当的细胞密度的工程化组织。挤出打印包括熔融沉积成型和墨水直写两种,分别用于热熔性聚合物和水凝胶打印[42]。
熔融沉积成型[图2(b)],首先将聚合物熔化,然后将熔化后的聚合物挤出以形成特定的几何形状。常用的热熔性聚合物有聚己内酯(PCL)[12]、聚氨酯(PU)[43]和聚乳酸(PLA)。墨水直写[图2(c)]可以沉积含细胞或不含细胞的水凝胶。研究人员通过设计同轴喷嘴[32]和多通道系统[12,43,44]扩展了挤出打印的能力。同轴喷嘴已广泛应用于构建微通道[45]和血管网络[32]。多通道打印系统能够制造具有结构和功能复杂的人造组织和装置,如软骨和骨[12,46,47]、肌肉组织[10,43]和肝脏毒性评估装置[18]。挤出打印技术面临的主要挑战是提高分辨率和减少剪切应力引起的损伤[48]。
2.1.3. 基于光的打印
基于光的打印包括激光辅助打印和立体光刻,其特点是相对较高的打印速度[49]和分辨率[50],并且对材料黏度没有限制[21]。基于激光诱导向前转移技术的打印已被用于制造类皮肤结构[51] [图2(d)]。Koch等[52]进行了参数化研究,以获得最佳的激光波长和脉冲持续时间。立体光刻是利用光(主要是紫外线)逐层将水凝胶光聚合[41]。可光交联的水凝胶被选择性地固化以产生特定的图案和几何形状,而该图案由数字微镜阵列装置决定[53]。因此,立体光刻也称为数字光处理[DLP,图2(e)]。它有助于更灵活地构建具有复杂形貌的结构[26,50,53]。研究人员已经采用该方法研发了跨尺度(50~250 µm)的血管网络[16]和异质性肝模型[26]。双光子聚合具有制造具有亚微米分辨率的三维结构的能力[29,54] [图2(f)]。该技术已被用于在微流体装置中开发精细的三维结构并复制亚微米仿生微环境[55,56]。但是,由于其分辨率极高,制造速度因而受到限制,因此难以构建大块组织类似物。
最近,生物三维打印技术的发展聚焦在多通道打印机的研发上。Kang和同事[12]开发了一种带有四个“墨盒”模块的集成式组织器官打印机,并通过制造下颌骨和颅骨、软骨和骨骼肌验证了其能力。Lind和同事[20]利用多通道生物三维打印机,能够用四个可单独控制的喷嘴打印六种功能化生物墨水。按照程序设置的顺序依次或同时打印细胞、细胞相容性水凝胶、高强度聚合物和可溶性因子,显著提高生物三维打印的效率并加快具有结构复杂的异质性组织器官的构建。此外,与其他制造技术(如静电纺丝)的结合,也可加快构建包含多种生物材料、跨尺度和复合功能的组织器官的进程。
《2.2. 生物墨水》
2.2. 生物墨水
生物墨水是指用以制备组织器官的原材料,它包括可打印的生物材料、细胞和其他生物制剂。生物材料为细胞黏附、迁移、增殖和分化等活动提供微环境和结构支持。理想的生物材料应具有针对特定组织的可加工性、细胞相容性、降解特性和机械性能,并且成本较低[21]。细胞在打印支架的过程中被包含在生物材料中[57],或者以细胞团和“组织丝”的形式直接用于“无支架”打印[15,46]。在“无支架”打印过程中,细胞经自组装后在仿生的细胞外基质中形成功能化的组织。表2总结了生物三维打印中常用的生物墨水[10–12,15,16,19,20,26,43,58–70]。
《表2》
表2 用于生物三维打印的生物墨水
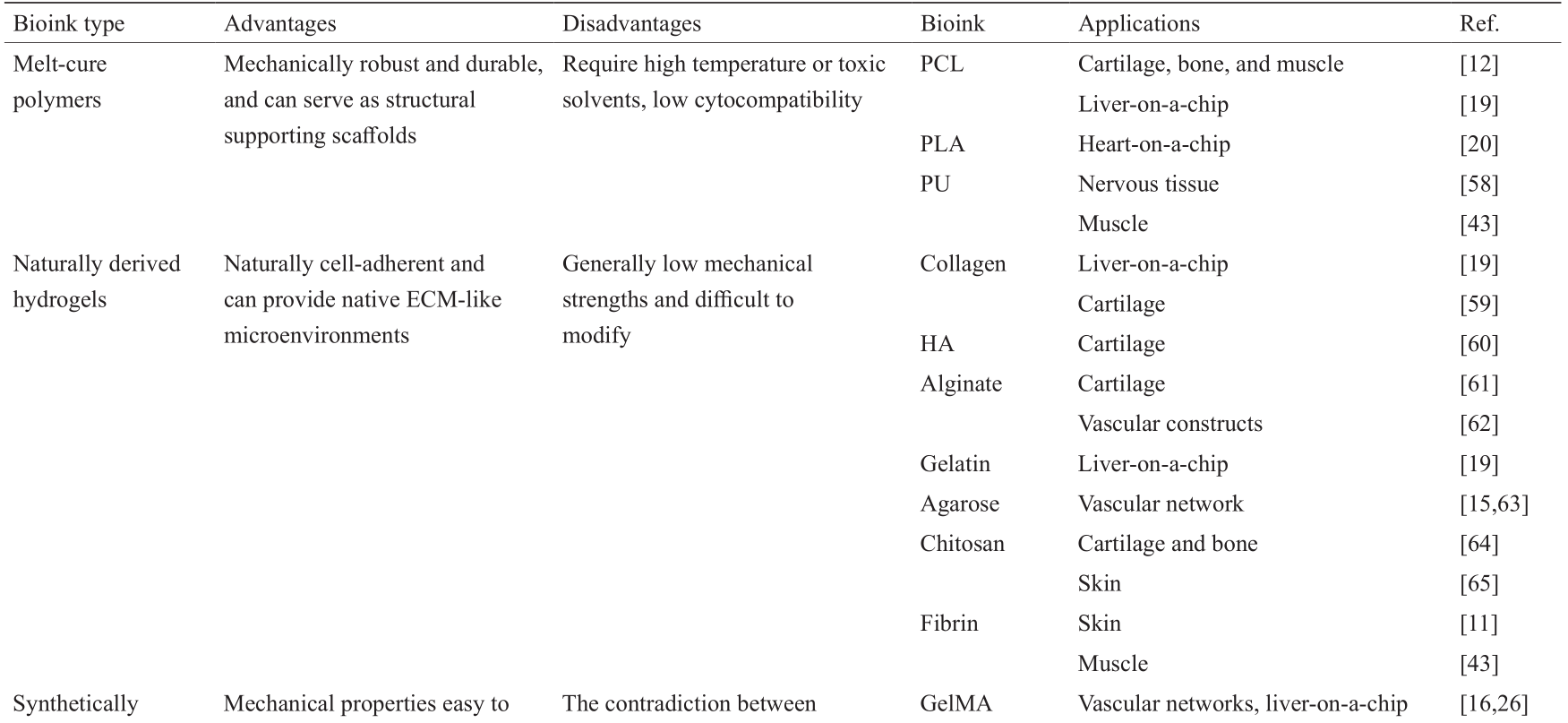
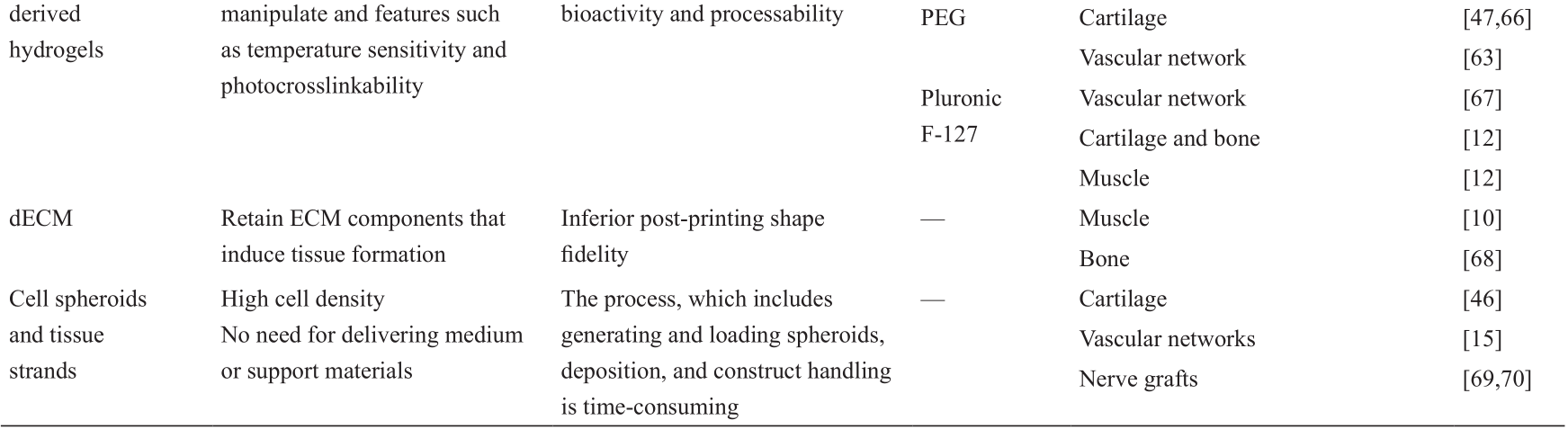
HA: hyaluronic acid; GelMA: methacrylated gelatin; PEG: polyethene glycol.
2.2.1. 生物材料
生物三维打印常用的材料分为三种类型,即热熔性聚合物、水凝胶和脱细胞细胞外基质[42],如图3所示[10,12,15,16,20,43,45,59,66–68,71,72]。此外还有结合多种材料的复合材料。
《图3》

图3. 用于生物三维打印的生物材料。(a)、(b)、(c)热熔性聚合物:(a)PCL作为含细胞水凝胶的支撑材料,用于下颌骨再生;(b)PLA制成的用于绝缘暴露的导线和培养基与其中的细胞;(c)PU支架提供微孔和空间,以便之后填充含细胞的生物墨水。(d)~(g)天然水凝胶:(d)高密度胶原用于软骨组织工程;(e)双交联HA的打印过程;(f)通过海藻酸钠与氯化钙溶液的同轴打印构建的血管结构;(g)为细胞团的融合与自组装从而形成血管结构提供空间的琼脂糖模具;(h)~(l)合成水凝胶:(h)包裹hiPSC来源的肝脏细胞及其支持细胞的GelMA水凝胶的荧光图片;(i)聚乙二醇(PEG)在构建用于耳再生的复杂水凝胶结构时作为牺牲材料; (j)、 (k)去除液化的Pluronic F-127以形成灌流的通道。(l)、 (m)dECM: (l)脱细胞骨骼肌生物墨水的凝胶化;(m)一种混合了脱细胞骨细胞外基质和PCL的生物墨水用于骨再生。(n)复合材料,例如,在海藻酸钠水凝胶中添加PLA纳米纤维(NF)以促进细胞增殖及人间充质干细胞(hMSC)的软骨形成分化。DI:去离子的[(a)经American Chemical Society 许可转载自Ref. [12], © 2016;(b)经Springer Nature许可转载自Ref. [20], © 2016;(c)经IOP Publishing许可转载自Ref. [43], © 2015;(d)经American Chemical Society许可转载自Ref. [59], © 2016;(e)经American Chemical Society许可转载自Ref. [71], © 2016;(f)经Elsevier许可转载自Ref. [45], © 2015; (g)经Elsevier许可转载自Ref. [15], © 2009; (h)经Elsevier许可转载自Ref. [16], © 2017; (i)经IOP Publishing许可转载自Ref. [66],© 2009;(j),(k)经John Wiley and Sons许可转载自Ref. [67], © 2014;(l)经John Wiley and Sons许可转载自Ref. [10], © 2016;(m)经American Chemical Society许可转载自Ref. [68], © 2016;(n)经American Chemical Society许可转载自Ref. [72], © 2016]。
热熔性聚合物通常机械性能强,可用作组织工程中的结构支撑,如PCL、PU和PLA。PCL是一种理想的支撑材料,因为与其他热熔性材料[19]相比,它熔点较低(60 °C),有利于降低由温度造成的细胞损伤。基于此特性,Lee和Cho[19]研发了一种使用PCL作为外壳材料的一体化制造肝脏芯片的方法。Kang等[12]采用集成式组织器官打印机打印PCL,在耳软骨重建和下颌骨再生中提供支撑支架,如图3(a)所示。在另一项研究中,PCL支柱用于稳定三维打印的肌肉组织,并在诱导骨骼肌细胞排列中发挥重要作用[12]。
类似的,在心脏芯片的制造中,PLA被用于打印遮罩,使暴露的导线及含有细胞和培养基的孔绝缘[图3(b)] [20]。
PU也是一种良好的生物材料。如图3(c)所示,Merceron等[43]在打印载有细胞的生物墨水之前打印PU,以便为载细胞的生物墨水提供结构支撑和空间。另外,Hsieh等[58]合成了一类可降解的热响应性水基PU分散体,并将神经干细胞载入该材料中。该分散体在约37 °C下凝胶化而不需交联剂。斑马鱼模型受损神经系统的功能在植入载有细胞的PU结构体后得以恢复,表明该生物材料在生物三维打印神经组织中的潜力。然而,热熔性聚合物的打印需要高温或有毒溶剂,使得这类材料细胞相容性较差。另外,在打印过程中结合热熔性材料与细胞相容性较好的水凝胶也是一大挑战。
水凝胶是可以吸收和保留大量水分的聚合物[57]。水凝胶分为天然水凝胶和合成水凝胶两类。它们经物理交联[73]、化学交联[26,63]或酶促交联[11,43]形成凝胶状结构。
天然水凝胶可以为细胞活动提供类细胞外基质的微环境。生物三维打印中最常用的天然水凝胶是胶原、透明质酸(HA)、海藻酸钠、明胶、琼脂糖、壳聚糖和纤维蛋白等。胶原可用于构建肝脏芯片以包裹细胞[19]和打印各种浓度的异质性软骨[59] [图3(d)]。此外,HA[60]和海藻酸钠[61]用于为软骨细胞提供环境。Ouyang和同事[71]对HA进行了修饰并利用双交联来改善其长期稳定性,如图3(e)所示。由于其经济实惠和易于使用,海藻酸钠可用于打印血管结构[45] [图3(f)]并与RGD结合以提供干细胞打印的温和条件[74]。明胶在低温下保持凝胶状态,但随着温度的升高(37 °C)很容易液化。该特性使得明胶可用于肝脏芯片的构建[19]。天然水凝胶也被用于构建具有分支结构的血管网络[图3(g)] [15]、皮肤[11]和肌肉[43]。虽然天然水凝胶已广泛应用于各种组织工程领域,但低机械强度仍是其主要限制因素。
与天然水凝胶相比,合成水凝胶更容易通过改性来提高机械强度和细胞黏附特性。甲基丙烯酸化明胶(GelMA)、聚乙二醇(PEG)和Pluronic F-127是较常见的合成水凝胶。在存在光引发剂的情况下,GelMA和PEG都可发生光致交联[57]。GelMA广泛用于基于光的打印和挤出打印[75]。例如,Zhu的研究团队[16]利用GelMA水凝胶构建具有不同宽度的复杂血管网络,并通过精确快速地定位三种类型的细胞来开发肝脏模型[图3(h)] [26]。PEG可以用作牺牲材料而不影响其去除后的细胞活力[66],如图3(i)所示。基于PEG的水凝胶,如聚乙二醇二丙烯酸酯(PEGDA)、聚乙二醇甲基丙烯酸酯(PEGMA)和聚乙二醇-四丙烯酸酯(PEGTA),可用于制备组织工程化软骨、骨[47,76]和血管网络[63]。Pluronic F-127是一种温敏材料,可在低温下液化。它已被用作软骨、骨和肌肉组织工程的牺牲材料[12],以及用于构建可灌注的内皮化血管通道[67] [图3(j)、(k)]。
基于水凝胶的生物三维打印的主要问题是生物活性和可加工性之间的矛盾。较高的浓度和交联密度通常意味着更好的可打印性和形状保真度[77]。然而,它们还导致更小的孔径和更低的细胞活力。因此,低浓度的水凝胶被用作载细胞的材料[63,78]用于生物打印。Yin等[77]开发了一种低浓度GelMA(5%)和明胶(8%)复合物的打印方法,获得了与高浓度GelMA(30%)相似的可加工性却具有更好的细胞相容性。这为打印同时具备良好可加工性和细胞相容性的水凝胶提供了一种思路。
脱细胞细胞外基质(dECM)解决了生物相容性问题,因为它保留了细胞外基质的组分[57]。Perniconi等[79]证明从小鼠提取的无细胞支架支持肌纤维的形成,这表明dECM可以在这个过程中提供合适的环境。Pati的研究团队[80]开发了脂肪、软骨和心脏组织来源的dECM生物墨水,并验证了这些组织特异性的dECM材料在生物三维打印中的可行性。他们使用骨来源的dECM[图3(l)]制备功能性骨骼肌组织,其提供了适宜肌肉形成的微环境[10]。此外,与PCL支架相比,dECM-PCL支架中人脂肪干细胞成骨基因的显著上调[图3(m)]表明dECM在骨再生中的有效性[68]。但是,较差的形状保真度问题亟待解决。此外,考虑到dECM的来源,当从实验室到临床环境进行转化时,dECM可能存在伦理问题。
复合材料结合了每种组分的优点,在机械强度、可打印性、生物相容性和凝胶化特性方面有所提升。例如,通过将各种纳米纤维引入水凝胶中,可以显著改善水凝胶的机械性能并且可以增强其细胞活性。Dolati等[13]报道,添加碳纳米管增强了由海藻酸钠制备的血管的强度。由纳米纤维素和海藻酸钠组成的生物墨水不仅表现出良好的形状保真度,而且还支持人鼻软骨细胞(hNC)的增殖和再分化,可用于耳廓软骨重建[61]。在PLA纳米纤维增强的生物墨水中,可以观察到更高水平的细胞增殖和代谢活性,如图3(n)所示,并且表现出软骨分化[72]。这些不同尺度的微环境因素被认为是通过纳米纤维的接触引导和调控水凝胶基质的渗透性来控制细胞的行为[81]。
材料的凝胶化过程可以通过混合各种生物材料来调节。将PEGDA和GelMA水凝胶与一种基于伊红-Y的光引发剂混合,可实现可见光光固化[82]。经过双交联的改性HA表现出比主客体组装或单独光聚合更好的长期稳定性[71]。基于海藻酸钠-GelMA的生物墨水也进行了双步凝胶化,用于可灌注血管和心脏芯片的生物三维打印[32,83]。另外,通过将纳米材料(如金纳米粒子或碳纳米管)引入生物墨水中,可开发出电导率可调控的电活性组织[84]。此外,打印后处理(包括结构重构和表面功能化)也被用以增强生物三维打印的能力并改善生物材料的功能[85]。
2.2.2. 细胞团和“组织丝”
组织和器官生理结构的形成需要适当的细胞间信号传导和自组织[21]。细胞团和“组织丝”(图4)作为生物墨水,使得模仿天然组织和器官的发育过程成为可能。Jakab等[86]通过实验和模拟研究验证了使用球形细胞团作为生物墨水的可行性。细胞团随时间的演变如图4(a)所示,在长期孵育后可以观察到细胞团的融合。图4(b)显示了由Norotte和同事[15]通过将细胞团沉积到琼脂糖棒模具上而构建的结构。该结构可构建单层和双层血管。在最近的一项研究中,Yu等[46]通过将细胞显微注射到海藻酸钠胶囊中产生“组织丝”[图4(c)、(d)]。在细胞聚集后,无支架组织丝可以直接打印在“生物纸”上,而不需要介质或支撑结构。
《图4》

图4. 细胞团和“组织丝”。(a)、(b)细胞团:(a)细胞团形貌随时间的变化[86];(b)细胞团融合成中空的分支结构。(c)、(d)组织丝:(c)一根8 cm长的组织丝;(d)细胞团在海藻酸钠“胶囊”的支持下聚合[(b)经Elsevier许可转载自Ref. [15], © 2009;(c),(d)经Springer Nature许可转载自Ref. [46], © 2016]。
由于细胞团或“组织丝”是通过直接组装细胞而形成的,所以这两种材料中的细胞密度很大。在构建心肌组织和血管等人工组织时,高细胞密度至关重要[15]。因此这些生物墨水可能在开发具有致密血管网络的长寿命的功能化组织中起重要作用。
2.2.3. 细胞来源
目前用于生物三维打印的细胞来源是各种类型的原代细胞或干细胞。通过沉积多种类型的原代细胞,打印的结构可以模拟其体内对应组织的功能。然而,原代细胞的寿命限制了移植后的组织发挥长期功能[21]。因此,干细胞是一种很有前景的选择[21]。它具有更长的寿命,且具有自我更新能力和多能性。
胚胎干细胞(ESC)和诱导多能干细胞(iPSC)具有分化成任何细胞类型的能力,并具有长期增殖的潜力[87]。干细胞的分化主要受生物、化学和物理因素的影响[88]。尽管研究人员已经通过沉积特定空间梯度的生长因子来调节细胞微环境[89],但是需要进一步研究干细胞分化的机制。除了为干细胞设计合适的微环境外,还需要在打印过程中提供合适的物理条件(如剪切应力),同时保持高活性和干细胞的多能性。例如,Ouyang等[90]系统地研究了生物三维打印参数对干细胞活性、增殖和多能性维持的影响。通过参数优化,他们成功地设计了具有90%成活率的含ESC的结构,并且ESC在打印后保持未分化状态。打印ESC和iPSC的一个挑战是致瘤性的风险[91];还应考虑伦理问题[88]。成体干细胞(ASC)是能够自我更新的未分化干细胞,它可以来源于骨髓、脂肪组织和肝脏等[92]。源自骨髓[93]和脂肪组织[94]的间充质干细胞(MSC)已被用于生物打印人工组织和器官[76,95]。MSC因致瘤性较低[91]而比ESC和iPSC更安全。
尽管干细胞打印仍处于起步阶段,但生物三维打印技术和干细胞技术的结合已经为组织工程带来了新的希望。它们的结合也可为开发个性化疾病模型和药物测试平台提供新方法。
《3. 实体组织》
3. 实体组织
实体组织是指不具有中空结构的组织。研究者已经打印了软骨[24,59,96,97]、骨[38,39,68,98]、皮肤[11,99]和肌肉[10,20,43]等工程化组织。
《3.1. 软骨和骨》
3.1. 软骨和骨
软骨和骨是人体内机械强度最高的组织。近期,软骨和骨的研究主要集中在改善机械性能和实现个性化的几何形状[100]。此外,骨软骨界面以及打印的结构与天然组织之间的界面在修复骨软骨缺损中起着至关重要的作用[101]。
软骨是弹性连接组织,是构成耳朵、鼻子和关节的主要部分[图5(a)~(c)]。关节软骨具有从关节表面到钙化软骨的复杂分层结构[图5(a)] [102]。这些层涉及不同的骨软骨损伤:部分软骨损伤、全层软骨损伤和骨软骨联合损伤[103]。喷墨打印可通过UV光聚合而进行直接软骨修复[24,30] [图5(b)]。将静电纺丝系统与喷墨打印系统整合[图5(c)]可产生机械强度更高的组织[96]。三维打印的软骨组织的发育受到生物墨水特性的显著影响。据报道,海藻酸钠和琼脂糖水凝胶支持透明软骨的发育,而GelMA和基于PEGMA的水凝胶支持纤维软骨的发育[47]。将纳米纤维素[61,97,104]和PLA纳米纤维[72]与载有细胞的海藻酸钠水凝胶结合,可提高细胞密度并增强机械强度。由于其机械稳定性和维持细胞生长的能力,高密度的胶原被认为是制造用于承重的人造软骨的优选材料[59]。
《图5》

图5. 软骨和骨的三维打印。(a)~ (c)三维打印软骨: (a)软骨的层状结构; (b)用丙烯酸酯化的PEG水凝胶喷墨打印软骨植入物,可同步进行光交联;(c)喷墨打印和静电纺丝符合打印方法。(d)~(f)三维打印骨:(d)三维打印的骨组织的机械强度与人体松质骨接近;(e)培养在DCB-PCL中的人脂肪干细胞(hASC)表现出明显的成骨基因上调和成骨分化; (f)通过在粉末状材料上喷射黏结剂构建骨结构; (g)、 (h)骨软骨界面的构建:(g)不同程度的骨软骨缺损,包括部分软骨缺损、全层软骨损伤和骨软骨联合损伤[103]; (h)修复骨软骨缺损的模块化组织组装策略[107] [(a)经Springer Nature许可转载自Ref. [102], © 2014;(b)经John Wiley and Sons许可转载自Ref. [24], © 2015;(c)经IOP Publishing许可转载自Ref. [96],© 2016;(d)经IOP Publishing许可转载自Ref. [98], © 2009;(e)经American Chemical Society许可转载自Ref. [68], © 2016;(f)经Elsevier许可转载自Ref. [39], © 2016;(g)经Mary Ann Liebert, Inc.许可转载自Ref. [103], © 2014;(h)经Springer Nature许可转载自Ref. [107], © 2016]。
生物三维打印用于骨的修复和再生可以通过挤出打印和喷墨打印实现[图5(d)~(f)]。Sawkins和同事[98]打印了基于PLGA的结构,其屈服应力和杨氏模量与人类松质骨性质相仿[图5(d)]。除了高机械强度之外,血管生成和骨生成在功能性骨植入物的制造中是至关重要的。使用脱细胞骨(DCB)基质和PCL作为生物墨水[图5(e)],人脂肪来源的干细胞显示出成骨基因的显著上调[68]。Lv和同事[105]将血管内皮生长因子(VEGF)的控制释放与生物三维打印结合以改善骨生成和血管生成。喷墨打印将黏合剂液滴沉积到粉末上[图5(f)],如羟基磷灰石和磷酸三钙,以制造类骨组织[38,39]。
构建骨软骨界面[图5(g)、(h)]是工程骨软骨植入物中最具挑战性的部分[106],特别是从关节面到软骨下骨的骨软骨联合损伤[图5(g)]。Schon和同事[107]提出了一种用于骨软骨病变修复的模块化装配策略[图5(h)]。生物三维打印能够将各种材料精确地沉积到多层梯度构造中,因此在该领域中有广阔的前景。丙烯酸酯化PEG水凝胶的UV光聚合显著增强了成骨和软骨形成的分化[24]。
总之,具有梯度结构和更强机械性能的骨软骨结构有待进一步研究[108]。梯度结构可能更好地与软骨和较硬的软骨下骨的宿主环境整合。合适的微环境有待研究,以改善细胞增殖和分化。此外,将生长因子及其控制释放纳入打印过程,也可能进一步提升工程化骨软骨的功能。
《3.2. 皮肤》
3.2. 皮肤
皮肤是人体最大的器官,在免疫系统中起着重要作用,是第一道防御屏障[109]。刮蹭、烧伤、糖尿病足溃疡和皮肤坏死是皮肤缺陷的主要成因,这需要大量的皮肤替代品进行治疗。由于大多数国家禁止在动物身上进行化妆品检测,因此化妆品行业也迫切需要功能化的人造皮肤[110]。
功能化皮肤模型的基础是具有真皮和表皮的双层结构。基于喷墨的三维自由形状制造(FF)起初将成纤维细胞和角质形成细胞同胶原一起打印,以在水凝胶支架中形成类真皮/表皮的明确分层结构[111] [图6(a)]。类似的,研究者构建了多层皮肤模型并在气液界面上进行培养[112]。与手动沉积模型相比,三维打印的皮肤组织表现出更好的形状保真度,并且表现出表皮和真皮的分层[图6(c)]。为了克服用胶原或海藻酸钠制造形状良好的三维支架的难题,Kim和同事[113]开发了一种低温打印系统,如图6(b)所示。他们将胶原溶液在–40 °C下逐层铺设,然后在–76 °C条件下冷冻干燥三天。孔隙率为98%的结构在共培养的角质形成细胞和成纤维细胞中表现出良好的性能。接着,他们设计了由胶原和海藻酸钠组成的混合核-壳支架,以改善这些皮肤支架的稳定性[114] [图6(d)]。体外和体内试验均表明这些混合支架的杨氏模量与纯胶原支架相比增加了约7倍,而生物相容性处于相似水平[图6(e)]。在另外一项研究中,羊水来源的干细胞(AFS)和骨髓来源的MSC被重悬在纤维蛋白-胶原凝胶中,并通过喷墨打印在裸鼠的伤口部位[25] [图6(f)]。与对照组相比,伤口的愈合率增加。Kim和同事[115]结合挤出打印和喷墨打印,利用功能化的Transwell系统一体化地制造人体皮肤模型,成本是传统培养方法的1/50,培养基用量是传统培养方法的1/10[图6(g)]。
《图6》
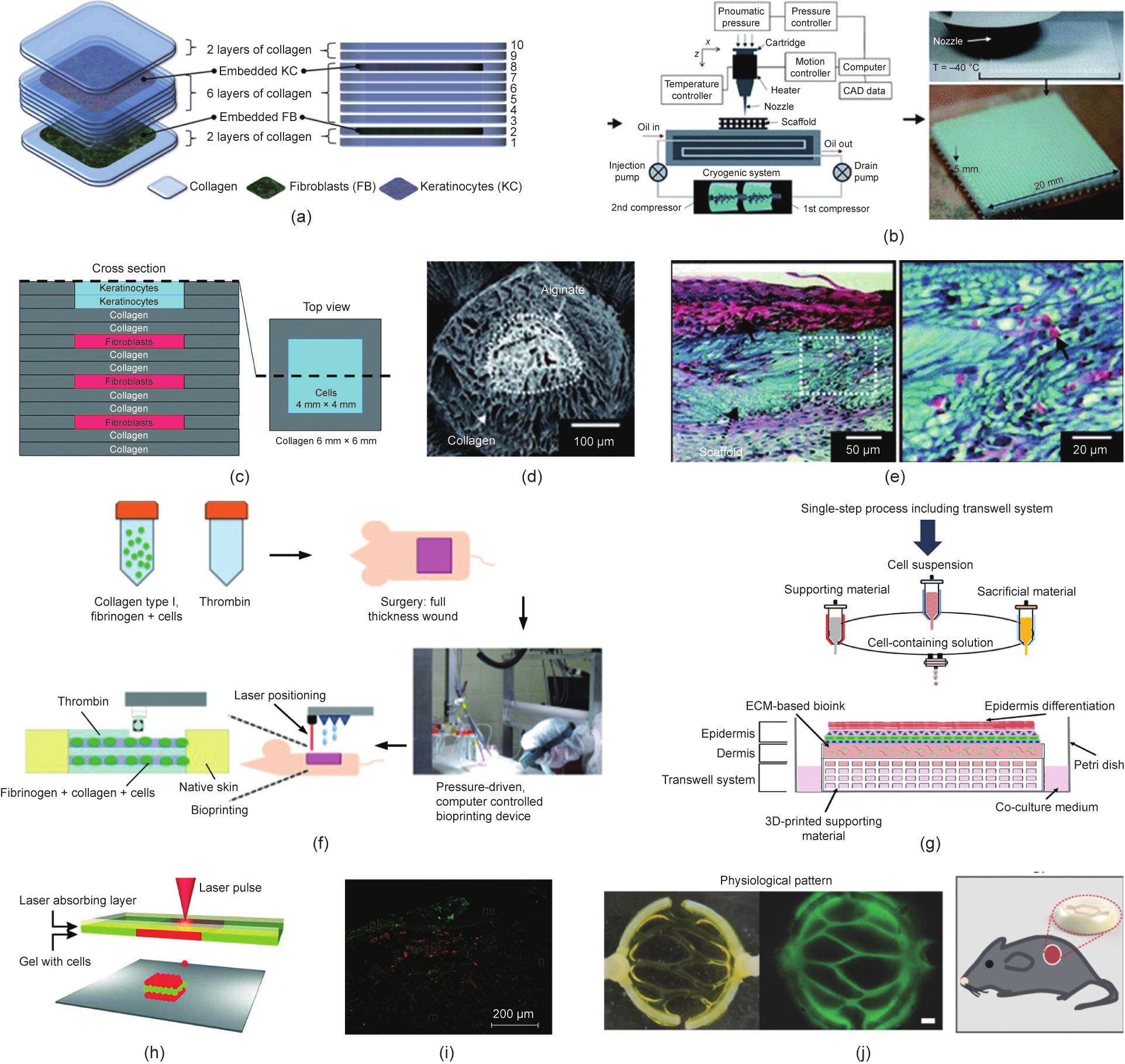
图6. 皮肤的三维打印。(a)~(e)挤出打印皮肤:(a)逐层打印多层皮肤细胞及胶原的示意图;(b)低温打印系统与三维支架制造的示意图;(c)三维皮肤组织的构建; (d)核-壳结构皮肤支架的扫描隧道显微(SEM)图片; (e)移植了皮肤支架区域的组织显微图片,箭头指出了生成的血管结构。(f)、(g)喷墨打印皮肤:(f)治愈过程示意图;(g)挤出-喷墨复合细胞打印策略示意图。(h)~(j)激光辅助打印皮肤:(h)激光辅助打印的示意图及多层结构的荧光图片; (i)组织工程皮肤结构植入裸鼠伤口; (j)皮肤结构制造过程及血管化模型的构建[ (a)经Elsevier许可转载自Ref. [111],© 2009;(b)经Royal Society of Chemistry许可转载自Ref. [113], © 1991;(c)经Mary Ann Liebert, Inc.许可转载自Ref. [112], © 2014;(d),(e)经Royal Society of Chemistry许可转载自Ref. [114], © 1991;(f)经John Wiley and Sons许可转载自Ref. [25], © 2012;(g)经IOP Publishing许可转载自Ref. [115], © 2009;(h)经John Wiley and Sons许可转载自Ref. [51], © 2012;(i)转载自Ref. [33];(j)经John Wiley and Sons许可转载自Ref. [99],© 2016]。
除了挤出打印和喷墨打印,激光辅助打印也可用于打印细胞水平分辨率的皮肤[51]。混在胶原凝胶中的NIH-3T3成纤维细胞和人角质形成细胞作为生物墨水打印在MatridermTM 薄片上。平行的层状结构显示了激光辅助打印制造微图案的能力[图6(h)]。裸鼠体内实验用于进一步评估人工组织的功能[图6(i)],在伤口区域发现新血管的形成[33]。
到目前为止,大多数皮肤打印研究都集中在表皮和真皮的几何结构上。然而,皮肤替代物的血管形成对临床应用也具有重要意义。iPSC技术与生物三维打印技术的结合可用于研究工程化人工皮肤的血管形成[99] [图6(j)]。微图案化的血管网络形成证明了在愈合期间促进和引导新血管形成的能力。内皮祖细胞和脂肪来源的干细胞被混入组织工程皮肤替代物中,被发现可加速体内新血管形成[116]。皮肤的血管化以及附属结构的引入有待进一步研究。近来,研究者在真皮-表皮截面精准打印黑素细胞,已构建色素沉积的皮肤组织[117,118]。这些结果意味着可以通过生物三维打印技术构建完全功能化的皮肤替代品。
《3.3. 肌肉》
3.3. 肌肉
人造肌肉因在肌肉疾病和损伤、药物研究等方面的潜在应用价值,吸引了众多研究者的兴趣,如图7所示[10,12,20,43,83,119]。
《图7》
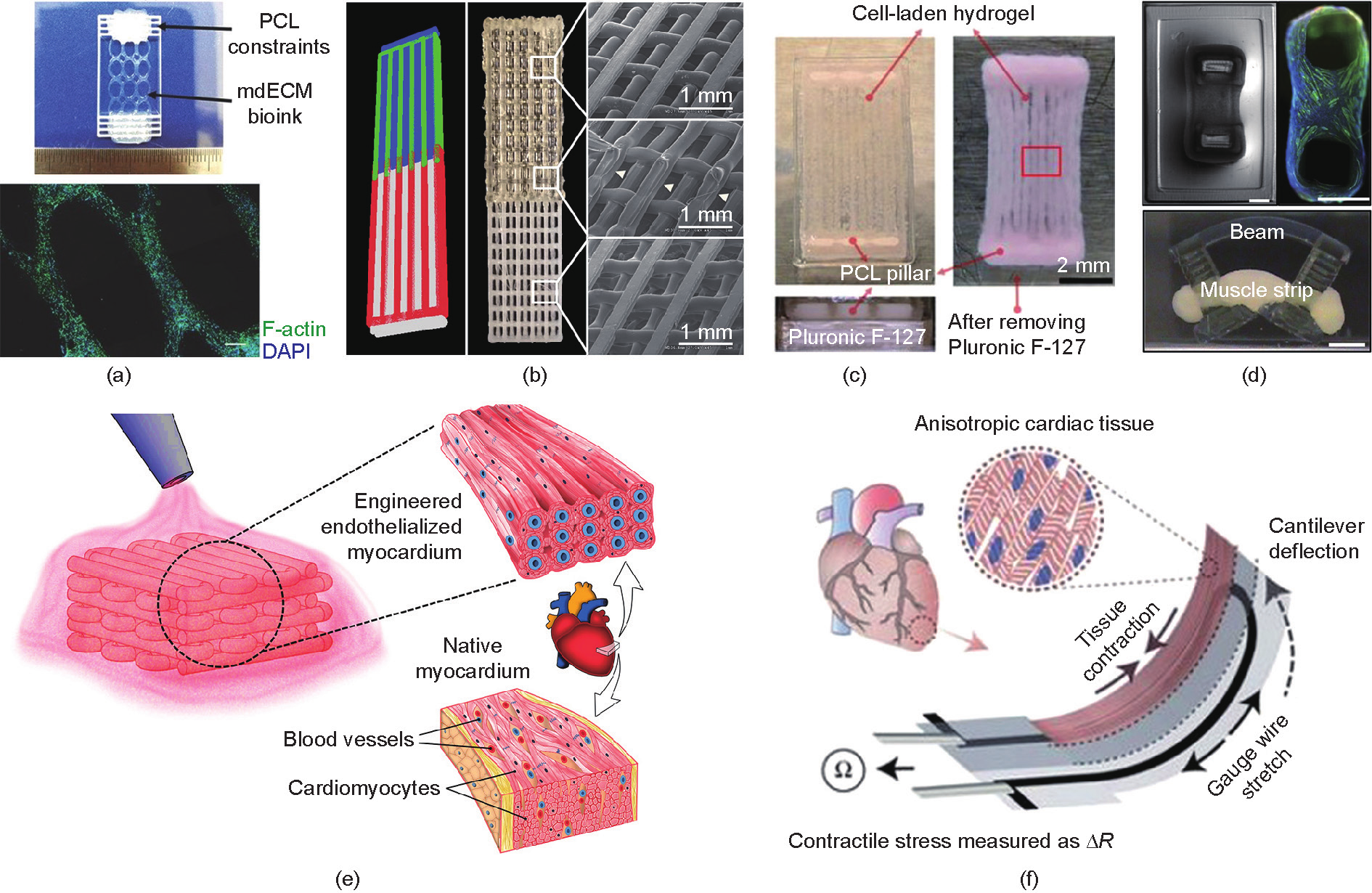
图7. 肌肉组织的三维打印。(a)~(d)三维打印骨骼肌:(a)dECM可提供肌肉生成和肌管形成的微环境和复杂的调控因子;(b)用一种集成化器官打印系统制备的分区域的肌肉-肌腱结构;(c)用PCL(作为支撑)、Pluronic F-127(作为牺牲材料)和搭载细胞的水凝胶构建的骨骼肌结构;(d)用工程化的肌肉束驱动细胞机器(bio-bot)[119]。(e)、(f)三维打印心肌:(e)在内皮化的水凝胶支架上种植心肌细胞,以构建心血管毒性评估平台;(f)集成了应变传感器的心肌微生理装置(心脏芯片)的原理[(a)经John Wiley and Sons许可转载自Ref. [10], ©2016; (b)经IOP Publishing许可转载自Ref. [43], © 2009; (c)经Springer Nature许可转载自Ref. [12], © 2016; (e)经Elsevier许可转载自Ref. [83], © 2016;(f)经Springer Nature许可转载自Ref. [20], ©2016]。
收缩性和肌肉形成是构建功能性肌肉的基础。Choi等[10]制备了基于脱细胞骨骼肌细胞外基质(mdECM)的新型生物墨水,为细胞增殖、肌管形成和成肌分化提供了适当的微环境[图7(a)]。Merceron和同事[43]打印了一个肌肉-肌腱单位,用弹性的PU-成肌细胞和坚硬的PCL-成纤维细胞分别模仿肌肉端和肌腱端[图7(b)]。该结构在打印后7天仍显示出较高的细胞成活率(>80%)。这些结果表明三维打印可以构建弹性模量和强度较好的肌肉组织。工程化肌肉组织的特性激发了对仿生细胞机器人和微马达的研究[120]。Cvetkovic和同事[119]研发了一种肌肉驱动的生物机器人[图7(d)],通过施加电刺激,触发肌细胞收缩以驱动装置的运动。
功能性肌肉组织可用于治疗肌肉损伤和开发用于毒性评估的器官芯片。Kang等[12]制造了一个骨骼肌结构[图7(c)],将其植入皮下并将腓总神经插入该结构。植入两周后获取该肌肉结构,观察到了有组织的肌纤维和神经支配能力。
心肌组织工程被认为是治疗心肌梗死的潜在方法[121]。研究者已经通过生物三维打印构建了可收缩和功能性的心脏补片[122,123]。Zhang和同事[83]通过将心肌细胞接种到内皮化水凝胶支架中来研究心脏组织的血管形成[图7(e)]。将类器官嵌入灌注微流体生物反应器中,使平台能够模拟心血管疾病并评估心血管毒性。Lind等[20]通过将柔性应变传感器与三维打印的层状心脏组织相结合,开发了一种心脏芯片[图7(f)]。他们研究了心肌组织对两种特定药物的反应,并研究了长期培养中心肌组织的收缩和发育状况。
《4. 中空组织》
4. 中空组织
相对于实体组织,中空组织的空间结构较为复杂。血管是中空组织三维打印中最主要的一个研究领域。血管的长度范围从微尺度血管(毛细血管)到毫米大小的血管(如动脉和静脉)[48]。不同尺度和结构复杂程度的血管系统需要不同的生物打印策略,主要有自组装、灌注法和挤出法,如图8所示。表3对比了这些方法的优缺点[13,15,31,35,45,62,67,69,124–129]。本节还讨论了其他具有中空结构的组织,如心脏瓣膜和神经导管。
《表3》
表3 血管构建方法的比较

《图8》
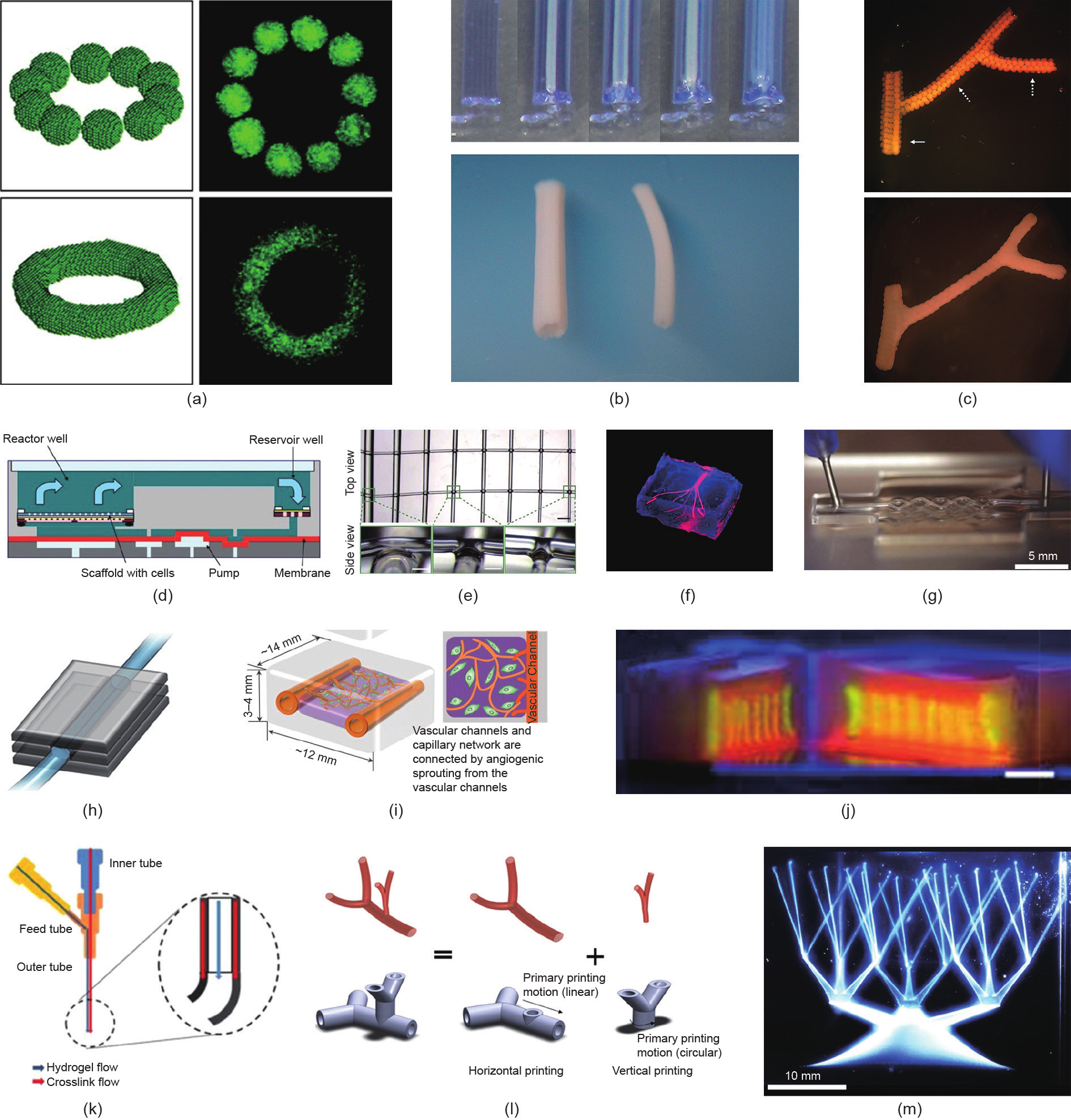
图8. 中空组织的三维打印。(a)~(c)自组装: (a)细胞团融合形成组织[86]; (b)无支架方法构建血管结构; (c)细胞团融合而形成的分支结构。(d)~(j)灌注法: (d)多孔的类肝脏结构,利于营养物质对流; (e)~(g)碳水化合物剥离、琼脂糖和Pluronic F-127作为牺牲材料,构建血管通道;(h)、(i)通过关注可溶性的因子促进血管新生;(j)1 cm厚的血管化组织[14]。(k)~(m)挤出法:(k)用于制备血管通道的同轴针头;(l)含细胞分叉结构的自由成形打印,氯化钙溶液既发挥交联剂的作用,又作为支撑材料;(m)在微颗粒状的凝胶介质中直写血管网络[(b),(c)经Elsevier许可转载自Ref. [15], © 2009;(d)经John Wiley and Sons许可转载自Ref. [126], © 2015;(e)经Springer Nature许可转载自Ref. [125], © 2012;(f)经Royal Society of Chemistry许可转载自Ref. [63], © 2014;(g)经John Wiley and Sons许可转载自Ref. [67], ©2014;(h)经Elsevier许可转载自Ref.[31], © 2014;(i)经Springer Nature许可转载自Ref. [40], © 2014;(k)经IOP Publishing许可转载自Ref. [13], © 1990;(l)经John Wiley and Sons许可转载自Ref. [62], © 2015;(m)转载自Ref. [128] ]。
《4.1. 自组装》
4.1. 自组装
自组装方法首先由Jakab等[86]提出,后用于组织和器官制造[图8(a)]。该过程使用细胞球作为无支架构建的单元。这些细胞球融合成特定的几何形状后逐渐形成功能组织[130]。
Norotte和同事[15]提出了一种无支架的方法来构建双层血管[图8(b)]。平滑肌细胞和成纤维细胞聚集成直径可控的细胞团或丝状单元。然后将细胞聚集体沉积到由琼脂糖棒构建的模具中,最后融合、组装、形成血管。复杂的分支结构是通过设计琼脂糖棒和细胞团的排列实现的[图8(c)]。由于这种方法使用细胞团作为生物墨水,因此与其他生物打印方法相比,该方法可实现最高的细胞密度。此外,Kucukgul等[131,124]将细胞聚集体的自组装与成像技术和计算算法相结合以模仿人体主动脉。与Norotte的方法不同,他们是在竖直方向上形成大直径主动脉(直径范围为4~10 mm)。
然而,由于细胞球尺寸的限制,通过自组装方法构建的血管壁通常太厚(300~500 µm)。对于营养物和氧气的扩散来说,需要100~200 µm的厚度[132]。此外,细胞球的制备时间通常耗时较长,这限制了血管网络的构建和更大组织器官的构建。
《4.2. 灌注法》
4.2. 灌注法
用于构建血管的灌注法包括两方面:一是载细胞的水凝胶支架的构建;二是生长因子、内皮细胞等的灌注。
Neiman和同事[126]开发了一种可灌注培养系统,包括含肝细胞的结构和表皮生长因子(EGF)的灌注,以维持白蛋白的产生[图8(d)]。然而,由于该系统的内部结构复杂,很难将它们内皮化以形成血管网络。此外,该结构不具有液体灌注的出入口,因此难以与天然血管网络整合。
研究者已经使用各种牺牲材料来制造血管网络[图8(e)~(g)]。Miller等[125]将碳水化合物玻璃制成网格状,并由琼脂糖、海藻酸钠、PEG等包裹以形成三维网络。在碳水化合物玻璃熔化后,将内皮细胞悬浮液注入类血管结构中。内皮细胞黏附在通道的内壁上,从而形成血管网络。Bertassoni和同事[63]采用琼脂糖制造微通道网络,并观察到单层的内皮组织。温敏材料(如Pluronic F-127)已被证明具有构建血管化异质组织的潜力[67]。Suntornnond等[133]开发了基于Pluronic-GelMA的结构,并使用Pluronic作为牺牲材料来制造中空四分叉血管状结构。该研究表明生物三维打印不但可以制造具有可灌注通道的块状结构,且可制造独立的三维血管网络。
除了细胞悬液的灌注外,研究者还研究了可溶性生物因子对血管生成过程的影响。通过在通道内灌注血管生成因子而不是灌注细胞悬液,研究者观察到内皮萌发和毛细血管网的形成[127,31,40],如图8(h)、(i)所示。这些研究表明了构建多尺度血管网络的可能性。
Kolesky和同事[14]构建了大块(厚度大于1 cm)的血管化组织,这为构建含血管网络的人体组织开辟了新的途径[图8(j)]。
《4.3. 挤出法》
4.3. 挤出法
挤出法的主要优势在于构建复杂几何结构和分支结构。使用同轴挤出方法[13,45,129]可制造直径为500~1000 µm的血管导管,将碳纳米管添加到水凝胶中[图8(k)]可进一步提高血管结构的机械强度[13]。
佛罗里达大学的研究者构建了当前三维结构最复杂的血管树状网络。他们采用的第一种方法是将载细胞的海藻酸钠水凝胶挤出到氯化钙溶液池中以形成具有水平和垂直分叉的结构[62] [图8(l)]。第二种方法是将载细胞的胶原挤出到颗粒状凝胶介质中,该介质在剪切应力作用下可以在流体和固体状态之间平滑过渡[128]。通过这两种方法,研究者研发了一种直径跨越几个数量级[从100 µm到厘米尺度,图8(m)]的连续血管网络。
总之,血管网络的构造需要提高结构的复杂程度和功能性。单向的血管通道和血管网格难以满足厚组织血管化的需求。三维分支网络应被整合到复杂组织中,以促进营养输送和代谢活动。其他打印策略(如立体光刻[16])也可以提供构建复杂血管网络的工具。血管网络可以应用于许多领域[48]。它们可以为研究体外血管生成的复杂过程提供实验平台。通过可灌注的血管化结构,研究者还可以探究可溶性因子(如VEGF)对组织功能的影响。此外,具有血管网络的三维打印组织可用作疾病模型和药物筛选平台。最后,血管化对于构建可用于临床移植的组织和器官也是必不可少的。
《4.4. 其他中空组织》
4.4. 其他中空组织
研究者还开展了其他中空结构组织的研究,如神经导管[70]和心脏瓣膜[69],如图9所示[134,135]。
《图9》

图9. 其他中空组织的三维打印。(a)多孔道的神经导管。(b)~(d)心脏瓣膜:(b)、(c)由微型计算机断层扫描图像(µCT)构建的主动瓣膜模型和相应的打印而成的主动瓣膜;(d)具有瓣膜结构的主动瓣膜,包裹了人主动脉瓣膜间质细胞(HAVIC) [(a)经IOP Publishing许可转载自Ref. [70], © 2009;(b),(c)经John Wiley and Sons许可转载自Ref. [134], © 2012;(d)经Elsevier许可转载自Ref. [135], © 2014]。
神经损伤严重影响患者的生活质量,而自体移植是神经修复的金标准。Owens和同事[70]使用无支架生物三维打印方法构建了新型多腔室神经导管[图9(a)],该方法类似于Norotte制造血管的方法[15]。结果表明,生物打印的神经导管是神经再生的潜在选择[70]。
作为一种日益严重的健康问题,心脏瓣膜疾病通常要求进行假体移植。目前用于心脏瓣膜移植的人工瓣膜包括机械瓣膜、生物瓣膜和肺自体移植物。但是这些瓣膜远不能达到很好的治疗效果,特别是对于年轻患者[134]。通过生物三维打印制造主动脉瓣膜是解决该问题的一种新思路。Duan和同事使用从µCT图像[134]重建或由Solidworks ® [135]设计的三维模型,成功地设计了异质性载细胞水凝胶主动脉瓣,如图9(b)~(d)所示。人体主动脉瓣膜间质细胞(hAVIC)被包裹在水凝胶导管中,保持了高成活率并表达了特定蛋白质[135]。
《5. 器官芯片》
5. 器官芯片
器官芯片将微流体技术与生物三维打印技术相结合,可应用于开发疾病模型、药物研发平台和高通量检测。它们提供了模仿天然细胞外基质的三维细胞外环境。因此,与二维培养条件下的细胞相比,细胞对药物的反应更接近真实情况[136]。通过生物三维打印制造器官芯片的研究主要集中在肝脏芯片和心脏芯片,甚至全身芯片[137]。
《5.1. 肝脏芯片》
5.1. 肝脏芯片
肝毒性是药物筛选和毒性测试中最重要的方面之一。Organovo公司专注于开发用于药物开发的肝组织系统[138–140]。他们构建了厚度为250~500 µm的多层结构,该结构具有与天然组织相当的细胞密度[138] [图10(a)]。实质和非实质组分都按照用户的指定而沉积在特定空间位置。此外,他们还开发了组织水平的药物导致的肝损伤(DILI)的肝毒性测试模型[140]。该模型在培养28天内维持细胞色素P450的表达和药物引发的酶活性。研究者测试了Trovafloxacin与Levofloxacin 的剂量反应,结果表明该模型能够有效地模拟组织水平的DILI [140]。Bhise和同事[18]开发了一种生物反应器,其中含有生物三维打印的肝脏结构,其中,人类HepG2 / C3A细胞球包裹在GelMA水凝胶中[图10(b)]。生物反应器可以支持人HepG2 / C3A细胞球的三维长期培养并用于药物毒性评估。研究者发现用15mmol·L–1 对乙酰氨基酚处理诱导的毒性反应与现有的体外模型相当[18]。此外,Lee和Cho [19]提出了肝脏芯片的一体化制造工艺[图10(c)]。芯片表现出低水平的蛋白质吸收,因此可以实现代谢活动和药物反应的准确测量。DLP技术也用于构建肝脏芯片[26] [图10(d)]。研究人员制作了一个三维共培养平台,该平台将hiPSC来源的肝祖细胞(hiPSC-HPC)与人脐静脉内皮细胞(hUVECs)和脂肪来源的干细胞嵌入六边形结构中。与其他生物三维打印技术相比,DLP可实现最高的分辨率和构建速度,从而有利于芯片的快速制造和异质组织的构建。
《图10》
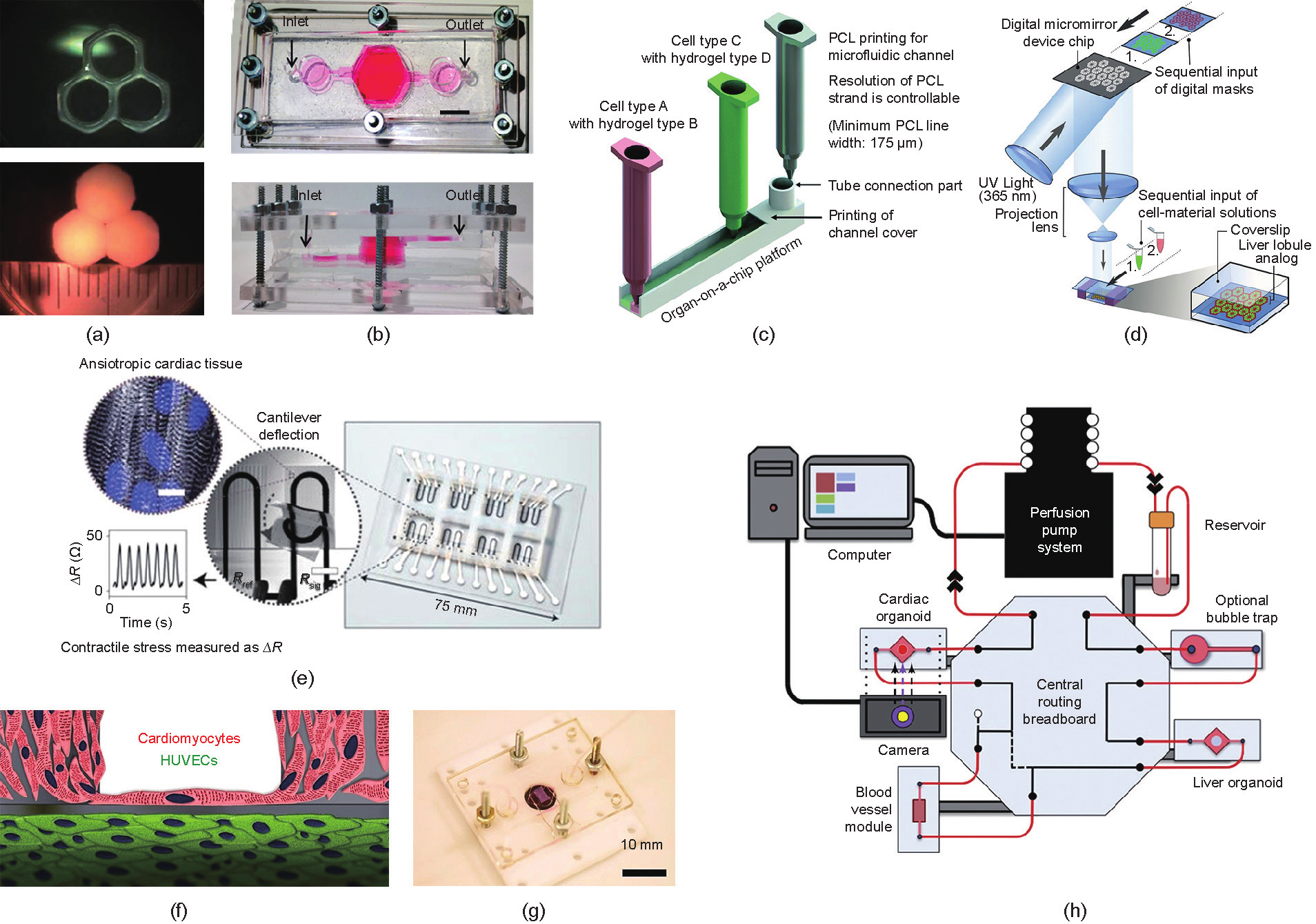
图10. 器官芯片的三维打印。(a)~(d)肝脏芯片:(a)厚度为250~500 µm的多层异质性肝脏组织;(b)一个含有三维打印的肝结构的生物反应器,用于长期培养HepG2/C3A细胞团;(c)一体化多打印头打印制备肝脏芯片;(d)用DLP方法制备的微观六边形结构,可共培养hiPSC-HPCs, hUVEC和脂肪来源的干细胞[26]。(e)~(g)心脏芯片:(e)用六种功能性生物墨水打印的微生理装置,集成了应变传感器用于药物毒性测试;(f)、(g)通过将心肌细胞种植在内皮化的水凝胶支架上,并集成到生物反应器中从而评估心血管药物毒性。(h)全身芯片的示意图 [(a)经Fedn of Am Societies for Experimental Bio许可转载自Ref. [138], © 1987;(b)经IOP Publishing许可转载自Ref. [18], © 2009;(c)经Royal Society of Chemistry许可转载自Ref. [19], © 2016;(e)经Springer Nature许可转载自Ref. [20], © 2016;(f),(g)经Elsevier许可转载自Ref. [83], © 2016;(h)经Elsevier许可转载自Ref. [137], © 2016]。
《5.2. 心脏芯片》
5.2. 心脏芯片
心脏芯片是评估药物心血管毒性的潜在工具。Lind和同事[20]在一个载有细胞的微结构中集成了柔性应变传感器,以检测三维打印的心肌组织的收缩[图10(e)]。他们采用六种功能性生物墨水来打印心脏芯片,通过嵌入式传感器在细胞培养箱环境中无创地获得了肌肉收缩应力的电子读数。此外,他们还研究了心肌组织对不同剂量药物的反应,并在心肌组织逐渐成熟的四周内研究了其收缩能力的发展变化。Zhang等[83]通过用水凝胶直接打印内皮细胞并将心肌细胞接种到内皮基底上来构建心脏芯片[图10(f)、(g)]。他们成功地得到了能够自发同步收缩的具有特定排列方向的心肌组织。随后,他们设计了微流体生物反应器对该组织进行了毒性评估,并通过细胞对不同剂量药物的反应,证明该平台用于毒性评估的可行性。
尽管研究已经验证了心脏芯片评估药物引发的心血管毒性的能力,但细胞-药物和细胞-细胞相互作用的机制还有待进一步研究。此外,心肌细胞排列的机制、收缩力产生的机制也有待进一步探索,以便更好地复制天然心肌的收缩能力和细胞间通信。研究者已经提出了若干种用于测量心肌细胞产生的收缩力的策略,包括集成的应变传感器[141]、微弹簧装置[123]和微悬臂梁[142]。然而,这些方法仅适用于具有定向排列心肌细胞(CM)的单层心脏补片或心肌细胞随机排列的大块心脏组织。而具备定向排列的心肌细胞并具有一定体积的人造心肌组织,以及相应的心脏芯片还有待进一步开发。
《5.3. 全身芯片》
5.3. 全身芯片
除了肝脏芯片和心脏芯片的三维打印之外,其他器官芯片(包括肺芯片[8]和肾脏芯片[143])也可通过非打印方法制造。最近报道了一种全身芯片[137],如图10(h)所示。
Huh和同事[8]是首先提出肺芯片概念的研究者。他们构建了肺泡-毛细血管屏障以模拟人肺的器官水平功能。纳米毒性研究的结果表明,芯片上的肺再现了肺的毒性和炎症反应。研究人员使用相同的方案开发了一种肾脏芯片装置,重建了肾小球-毛细血管壁功能[143]。在该模型中,人诱导多能干细胞分化成足细胞,表达成熟表型标记物(nephrin+ , WT1+ , podocin+ ,PAX2– )。
全身芯片集成了多个功能性类器官,包括心脏类器官、肝脏类器官、血管模块等,以及微流体灌注系统[137]。该技术将显著提高药物研发的效率并降低成本。然而,如何实现高通量和研发合适的培养基仍是较大的挑战。
《6. 挑战与展望》
6. 挑战与展望
尽管生物三维打印技术已被广泛应用于组织工程、疾病研究和药物筛选,但许多问题尚未得到解决。表4列出了生物打印各种组织器官的主要挑战[12,14,15,19,20,62,83,103–105,137,138,144]。 本 节 探 讨生物打印方法、生物墨水和血管化等研究面临的主要挑战。
《表4 》
表4 组织器官三维打印的挑战

目前,由于打印速度、分辨率或材料兼容性的限制,现有的生物三维打印技术(喷墨打印、挤出打印或基于光的打印)均无法完全满足构建人造组织或器官芯片的需求。打印速度仍需大幅提高以制造临床可用的尺寸的组织器官的构建。连续液体界面(CLIP)方法已经展现了在厘米级别制造三维物体的能力,其特征分辨率低于100 µm,而且制造时间以分钟而不是小时计[145],存在应用于组织器官制造的可能性。打印的分辨率也有待进一步提高,以便精确控制生物材料、细胞或生物分子的梯度化的空间分布。最近,熔融静电直写技术被用于超细长丝的制备和堆叠(10~20 µm,最多50层)[146,147]。该技术结合了三维打印和静电纺丝的优势,为高分辨率增材制造开辟了道路。此外,多通道生物打印[12,44,148]或复合打印策略[96,115]有利于各种生物材料的同步打印及制造具有异质性结构和功能的复杂组织器官。通过这些技术进步和新技术的开发,可移植的人造组织很可能在短时间内被制造出来,并且具有精细的微观和宏观结构以及更接近人体组织的功能。
可加工性和生物相容性之间的平衡是研发生物墨水的主要挑战。目前普遍通过采用易于加工的、机械强度高的材料作为结构支撑,而采用生物相容性较好的水凝胶作为细胞外基质来实现这一平衡。但是,这就需要在不同的打印模块之间快速切换。Lewis的研究团队[149]开发了一种主动混合系统,可以在微尺度上均匀化诸多类型的流体,为动态调节生物墨水流变性质提供了一种工具。连续的多材料挤出可以通过切换生物墨水的容器而不是打印头来实现,这为快速切换多种材料提供了另一个方向[84,150]。通过添加热敏明胶和双交联方法,Yin等[77]将低浓度GelMA的形状保真度提高到高浓度GelMA的水平,同时保持了较高的细胞相容性。为了减少打印过程对细胞的损伤,研究者已经探索出可见光交联的生物墨水[84,151]。此外,天然组织中细胞外基质的微环境还有待研究,以指导具有特异性组成和梯度的合成细胞外基质的构建[21]。对生物三维打印使用的生物墨水进行标准化,以便比较各种生物墨水的性能[152]。更重要的是,生物材料的降解性能也需要进一步研究。移植到体内后,打印的组织应保证细胞初始的空间位置,并随时间降解而不产生有毒副产物。
终末分化细胞和干细胞的结合是生物三维打印的趋势。多种类型的细胞对于重现细胞与细胞的相互作用和再现组织或器官的功能是必不可少的。研究干细胞增殖和分化的潜在机制尤为重要。研究表明,干细胞的命运可以通过生物分子的特定分布来诱导[89]。精确定位细胞和生物活性因子的能力在制造人造组织或器官中起着至关重要的作用。可能需要进一步研究细胞-材料界面以指导适用于特定组织的材料的选择。此外,可灌注生物反应器的设计也是将来研究的方向之一。生物反应器可为细胞提供特定的物理或化学刺激,并维持细胞活性和功能。
血管化和神经化是组织工程领域的共同挑战[21]。在构建大块组织或器官时,血管网络对于提供营养物质、氧气和代谢废物的通道至关重要。研究者已经开发出具有分层分支和大直径血管的复杂可灌注血管网络[125,128]。最近的研究表明,血管网络可以支持超过1 cm厚度的结构的长期灌注[14]。Lee等[40]开发了从毫米级通道到微米级毛细血管的多尺度血管网络。已经证明,同轴挤压能够制造直径达8 mm的血管结构[153]。许多研究通过使用牺牲材料,通过事后将其移除,以形成分支状和可灌注的通道[63,125]。然而,尚未实现可与宿主组织整合的仿生的三维分支血管网络。最近,Wang和同事[154]开发了使用冰作为牺牲材料的独立式分支结构。经优化,该结构可承受手术缝合,并有可能与宿主血管网络整合。虽然他们的平台的分辨率限制在1 mm,但这一研究同样提供了制造血管替代物和下一代血管结构的途径[155]。神经化是构建功能性组织或器官的下一个步骤[156],神经化的组织有望对其周围环境产生响应。
总之,生物三维打印实体组织和中空组织的研究成果将相互促进,从而促进寿命更长、体积更大、功能更丰富且可移植的组织器官的研发。这一发展将为器官移植等候名单上的患者提供个性化诊疗方案。此外,得益于干细胞技术、生物反应器、微流体技术和器官芯片装置的进步,这些高性能的人造组织器官将逐渐应用于可靠、高通量和低成本的疾病和药物研究平台。了解疾病的发生和发展机制及其对药物毒性的反应,将极大地促进人类健康事业。
《7. 结论》
7. 结论
本文回顾了生物三维打印方法和生物墨水的最新进展,以及该技术在组织工程、疾病研究和药物筛选中的应用。打印机的打印速度、分辨率及与生物材料的兼容性需要进一步改进,多通道打印将为更复杂的组织器官提供有力工具。生物墨水的机械性能和细胞相容性的提高将有利于提供更加仿生的细胞外环境。干细胞技术和生物三维打印的结合有望构建性能更佳的组织器官和器官芯片。为了提高打印结构的寿命、增强其功能,血管化和神经化有待于进一步研究。一旦解决了这些问题,体外构建的可移植组织器官和能够复现器官水平反应的器官芯片将极大地促进组织工程和再生医学的发展。
《致谢》
致谢
作者得到国家自然科学基金(51875518,51475419,81501607)、浙江省自然科学基金(LY15H160019)和浙江省重点研发计划(2017C01054)的资助。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Bin Zhang, Lei Gao, Liang Ma, Yichen Luo, Huayong Yang, and Zhanfeng Cui declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




