《1. 引言》
1. 引言
冠状病毒(CoV)属于包膜的、正链的RNA病毒,可引起人类轻度的上呼吸道感染。中东呼吸综合征(MERS)是由一种新型冠状病毒——中东呼吸综合征冠状病毒(MERS-CoV)引起的病毒性呼吸道疾病。MERS-CoV首次发现于一名阿拉伯患者体内,该患者于2012年死于MERS-CoV相关呼吸衰竭和肾衰竭。MERS-CoV属于冠状病毒科,β类冠状病毒的2C亚群。世界卫生组织(WHO)实验室的全球报告指出,从2012年4月到2019年5月22日确诊的MERS病例总数为2428例,其中838例死亡(病死率约35%,其中在沙特阿拉伯的病死率为40.43%)[1]。除了中东呼吸综合征病毒(MERS-CoV)外,已知只有少数几种CoV会感染人类引起较轻的呼吸系统疾病[2,3],包括人类冠状病毒(HCoV)229E、NL63、HKU1和OC43。但是,严重的急性呼吸道综合征病毒(SARS-CoV)和MERS-CoV具有很高的致病性和致死率,尤其是在老年人群和免疫功能低下的患者中[4,5]。中东呼吸综合征已在全球27个国家/地区爆发,主要疫情发生在沙特阿拉伯、阿拉伯联合酋长国和韩国。MERS-CoV的主要中间宿主是单峰骆驼,终宿主可能是蝙蝠。但是,单峰骆驼在病毒传播中的具体作用尚不清楚。迄今为止,除了潜在的MERS特异性治疗剂——完整人免疫球蛋白G(IgG)(SAB-301)在安全性和耐受性方面得到一定的验证外,还尚未发现其他有效的疫苗或抗体可用于人体免疫和治疗[6]。因此,对MERS患者需要采用包括控制传播的多种方法进行综合干预治疗,在本文中,我们论述了MERS-CoV蛋白的结构和生物功能,并讨论了针对各个环节和蛋白分子的干预策略来防止病毒的传播。
《2. 结构蛋白》
2. 结构蛋白
许多冠状病毒,包括MERS-CoV,都具有长约30 kb的大型RNA基因组,并带有至少10个开放阅读框(ORF)[3,7]。 MERS-CoV结构蛋白的ORF排列为5′-ORF1a/b-S-E-M-N-poly(A)-3′,与冠状病毒属C系中其他CoV的排列相似[8]。许多研究将这些基因及其编码的蛋白质作为疫苗的靶标,或用于诊断及治疗目的(表1)[9,10]。
《表1》
表1 结构蛋白、基因及其在MERS-CoV中的潜在功能
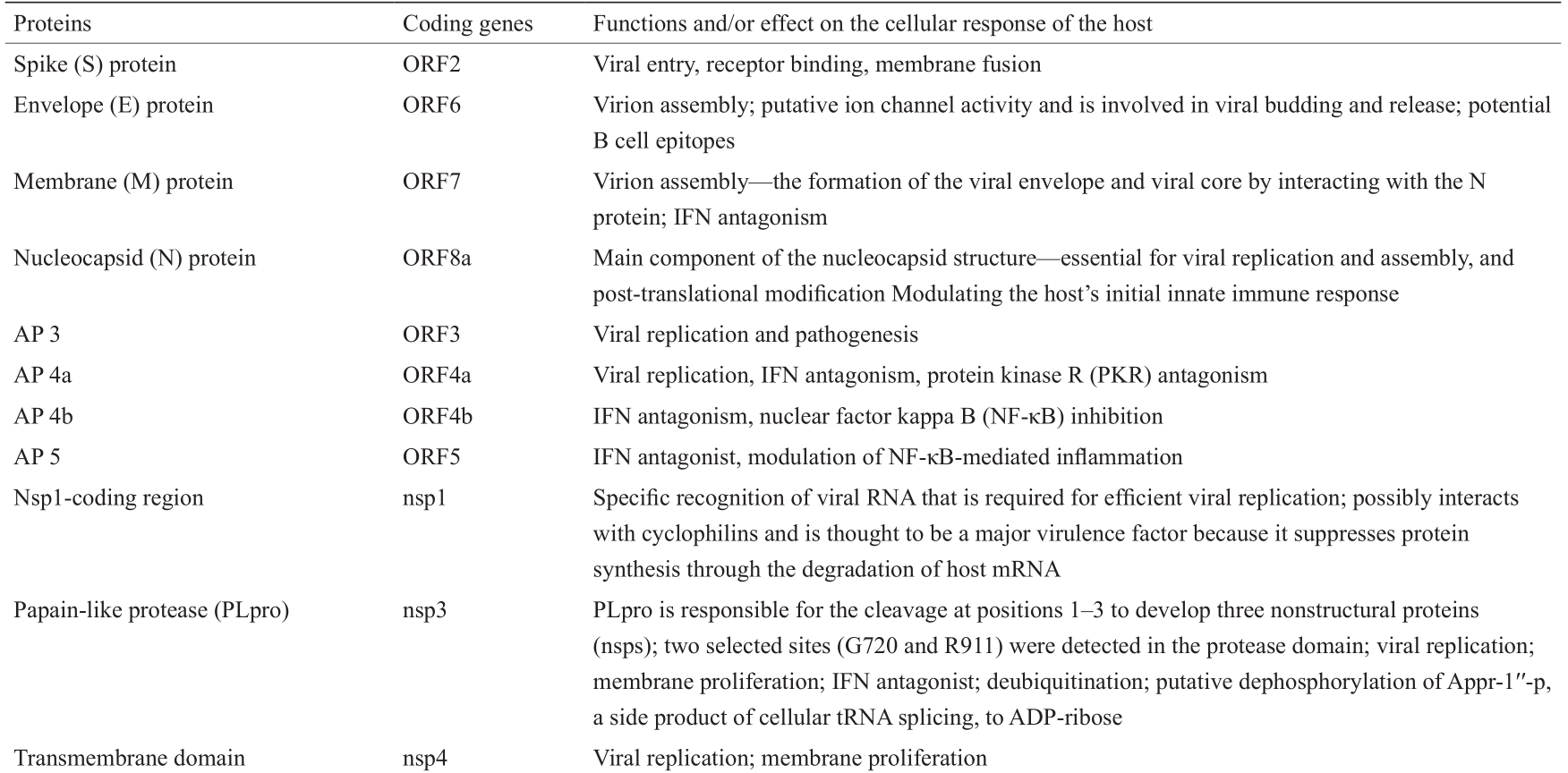

与其他冠状病毒一样,MERS-CoV携带编码辅助蛋白(AP;3、4a、4b和5)的基因,这些蛋白拮抗宿主的抗病毒反应[通常是Ⅰ型干扰素(IFN)反应]并造成病毒的致病性和发病机制。当单独表达CoV AP时,它们可能会干扰先天性抗病毒信号传导途径[11]。
《2.1. 棘突蛋白》
2.1. 棘突蛋白
MERS-CoV的棘突(S)蛋白是Ⅰ型跨膜糖蛋白,在病毒包膜表面表达并在病毒体上形成刺突。S蛋白包含1353个氨基酸,糖基化程度高,并具有较大的细胞外结构域和较短的胞质末端。S蛋白可以分解为S1和S2,它们在病毒结合、融合和入侵中具有重要作用。
2.1.1. 病毒吸附
S1亚基具有N端结构域(NTD)和受体结合结构域(RBD),并且包含约240个残基。MERS–RBD包含胞内和胞外域。CoV的胞内域相对保守[12],而CoV的胞外域结构变化很大,胞外域主要参与受体结合,导致不同CoV与宿主细胞的结合受体差异。RBD负责结合二肽基肽酶Ⅳ(DPP4,也称为人CD26)。 有趣的是,MERS-RBD可以在体内诱导产生大量抗体,这表明S蛋白对于诱导中和抗体(nAb)具有良好的免疫原性[13–16]。NTD的免疫原性和保护潜力已被证实,重组N端结构域(rNTD)可作为抗MERS的候选疫苗[17]。
2.1.2. 膜融合
S2亚基中有两个区域参与病毒融合,即七肽重复序列1和2(HR1和HR2),它们组装成典型的六螺旋束(也称为融合核心)。HR1侧槽芯中的3个HR2链发出3个HR1螺旋,形成一个关键的膜融合结构[18,19]——中心螺旋形的核心。当S1结合DPP4后,HR1结合HR2形成即时中间结构,从而导致病毒膜和细胞膜靠近并融合膜。
2.1.3. 病毒进入
S蛋白在CoV的趋化性和发病率中起关键作用,并在期间水解为S1和S2[20]。宿主中有多种蛋白酶(参考文献[21])可以消化MERS-CoV的S蛋白。例如,在感染期间,卵裂的激活过程中,MERS-CoV可将弗林蛋白酶分为两步使用。首先,弗林蛋白酶在生物合成过程中识别R751 / S752的位置并切割S蛋白,在病毒进入后,S2在与融合肽相邻的位置R887 / S888处进一步消化成S2’ [20]。
《2.2. 包膜蛋白》
2.2. 包膜蛋白
包膜蛋白是一种内膜蛋白,也是MERS-CoV的一种小结构蛋白。长度为82个氨基酸,推测至少包含一个跨膜结构[22]。CoV的E蛋白在细胞内运输、宿主识别、病毒装配和病毒出芽中起重要作用[22]。但是,CoV E蛋白在病毒感染过程中的确切功能仍不清楚。
2.2.1. 病毒装配
研究人员已经使用传染性支气管炎病毒(IBV)感染证明了E蛋白是病毒体组装所必需的,E蛋白的另一作用是干扰分泌途径[23]。MERS-CoV E蛋白具有一个单一的疏水结构域(hd),该结构域以高尔基复合膜为靶点,并在体外具有阳离子通道活性。纯化的MERS-CoV E蛋白在脂质双层中形成五聚体离子通道。缺少E蛋白可能导致通道活性的丧失。由于此通道活性是重要的毒力因子,因而MERS-CoV E蛋白是潜在的抗病毒治疗靶标[22]。
2.2.2. B 细胞表位
研究人员已使用LaserGene(DNASTAR,Inc.,USA)、PHYRE 2(Structural Bioinformatics Group,Imperial College London,UK)和PyMOL(Schrödinger,LLC,USA)等软件或程序鉴定了E蛋白58~82位具有高抗原性的潜在B细胞表位[24]。
《2.3. 膜蛋白》
2.3. 膜蛋白
膜(M)蛋白在病毒装配、病毒包膜的形成以及与核衣壳(N)蛋白相互作用形成病毒核心方面具有重要作用[25,26]。因此,开发融合肽和干扰素拮抗剂可能是一个重要的治疗策略研究方向。
《2.4. 核衣壳蛋白》
2.4. 核衣壳蛋白
MERS-CoV的N蛋白是磷酸化的碱性蛋白,是MERS-CoV第二大结构蛋白,含有413个氨基酸残基。N蛋白与RNA基因组结合形成核衣壳,这在病毒复制和组装中十分重要[27]。
2.4.1. 病毒粒子的复制和组装
N蛋白的N端(残基39~165)可能是RNA结合区域,C端可能是自结合低聚物形成区域[28]。MERS-CoV与其他CoV之间同源性的比较表明,尽管N蛋白在整个氨基酸序列上同源性较低,但某些局部氨基酸序列(尤其是N端氨基酸序列)却高度保守。SARS-CoV N蛋白可通过超表达增加复制[29]。核衣壳结构不仅需要识别病毒RNA的特征序列,而且还必须识别与其他结构病毒蛋白的结合。在N蛋白与病毒基因组RNA形成复合物后,RNA受到保护而不被宿主细胞中核酸酶破坏[30]。利用X射线衍射测量获得高分辨率(2.4Å)的N蛋白结构,检测到N端固有的无序区(IDR)和NTD,同时发现CoV中的NTD相对稳定[31]。
2.4.2. 翻译后修饰
SARS-CoV和MERS-CoV的N蛋白被ADP-核糖修饰,这是常见的翻译后修饰,然而,目前尚不清楚它是如何调节RNA病毒感染的。在一项筛选CoV感染后ADP核糖化蛋白的研究中,研究人员鉴定出约55 kDa的ADP核糖基化蛋白,随后被证实为CoV N蛋白。因此,CoV N蛋白可能会调节某些重要蛋白的翻译后修饰[30]。
2.4.3. 调节先天免疫反应
CoV的N蛋白可能通过干扰三基序蛋白25(TRIM25)和视黄酸诱导基因Ⅰ(RIG-1)之间的相互作用,并与TRIM25的E3泛素连接酶结合,从而抑制Ⅰ型IFN的产生。因此,抑制TRIM25介导的RIG-1的泛素化和激活化,最终导致IFN的产生受到抑制,这表明CoV的N蛋白可调节宿主对病毒的免疫应答[29]。
在宿主中MERS-CoV N蛋白能与甘氨酸相关的丝氨酸蛋白酶2(MASP2)[32]和翻译延伸因子1(EF-1A)[33]相互作用。一旦甘露糖结合凝集素识别出病毒感染细胞表面的甘露聚糖,它就会募集MASP2,然后激活其酶促活性,最终引起局部或全身性炎症反应。EF-1A充当翻译延伸因子,并催化氨酰-tRNA进入核糖体的A位点。EF-1A在细胞骨架、微丝和胞质分裂环的组装中起调节作用。MERS-CoV N蛋白与EF-1A之间的相互作用破坏了胞质分裂环的形成并抑制了淋巴细胞的增殖,这可能是MERS患者淋巴细胞数量减少的原因。
《3. 辅助蛋白》
3. 辅助蛋白
MERS-CoV具有大量编码各种辅助蛋白(dORF:ORF3、ORF4a、ORF4b、ORF5)的基因组。即使是密切相关的CoV,它们的数量和序列也不同,并且可以造成宿主移位和HCoV暴发[34]。
《3.1. 病毒复制》
3.1. 病毒复制
MERS-CoV AP ORF对于病毒在体内和体外的复制非常重要,这使得这些ORF可用作疫苗制备的靶标,并且MERS-CoV AP也是监测和治疗的潜在靶标。此外,AP ORF的平行破坏为SARS或MERS-CoV AP ORF的新突变提供了快速响应平台[35]。
《3.2. 宿主反应失调》
3.2. 宿主反应失调
MERS-CoV的辅助蛋白可以通过不同的方式激发抗病毒反应,其中包括IFN拮抗作用和蛋白激酶R(PKR)以及核因子κB(NF-κB)途径。
3.2.1. IFN 拮抗作用
dORF3-5突变体功能减弱主要是由宿主反应紊乱引起的,包括细胞生理过程破坏和强烈的炎症反应。ORF4-5蛋白能抑制IFN途径的激活,是有效的IFN拮抗剂。它们可以抑制IFN的产生(如IRF-3 / 7)以及干扰素刺激反应元件(ISRE)的信号通路。MERS-CoV ORF4a蛋白很可能会干扰IFN的抗病毒作用[36]。
IFN拮抗作用是病毒致病的一个关键因素。IFN诱导的寡腺苷酸合成酶(OAS)-RNase L途径在检测到病毒双链RNA(dsRNA)后激活,从而裂解病毒和宿主的单链RNA(ssRNA),这会阻碍病毒的复制和传播。ORF4b主要位于细胞核内(而所有其他蛋白都位于细胞质内),它具有磷酸二酯酶(PDE)活性并能激活RNaseL。NS4B的治疗干扰了体内模型中MERS-CoV的发病机制[37]。
3.2.2. PKR 拮抗作用
MERS-CoV的p4a对于PKR的拮抗活性至关重要。为了建立感染和传播,MERS-CoV必须调节复杂的宿主抗病毒反应网络[I型IFN(IFN-α/β)反应]。PKR磷酸化eIF2α可抑制细胞和病毒的转录,并形成应激颗粒(SG),这将为抗病毒信号通路提供策略[38]。
3.2.3. NF-κB 抑制作用
在感染过程中,MERS-CoV 4b能防止强烈的宿主反应。在病毒感染过程中,4b通过将NF-κB与核转录因子α4(KPNA4)结合并将其易位到核中来发挥竞争作用,从而干扰NF-κB介导的先天免疫反应[20]。ORF5对调节NF-κB介导的炎症也有一定作用[35]。
《4. 非结构蛋白》
4. 非结构蛋白
在CoV基因组5′末端的ORF1a和ORF1b编码多聚蛋白1a和多聚蛋白1b,它们可以切割成16种非结构蛋白(nsp)。这些蛋白是病毒复制和转录必不可少的[39]。
《4.1. 蛋白水解》
4.1. 蛋白水解
MERS-CoV 3C样蛋白酶(3CLpro)和木瓜蛋白酶样蛋白酶(PLpro)受蛋白质序列形成、密码子使用方式和密码子使用偏性的不同遗传和进化影响。PLpro的切割点位于位置1~3,产生3个非结构蛋白,而3CLpro的切割发生在位置4~16。nsp3(200 kDa)是一种多功能蛋白,包含多达16个不同的结构域和区域,并和病毒RNA、核衣壳蛋白以及其他参与多聚蛋白加工的病毒蛋白有关。nsp3的PLpro活性已确定为新抗病毒药物的靶标[40]。PLpro受多种成分、突变和其他因素的影响。现在已经研究了多种抗病毒药物,如PLpro抑制剂和3CLpro抑制剂(表2)[41,42]。nsp5广泛参与了病毒编码的多聚蛋白(ppla、pplab)和16个非结构蛋白的加工。因此,nsp5对于病毒生存必不可少。此外,由于NSP5与人类细胞无同源性,使其成为抗病毒药物设计的理想靶标[43]。nsp3在MERS-CoV毒株中的适应性进化的相关研究正在进行中。冠状病毒nsp3通常用于病毒监测和特定靶点的研究,因而对nsp3基因序列分析也十分重要[44]。
《表2》
表2 针对MERS-CoV蛋白的潜在产品概要



《4.2. 病毒复制》
4.2. 病毒复制
冠状病毒RNA合成与由修饰的内质网(ER)膜构成的复制细胞器(RO)相关。它们被转换为含有病毒dsRNA的双膜囊泡(DMV),然后转换为其他卷曲的膜,并一起形成网络状囊泡。SARS-CoV的nsp3、nsp4和nsp6包含跨膜结构域,均负责DMV的形成[45]。另外,nsp1编码区5′末端的顺式作用元件能促进病毒RNA的特异性识别,这对于有效的病毒复制是必需的[46]。
MERS-CoV解旋酶(nsp13)是最重要的病毒复制酶之一,主要表现在对病毒趋向性和毒力的影响[47]。nsp13在5′到3′方向上打开DNA和RNA,它是一种运动蛋白,可以利用ATP水解产生的能量催化双链核酸逐步分解为两个单链核酸。因此,nsp13解旋酶可以用作抑制MERS-CoV复制的治疗靶标[48]。另外,nsp8在病毒复制中具有重要的活性。nsp12[RNA依赖性RNA聚合酶(RdRp)]在病毒复制和转录中发挥重要作用,可以用于病毒诊断(RdRpSeq分析)以及用作抗病毒靶标(聚合酶抑制剂)。nsp14具有核糖核酸外切酶活性。最后,nsp15具有核糖核酸内切酶活性,可有效阻止宿主细胞中dsRNA传感器[包括黑色素瘤分化相关蛋白5(Mda5)、OAS和PKR]的激活[9,49,50]。
《4.3. 甲基转移酶抑制》
4.3. 甲基转移酶抑制
nsp16是S-腺苷-L-蛋氨酸(SAM)依赖的2′-O-甲基转移酶(2′-O-MTase),nsp10在调节2′-O-MTase活性中起重要作用。SAM结合可以促进nsp10 / nsp16复合物构成,该复合物通过SAM的2′-OH甲基化,酶解将7mGpppG(cap-0)转化为依赖SAM的7mGpppG2′ Om(cap-1)RNA。丙氨酸诱变已用于鉴定影响RNA识别的nsp16残基。SAM / S-腺苷-L-高半胱氨酸(SAH)的平衡可以调节2′-O-甲基转移酶的活性,从而增加SAH水解酶的抑制作用,并可能干扰冠状病毒复制周期[51]。
《4.4. 膜增殖》
4.4. 膜增殖
nsp3和nsp4在膜配对中一起发挥作用。nsp6可以通过形成核周小泡来促进膜增殖,这里需要全长nsp3,因为在与nsp4和nsp6共表达C端截短的nsp3的细胞中没有发现DMV [52]。
《4.5. 与宿主相互作用》
4.5. 与宿主相互作用
4.5.1. IFN 拮抗剂
大多数适应性反应通过nsp3发生,nsp3通过其去泛素化和去酯化活性抑制IFN反应[41]。目前正在根据从人类和骆驼身上分离出来的MERS-CoV进行nsp3筛选[44]。nsp3(R911C)的阳性选择变化仅在人类病毒的样本中观察到,这表明在人类中病毒的适应性表现出潜在的压力选择[44]。nsp16促进病毒先天免疫逃逸,并使用具有三角形四肽重复蛋白1(IFIT-1)的IFN诱导蛋白来抑制病毒转录[34]。采用反向遗传学实验证实,dnsp16突变的MERS-CoV表现出对Ⅰ型IFN的反应减弱。在没有IFIT-1的情况下,突变部分可恢复[53]。
4.5.2. 去泛素化
PLpro的泛素样结构域(Ubl)与泛素结合后变为高度可延展性,其增加的柔性对于与其他下游蛋白相互作用以及抑制先天免疫至关重要[54]。涉及去泛素化-L106、R168、P163和F265的4个主要残基在所有的MERS-CoV中都是保守的,但不同于其他β冠状病毒。因此,nsp3去泛素化的下调可能导致MERS-CoV与宿主免疫系统之间的相互作用减弱[54,55]。
4.5.3. 抑制宿主 mRNA 的表达和翻译
nsp1通过结合dsRNA和细胞双链DNA抑制宿主的先天免疫反应。因此,它可以作为病毒入侵的最佳检查点[56]。同时,nsp1的C端靶向TNF受体关联因子3(TRAF-3),以抑制IFN-β的产生[57]。另外,其他nsp1域可能抑制干扰素调节的转录因子3(IRF3)和PKR的激活 [59]。CoV的nsp1也可能与亲环素相互作用,它是主要的毒力因子,因为它会降解宿主mRNA。MERS-CoV nsp1的mRNA降解活性与其翻译抑制功能是分开的。此外,MERS-CoV nsp1的某些残基对于避免翻译停止至关重要[46]。MERS-CoV mRNA的细胞质起源促进被MERS-CoV nsp1抑制的MERS-CoV mRNA逃逸[60]。
《5. 治疗 MERS 的潜在方法》
5. 治疗 MERS 的潜在方法
现在没有完全有效的方法可以治疗MERS-CoV。目前的治疗方法主要是模仿对SARS-CoV的治疗,其中包括:对症治疗,包括生物治疗[如单克隆抗体(mAb)、阻断剂、蛋白酶抑制剂、皮质类固醇和IFN];化学药品(如阿昔洛韦[61]、盐酸氯丙嗪[62]、洛哌丁胺和洛匹那韦[63])、广谱抗真菌药(如利巴韦林、洛匹那韦利托那韦或霉酚酸酯[64]),以及纳米颗粒疫苗[65]。但是,对MERS-CoV的治疗尚未进行系统的临床试验。因此,我们从分子特征的角度分析了潜在的预防和治疗策略,以期为开发有效、有针对性的预防和治疗方法,尤其是生物学方法提供参考。
《5.1. 与 S 蛋白有关的方法》
5.1. 与 S 蛋白有关的方法
5.1.1. 对 S 蛋白的抗体
单克隆抗体可以作为一种潜在的干预方法,它已应用于许多感染性疾病。主要产品如表2所示。LCA60是目前为止唯一从康复的MERS患者中分离的抗体。该产品的临床前研发已经完成,并且已经建立了符合GMP的工程细胞系,该细胞系能高效表达抗体[66]。人类nAb [67]和mAb [68,69]的研究也在进行中。这些基于抗体的药物是RBD的特异性的有效抑制剂,并表现出强烈的对MERS-CoV的中和活性。表2描述了有关潜在抗体和mAb的相关研究。潜在抗体REGN3051和REGN3048对MERS-CoV感染的动物模型能进行有效预防[70,71]。此外,以下治疗方法同样有效:Mersmab [72],1E9、IF8、3A1、2F9、1F7和YS110 [73],hMs-1 [74],4C2[75]以及RBD s377-588-Fc IgG融合蛋白[76]。G4能识别冠状病毒中的可变糖基化环,该环与三聚体的4个构象状态形成相关。这些研究为设计基于结构的CoV疫苗提供重要的理论和研究基础[5,77]。
5.1.2. 抑制剂
MERS-CoV SP对于病毒进入细胞来说很重要。因此,可以考虑使用其他阻断病毒细胞膜融合的治疗剂,如猫源蛋白抑制剂[78]、TMPRSS2抑制剂[79]、PLpro抑制剂[41]、弗林蛋白酶抑制剂[80]、激酶抑制剂[81]和IFN诱导跨膜(IFITM)蛋白[82]。
5.1.3. 多肽
Lu等[19]和Liu等[83]已经确定了在998~1038位的HR1P和在1251~1286位的HR2P负责形成聚变核。HR2P多肽可以抑制MERS-CoV在细胞系(如Calu-3和HFL)中的病毒复制[19]。HR2P在抑制MERS-CoV复制及其刺激性融合中发挥作用。尽管关于它们结合和释放的机制尚不清楚,但是抑制这些病毒的过程可能是将来研究的重要目标[64,84]。
5.1.4. 潜在的治疗成分
冷冻电镜技术揭示了全长S胞外域的融合前结构,表明NTD和C末端域(CTD)形成“V”形,有助于形成整个S三聚体的三角形外观[85–87] 。S2亚基与病毒膜连接,其特征为存在长α螺旋。该结构信息可以为基于结构的抵抗β-冠状病毒疫苗免疫原设计奠定基础。计算生物学和病毒学的结合可以加速抗MERS-CoV的药物设计优化,提高疗效[64]。
《5.2. 与 N 蛋白有关的方法》
5.2. 与 N 蛋白有关的方法
在感染过程中,MERS-CoV的N蛋白大量产生,它们具有很强的免疫原性,这表明它们可以作为检测病毒抗体的理想抗原。抗N IgG可以用作人类冠状病毒感染的指标[88]。报告描述了产生针对N蛋白的mAb的新方法,使用小麦生殖细胞蛋白质合成系统,成功制备了一系列MERS-CoV N蛋白抗原,而且它们具有高度可溶性和完整的免疫状态[89]。
《5.3. 根据 MERS-CoV 特征对其进行治疗的潜在方法》
5.3. 根据 MERS-CoV 特征对其进行治疗的潜在方法
考虑到MERS-CoV的生物学特性,为了防止这种病毒潜在的传播,预防和控制感染十分重要。对于MERS患者,难以实现有效的早期诊断和早期治疗,这主要是因为早期症状的非典型性、检测方法的局限性以及其空气传播特性。因此,无论诊断如何,医疗机构应始终对所有患者采取一致的标准预防措施。此外,需要更有效地检测针对MERS-CoV蛋白的IgM型抗体,并研发出更有效的特异性识别病原的抗体。
《6. 结论》
6. 结论
MERS-CoV的暴发性流行严重威胁全球公共卫生,除了重点开发针对MERS-CoV感染的有效治疗和预防药物外,还需要进一步研究该病的流行病学和发病机制。尽管在疾病诊断和公共卫生防控措施方面取得了迅速进展,但仍有新的MERS-CoV病例出现。这表明,有必要针对不同的高危人群采取多种干预措施,以防止MERS-CoV再次大规模暴发。如本文所述,根据MERS-CoV蛋白相关的生物信息可研发具有潜在预防和治疗作用的药物,以遏制MERS暴发。此外,为了明确在MERS的致病过程中起重要作用的病毒和宿主互作因素,有必要深入研究MERS-CoV的发病机制,这可能为我们提供潜在的新的治疗和干预策略。
《致谢》
致谢
这项工作得到传染病防治国家科技重大专项(2018ZX10711001和2018ZX10102001)的支持。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Yan-Hua Li, Chen-Yu Hu, Nan-Ping Wu, Hang-Ping Yao, and Lan-Juan Li declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




