《1. 引言》
1. 引言
中医药作为一种传统疗法,广泛用于治疗各种急性和慢性疾病。中药安全性和疗效的重要性更是不言而喻。中药包括但不限于草药、茶剂、汤剂和制剂等形式,能够与化学药品和生物应用形成互补。在过去的几十年中,随着中医药行业的蓬勃发展,中药的治疗机制和物质基础均得到更深入的阐释[1–5]。更重要的是,人们现已将中药与其他药物疗法相结合,不仅能够治疗患者的疾病,还可为健康人提供保健功效。目前,中药已逐渐得到欧美发达国家的认可。美国正在就针对各种适应症开发的中药制剂进行临床试验[6–9]。一旦获得有关当局的上市许可,将有助于中药在全球范围内推广。
然而,中药的质量控制体系仍不够完善。尽管官方或民间出版的药典和指南(表1)[10,11]中提供了关于草药、炮制品和制剂质量控制的专论和标准,其中包含了定义、特性、鉴别、测试、化验和存储等信息,但此类标准所提供的信息尚不足以明确区分高度相似的药材品种。例如,根据2015年版的《中华人民共和国药典》,很难判定“辛夷(Flos Magnoliae)”这一味药材究竟源自于木兰科望春花(Magnolia biondii Pamp.)、木兰科玉兰(Magnolia denudata Desr.)还是木兰科武当玉兰(Magnolia sprengeri Pamp.)。“紫草”和“木通”[12,13]也存在类似问题。“紫草”可能源自紫草(Lithospermum erythrorhizon)、软紫草(Arnebia euchroma)或滇紫草(Onosma paniculatum),而“木通”则可能源自于川木通(Clematis armandii Franch.)或关木通(Aristolochia manshuriensis Kom.)。
《表1》
表1 不同国家/地区的中药药典和指南
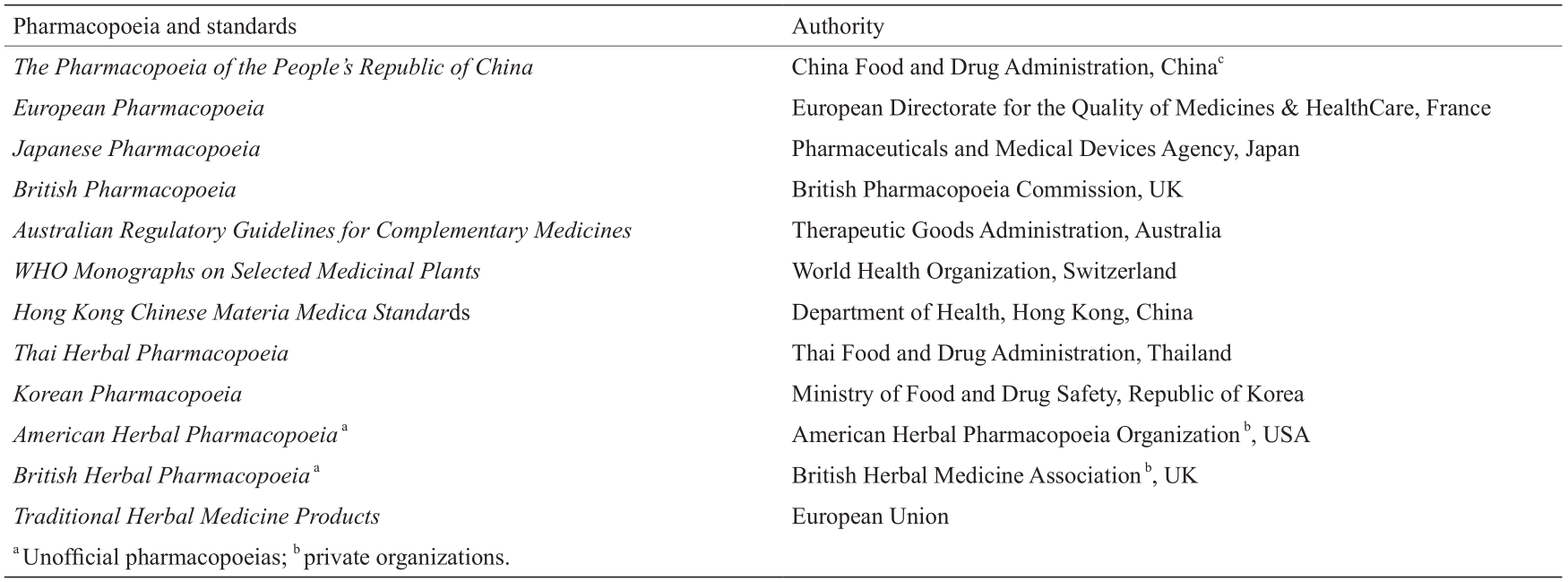
Adapted from Refs. [10,11].
a Unofficial pharmacopoeias.
b Private organizations.
c Rebranded and restructured as the National Medical Products Administration of the State Administration for Market Regulation of PRC since 2018.
近年来,市场对完善中药质量控制体系的需求促成了新的研究热点。几年前,Liu等[14,15]提出了中药质量标志物的新概念。本文考虑了中药的复杂性和影响中药质量的因素,对探索中药质量控制的潜在质量标志物时所涉及的新方法和新技术进行了综述,并洞悉建立适当中药质量控制和评估体系的合理依据。本文还讨论了中药质量控制方面取得的进展,以便为将来的研究提供有益参考。
《2. 建议的中药质量标志物》
2. 建议的中药质量标志物
在化学药品行业中,会为每种药品制定明确的、具有针对性的质量标准。相比之下,对中药质量的研究及其标准的制定则复杂得多。人们就“应如何制定中药质量标准以及采用何种方法进行质量研究”各执一词。任何药品(包括但不限于化学实体、草药和生物应用)均必须被证明具有合格的质量、疗效和安全性,才能获取上市许可,供医生和患者使用。令人欣慰的是,中草药目前在亚洲(特别是中草药备受推崇的东亚)以外的地区得到了推广,并逐渐为全世界接受。例如,中药在欧洲国家被用作补充和保健类药物,并得到欧盟的监管认可。通过现代技术研发的草药专著和标准能够提供更先进的质量控制标准,从而使中药获得更加广泛的认可。
但是,目前在《中华人民共和国药典》和其他药典/指南(无论是官方还是民间组织出版)中提供的专论和标准均达不到质量控制要求。目前实施的质量标准尚存争议。例如,现行做法是评估众多草药和制剂中的一种(或几种)化合物的含量,以此用作质量标志物。但由于测试的化学成分数量有限,所评估的成分可能既不与药物临床疗效密切相关,也不能反应其药理作用。到目前为止,中药质量评估侧重于区分正宗草药和掺假药。但是,通过现代分析技术对多种特定成分进行定性和定量分析对于建立具有针对性和可控性的中药质量标准至关重要。
因此,Liu等[14,15]根据传统中医理论、复方配伍、中药制备以及中药的临床应用,提出了一种被称为“中药质量标志物”的新概念。中药的质量标志物是天然存在于草药和草药制成品(包括炮制品、提取物、制剂或在加工和制备过程中形成的物质)中的化学物质。这些化合物应与中药的功能和性质相关,反映其安全性和疗效,以便用作质量控制指标。中药质量标志物是一种化合物,可能存在于原始品种、加工产品或最终产品中,甚至在中药被吸收入血后仍存在人体内。最重要的是,应对用作质量标志物的化合物的化学结构进行验证,并且该化合物应为可通过定性和定量分析确定的特定成分。因此,在选择将满足上述要求(如参考文献[14,15]中所述)的分子用作质量标志物之前进行了慎重考量。具体来说,质量标志物应当是具备以下特点的化合物:①天然存在于草本植物中,或在加工过程中形成的;②与中药的功能和性质密切相关,具有特定的结构;③可通过定性和定量分析确定;④从中药配伍的角度出发,最好能够代表君药,但也可以代表臣药、佐药或使药。
《3. 质量标志物的探索》
3. 质量标志物的探索
中药质量标志物的新概念提出后,引发了关于“如何探索用作潜在质量标志物的中药化学成分”的讨论。已基于中医理论,采用多学科方法(包括但不限于常规植物化学、分析技术、仿生学、系统生物学以及计算方法等)来确定符合质量标志物要求的化合物。Zhang等[16]详细研究了延胡索(Corydalis rhizoma)的基本特性和作用机制,重点关注探索质量标志物的多种方法。现已根据这些思路研究出益母草(Leonurus japonicus)、赶黄草(Penthorum chinense)和藏黄精(Polygonati Rhizoma)的质量标志物。
《图1》

图1. 探索潜在质量标志物的典型工作流程图。经爱思唯尔许可,转载自参考文献[19],© 2019年。
最近讨论的一种探索中药质量标志物的方法既有趣又合理,其工作流程图如图1 [19]所示。概括说来,这种方法首先是阐明了特定草药及其相关制剂的物质基础。然后通过植物化学研究[液相色谱(LC)、核磁共振(NMR)光谱和液相色谱-质谱(LC-MS)]对尽可能多的化学成分进行分析,以提供化学成分的基本信息。
除化学成分的结构表征外,生物合成途径分析还可提供特定成分的化学成分信息,因为中药中的大多数化学成分是通过各种生物合成途径产生的次生代谢产物。根据中药理论,形成酸甜苦辣咸等味觉的化学成分可作为成分相关属性通过仿生分析(如电子鼻与电子舌)以及数值计算等多种方法综合研究确定。下一步涉及探索与特定草药的疗效和治疗价值相关的化学物质。将使用体外或体内模型对单一化合物和(或)提取物的疗效进行筛选。在此过程中,对中药的药代动力学作用进行研究将有助于确定能够反映出复方配伍的代表性化合物。
现已针对延胡索的质量标志物开展初步研究。研究将植物化学分析、药理学分析、与特性相关成分的数值计算以及生物合成途径分析所获得的所有实验结果进行整合,以制定建立质量标志物的方法[16]。醋制延胡索的标准汤剂采用高压液相色谱飞行时间质谱(HPLC-TOF-MS)进行表征。在31种化学成分中鉴定出了28种,且均为生物碱,被分为3组:原小檗碱、普鲁托品和阿朴啡型生物碱。这些生物碱的生物前体均为酪氨酸。基于对延胡索的生物碱生物合成途径和特异性的分析,初步入选的质量标志物为延胡索乙素、延胡索碱、黄连碱、巴马亭、脱氢延胡索碱、D-四氢药根碱和普鲁托品。普鲁托品和阿朴啡生物碱为生物合成下游产物,具有更理想的特异性,而从含量上讲,原小檗碱(如延胡索乙素和延胡索碱)是主要成分。针对延胡索乙素提取物进行的体内和体外药理研究证实,通过在拉伸实验中显著延长潜伏期和对关键蛋白进行调节,延胡索乙素能够有效缓解疼痛。例如,该成分能够上调内啡肽,并降低5-羟色胺(5-HT)和降肾上腺素。网络药理学分析还预测了以延胡索乙素、巴马亭、普鲁托品和海罂粟碱作为计算的代表性成分。大多数预测的靶标和细胞信号通路被认为与中枢神经系统在不同阶段的镇痛作用有关。经证实,这些化学成分是与功效相关的生物活性成分。因此,海罂粟碱被认为是质量标志物的选项之一。通过对延胡索乙素、黄连碱、巴马亭、别隐品碱、D-海罂粟碱、普鲁托品和苦味受体TAS2R10进行同源性建模和分子对接,以及针对与辣味和苦味相关功能性受体[包括5-HT1A 受体、μ-阿片受体(OPRM1)、β2 肾上腺素受体(ADRB2)、血栓素-前列腺素受体(TP/TBXA2R)、乙酰胆碱受体(M2)和多巴胺受体(D2)]的反应亲和性研究,提供了特性相关成分的支持性证据[20]。研究认为,延胡索乙素和普鲁托品能够与这些受体共同起作用。此外,利用鼠类进行的药代动力学研究表明,在口服延胡索提取物之后,延胡索乙素、四氢药根碱、普鲁托品、紫堇鳞茎碱、α-别隐品碱、N-甲基延胡索乙素、延胡索碱、四氢小蘗碱、二氢白屈菜红碱和二氢血根碱被吸收进入实验鼠的身体循环,且其脑组织中检测到其中7种成分。四氢小蘗碱的存在归因于黄连碱,因为黄连碱可能在肠内代谢,其代谢产物以三级生物碱的形式被吸收。基于这些广泛的研究,建议将延胡索乙素、延胡索碱、黄连碱、巴马亭、脱氢延胡索碱、D-四氢药根碱和普鲁托品作为延胡索的质量标志物。针对延胡索醋制工艺中这些化学成分和指纹图谱制定了定量方法,并对其制剂(如延胡止痛滴丸)的质量控制[21]进行了扩展。
《4. 质量标志物在质量评估中的应用》
4. 质量标志物在质量评估中的应用
尽管人们不断探索中药的化学成分,以建立质量评估和控制体系,但就大多数品种而言,将化学标志物作为辨别药材真伪和判断相关制剂质量的指标是否有效尚不明确。本节以特定案例的成功经验为例,进一步讨论了基于质量标志物的质量控制和评估体系的应用所取得的进展。
丹参(Salvia miltiorrhiza)的干燥块根因其改善血液流动和促进血液循环的功效而被广泛应用于治疗心脑血管疾病[22]。已针对其主要生物活性成分进行了研究,并分为两类:亲脂丹参酮(丹参酮I、丹参酮IIA和隐丹参酮)和亲水酚酸(丹参素、丹酚酸B、原儿茶酸)。酚酸具有生物活性,如抗动脉粥样硬化、抗肺炎、抗氧化、抑制血小板聚集、改善微循环以及防止心肌损伤。此外,丹参酮能够抑制血管生成、扩张冠状动脉、增强冠状动脉血流量并防止缺血[23–25]。目前,以丹参为主要成分的药物制剂[如《中华人民共和国药典》中所列的复方丹参滴丸(CDDP)和复方丹参片(CDT)]已应用于临床用途。因此,市面上对丹参的需求量显著增加,且此类产品的市值达数百万美元以上。在商业利益的驱使下,难免出现掺假和使用劣质原材料的行为。因此,为该种药材、提取物和最终成品制定质量控制和评估体系对于保证丹参的安全性和疗效至关重要。
21世纪初,Li等[26]对中国的丹参及相关药用植物进行了大规模的田间调查,调查结果于2008年发表。该调查旨在将丹参与其他物种进行区分,以满足《中华人民共和国药典》(其中对丹参进行了记载)的官方要求。除植物鉴定外,还对丹参酮和酚酸进行了定量分析。调查发现,在当地民间医学中被视作丹参的鼠尾草有20多种,其采集地点、生长环境和分布情况均不相同。调查中采集并加工了不同植物物种的样品。结果表明,所有样品中均检测出酚酸;但除含量最高的迷迭香酸和丹酚酸B外,其余成分均为微量级。例如,丹酚酸B的含量范围从微量到82.52 mg·g–1 。丹参酮的含量水平被证明与该物种根皮的颜色有关。不同天然产物的特性归因于遗传或环境变化。值得一提的是,在各种丹参样品中,丹酚酸B的范围从30.95 mg·g–1 至55.77 mg·g–1 不等。此外,就浓度而言,丹参酮和酚酸的相关性似乎较低,这表明它们可能是两种独立变量,均应作为质量控制的标志物。根据《中华人民共和国药典》(2005年版)对丹参的定量要求,丹酚酸B和丹参酮IIA的含量应分别不低于30 mg·g–1 和2 mg·g–1 。其中几份丹参样品达到了要求,这些样品被判定为正式样品,与其他样品区分开来。
研究证明,丹参的质量与种质和收成相关[27]。采收丹参时,必须等特定的生物活性化合物的数量达到合格水平后再采收,而非在须根上长出疣状突起时采收,尽管后者是传统意义上的采收阶段,也是这种草药产量最高的时期。在相同条件下培养但在不同时期采收的3个种质根中,持续检查到隐丹参酮、丹参酮IIA、丹参素和丹酚酸B含量的变化。例如,河南紫花丹参中隐丹参酮和丹参酮IIA的含量持续下降,而丹参素和丹酚酸B的含量则先降后增,并以一种非常规的方式累积[27]。这些化学标志物含量的变化显示出最佳的采收时间,并为特定生物活性化合物含量的种质系选择提供了关键依据。
化学标志物被用作指示植物和切片等原材料质量控制的指标;此外,这些化合物还被进一步用作药物制剂质量控制的标志物,并特别关注一致性。结合色谱分离和化学计量学方法对丹参制剂进行了质量研究[28–32]。除人参皂苷Rg、人参皂苷Rb和三七皂苷R外,还选择原儿茶醛、丹酚酸B、隐丹参酮和丹参酮IIA作为复方丹参片的质量控制标志物。研究结果显示,丹酚酸B在由不同公司生产的样品中含量最高,而片剂中其他3种化合物的含量则较低。此外,测试样品中的含量也有所不同,这归因于所用原材料的质量各异[29]。同样,为了评估不同生产商生产的丹参提取物颗粒剂的质量,还检查了8种酚酸和丹参酮的含量[30]。在评估的15批颗粒剂中,丹酚酸B和迷迭香酸是含量最高的酚酸,而丹参酮I、隐丹参酮以及丹参酮IIA则是含量最高的疏水性成分。相比之下,丹酚酸B的含量变化高达30倍。最重要的是,鉴定的含量与这些颗粒剂标签上标明的含量并不一致,表明其疗效和安全性均存在潜在风险。结合HPLC指纹图谱与相似度评估,对丹参及其制剂的质量进行了研究[33]。对丹参、复方丹参滴丸、复方丹参片以及丹参注射液的色谱指纹图谱进行相似度评估。通过对比参照物确定了化学成分的峰值。丹参、复方丹参滴丸和复方丹参片等标准样品的相关系数均大于0.9,而随机样品和丹参注射液的相关值则较低、差异较大,说明其质量参差不齐。
研究人员建立了一种简单、快速的质子核磁共振( 1H NMR)技术,用于定性和定量分析复合丹参提取物和复方丹参滴丸。经证实,该技术与液相色谱方法形成良好互补[31]。使用核磁共振研究了32批复合丹参提取物。使用液相色谱同步测定和交叉测试了3种酚酸(丹参素、丹酚酸B和原儿茶醛)。两种方法测出的3种酚酸的含量并无明显差异。当使用该方法测试12批复方丹参滴丸时,测定出的酚酸含量仍表现出良好的一致性,表明其可以作为控制最终产品质量的可选方法。
随着灵敏分析方法的发展以及对中药物质基础和药理作用的深入理解,针对草药品种、提取物和制剂等方面的质量控制标准已逐步完善。在2000年版的《中华人民共和国药典》中,丹参素和丹参酮IIA分别被选作复方丹参滴丸和复方丹参片质量控制的单一标志物。而如今,已有多种成分被用作丹参及其相关制剂的质量标志物。现已将隐丹参酮、丹参酮I、丹参酮IIA和丹酚酸B同时用作丹参的组合标志物。尽管已将丹参酮IIA和丹酚酸B作为复方丹参片、复方丹参颗粒和复方丹参胶囊的质量标志物,但因2015年版《中华人民共和国药典》的配方和规格不同,而不同的加工和生产过程可能导致含量变化,因此这些标志物的具体含量的差异可能较大。总之,丹参的质量控制体系尚待进一步优化。此外,丹参中的其他化学成分也不容忽视。例如,丹参根部的迷迭香酸含量丰富,浓度范围在0.59~34.44 mg·g–1 之间,且具有多种生物活性。该成分也被提议用作可选标志物[26]。近期从丹参中分离得到了一对具有阻旋异构三聚体的咖啡酸衍生物——丹酚酸T和丹酚酸U,有效完善了丹参的现有质量控制体系,并为未来的质量控制体系的建立提供了新的思路。还报道了一种将丹酚酸用作注射剂质量标志物的实验方法。
《5. 其他质量控制方法》
5. 其他质量控制方法
在草药的鉴定中,生物测定是利用化学成分作为物种和制剂鉴定指标的重要补充手段。其中,DNA条形码在区分真假物种方面颇具前景。例如,某项大规模研究将ITS2作为潜在的DNA条形码来研究[36]。此次共研究了61种常用草药、近缘种或掺假品,共采集4000余份样品。结果令人满意,成功率高。ITS2成功将34种草药与111种掺假品区分开,并从51种草药和2382种近缘种当中分离出48种草药。目前,DNA条码技术尚处于起步阶段。但其在质量控制方面的潜力不容小觑。
另一种中草药质量控制方法为生物测定。例如,Qin等[37]试图通过毒性来区分乌头。建立了通过生物测定最小致死量来评估毒性的方法,计算并比较了毒性暴露。该研究通过优化实验条件以确保可靠性。但由于提取物的总毒性远高于通过液相色谱并行测定的3种有毒生物碱的总毒性,因此,该研究未能解释草药的总毒性。尽管研究结果并不理想,但经过进一步完善后,生物测定也有望成为中草药安全性评估的一把利器。
《6. 前景》
6. 前景
总之,中药的功效和安全性与各种多样结构化合物的化学成分密切相关。作为一种重要的治疗方法,中药的质量对于保障其治疗价值和安全性至关重要。目前,大多数草药、炮制草药产品和中药制剂的质量控制和标准均不够完善,这归咎于质量评估与功效之间的关联不充分,或所选用于质量控制的化学物质不具有整体代表性。此外,有关草药、炮制品和制剂的质量研究仍林林总总,有待整合。
对于制药行业,解决中药的质量控制问题已迫在眉睫。过去几年中,科学家通过举办高端研讨会来深入探讨研究策略和技术方法,包括国家自然科学基金委员会等在内的中央资助机构也尤其关注质量标志物概念和相关研究。计划在该新领域中开展多项重大研究项目,以资助有关质量标志物概念的科学原理的研究。最近,权威期刊《植物医学》出版了一期关于质量标志物的特刊。其中阐述了新的方法、研究模式和研究成果,并讨论了质量标志物[38]的概念,提出将生物活性,特别是将“生物响应”[39]和“通过近红外光谱进行智能质量管理”[40]纳入中药质量评估中。此外,还综述了草药成分的药代动力学研究,以阐述质量标志物的发现和鉴定[41,42]。在讨论方法的同时,还报道了采用不同方法的质量标志物研究[43–48]。这些研究包括分子连接性指数、中药效应成分指数、基于质量标志物的化学生产和控制、整合药理学和相关数据挖掘。同时,包括质谱和化学计量学在内的现代分析技术已用于确定薏苡仁[49]、人参[50–51]和制剂[51–54]的潜在质量标志物。这些研究围绕质量标志物概念开展,极大地拓展了中药质量控制的范围。
结合中药的生物学特性、生产工艺和配伍原则,科研人员提出了中药质量标志物的概念;重点研究中药的疗效、物质基础和代表性成分之间的关系,以便将中药质量研究进行整合。通过研究提出了相关概念以及重要的新颖研究模式,并重点关注整个质量控制程序中质量的可追溯性和可传递性,这些均将有利于中药质量控制体系的建立。
《致谢》
致谢
作者在此感谢国家重点研发计划(2016YFE0121400)、国家自然科学基金(81430096)、教育部长江学者创新团队项目(IRT_14R41)、澳门科学技术发展基金(006/2015/AMJ)以及天津市自然科学基金提供的资金支持。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Yazhuo Li, Ying Xie, Yufei He, Wenbin Hou, Maoliang Liao, and Changxiao Liu declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




