《1. 引言》
1. 引言
具有明显的新的分子靶标[作用位点(SOA)]的商业除草剂已经有30多年没有被使用了[1]。在此期间,进化出的独特的抗除草剂杂草的数量增加了约5倍,现在,多种恶性杂草对几种具有不同SOA的除草剂都产生了抗性[2]。控制除草剂耐药性演变风险的一种方法是,将具有不同作用方式(MOA)的几种除草剂组合使用,类似于混合药物延迟耐药性的演变。与抗生素和其他一些药物(如抗癌药)一样,我们迫切需要一种具有新 SOA的化合物用于耐药性管理。
不幸的是,由于抗草甘膦作物的巨大成功以及由此导致的除草剂市场价值下降,在20世纪90年代中期,农药化学工业减少了在除草剂发现方面的投资[1]。参与除草剂发现的公司的迅速合并[3]也导致除草剂发现方面总体投资的下降。发现具有新SOA的除草剂的迫切需求激发了人们对实现这一目标的方法的研究兴趣。过去,除草剂的发现一直依赖于通过大型化学库的合成和评估来识别具有良好除草活性的先导化合物(高通量筛选)。另一种方法是优化具有新型分子靶标的中等活性化合物的结构,以期能开发出分子靶标不变但可增强靶位点活性和可用于农业的商品。如三苯酮类除草剂,该除草剂是通过优化化感物质纤精酮(allelochemical leptospermone)的结构而得到的[4]。纤精酮和这类商业除草剂类似物可抑制二羟苯基丙酮酸双加氧酶(HPPD)的活性[5],HPPD是最新引入的除草剂SOA。许多其他具有新型分子靶标的天然植物毒素可作为发现除草剂的起始模板[6]。但是,到目前为止,还没有人通过这种方法生产出具有新SOA的商业除草剂。同样地,对与潜在除草剂靶标酶结合的小分子进行计算机模拟(生物理性设计),以及使用潜在靶标酶的体外实验来筛选大型组合化学库,也未能得到具有新作用靶位点的商业化产品。最后,使用基因敲除技术寻找通过新的作用靶位点已经识别出的潜在的新的除草剂靶标(参考文献[7]中有详细讨论),但并未找到这些靶标的有良好除草活性的分子。这种方法存在的一个问题是,敲除突变体通常会完全消除靶标酶的活性,而化学物质很少能100%抑制该酶的活性。因此,用基因敲除获得的致死表型不会转化为除草活性,而会通过化学作用部分抑制靶标的活性。为了更好地评估除草剂的SOA,我们需要一种基因敲除的校正方法。
虽然人们对发现具有新SOA的除草剂的方法有着浓厚的兴趣,但很少有论文为此类发现提供新的策略和见解。一个例外是,使用基因组学方法,从编码天然植物毒素生物合成途径的酶的基因簇中,发现植物毒素的靶标酶(如参考文献[8])。能够产生抑制初级代谢酶的毒素的微生物,通常在毒素合成的基因簇中具有抗性基因 [9]。在某些情况下,抗性基因编码了毒素靶标的突变型抗性形式。因此,研究微生物植物毒素有可能发现新的潜在除草剂及其SOA。这种方法是有前途的,但未经证实。例如,尽管通过这种方法发现了支链氨基酸合成途径酶-二羟基酸脱水酶(DHAD)的微生物产生的天然产物抑制剂(天冬氨酸),但该抑制剂是酶的弱抑制剂和弱除草剂[10]。尽管DHAD在一段时间内一直被认为是潜在的除草剂SOA(如参考文献[9]中的讨论),但目前还没有出现抑制DHAD的商业除草剂。
本文讨论了两种新的除草剂靶标识别方法。第一种是识别被抑制后引起植物毒性代谢产物积累的酶(图1),第二种是鉴定植物组织中低分子浓度的靶位点(图1)。这两种方法都可能会识别出能够响应低剂量除草剂的靶位点。从环境和毒理学的角度来看,低剂量是可取的,而且如果一个化合物分子的生产成本昂贵,低剂量的特性可以使其作为除草剂在经济上可行。
《图1》

图1. 本文讨论了两种新的用于识别除草剂靶标的潜在方法。第一种是识别被抑制后引起植物毒性代谢产物积累的酶(左),第二种是识别植物组织中低分子浓度的靶位点(右)。
《2. 初级代谢酶的毒性前体》
2. 初级代谢酶的毒性前体
大多数商业除草剂在杂草中只有一个主要的分子靶位点。在某些情况下,除草剂以同一类型酶的几种变体为靶标,如含有丝氨酸-苏氨酸蛋白磷酸酶抑制剂内毒素和抑制长链脂肪酸合成酶的除草剂。这些靶标几乎都是初级代谢的酶。非酶靶标的除草剂包括光合系统II的光合电子流抑制剂(如阿特拉津和敌草隆)、光合系统 I的能量转移剂(如百草枯和敌草快)以及与非酶蛋白 F-box蛋白结合的生长素类除草剂[如2,4-二氯苯氧基乙酸(2,4-D)],F-box蛋白可以介导信号转导和基因表达。
通过抑制酶阻断初级代谢途径通常是致命的,但是,用化学制剂完全阻断代谢途径又很困难。除阻断部分代谢途径外,植物毒性化合物的积累还应提高除草剂的药效。一些非常成功的除草剂和一些天然植物毒素发挥作用的主要原因是植物性毒性的中间代谢产物或代谢产物的衍生物的积累(图1)。最明显的例子是原卟啉原氧化酶(PPO)抑制剂(表1)[11]。PPO抑制剂类除草剂种类相对较多。PPO是一种存在于线粒体和质体(如叶绿体)中的酶,参与生产血红素和叶绿素所需的卟啉的生物合成。尽管这类抑制剂抑制了PPO,但它们会导致PPO的酶促产物原卟啉IX(PPIX)的积累。在光和分子氧存在的情况下,PPIX有剧毒,因为在这种条件下,PPIX充当一种光敏色素,并生成单线态氧,进而产生其他活性氧(ROS)。当PPO被抑制时,其前体原卟啉原IX会积累并退出卟啉途径,通过PPO以外的方式在对细胞中单线态氧和其他ROS防护相对较弱的位置上被氧化成PPIX。正常情况下,PPIX和其他卟啉途径中间体的浓度非常低,并且仅限于线粒体和质体中的卟啉途径,这些地方较好地防护了ROS,尤其是在叶绿体中。这种作用方式的优点是,致命的ROS水平可能是通过抑制植物中部分PPO的活性而产生的。最有效的PPO抑制剂是一些活性最强且施用量最低(每公顷几克)的除草剂。在致死剂量下,所有除草剂都会产生ROS,这是严重生化和生理破坏的三级作用。而ROS会进一步破坏植物的生理和生化特性。有许多文章误以为这种普遍的三级作用是初级作用。使用PPO抑制剂时,ROS的产生更接近于PPO抑制的主要产物。
乙酰乳酸合酶(ALS)抑制剂是一大类除草剂(表 1)。 ALS是支链氨基酸(缬氨酸、亮氨酸和异亮氨酸)合成途径中的第一个酶。从理论上讲,如果ALS抑制剂的作用完全取决于支链氨基酸的消耗,则该合成途径中其他两种酶的任意一种都可以作为除草剂的靶标。然而,有许多来自不同化学类别的商用抗ALS除草剂,并没有以该合成途径中其他两种酶作为靶标。酮酸还原异构酶(KARI)和DHAD(该合成途径中的第二种酶和第三种酶)的良好体外抑制剂已被发现[12–14]。但是,利用KARI和DHAD抑制剂开发商业除草剂的研究一直都没有成功。这三种酶之间的一个区别是,只有ALS底物a-酮丁酸酯(2KB)具有植物毒性。2KB可以通过转氨作用被转化为对植物有毒的2-氨基丁酸酯(2-AB),而2KB和2AB在用ALS抑制剂处理的高等植物中积累 [15]。尽管Shaner和Singh [16]认为,由于2AB与ALS抑制剂的除草作用之间没有良好的相关性,缺乏良好的相关性并不能排除它们没有参与作用的可能性。在同一篇论文中,他们表明,用高浓度缬氨酸处理玉米幼苗会抑制幼苗生长和2AB的积累。2AB的植物毒性可能导致这一生长抑制。他们的实验结果缺乏良好相关性,这可能是由于参与植物毒性的2AB库的细胞定位的混淆效应。 ALS抑制剂也会导致奎宁酸盐(一种来自莽草酸途径的植物毒素)的积累,如参考文献[17]所述。ALS如何导致奎宁酸盐的积累尚不清楚。与大多数商业除草剂相比,最好的ALS抑制剂可以在极低的剂量下有效地除草。
AAL(Alternaria alternata f. sp. lycopersici)毒素是一种天然的植物毒素,它可以在极低的剂量下起效。通过抑制神经酰胺合酶(植物中的CS或鞘氨醇N-酰基转移酶),它可以导致鞘氨醇基CS前体鞘氨醇类和4-羟基鞘氨醇迅速而高水平地积累(表1)[18]。即使在亚微摩尔浓度下,该作用也非常迅速和强烈。此外,外源供应的CS前体会引起与AAL毒素类似的植物毒性症状[19],这表明前体的积累是膜功能迅速丧失的原因,而不是由神经酰胺合成所引起的。健康植物组织中CS前体的含量非常低,但是神经酰胺及其糖基化形式是植物质膜的重要组成部分[20]。游离鞘脂碱基能够迅速破坏质膜的完整性[19],这可能是由于这些化合物对质膜完整性有直接影响,而其他机制对其有间接影响。AAL毒素和其他结构相关的CS抑制剂(如伏马菌素)对CS前体的积累也有类似的作用[21]。尽管许多人已经将诱导细胞凋亡看作AAL毒素的MOA(如参考文献[22]),但与AAL 毒素对CS前体的作用相比,这些作用显然是毒素对CS 的次级或三级作用,正如植物中与百草枯毒性相关的细胞凋亡显然是除草剂的二级作用一样[23]。在阳光充足的情况下,大量ROS的产生会迅速破坏质膜,因此百草枯导致的细胞死亡速度很快,细胞无法参与凋亡过程。
《表1》
表1 涉及有毒前体积累和(或)低浓度靶位点(SOA)的除草剂MOA
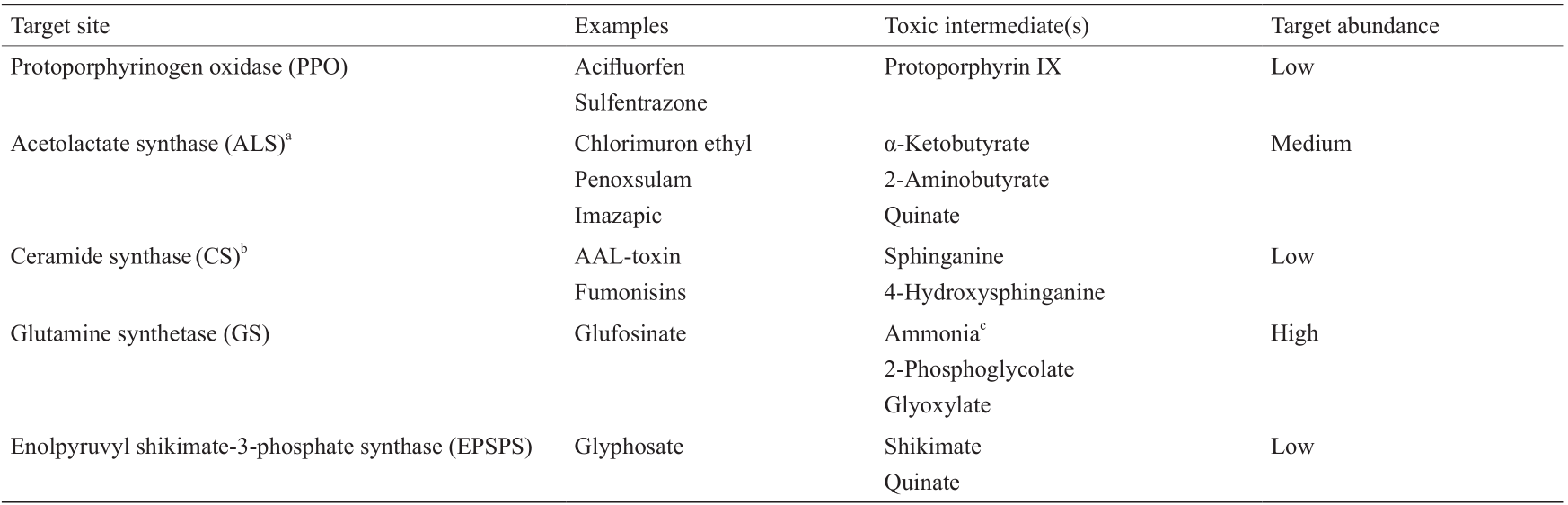
AAL: Alternaria alternata f. sp. Lycopersici.
a Also called acetohydroxy acid synthase (AHAS).
b Also called sphinganine N-acyltransferase.
c Glufosinate causes accumulation of ammonia but this may not be related to its herbicidal activity.
草铵膦(glufosinate)是一种广谱的非选择性除草剂,可使植物迅速死亡(接触活性)。草铵膦是D-和L-磷脂酰丝菌素的外消旋混合物。L-磷脂酰丝菌素是潮链霉菌(Streptomyces hygroscopus)的天然产物,该对映异构体是草铵膦的唯一活性成分。它被用于非农作物区和抗草铵膦转基因作物中的杂草管理。它可以抑制谷氨酰胺合成酶(GS)的活性,GS是一种存在于植物叶片中的高丰度酶,草铵膦在植物氮同化中起着至关重要的作用(表1)[24]。同源异构体GS1位于细胞质中,而同源异构体GS2存在于叶绿体中[25]。GS2将光呼吸产生的氨同化为谷氨酰胺[26,27]。尽管已有几种已知的GS抑制剂(大多数是由微生物产生的化合物),但草铵膦是唯一一种被开发成商业除草剂的分子[6]。
草铵膦不可逆地与GS结合,导致由光呼吸途径产生的氨积累。虽然草铵膦的作用机理与其对光呼吸途径的改变有关,但是草铵膦的毒性与氨的积累并没有直接的关系,而是与ROS迅速积累及随后的脂质过氧化相关 [28]。ROS的来源尚不清楚,但可能与用该除草剂处理过的敏感植物中观察到的碳同化抑制有关。这种抑制可能是由于光呼吸途径中某些中间体(磷酸乙醇酸、乙醇酸和乙醛酸)的积累所致。其中有一些中间体是1,5-二磷酸核酮糖羧化酶/加氧酶(又称RUBP羧化酶或Rubisco)的强抑制剂[29,30],因此可以被认为是天然植物毒素。
草甘膦(glyphosate)是世界上使用最多的除草剂[31]。它只有一种SOA,即5-烯醇丙酮莽草酸-3-磷酸(EPSPS)合酶,但是目前关于通过对EPSPS合酶的抑制来杀死植物的作用机理仍不完全清楚(表1)[32]。 EPSPS合酶是莽草酸合成途径的一种酶,该合成途径负责产生芳香氨基酸(苯丙氨酸、酪氨酸和色氨酸)。大多数植物中都含有极低水平的莽草酸-3-磷酸酯(EPSPS 的底物)和莽草酸酯(EPSPS合酶的底物),但是在用草甘膦处理过的植物中有大量莽草酸酯积累,而奎宁酸盐含量较低[莽草酸途径的中间体(3-脱氢奎宁酸酯)的另一种产物]。奎宁酸盐水解酶与莽草酸酯作用生成奎宁酸盐[33]。有趣的是,ALS抑制类除草剂(参见上文)也会导致奎宁酸盐的积累[17]。通过任何抗性机制对草甘膦产生抗性的植物,不会积累莽草酸酯,因此测量草甘膦对莽草酸酯的反应是一种检测草甘膦抗性的快速生物测定方法[34]。我们尚未发现莽草酸酯的植物毒性数据,但奎宁酸盐具有中等植物毒性,可能会引起类似ALS抑制剂和草甘膦的作用[17,35,36]。奎宁酸盐的某些作用,如对碳水化合物代谢的作用与草甘膦的作用类似[35]。因此,草甘膦的除草作用至少有一部分可能是由于高水平的奎宁酸盐。
虽然在大多数植物组织中,莽草酸酯和奎宁酸盐的含量都非常低,但是仍有少数植物种类积累了大量的莽草酸酯[如八角茴香(Illicium verum)和甜菊(Liquidamber styraciflua)] [37,38]和奎宁酸盐[如金鸡(Chinchona officianalis)] [39]。我们假设这类植物能够将这些化合物与正常生长发育所涉及的细胞分开,以避免自毒,正如许多其他会导致植物自毒作用的化合物那样[40]。
许多年前,Cornish-Brown [41]预测,由于代谢中间体的大量积累,通过非竞争性抑制作用生效的农药可能特别有效。如果中间体对靶标生物有毒,那么这种效果将被放大。草甘膦是商业上唯一已知的非竞争性(不与莽草酸酯竞争)酶抑制剂类除草剂,它会导致两种中间体的大量积累。因此,抑制合成具有植物毒性前体的酶的非竞争性酶抑制剂类除草剂可能特别有效。
次级代谢中会产生许多植物毒性代谢产物,但产生这些代谢产物的酶不太可能成为良好的除草剂靶标。原因有以下几个方面。首先,次级代谢产物毒性很大,必须将它们分隔开或排泄出去,避免自毒作用。例如,在腺毛表皮下的空间中将高植物毒性的青蒿素分隔开以远离细胞质[40,42]。液泡中有一些具有植物毒性的化合物,这些化合物不会对细胞造成伤害,如被储存在植物液泡中的具有植物毒性的芥子油苷[43]。化感物质高粱酮(allelochemical sorgoleone)的对苯二酚前体被高粱(Sorghum)的根毛分泌到土壤中,在土壤中被氧化为对植物有毒的醌高粱酮(quinone sorgoleone)[44]。这些次级化合物通常位于生物合成途径的末端,因此它们不是通过抑制酶而积累的底物。另一个问题是,能产生最具植物毒性的次生代谢产物的植物物种非常有限,其中大多数不太可能成为目标杂草。一个极端的例子是青蒿素,它仅由一种非常少量的杂草黄花蒿(Artemisia annua)产生[42]。次级化合物几乎可以被认为是初级代谢产物,因为它们在高等植物中几乎无处不在。例如,高等植物中的叔查耳酮(t-chalcone)是一种苯丙烯类化合物的前体。它是一种中度有效的植物毒素[45],因此抑制将其用作前体的酶(查尔酮异构酶)可能会导致其毒性水平上升。
另一个可能促进植物毒性中间体产生的因素是,当 SOA被抑制时,代谢途径失调。我们对这一现象知之甚少。有证据表明,抑制EPSPS合酶会导致一种或多种莽草酸途径的产物浓度降低,这些产物负责调节莽草酸途径中碳的流入[32]。抑制ALS、CS、GS和PPO也可能会发生类似的情况。如果是这样,有毒中间体是否达到致命水平与途径失调的程度息息相关。
另一个要考虑的因素是有毒中间体的体内半衰期。该化合物可能是不稳定的,或者可能被代谢转化为毒性更低或更高的化合物。后者的一个例子是莽草酸酯转化为羟基苯甲酸,如原儿茶酸和没食子酸[46]。没食子酸是一种植物毒素[47]。
这些通过抑制酶引起有毒代谢产物积累的案例,只代表了该方向的小部分思路。据我们所知,目前还没有研究对所有初级代谢产物的植物毒性进行过检验,更不用说次级代谢产物的植物毒性了。另一种方法是检查代谢组学数据,以发现那些在健康植物组织中的浓度非常低的化合物,因为进化已使植物体内的有毒的初级代谢中间体的积累最小化。然后通过测定这些化合物的植物毒性,以确定潜在的除草剂靶标酶。
《3. 靶标的低浓度》
3. 靶标的低浓度
另一种可行的除草剂靶标识别方法是检测植物中以相对较低浓度存在的靶标(图1)。相反,研究人员早就认识到,大量存在的潜在靶位点不是好的靶位点,因为为了杀死植物,需要高剂量除草剂才能抑制足够的靶标。例如,Rubisco是负责C3光合碳固定的酶。Rubisco 是植物中最丰富的蛋白质,在C3和C4植物绿叶中分别占总蛋白质含量的50%和30% [48]。由于其含量丰富,甚至有人提出将其作为绿叶中膳食蛋白质的来源[49]。目前既有Rubisco的天然抑制剂也有合成抑制剂,如2- 羧基阿拉伯糖醇-1-磷酸(Rubisco中间体的天然过渡态中间体)[50]和碘乙酰醇(一种合成化合物[51]),但是要抑制足够的Rubisco并杀死杂草,需要大量施用除草剂。因此,这不是参与除草剂发现工作的研究人员所感兴趣的靶位点。
通过基因扩增靶标(EPSPS)而造成草甘膦抗性进化的案例证明,除草剂靶位点的数量对除草剂是否可行至关重要。草甘膦是一种使用率很高的除草剂,在许多情况下需要约1 kg·hm−2才能有效地杀死大多数目标杂草。草甘膦作为地球上使用最广泛的除草剂[31],产生抗药性的选择压力是巨大的。已有47种杂草在刚刚过去的20年中产生了抗药性,这一现象大约开始于草甘膦商品化的25年后[2]。植物进化出了多种抗药性机制 [52,53],但是最常见的机制之一是EPSPS基因的扩增,这导致杂草中EPSPS合酶的浓度更高,因此需要更高剂量的草甘膦才能抑制足够的EPSPS合酶,从而致命性地阻断莽草酸途径[54]。在抗草甘膦长芒苋(Amaranthus palmeri)中,EPSPS基因的拷贝增加了90倍,导致 EPSPS蛋白质的量增加了12倍[54],该数量导致所需草甘膦的量增加了约6~8倍,这种剂量既不经济也不环保 [54]。自第一例基因扩增以来,在阔叶植物和草类植物中已经发现这种抗草甘膦的机制(如参考文献[54–59])。如果杂草中的EPSPS水平通常与那些进化基因扩增的除草剂目标基因的一样高,那么草甘膦永远不会被开发为除草剂,因为每公顷至少需要10 kg除草剂,该剂量在经济和环境上都是不可行的。如果它是一种低使用率的除草剂,情况可能并非如此。研究人员已经发现,基因扩增也是抗乙酰辅酶A羧化酶抑制剂类除草剂的一种机制[60]。大多数抗除草剂的抗性机制,以及某些物种对某些除草剂具有天然抗性的抗性机制均尚未被查明,因此我们无法完全了解酶的丰度在许多进化抗性和自然耐受情况下的重要程度。
同样,对于植物中每一种主要生化途径的酶的蛋白质含量(无论是绝对含量还是相对含量),也几乎没有相关的信息。这个含量代表了潜在的除草剂结合位点的数量,与草甘膦一样,它会影响除草剂的浓度,除草剂必须到达这些酶的亚细胞位点才能对植物产生致命作用。蛋白质组学在过去的20年中取得了巨大进展,其在比较蛋白质组学、蛋白质的亚细胞定位、蛋白质功能、翻译后修饰等方面提供了大量信息,但是,即使是拟南芥(Arabidopsis thaliana),我们也尚未确定其初级代谢物所涉及的所有酶中每种蛋白质的实际相对浓度。但是,仍有一些方法可以识别植物细胞中低丰度的蛋白质,最低可以测量2.25 fmol·mg−1的叶片鲜重的丰度(如参考文献[61])。低丰度酶比高丰度酶更有可能成为更好的潜在除草剂靶位点。
《4. 最后的几个观点》
4. 最后的几个观点
对于这两种可能的方法,我们有一些注意事项要说明,这些注意事项与库的大小或浓度不能反映库的周转率这一事实有关。对于利用有毒代谢产物的方法,当互补的SOA被抑制时,较高的库周转率意味着化合物更快的积累,从而促进除草剂生效。对于以酶为SOA的方法,较高的周转率可能会降低除草剂对其作用靶位点的功效,因为随着单位时间内酶的数量的增加,除草剂与靶标相互作用的可能性会增加。如果除草剂是不可逆的结合剂,并且酶的降解不会释放未改变的除草剂,这将更为重要。被抑制的酶和(或)与该酶结合的除草剂的去向会影响酶代谢库通量速率对除草剂功效的作用。研究人员必须牢记这些注意事项。
为了尽快开发出新SOA的商业除草剂,我们有必要使用所有可能的发现方法以最大程度地提高成功的可能性。本文,我们提出了两种概念简单的策略。代谢组学可被用于识别可能具有毒性前体的靶标,或如果在体内蓄积可能会转化为毒素的前体。蛋白质组学可被用于鉴定低丰度的酶靶标。理想情况下,寻求被抑制时会产生植物毒素的低丰度SOA是最好的,如PPO(表1)。然而,情况并非总是如此,草铵膦的靶标GS(叶片中第二大富集酶)即是例子。我们所讨论的两种方法可能已被除草剂开发公司使用过,但目前我们还没有发现这样的公开记录。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Franck E. Dayan and Stephen O. Duke declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




