《1. 引言》
1. 引言
医疗干预措施的有效性和安全性评价主要基于相关结局指标的测量和数据分析。然而国内外研究发现,临床研究采用的评价指标普遍存在不一致、不规范、不合理、不重要等问题,影响了研究结果的科学性和实用性,导致研究浪费[1–3]。为了解决上述问题,循证医学和临床研究方法学专家们提出了研制核心指标集(core outcome set, COS)的应对策略。COS是指健康或卫生保健等特定领域中所有临床研究都必须测量和报告的最少的、最重要的指标集合[4],旨在规范临床研究结局指标,提高研究结果的实用性、可比性和透明度[4]。 2010年,有效性试验核心指标(core outcome measures in effectiveness trials, COMET)协作网成立,通过制定 COS的方法学指南,致力于促进COS研究的质量。目前已发布了《有效性试验核心指标(COMET)手册》(1.0版) [5]、核心指标集的研制规范(Core Outcome Set-STAndards for Development, COS-STAD)[6]、核心指标集的报告规范(Core Outcome Set-STAndards for Reporting, COS-STAR)[7]和核心指标集研究方案报告条目(Core Outcome Set-STAndards Protocol Items,COS-STAP)[8] 等一系列研究技术指南。
自从新型冠状病毒肺炎(Coronavirus Disease 2019, COVID-19)疫情暴发以来,已有数百个临床试验方案完成注册,且部分临床试验已经开始实施招募患者。截至2020年2月20日,在www.chictr.org.cn和clinicaltrials. gov平台已有228个COVID-19临床试验完成注册。然而,这些已经注册的临床试验方案,尤其是方案中涉及的结局指标尚存在一些不足,如大部分的结局指标名称使用不规范,类似研究间结局指标的同质性差、缺乏临床重要性、指标的测量时点不清等。因此,需要构建 COVID-19临床试验核心结局指标集(COS-COVID),这也是本项研究的目的。
我们鼓励研究者在COVID-19的临床试验中应用 COS-COVID评价不同干预措施(包括药物或非药物干预措施)的疗效。COS-COVID根据COVID-19病情分类,从轻型、普通型、重型、危重型、康复期5个层次分别遴选核心指标。COS-COVID不仅适用于临床试验,也适用于系统评价/Meta分析、临床实践指南和其他关于COVID-19证据评价和临床决策的研究。
《2. 研究方法》
2. 研究方法
本研究按照COMET手册及COS-STAD执行,研究报告格式参照COS-STAR声明中的条目清单,以保证研究与报告过程的透明度及完整性。研究计划已在 COMET网站(comet-initiative.org)与中国核心指标集研究中心网站(chicos.org.cn)发布。
《2.1. 成立工作组》
2.1. 成立工作组
为了保证COS-COVID研究实施的质量和效率,课题组前期成立了一个包含不同利益相关群体的指导小组,小组成员包括西医学、中医学、循证医学、临床药理学、统计学领域专家和医学杂志编辑,共20名。专家的选择考虑了相关专业、认知度和地域代表性等,其中临床专家代表均为具有COVID-19诊治经验的呼吸及危重医学专家。各利益相关群体的代表专家均参与了 COS-COVID研究方案设计到共识会议的全过程。此外,本研究还成立了协调小组,负责研究过程的协调和数据分析。
《2.2. 信息来源》
2.2. 信息来源
计算机检索2019年12月1日至2020年2月12日在 www.chictr.org.cn和clinicaltrials.gov临床试验平台中已完成注册的COVID-19临床试验方案。纳入评价不同干预措施治疗COVID-19确诊患者的临床随机对照试验或非随机对照试验、病例系列研究及队列研究。排除疑似患者的研究、诊断性试验和中医证候学调查研究。由两名评价员严格按照纳入与排除标准筛选检索得到的试验方案。采用预先设计的Excel表格提取数据,包括研究设计类型、干预措施、研究对象、评价指标等内容。其中指标信息涉及指标名称、测量方法、测量时点及数据类型。若有分歧则讨论解决。
将提取的指标信息进行相似性排序,去除重复的指标,对不规范表述的指标进行标准化处理,对同义指标进行合并。该过程由两名研究者独立进行,如有分歧则讨论解决。
将纳入的指标归类为临床症状、理化检查、病原学检测、生活质量、重大事件、疾病转归和安全性指标共 7个指标域。专家组首先对每个指标域的指标进行投票决定是否纳入,75%以上参与投票的专家认为不进入初始清单的指标将被剔除,保留下来的指标经过专家组讨论后形成COS-COVID初始指标清单。根据COVID-19 病情分类,初始指标清单涵盖了COVID-19轻型、普通型、重型、危重型和康复期5个疾病分型。
《2.3. 共识过程》
2.3. 共识过程
本研究共进行两轮Delphi共识。每轮Delphi调查反馈数据统计后,均进行专家会议对结果进行讨论,确认是否有需要增加或剔除的指标。
2.3.1. 确定利益相关群体
为了保证共识过程的效率和质量,本研究邀请了呼吸、重症、中医、循证医学、医学管理和期刊编辑等领域代表参加Delphi调查。考虑到地域的均衡性,参与调查的专家主要来自中国武汉、天津、北京、江苏、广东、上海、河南、四川以及意大利、韩国、英国和美国。所有参与者均知情并同意参与本调查。
2.3.2. 问卷过程
采用电子调查问卷形式,通过定点发放问卷进行 Delphi调查。调查问卷主要包括两项内容:①对每个指标进行重要性评分;②推荐需要增加的指标。每一轮调查信息反馈后,均需要召开专家组电话会议,对反馈信息进行讨论,确定是否增加、删除或合并指标。由于研究时间紧迫,将要求参与问卷调查的专家在24 h内反馈信息。
2.3.3. 评分机制
应用Likert 9分量表,对指标的重要性进行评分。每一个指标分值设置为1~9分,其中1~3分为“不重要”,4~6分为“重要但不关键”,7~9分为“关键”。每轮Delphi结束后立即进行数据分析,根据指标的“重要性”排序,保留75%以上专家一致认为的“关键”评分(7~9分)指标。此外,专家建议补充的指标经指导小组讨论后确定是否进入第二轮Delphi调查。
2.3.4. 共识会议
研究邀请完成两轮Delphi调查的各利益群体优秀代表、临床资深专家代表和指导小组成员参加共识会议。如果某个指标取得了至少75%投票的“关键”评分(7~9 分)支持,则认为达成共识,该指标将被推荐到最终的 COS [5]。
鉴于研究正处于COVID-19流行的特殊时期,共识会议以电话会议的形式代替现场会议。共识会议主要包括以下5项议程:①报告COS-COVID的研究方法;②报告两轮Delphi调查的结果;③提出需要讨论的重点内容;④参会者对候选核心指标进行充分讨论;⑤在讨论基础上对指标进行投票表决,再经讨论达成共识,形成 COS-COVID。
《3. 结果》
3. 结果
检索共获得COVID-19临床试验注册方案107项,其中ChiCTR注册平台84项,Clinicaltrials.gov注册平台23 项。通过浏览,78项研究符合纳入排除标准,其中52 项研究的干预措施为化学、生物药等,其余26项研究采用中药及中西结合疗法。
《3.1. 指标池》
3.1. 指标池
对纳入方案中涉及的结局指标进行整理合并,得到 259个结局指标,共计使用596次。在保证原意不变的情况下对指标名称进行标化和归类,得到132个结局指标,归属7个指标域。COVID-19临床试验指标池详见表1。
《表1》
表1 COVID-19临床试验方案采用的结局指标

TTCI (time to clinical improvement):临床改善时间;CT (computed tomography):电子计算机断层扫描;MRI (magnetic resonance imaging):磁共振成像;SF-36 (the medical outcome study 36-item short-form health survey):健康调查简表;MODS (multiple organ dysfunction syndrome):多器官功能障碍; ARDS (acute respiratory distress syndrome):急性呼吸窘迫综合征;DIC (disseminated intravascular coagulation):弥漫性血管内凝血;ICU (intensive care unit):重症加强护理病房;ECMO (extracorporeal membrane oxygenation):体外肺膜氧合;APACHE (acute physiology and chronic health evaluation):急性生理与慢性健康评分;CURB-65 (confusion, uremia, respiratory rate, blood pressure, age≥65 years):英国胸科协会改良肺炎评分;NEWS (national early warning score):英国国家早期预警评分;SOFA (sequential organ failure assessment):序贯器官衰竭评分;HRCT (high resolution CT):高分辨率CT;PSI (pneumonia severity index):肺炎严重指数。
由于指标清单过长,为了提高Delphi调查效率和质量,5名指导小组的专家组对指标池中的指标是否保留进行讨论和投票,最终达成共识,保留58个指标,并根据COVID-19轻型、普通型、重型、危重型和和康复期进行归类,形成了用于第一轮Delphi调查的初始指标清单[9]。其中轻型包括17个指标、普通型包括33个指标、重型包括35个指标、危重型包括22个指标、康复期包括6个指标。初始指标清单详见表2。
《表2》
表2 第一轮Delphi调查结局指标清单

《3.2. Delphi 调查》
3.2. Delphi 调查
研究邀请了60名专家参与第一轮Delphi调查,最终成功收回52份问卷,失访率为13.3%。根据专家独立投票结果和共识标准,得到10个轻型关键指标、25个普通型关键指标、34个重型关键指标、22个危重型关键指标、5个康复期关键指标。此外,专家建议在COVID-19 不同分型中增加体重指数(body mass index, BMI)、血常规、动脉血气分析、腹泻B型钠尿肽(B-type natriuretic peptide, BNP)、心肌梗死指标、重症加强护理病房(intensive care unit, ICU)住院时间和免疫功能等指标。根据投票结果和专家反馈意见,指导小组召开会议对进入第二轮Delphi调查的指标进行讨论。为提高指标的集中度,对相同指标的不同表达方式再次进行合并调整。最终进入第二轮Delphi调查的指标包括:5个轻型指标、 15个普通型指标、20个重型指标、15个危重型指标、5 个康复期指标。详见表3。
《表3》
表3 第二轮Delphi调查结局指标清单
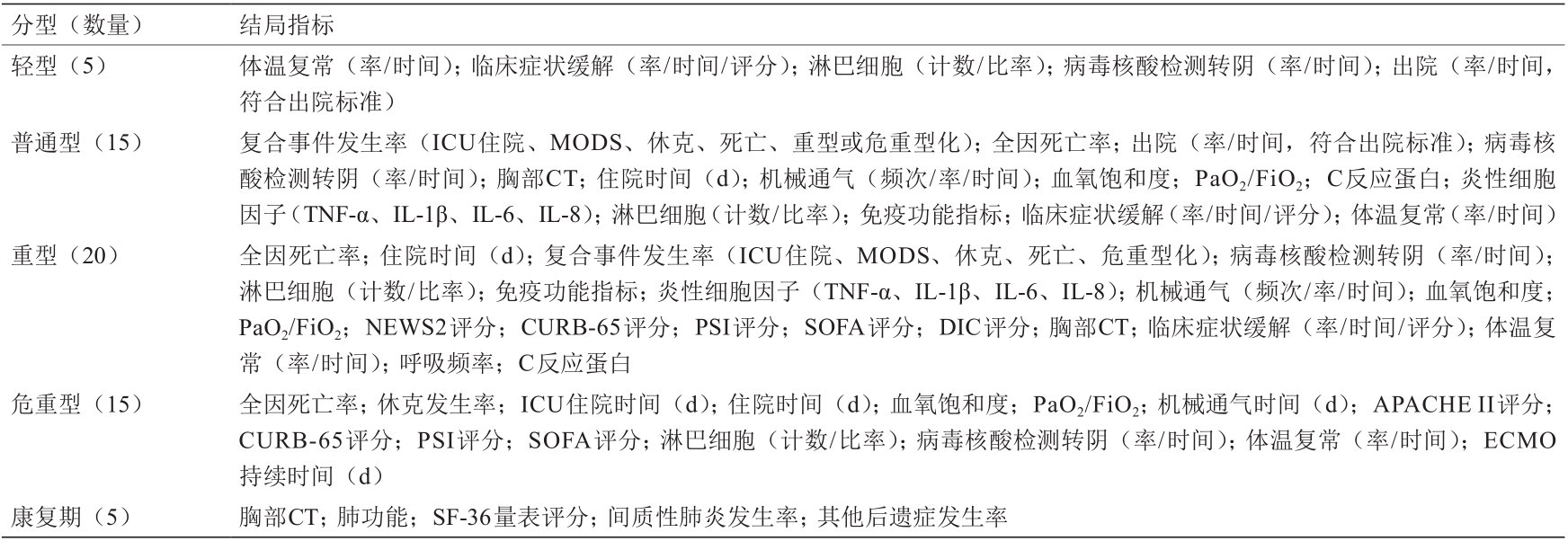
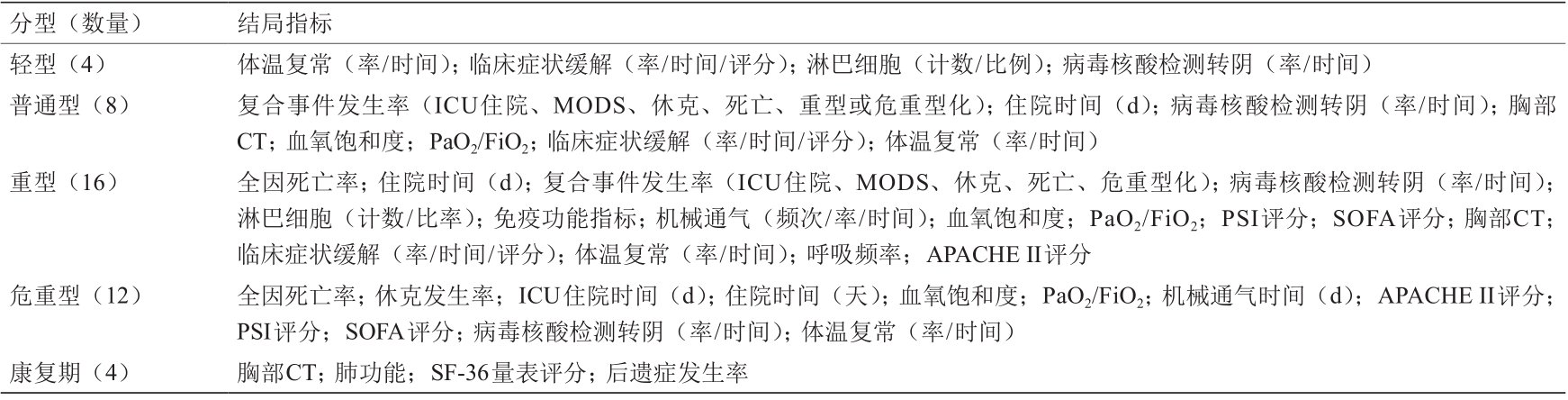
第二轮Delphi调查邀请22名专家参与,其中大部分的专家为参与COVID-19抗疫一线的临床专家。24 h内共收回20份问卷,失访率为9.1%。通过对结果进行统计,专家建议在以上共识指标中增加胸部CT、呼吸频率、血气分析、APACHE II评分、乳酸和心理测试指标。基于第二轮Delphi调查结果,指导小组召开电话会议,讨论并确认最终进入共识会议的候选指标。经讨论,指导小组专家一致同意重型中增加急性生理功能和慢性健康状况评分系统(acute physiology and chronic health evaluation, APACHE)II评分,危重型中剔除CRUB-65评分、体外膜氧合(extracorporeal membrane oxygenation, ECMO)持续时间,将其他后遗症发生率和间质性肺炎发生率合并为后遗症发生率。最终形成的共识会议指标清单包括:4个指标轻型、8个指标普通型、16个指标重型、12个危重型指标、4个康复期指标。详见表4。
《表4》
表4 共识会议结局指标清单
《3.3. 共识会议》
3.3. 共识会议
共识会议于2020年2月24日举行,共邀请20名各领域专家代表参与,包括呼吸及重症医学专家、中医药专家、循证医学专家、临床药理学家、统计学家、医学期刊编辑和临床决策者。参加共识会议的各利益代表群体无利益冲突。共识会议首先由课题组进行两轮Delphi调查结果的汇报,再由与会专家逐个对每个指标进行讨论共识。
结合Delphi调查结果,会议专家依据COVID-19不同分期的临床表现和疾病转归情况,从指标临床重要性、临床可行性以及指标稳定性等方面进行讨论,并匿名投票表决,符合共识的指标将被列入COS-COVID。最终确立的COS-COVID包括:1个轻型核心指标(病毒核酸检测转阴时间),4个普通型核心指标(住院时间、复合事件发生率、临床症状积分和病毒核酸检测转阴时间),5个重型核心指标[复合事件发生率、住院时间、动脉血氧分压(PaO2)/吸氧浓度(FiO2)、机械通气时间和病毒核酸检测转阴时间],1个危重型核心指标(全因死亡率),1个康复期核心指标(肺功能)。详见表5。
《表5》
表5 COVID-19临床试验核心结局指标集(COS-COVID)

a 病毒核酸检测转阴:连续两次痰、鼻咽拭子等呼吸道标本核酸检测阴性(采样时间至少间隔24 h)。
b 出院标准:①体温恢复正常3 d以上;②呼吸道症状明显好转;③肺部影像学显示急性渗出性病变明显改善;④连续两次痰、鼻咽拭子等呼吸道标本核酸检测阴性(采样时间至少间隔24 h)。
c 重型(符合下列任何一条):①出现气促,RR≥30次·min−1;②静息状态下,指氧饱和度<93%;③PaO2/FiO2≤300 mmHg(1 mmHg = 0.133 kPa);④肺部影像学显示24~48 h内病灶明显进展大于50%者按重型管理。
d 临床症状积分:对发热、咳嗽、乏力、气短、腹泻、体痛等6种常见且重要的临床症状进行总分,每一项评分为0分(无)、1分(轻度)、2分(中度)、 3分(显著性)。
《4. 讨论》
4. 讨论
本研究虽是在特殊的环境和要求下完成的一个快速的COS研究,但全程严格参照COS-STAD和COS-STAR 规范进行实施与报告。本COS-COVID具有及时性和临床重要性。希望COVID-19相关临床研究和证据转化研究在方案设计和临床决策时积极采用COS-COVID。对于合理使用COS-COVID,有3点需要说明:①COS是每个临床研究均应该报告的最小的指标集合,但具体的研究根据研究目的不同,可以加设必要的评价指标;②COS不等于主要疗效指标,不同的研究根据其主要研究目的,可选择某个或几个COS指标作为主要疗效指标;③COS没有限制干预的疗程和测量时点,但不同研究需在科学性和可行性基础上明确其干预疗程, COVID-19疗程建议为两周及以上。此外,由于不同的药物可能产生的不良反应不同,因此COS-COVID未涉及安全性指标。但是,我们建议研究者报告临床试验中发现的所有的不良事件。
本研究仍存在一定局限性:①本研究指标池中的指标仅来源于两个临床试验注册库,未邀请临床医生和患者补充相关指标,因此可能存在潜在的重要指标缺失的情况;②由于研究正处新发传染病的流行时期,未邀请患者参与Delphi调查和共识过程,故病人的意见可能未得到充分反映;③不同利益群体代表数量可能不足,调查专家主要来自中国,地域代表性有一定欠缺;④共识会议以电话会议代替面对面的现场会议,讨论和投票环节受到一定的限制;⑤目前我们对于COVID-19转归的认识还不全面,因此相关评价指标及COS需要在实践中不断更新完善。此外,我们希望加强与国际相关学术组织交流,推动COS-COVID的应用与更新。
《致谢》
致谢
谨对奋战在抗疫一线期间协助本研究问卷调查的医务工作者表示诚挚的感谢。本研究得到科技部国家应急项目(中西医结合防治新冠病毒感染的肺炎的临床研究, 2020yfc0841600)资助。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Xinyao Jin, Bo Pang, Junhua Zhang, Qingquan Liu, Zhongqi Yang, Jihong Feng, Xuezheng Liu, Lei Zhang, Baohe Wang, Yuhong Huang, Alice Josephine Fauci, Yuling Ma, Myeong Soo Lee, Wei’an Yuan, Yanming Xie, Jianyuan Tang, Rui Gao, Liang Du, Shuo Zhang, Hanmei Qi, Yu Sun, Wenke Zheng, Fengwen Yang, Huizi Chua, Keyi Wang, Yi Ou, Ming Huang, Yan Zhu, Jiajie Yu, Jinhui Tian, Min Zhao, Jingqing Hu, Chen Yao, Youping Li, and Boli Zhang declare that they have no conflict of interest or financial conflicts to disclose.














 京公网安备 11010502051620号
京公网安备 11010502051620号




