《1. 引言》
1. 引言
新冠病毒肺炎(COVID-19)是一种具有高度传染性的疾病。国际病毒分类委员会冠状病毒研究小组已将其病原体命名为严重急性呼吸综合征冠状病毒2(SARSCoV-2)。COVID-19最常见的临床表现为肺炎。
H7N9是一种引起肺部损害的病毒性传染病。先前的研究发现,H7N9患者的肠道菌群失调,尤其是重型和危重型患者[1]。Qin等[2]分析了26例H7N9患者的肠道菌群组成,结果显示,在门水平上,患者拟杆菌门丰度减少,而变形菌门丰度增加;在属水平上,H7N9患者的直肠真杆菌(Eubacterium rectale)和双歧杆菌(Bifidobacterium)丰度显著减少,而沙门氏菌(Salmonella)和肠球菌(Enterococcus, Ec)的丰度增加。有益肠道菌可调节免疫功能[3]。一项针对重症监护病房(ICU)患者的前瞻性研究显示,使用益生菌可降低全身炎症,从而使血清白细胞介素-6(IL-6)水平降低[4]。肠道微生物菌群失衡似乎与人体炎症反应有关,肠道微生物组分的变化与胃肠道细菌易位引起的继发感染相关[5]。细菌易位是多器官功能障碍综合征(MODS)的重要病因 [6,7]。临床研究表明,肠道细菌受缺氧、缺血和危重型患者抗生素使用的影响。肠道微生态制剂有助于预防感染、脓毒症和MODS的发生[8]。
COVID-19疾病由急性呼吸道病毒感染引起,在重型和危重型病例中引起细胞因子风暴。重型患者血清IL-6水平显著升高[9]。急性呼吸窘迫综合征是 COVID-19中最常见的器官功能障碍[10]。根据肠道菌群的丰度和临床意义,我们采用定量聚合酶链反应(q-PCR)检测了患者的10种肠道优势菌群,包括益生菌[乳酸杆菌(Lactobacillus)和双歧杆菌]、条件致病菌[肠球菌、肠杆菌科细菌(Enterobacteriaceae, E)和奇异菌(Atopobium)]和其他共生细菌[普拉梭菌(Faecalibacterium prausnitzii)、酪酸梭菌(Clostridium butyricum)、柔嫩梭菌(Clostridium leptum)、直肠真杆菌和拟杆菌(Bacteroides)],并探讨它们与COVID-19严重程度的关系。
《2. 材料与方法》
2. 材料与方法
《2.1. 研究设计》
2.1. 研究设计
对57例COVID-19确诊患者的新鲜粪便标本中的10 种优势肠道菌群进行检测。根据中国《新型冠状病毒肺炎诊疗方案(试行第七版)》[11],将所有患者分为普通型、重型及危重型三组。
普通型患者,即具有发热、呼吸道症状,影像学可见肺炎表现。重型患者,即符合下述任何一条者:呼吸频率≥ 30次·min–1;静息状态下氧饱和度≤ 93%;动脉血氧分压(PaO2)/吸入氧比例(FiO2)≤ 300 mmHg(注: 1 mmHg = 133.3 Pa);肺部影像学显示24~48 h内病灶明显进展>50%。危重型患者,即符合以下情况之一者:出现呼吸衰竭且需要机械通气;出现休克;合并其他器官功能衰竭需ICU监护治疗[11]。所有临床数据,包括生化和免疫学指标均从电子病历中收集,并列于表1。
《表1》
表1 普通型、重型和危重型人群中57例COVID-19合并肺炎患者的实验室检查结果


Significant differences among general, severe, and critical groups are indicated by asterisks (*: P <0.05,**P< 0.01,***P< 0.001).
IQR: interquartile range; WBC: white blood cell; CRP: C–reactive protein; PCT: procalcitonin; ALT: alanine aminotransferase; AST: aspartate aminotransferase; ALB: albumin; CK: creatine kinase; LDH: lactate dehydrogenase.
《2.2. 应用 q-PCR 检测肠道优势菌群》
2.2. 应用 q-PCR 检测肠道优势菌群
所用引物见附录A中的表S1。所有的寡核苷酸引物均由南京金斯瑞生物科技有限公司合成。实验使用 ViiATM 7实时荧光PCR系统(应用生物系统,美国)进行q-PCR。扩增反应包含10 μL的SYBRTM q-PCR预混液(由绍兴同创医疗器械有限公司提供)、8 μL引物(0.2~0.6 μmol·L‒1)、2 μL模板DNA或2 μL水(阴性对照),最终体积为20 μL。每个反应重复3次,重复之间的循环阈值(ΔCt)< 0.5。反应程序设置如下:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火延伸30 s,采集荧光信号,共40个循环。标准曲线的模板为梯度稀释的已知浓度的质粒,使用与目的菌相同的引物扩增得到标准曲线。
《2.3. 统计分析》
2.3. 统计分析
应用SPSS 22.0和GraphPad 8.0对所有数据进行统计分析。正态分布数据用均值和标准差表示,而非正态分布数据用中位数和四分位数范围(IQR)表示。采用单因素方差分析(ANOVA)对临床资料的组间差异进行分析。非正态分布的数据使用曼-惠特尼(MannWhitney)U检验或克鲁斯卡尔-沃利斯(Kraskal-Wallis)检验进行分析。采用卡方(χ2 )检验比较分类数据。利用皮尔逊相关分析建立微生物与实验结果之间的相关性。构造受试者工作特性(ROC)曲线以确定最佳截止值。曲线下面积(AUC)用于评估菌群对疾病严重程度的诊断价值。P < 0.05表示差异有统计学意义。
《2.4. 伦理》
2.4. 伦理
本研究得到武汉大学人民医院临床研究伦理委员会(WDRY2020-K153)的批准。研究内容遵守1975年《赫尔辛基宣言》[12]中规定的伦理标准。
《3. 结果》
3. 结果
《3.1. 人口统计学和临床特征》
3.1. 人口统计学和临床特征
根据中国《新型冠状病毒肺炎诊疗方案(试行第七版)》[11],所有COVID-19患者被分为普通型、重型和危重型三组。在研究人群中检测10种主要肠道菌群。 20 例患者为普通型,中位年龄为59岁(IQR, 53~63),男女比例为2∶3(表1)。19例患者为重型,中位年龄为66岁(IQR, 61~74),男女比例为9∶10。18例患者为危重型,中位年龄为68岁(IQR, 55~70),男女比例为2∶1。重型和危重型患者的中位年龄高于普通型。三组患者的性别比例无显著差异。三组患者从入院到肠道菌群检测送检的时间分别为20 d、23 d和22 d,三组间无显著差异。三组患者存在一种以上慢性疾病(包括高血压、糖尿病、肝病和肾脏疾病)的比例分别为 50.0%、63.2%和77.8%。其中存在高血压的比例分别为 35%(7 例)、42.1%(8例)、66.7%(12例),三组间存在显著差异且呈递增趋势(P < 0.05)。肝肾疾病发生率无显著差异,可能是样本量受限。
3.1.1. 实验室检查结果
三组患者的白细胞计数(WBC)存在显著差异(P < 0.05)。危重型组患者的白细胞计数高于普通型组(P < 0.05),但普通型组与重型组之间无显著差异。三组患者的中性粒细胞比例、淋巴细胞比例和单核细胞比例存在显著差异(P < 0.05)。在C反应蛋白(CRP)、降钙素原(PCT)、IL-6方面,普通型组与重型组相比无明显差异,而危重型组明显高于重型组(P < 0.05)。危重型组患者与重型组患者在D-二聚体、肌红蛋白和乳酸脱氢酶(LDH)水平上存在显著差异(P < 0.05),而普通型组与重型组患者之间无明显差异。丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、肌酐(Cr)水平在三组患者之间无明显差异。危重型患者的血清白蛋白(ALB)水平明显降低。
3.1.2. 治疗与结局
共有50.9%、5.3%和12.3%的患者分别接受了抗生素、抗真菌药物和益生菌治疗。危重型患者使用抗生素和抗真菌药物更为普遍,而益生菌不常使用。在给予益生菌治疗的患者中,普通型有1例(5%)、重型4例(21.1%)、危重型2例(11.1%)。18例危重型患者中死亡8例(44.4%)。
《3.2. COVID-19 患者肠道菌群组成的变化》
3.2. COVID-19 患者肠道菌群组成的变化
COVID-19患者的益生菌,如乳酸杆菌和双歧杆菌,以及抑炎菌,如普拉梭菌、酪酸梭菌、柔嫩梭菌和直肠真杆菌的丰度在减少。条件致病菌肠球菌丰度在增加,而肠杆菌的丰度在减少。奇异菌的丰度无显著变化。拟杆菌的丰度在三组患者间无明显差异,下降比例分别为 55%、47.4%和61.1%。
常用对数(lg)用于计算细菌数量,即每克粪便细菌的拷贝数(图 1)。益生菌和抑炎菌丰度在三组间的差异显著。随着疾病严重程度的增加,有益菌的丰度在减少。Ec/E值的计算公式为lg(1000×Ec/E),细菌计量方式为lg,并根据既往研究健康人群的Ec/E值,用1∶1000 修正。这一比值在危重型患者中显著增加。
《图1》

图1. COVID-19患者有组间统计学差异的优势菌属变化。(a)乳酸杆菌:普通型组丰度的中位值为1.8 × 104 ,重型组为1.8 × 104 ,危重型组为200 ,正常值参考范围为1.0 × 106 ~9.0 × 108 ;(b)双歧杆菌:普通型组丰度的中位值为5.7 × 106 ,重型组为4.4 × 106 ,危重型组为1.4 × 104 ,正常值参考范围为1.0 × 105 ~9.0 × 108 ;(c)普拉梭菌:普通型组丰度的中位值为5.0 × 106 ,重型组为1.6 × 105 ,危重型组为1.7 × 104 ,正常值参考范围为1.0 × 106 ~9.0 × 109 ;(d)丁酸梭菌:普通型组丰度的中位值为1.6 × 105 ,重型组为1.9 × 105 ,危重型组为310,正常值参考范围为1.0 × 105 ~9.0 × 108 ;(e)柔嫩梭菌:普通型组丰度的中位值为4.3 × 106 ,重型组为6.4 × 105 ,危重型组为1.4 × 104 ,正常值参考范围为1.0 × 106 ~9.0 × 108 ;(f)直肠真杆菌:普通型组丰度的中位值为1.8 × 104 ,重型组为8.2 × 104 ,危重型组为49,正常值参考范围为1.0 × 105 ~9.0 × 106 ;(g)肠杆菌:普通型组丰度的中位值为1.1 × 104 ,重型组为8.6 × 104 ,危重型组为2.4 × 102 ,正常值参考范围为1.0 × 105 ~9.0 × 106 ;(h)奇异菌:普通型组丰度的中位值为6.9 × 106 ,重型组为4.3 × 106 ,危重型组为2.2 × 104 ,正常值参考范围为1.0 × 103 ~9.0 × 106 ;(i)Ec/E值:普通型、重型和危重型组的中位值分别为0.4、 0.7和3.3。用单因素方差分析进行统计分析,图中的值用平均值±标准差表示。*:P < 0.05、**:P < 0.01、***:P < 0.001。Lg(copies·g−1):每克粪便细菌拷贝数的lg值。
《3.3. COVID-19 细菌丰度与临床指标相关性的研究》
3.3. COVID-19 细菌丰度与临床指标相关性的研究
在10种优势菌群和COVID-19的临床指标之间进行皮尔逊相关分析,评估肠道微生物的临床价值(图2)。产丁酸菌(BPB)与炎症标志物(CRP、WBC、淋巴细胞比例、中性粒细胞比例、IL-6)呈显著正相关。
《图2》
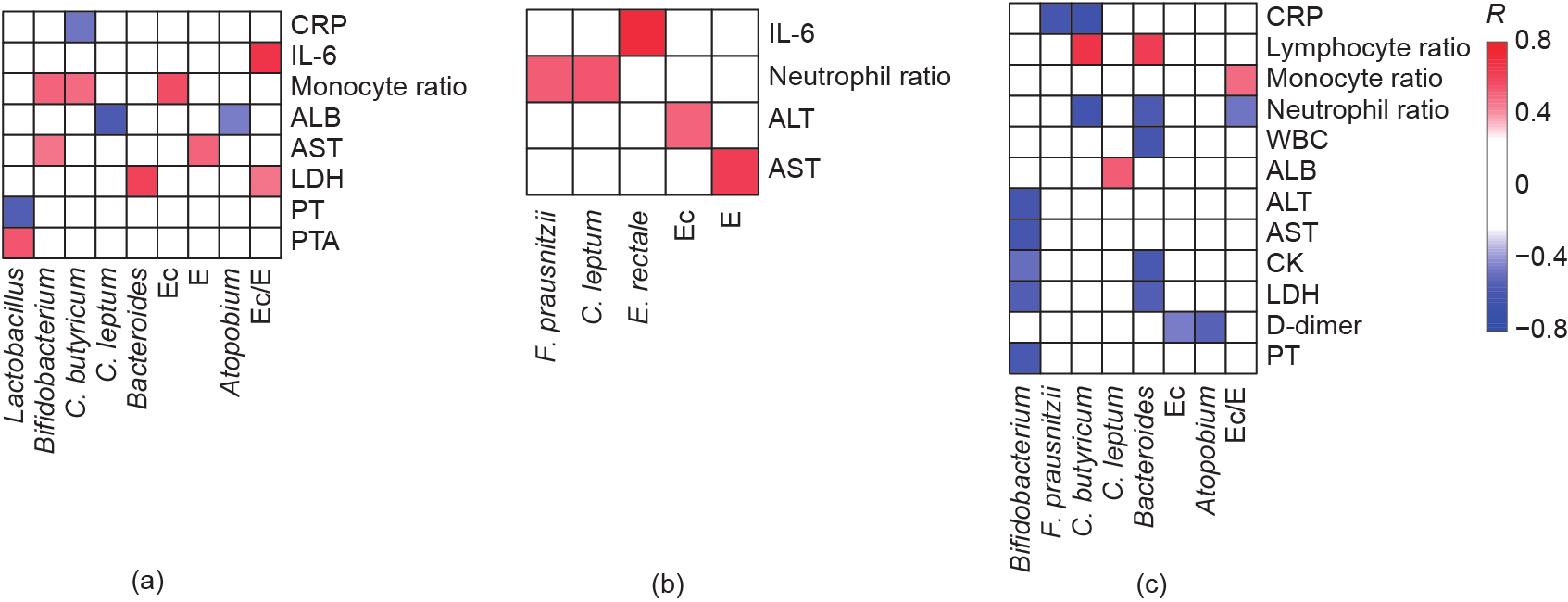
图2. 普通型(a)、重型(b)、危重型(c)COVID-19患者的肠道细菌与临床指标的相关性。PT:凝血酶原时间;PTA:凝血酶原活动度;R:皮尔逊相关系数。
在普通型组中,酪酸梭菌与CRP水平呈负相关(皮尔逊相关系数R = −0.5)。在重型组中,普拉梭菌和酪酸梭菌与中性粒细胞比例呈正相关(R = 0.5),而直肠真杆菌与IL-6水平呈正相关(R = 0.7)。在危重型组中,酪酸梭菌与CRP(R = −0.7)和中性粒细胞比例(R = −0.6)呈负相关,普拉梭菌与CRP呈负相关(R = −0.6)。
菌群变化也与肝功能标志物ALT和AST浓度的变化有关。在普通型和重型患者中,条件致病菌肠球菌与AST呈正相关(R = 0.5和0.6)。重型患者血清肠杆菌浓度与ALT异常血清浓度呈正相关(R = 0.5)。在危重型组中,益生菌双歧杆菌与ALT和AST呈负相关(R = − 0.6)。
部分菌群与器官功能指标(D-二聚体、LDH、肌酸激酶)有关。在普通型组中,乳酸杆菌与凝血酶原时间(PT)呈负相关(R = −0.6)。在危重型组中,双歧杆菌与PT和LDH呈负相关(R = −0.6和−0.5)。此外,在危重型组中,奇异菌与D-二聚体水平(R = −0.5),以及双歧杆菌与LDH和肌酸激酶水平(R = −0.6)呈负相关。
《3.4. 危重型患者肠道微生态衰竭》
3.4. 危重型患者肠道微生态衰竭
我们对7种有益菌进行进一步分析,其中包括益生菌(乳酸杆菌和双歧杆菌)、抑炎菌(普拉梭菌、酪酸梭菌、柔嫩梭菌、直肠真杆菌)和拟杆菌。如果以正常范围的下限的1000倍作为阈值,则出现至少一种有益菌显著减少,分别占普通型、重型和危重型患者的80%、 84.2%和94.4%。危重型患者的肠道有益菌群出现显著下降,10例患者(55.6%)表现为肠道微生态衰竭,即三种以上有益菌显著减少。15例患者的肠道细菌总数减少,这些患者的7 d、14 d死亡率分别为26.7%和40%。
条件致病菌肠球菌和肠杆菌科细菌均为条件致病菌。存活者(49例)的Ec/E值的平均值为1.3 ± 2.5,而死亡患者(8例)为 3.3 ± 1.4(P < 0.05)。在18例危重型患者中,17例患者的Ec/E值出现了增加。
《3.5. 产丁酸菌含量降低对危重型患者预后的影响》
3.5. 产丁酸菌含量降低对危重型患者预后的影响
通过ROC曲线分析评估4种产丁酸菌(普拉梭菌、酪酸梭菌、柔嫩梭菌和直肠真杆菌)对危重型患者的预测价值。结果发现,普拉梭菌、酪酸梭菌、柔嫩梭菌和直肠真杆菌能较好地区分重型和危重型患者,且 AUC分别为0.70 [95%置信区间(CI),0.50~0.89;特异性(SPE),0.44;灵敏度(SEN),0.93]、0.73(95% CI,0.54~0.92;SPE,0.84;SEN,0.62)、0.75(95% CI,0.57~0.92;SPE,0.88;SEN,0.57),和0.80(95% CI,0.61~0.98;SPE,0.71;SEN,0.92);截断值分别为6.4×104 、2.2×103 、7.8×104 和2.8×103 [图3(a)]。 4种产丁酸菌亦能较好地区分普通型和危重型患者,且 AUC分别为0.87(95% CI,0.74~0.99;SPE,0.78; SEN,0.86)、0.81(95% CI,0.64~0.97;SPE,1.00; SEN,0.54)、0.81(95% CI,0.65~0.97;SPE,0.77; SEN,0.86)和0.82(95% CI,0.65~0.98;SPE,0.61; SEN,0.92);截断值分别为1.7×106 、880、8.0×105 和 180 [图3(b)]。
《图3》

图3. 产丁酸菌对COVID-19重型患者与危重型患者(a)以及普通型患者与危重型患者(b)的预测能力对比。
《4. 讨论》
4. 讨论
根据疾病严重程度,我们将COVID-19患者分为三组。结果显示,危重型患者的年龄大于普通型和重型患者。此外,危重型患者表现出更多的合并症,同时危重型患者的WBC、PCT、IL-6、D-二聚体、LDH 和CRP的水平显著高于其他两组,然而这些指标在普通型组和重型组之间没有显著差异。三组间血清ALT、 AST、Cr水平无显著统计学差异。
在我们的研究中,8例患者死亡(均为危重型患者), 50.9%的患者接受了抗生素治疗,而7例患者接受了益生菌治疗。为了预防和控制继发感染,抗生素的使用比例在重型和危重型组中相对较高。而检测肠道微生物菌群组成的变化可以揭示COVID-19患者的肠道菌群失调情况,尤其针对重型组和危重型组患者,从而为经验性抗生素治疗提供依据。
肠道作为人体最大的免疫器官,居住着大约1014个细菌[13]。肠道微生物菌群是必不可少的功能器官,参与免疫应答调节、营养吸收代谢以及感染控制[14–16]。病毒感染、抗生素使用和化疗等因素会导致肠道微生物菌群与宿主免疫系统之间的平衡失调[1,3]。微生物菌群失调表现为肠道内正常微生物菌群数量、种类和比例的异常变化,导致一系列病理生理反应。本研究发现,COVID-19患者存在肠道菌群显著改变,这与既往在H7N9患者中的发现类似,表现为乳酸杆菌、双歧杆菌和产丁酸菌的丰度减少,以及机会性病原体,如肠球菌和肠杆菌的过度生长,同时这些菌群与疾病严重性密切相关[2]。
在本研究中,检测的优势菌群在肠道稳态中发挥着重要作用。众所周知,乳酸杆菌和双歧杆菌可以产生乳酸,并在调节机体免疫和维持肠道屏障功能方面发挥重要作用[17,18]。普拉梭菌、酪酸梭菌、柔嫩梭菌和直肠真杆菌能产生短链脂肪酸(SCFA),有助于宿主抵抗肠道病原体定植和发挥免疫调节作用。肠杆菌科细菌,特别是大肠杆菌(Escherichia coli)能产生各种毒力因子。因此,我们假设通过检测COVID-19患者的肠道菌群的丰度,可反映COVID-19患者肠道微生态失调情况,其中包括菌群组成和功能变化。
我们发现乳酸杆菌和双歧杆菌的丰度接近或低于正常范围下限(图1),尤其在重型组中,这与既往在重型 H7N9患者中的发现类似[2]。此外,在部分患者中未检测到乳酸杆菌。在危重型组患者中,双歧杆菌的丰度与ALT、AST、LDH水平呈负相关,提示双歧杆菌与脏器功能,如肝功能及心功能密切相关。
在大多数COVID-19患者中,产丁酸菌,如普拉梭菌、酪酸梭菌、柔嫩梭菌和直肠真杆菌表现为菌群丰度下降。这些菌群丰度的中位数在普通型组和重型组患者中接近正常参考范围的下限,而在危重型组患者中显著低于正常参考范围的下限。丁酸能抑制条件致病菌过度生长、维持肠道黏膜屏障的完整性、激活适应性免疫应答、增强机体抗病毒免疫力[19,20]。体外研究表明,丁酸可以调节调节性T细胞(Treg)的数量和功能,并促进辅助T细胞(Th17和Th1)的活化[21]。此外,机体炎症反应的强度,特别是细胞因子风暴与COVID-19患者的病情加重相关[22]。这些研究表明,产丁酸菌在抵抗SARS-CoV-2感染中发挥重要作用。抑炎菌丰度的减少往往提示患者病情愈加严重。重型患者中产丁酸菌丰度的降低可能与宿主免疫力降低和炎症反应有关。产丁酸菌丰度与外周血炎症标志物的相关性分析提示,普通型组患者中酪酸梭菌和CRP水平呈负相关(R = −0.5),而危重型组患者中酪酸梭菌和CRP(R = −0.7)、酪酸梭菌和中性粒细胞比例(R = −0.6)、普拉梭菌和CRP(R = −0.6)呈负相关。因此,产丁酸菌丰度的减少可能加重病毒性肺炎的炎症反应,并可能与疾病的严重程度密切相关。研究结果表明,普拉梭菌、酪酸梭菌、柔嫩梭菌和直肠真杆菌的菌群变化情况可用于预测疾病严重程度。产丁酸菌丰度的变化可以准确区分危重型组和普通型组患者,另外,微生物菌群特征可能是预测疾病严重程度的有力工具。
Qin等[2]发现H7N9患者的普拉梭菌和直肠真杆菌的丰度显著下降,提示COVID-19患者中产丁酸菌的减少可能与呼吸道病毒感染的炎症发病机制有关,并与细胞因子释放综合征有关。在COVID-19早期阶段给予针对性的微生态制剂治疗,有助于减少重型和危重型患者人数。值得注意的是,酪酸梭菌在COVID-19患者中表现为丰度减少,但在H7N9患者中丰度增加。因此需要更多的研究来阐明病毒感染对肠道有益菌的影响。
条件致病菌,如肠球菌和肠杆菌可通过受损的肠道屏障进入血液并引起感染。此外,条件致病菌的过度生长易导致肠道菌群进一步失调、肠道上皮屏障破坏和继发感染的发生[5,23,24]。在本研究中,73.7%(42/57)患者的Ec/E值增加,特别是危重型患者。同时,该比值在普通型和重型患者之间存在显著性差异。死亡组与存活组之间也存在显著性差异。危重型患者的肠杆菌明显减少,这可能与抗菌药物的使用有关。危重型患者的碳青霉烯、头孢菌素类等抗菌药物的广泛使用,导致肠道内肠杆菌的丰度下降,同时也造成Ec/E值的增高,进一步造成肠道菌群失调[1]。重型患者的肠球菌丰度与血清ALT水平呈正相关(R = 0.5)。除了继发真菌感染外,应注意万古霉素耐药肠球菌血流感染在晚期并发症中的发生率[25]。防止肠道细菌易位是COVID-19治疗和预防相关并发症的一个重要手段。然而,经验性抗生素预防会破坏肠道菌群稳态,是继发性细菌和真菌感染的危险因素。微生态制剂治疗目前在急性感染性疾病的研究中没有得到足够的重视[26]。在我们的队列中,少数患者使用了益生菌制剂来改善肠道微生物菌群并维持肠道屏障的完整性。
Qin等[2]对40例H7N9患者和健康人群的肠道菌群进行了比较,发现H7N9患者中拟杆菌丰度减少,肠杆菌、肠球菌等病原菌丰度增加。与之类似的是,在我们研究的COVID-19重型和危重型患者中,拟杆菌的丰度显著减少。肠道中拟杆菌对宿主有益,但易位时可引起显著的病理改变[27]。此外,拟杆菌可以产生短链脂肪酸,短链脂肪酸有助于改善肠道功能,调节微生态平衡和宿主免疫系统[28]。然而,一些拟杆菌属可能引起感染。目前拟杆菌属在COVID-19中的作用机制尚不清楚 [29]。
菌群丰度的变化与脏器功能相关血清标志物,如D二聚体、LDH和肌酸激酶等有关。例如,在普通型患者中,乳酸杆菌的丰度与PT呈负相关(R = −0.6)。在危重型组中,双歧杆菌的丰度与PT(R = −0.6)和LDH(R = −0.5)呈负相关,奇异菌的丰度与D-二聚体、拟杆菌和 LDH、肌酸激酶均呈负相关。因此,肠道菌群失调可能导致血液学指标的改变[30]。
在本研究中,通过q-PCR监测了10种肠道优势菌群的含量,与第二代测序相比,q-PCR具有快速、易于使用、可靠的优点[31]。及早识别微生态失衡有助于临床医生实施有效的诊断和治疗,减少由于肠道微生态失调甚至衰竭引起的疾病加重,并改善治疗过程。SARSCoV-2通过血管紧张素转换酶2(ACE2)受体进入宿主细胞[32]。ACE2受体存在于几乎所有人体细胞中,据报道,在粪便中可检测到SARS-CoV-2 [9,33]。我们推测肠道菌群失调增加了病毒感染的风险,因为微生物有助于维持肠道黏膜的完整性。鉴于肠道微生物菌群在 COVID-19患者中的重要作用,包括抗病毒应答和预防感染,明确病毒感染与肠道微生物菌群之间的相互作用机制及其对SARS-CoV-2感染宿主反应的影响是至关重要的。
《5. 结论》
5. 结论
研究结果表明,10种肠道优势菌群变化与 COVID-19患者血液学参数之间存在潜在的相关性。本研究首次使用Ec/E值预测危重型患者的死亡。
《致谢》
致谢
本研究获浙江省重点研发计划应急项目(2020C03123)、国家“十三五”科技重大专项“突发急性重症呼吸道传染病救治新技术和新方案研究”(2017ZX10204401)和浙江省自然科学基金(LED20H190001)的支持。
《Compliance with ethics guidelines 》
Compliance with ethics guidelines
Lingling Tang, Silan Gu, Yiwen Gong, Bo Li, Haifeng Lu, Qiang Li, Ruhong Zhang, Xiang Gao, Zhengjie Wu, Jiaying Zhang, Yuanyuan Zhang, and Lanjuan Li declare that they have no conflict of interest or financial conflicts to disclose.
《Appendix A. Supplementary data 》
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2020.05.013.














 京公网安备 11010502051620号
京公网安备 11010502051620号




