《1. 引言》
1. 引言
由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的新冠病毒肺炎(COVID-19)正在全球范围内迅速传播[1]。尽管很多国家采取了严格的控制措施,截至2020年6月26日,仍有188个国家和地区报道了共947万COVID-19确诊病例和约48万死亡病例。目前针对COVID-19尚无有效的药物或疫苗,因此,对感染SARS-CoV-2的患者进行快速诊断和隔离被认为是抑制大流行继续发展的最有效的方法。不幸的是, COVID-19与流感和感冒有许多共同症状,如发烧、干咳、肌痛或疲劳[2]。因此,在抵抗COVID-19的过程中,急需能够将新冠病毒与其他常见呼吸道病毒区分开来的可靠的诊断工具。到目前为止,大量基于逆转录聚合酶链反应(RT-PCR)方法的核酸检测试剂盒被开发出来,它们在COVID-19的临床诊断中发挥着核心作用[3,4]。但是,这些基于RT-PCR方法的检测通常耗时长,且只能检测SARS-CoV-2,并且有时会出现由于采样或灵敏度问题导致的假阴性结果。在临床治疗中,如果对使用 RT-PCR试剂盒测试结果为SARS-CoV-2阴性,但持续带有COVID-19症状的患者治疗不当,不但会消耗大量宝贵的医疗资源,而且会极大地增加交叉感染风险。因此,迫切需要开发一款诊断工具,该工具不仅可以快速检测SARS-CoV-2,而且还可以准确检测其他常见的呼吸道病毒,如流感病毒、人副流感病毒(HPIV)等[5–7],以便在SARS-CoV-2检测阴性时可以知道引起症状的确切原因。
多重RT-PCR可通过在单个试管中加入全部引物实现对多种类型病毒的检测。但是,由于混合引物之间不可避免的相互干扰作用以及用于检测的荧光基团的数量有限,开发鲁棒的多重检测系统非常困难,且每个反应中能够检测的靶标数量通常少于10个[8]。最有希望打破此限制的方法之一是通过物理隔离将不同的引物对加入指定的腔室中,从而将多重PCR转换为多个单重PCR。在过去几十年中,微流控技术已发展成实现样品分配而不引入其他人工操作的最常用方法之一。在各种微流控技术中,相比亲疏水结构化修饰技术[9,10]、滑动芯片技术[11–14]和电介质上电润湿技术(EWOD)[15,16],基于离心操作的微流控技术具有以下优点:操作简单、微结构完全封闭、易于集成其他微流控功能[17,18]。我们课题组之前开发了一种基于离心操作的、适用于单通道紧凑型仪器的碟式微流控芯片(每次运行仅测试1个样本),并结合使用环介导等温扩增技术(LAMP)实现了对13种呼吸道致病菌的检测,证明了该系统出色的多重检测能力[19]。然而,当涉及病毒检测时,由于热循环和引物设计困难,RT-PCR和LAMP都不适合在微流控芯片上使用。尽管其他微流控系统,如FilmArray®和 Verigene®也可用于多重病原体检测,并具有与样本处理集成的优势[20–22],但是目前还没有可以区分SARSCoV-2与其他呼吸道病毒的微流控系统被报道。
核酸依赖性扩增检测技术(NASBA)是一种基于酶的等温扩增方法,该方法所用试剂主要包括逆转录酶、核糖核酸酶H(RNase H)、T7核糖核酸(RNA)聚合酶、两个特殊设计的引物和一个特殊设计的探针 [23,24]。在NASBA起始反应阶段,引物1退火结合单链RNA,合成转录脱氧核糖酸(cDNA),并形成 RNA:DNA杂合体。随后,RNase H水解RNA链形成单链DNA。引物2退火结合单链cDNA后,由逆转录酶进一步合成带有可被T7 RNA聚合酶识别的启动子区域的双链DNA [23,24]。一旦生成带有启动子区域的双链 DNA,反应就会进入RNA转录、反转录和水解的连续循环过程[23–25]。由于每次转录可生成10~1000个RNA 转录本,因此NASBA反应过程比PCR或LAMP反应过程需要更少的循环周期,从而减少了总反应时间和出错频率[23,26]。作为一种等温扩增技术,NASBA鲁棒性好、特异性强且特别适用于单链RNA的检测,但并不适用于双链DNA的检测[23,27]。
在本研究中,我们介绍了一款满足高通量和多指标的核酸等温扩增分析仪(RTisochipTM-W),该仪器基于我们之前开发的碟式微流控系统,进行了两方面的改进。首先,我们使用高效且灵敏的NASBA扩增技术代替了不适合在离心式微流控芯片上对病毒进行检测的 PCR技术和LAMP技术[23,26,28,29]。其次,为了提高系统的通量,我们对仪器进行了更新,使其由单通道增加到16个通道。因此,这种全新的RTisochipTM-W系统能够在90 min内一次性检测出16份临床样本中包括 SARS-CoV-2在内的19种常见呼吸道病毒。本研究证明了该系统出色的性能,使我们相信此系统能够在抗击 COVID-19大流行中发挥重要的作用。
《2. 材料和方法》
2. 材料和方法
《2.1. 样本收集和 RNA 提取》
2.1. 样本收集和 RNA 提取
含有靶标病毒序列的质粒由上海生工生物工程股份有限公司合成。根据试剂盒操作说明,使用HiScribeTM T7高产RNA合成试剂盒(NEB,美国)通过体外转录制备RNA模板。灭活的病毒保存液由广州医科大学附属第一医院的钟南山院士赠送。在患者知情并同意下,于2018—2020年,从北京清华长庚医院、首都儿科研究所、广州医科大学附属第一医院、四川大学华西医院和首都医科大学附属北京佑安医院收集临床样本。
使用DNA口腔采样拭子(93050,麦瑞科林,中国)采集咽拭子样本,具体操作是通过旋转拭子尖端以收集咽部脱落细胞,然后将拭子放入病毒采样管(MT0301,友康,中国)中,并将拭子前端浸入病毒保存液几秒钟之后,折断拭子末端,样本保存于−70 ℃的冰箱。
按照试剂盒操作说明,使用TRIzolTM试剂(Invitrogen,美国)或QIAamp®病毒RNA迷你试剂盒(Qiagen,德国)提取临床样本中的总RNA。根据用户操作手册,使用KingFisherTM Flex纯化系统(Thermo Fisher Scientific,美国)进行RNA的自动化提取。将提取的RNA溶于无核酸酶水中,并使用Nanodrop 2000或Qubit 3.0(均购自美国的Thermo Fisher Scientific公司)进行定量。使用含1%甲醛的变性凝胶进行RNA完整性的电泳检测。
《2.2. 引物设计和 NASBA 反应》
2.2. 引物设计和 NASBA 反应
该系统可检测的呼吸道病毒包括SARS-CoV-2(S 基因和N基因)、甲型流感病毒(influenza A,如H1N1、 H1N1 2009、H3N2、H7N9)、乙型流感病毒(influenza B)、呼吸道合胞病毒(RSV)、人偏肺病毒(HMPV)、人副流感病毒(HPIV1、HPIV2、HPIV3、HPIV4)、人鼻病毒(HRV)、肠病毒71(EV71)、柯萨奇病毒A16 (CA16)、柯萨奇病毒A6(CA6)和人冠状病毒(HCoV229E/NL63、HCoV-OC43/HKU1)。在芯片上,使用等温扩增技术NASBA对病毒RNA进行检测。使用Primer Premier v.5.0软件(Premier Biosoft,美国)设计NASBA 引物及探针序列,并由上海生工生物工程股份有限公司合成。引物和探针的序列在附录A的表S1中列出。针对每种病毒的引物和探针序列,进行进一步的覆盖度分析,结果列在附录A中的补充数据2中。通过下载每种病毒的10个最新发布的完整全基因组序列,分析引物及探针的覆盖度。总体而言,系统中所用的引物和探针具有很好的覆盖率。例如,对于H1N1 2019,其引物和探针序列与最新发布的10个完整的全基因组序列完全匹配,这表明我们选取的用来设计引物和探针的区域非常保守。
在芯片上进行NASBA反应时,将针对每个指标所设计的1 µL引物和探针的自制溶液加入相应的反应腔室中,并在室温下使其完全干燥。检测起始,将16.5 µL 缓冲溶液、13 µL核糖核苷三磷酸(NTP)溶液、5.5 µL 酶混合物(均来自北京博奥晶典生物技术有限公司)和 20 µL RNA模板在试管中混匀,共得到55 µL NASBA反应混合物,然后使用移液器将其转移到芯片中。
《2.3. 微流控芯片的设计与运行》
2.3. 微流控芯片的设计与运行
我们小组先前报道了一种用于检测19种呼吸道病毒的微流控芯片[30,31]。简而言之,如图1(a)所示,碟式微流控芯片的直径为62 mm,厚度为0.6 mm。它由结构层和通过双面胶带连接的薄覆盖层组成。结构层包含 24个反应腔室(每个腔室直径为3 mm,深度为0.2 mm,每个反应腔室的体积为1.45 µL)、24个缓冲池、一个正弦形主通道(宽度为0.2 mm,深度为0.1 mm)、入口和出口。每个反应腔室通过缓冲池和短管连接主通道。结构层材料为聚碳酸酯,通过精密注塑模具制成,表面光滑,粗糙度小于10 µm。如图1(b)所示,将每套 NASBA引物和探针加入指定的反应腔室中并在室温下进行干燥。使用人基因甘油醛-3-磷酸脱氢酶(GAPDH)及其对应的引物作为内部对照(IC),使用酿酒酵母的质粒及其相应的引物和探针作为阳性对照(PC),使用无菌无核酸酶水作为阴性对照(NC)。完成引物预固定后,用双面胶带将结构层和覆盖层密封在一起,并用压力机进行冲压。单独对每个芯片进行真空包装,并将其存储于−20 ℃的冰箱中以备使用。
NASBA的机制如图1(c)所示。RTisochipTM-W系统的整个分析过程如图1(d)所示。简而言之,在接收咽拭子样本后,使用商业化的核酸提取试剂盒从临床样本中提取RNA,并与不含有引物和探针的NASBA反应混合物混合。然后,将55 µL反应混合物通过入口转移到芯片中,使其填充主通道。之后,将入口和出口用胶带进行密封。将芯片装入仪器托盘后,单击控制程序中的开始按钮,系统将自动执行其余过程。首先芯片将以6000 r·min−1的速度进行旋转:先旋转10 s,然后间隔 120 s再旋转30 s,以使反应试剂从主通道进入24个反应腔室中。接下来对微流控芯片进行孵育,41 ℃孵育 35 min。在此期间,由扩增产生的荧光信号将被检测出来并实时显示在计算机屏幕上。
《图1》

图1. 碟式微流控芯片设计和呼吸道病毒检测流程。(a)微流控芯片示意图。(b)各靶标病毒以及对照在芯片上对应的反应腔室分布。(c) NASBA原理图。在非循环阶段,引物1与靶序列退火形成RNA:DNA杂合体,RNase H水解该RNA:DNA杂合体中的RNA。接下来,引物2与单链DNA(ssDNA)退火并由逆转录酶合成双链DNA(dsDNA)。在循环阶段,重复进行从dsDNA模板转录生成RNA、合成cDNA、水解RNA:DNA杂合体中RNA链以及形成dsDNA的过程。(d)病毒检测流程。从左到右:收到灭活临床样本、从样本中提取RNA、将试剂转移到芯片中、用胶带密封芯片、将芯片放入仪器中、将试剂分配到芯片上的反应腔室中和使用RTisochipTM-W系统完成扩增和检测。
《2.4. 用于分析呼吸道传染病的微流控仪器》
2.4. 用于分析呼吸道传染病的微流控仪器
RTisochipTM-W由4个相同的子模块组成,每个子模块都可以控制微流控芯片并对其进行检测。可以将4个分析仪堆叠在一起,形成一个由一台计算机控制的16通道系统[图2(a)]。如图2(b)、(c)所示,子模块主要由电机、控制面板、电源模块、温度控制模块、检测模块和通信模块组成。控制面板控制电机的旋转、微流控芯片的进入/退出以及所有其他模块。比例-积分-微分(PID)温度控制器用于调控核酸扩增所需的温度。光学检测系统实时监控反应腔室中的荧光信号。荧光信号数据同时发送到计算机,该计算机通过通信模块与路由器连接。
《图2》
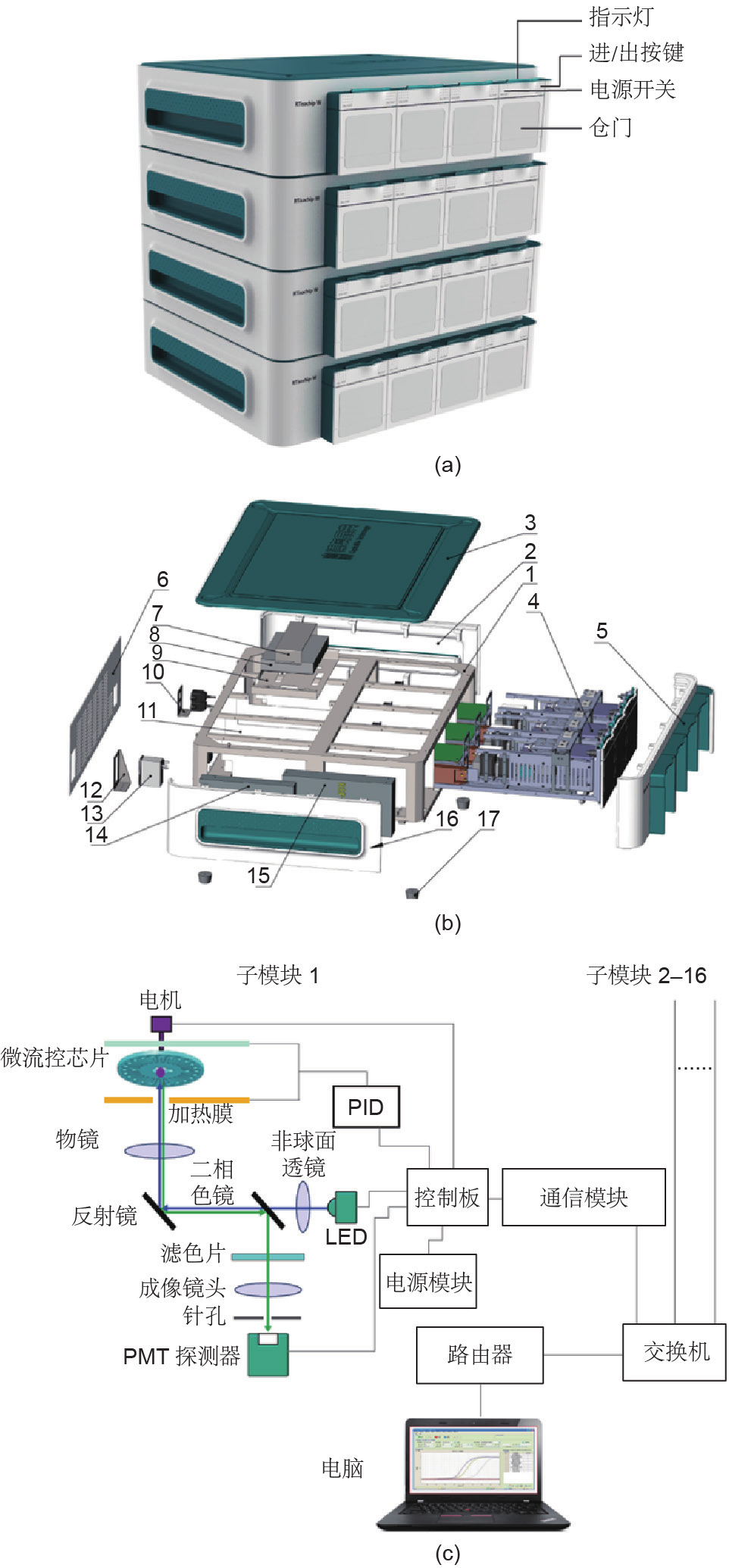
图2. RTisochipTM-W系统的设计。(a)由具有16通道的4个堆叠放置的分析仪组成的RTisochipTM-W系统,每个分析仪包含4个子模块。(b)包含4个子模块的分析仪的分解图。1:钣金框架;2:右侧面板;3:上面板;4:子模块;5:前面板;6:后面板;7:交换机的固定上盖板;8:交换机;9:交换机固定面板;10:网络端口安装面板;11:隔板;12:电源插座安装面板;13:插座式电源滤波器;14:系统电源; 15:芯片加热器的电源;16:左侧面板;17:橡胶脚。(c)仪器内部子模块的结构示意图。通过路由器最多可以将16个相同的子模块连接到计算机。PMT:光电倍增管;LED:发光二极管;PID:比例-积分-微分。
《3. 结果》
3. 结果
《3.1. 优化用于 RTisochipTM-W 系统的 RNA 提取方法》
3.1. 优化用于 RTisochipTM-W 系统的 RNA 提取方法
作为检测的第一步,从临床样本中提取的RNA在整个分析过程中起着至关重要的作用。为了选择合适的RNA提取方法,我们比较了用于提取咽拭子中病毒 RNA的TRIzolTM总RNA提取试剂盒和QIAamp®病毒 RNA迷你试剂盒的提取效率。阳性值出现时间(Tp,即指数放大曲线的二阶导数拐点处的时间)被用作评估提取效率的关键因素,Tp值通常与模板浓度呈负相关。如图3(a)所示,通过TRIzolTM试剂提取法检测的Tp 值总是比通过QIAamp®试剂盒提取所检测到的Tp值略小。因此,我们推荐采用TRIzolTM提取试剂作为手动提取试剂。接下来,为了进一步减少人工操作,我们使用 KingFisherTM Flex纯化系统来自动提取RNA。图3(b)、(c)证明,在对两个病毒靶标HCoV-229E/NL63和H1N1 2009进行检测时,在以半数细胞培养感染量(TCID50,组织培养中值感染剂量)定量的较大模板浓度范围内,该自动化操作系统与手动TRIzolTM提取方法相比,具有更高的提取效率和更好的重复性。但是,由于自动化系统的成本较高,我们同时选择了TRIzolTM提取试剂和KingFisherTM系统进行后续测试。
《图3》
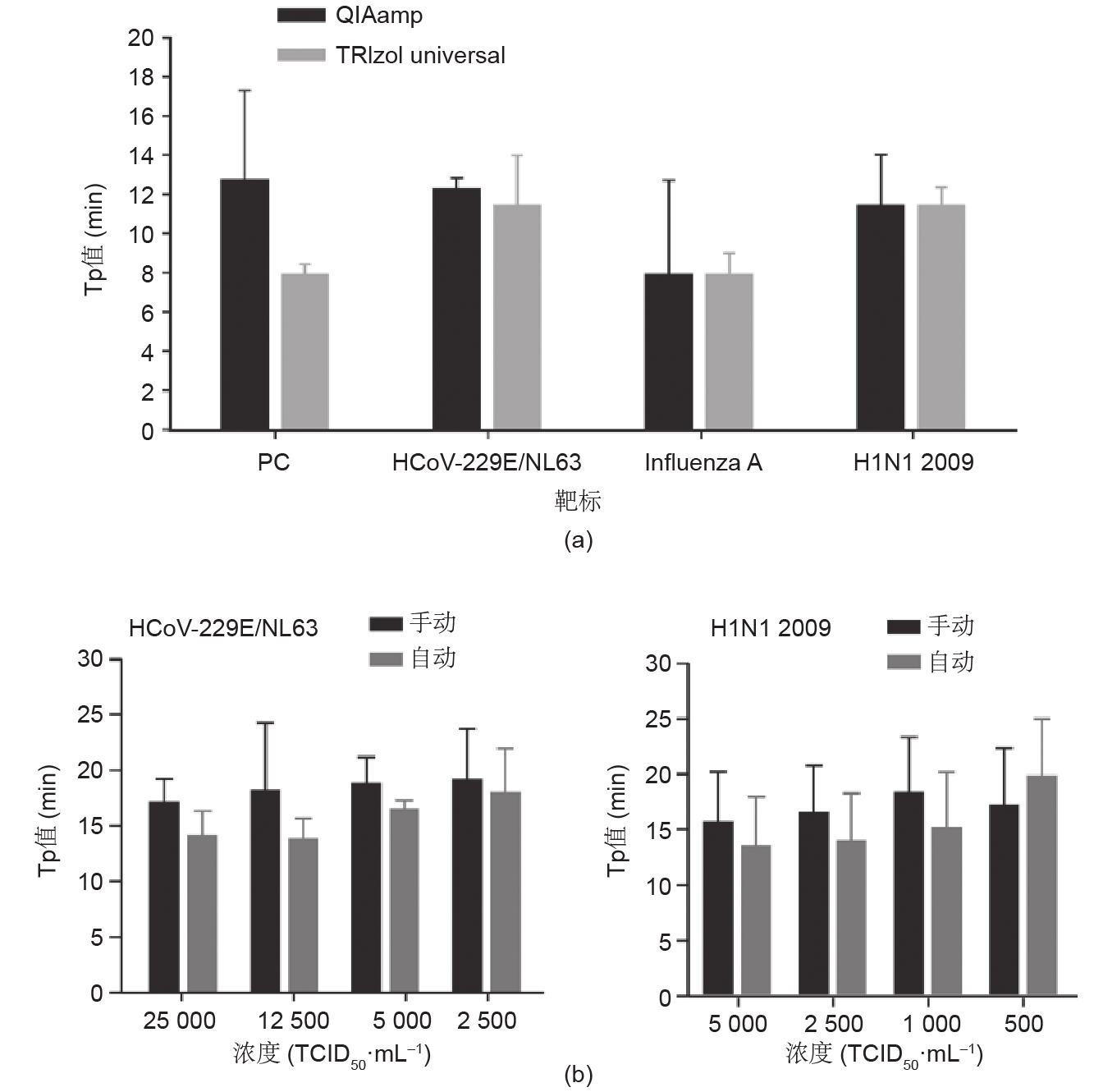
图3. 用于芯片上病毒检测的RNA提取方法的比较。(a)通过对不同病毒靶标的检测,比较QIAamp®和TRIzolTM提取试剂的RNA提取效率(n = 3);(b)通过对HCoV-229E/NL63和H1N1 2009的检测,比较TRIzolTM提取试剂和自动化提取系统KingFisherTM Flex的RNA提取效率(n = 3)。所有误差线代表标准偏差。
《3.2. 评估 RTisochipTM-W 系统的灵敏度和重复性》
3.2. 评估 RTisochipTM-W 系统的灵敏度和重复性
为了评估该平台的灵敏度,我们将合成的针对这19种呼吸道病毒的RNA模板进行梯度稀释,形成 250拷贝·μL−1、50拷贝·μL−1、25拷贝·μL−1、10拷贝·μL−1 的浓度梯度样本。其中,将SARS-CoV-2 N核酸和 SARS-CoV-2 S核酸混在一起进行稀释。图4(a)列出了所有病毒的检测限(LOD)。实验结果表明,H7N9、 CA16、RSV、HPIV1、HPIV2、HPIV3、HPIV4、 HCoV-229E/NL63和HMPV的LOD值为50拷贝·μL−1; H1N1、H3N2、乙型流感病毒、EV71、HCoV-OC43/ HKU1、CA6、HRV和SARS-CoV-2 N基因的LOD值为 25拷贝·μL−1;H1N1 2009和SARS-CoV-2 S基因的LOD 值可以达到10拷贝·μL−1。这些指标的灵敏度与常规RTPCR方法相当。H1N1 2009和SARS-CoV-2 S基因在不同模板浓度下以及阴性对照组检测的典型扩增曲线如图4 (b)和(c)所示。在H1N1 2009和SARS-CoV-2 S基因的Tp值与RNA浓度之间可观察到良好的线性相关性。
我们选择H1N1 2009和SARS-CoV-2作为评估系统重复性的检测靶标。首先,使用500拷贝·μL−1 的H1N1 2009和SARS-CoV-2 S基因灭活假病毒测试了三个批次的微流控芯片(每批次重复10次)。将提取后的RNA样本上样到RTisochipTM-W系统中进行测试。如图4(d)所示,在每个批次内以及三个批次之间,这两个靶标的Tp值均未观察到显著差异,表明RTisochipTM-W系统具有极好的重复性。用模拟样本进行评估后,进一步使用从临床样本中提取的RNA对SARS-CoV-2 S基因和N 基因进行检测,以测试系统的重复性。图4(e)显示, 10次重复实验的S基因和N基因检测结果的变异系数(CV)分别为16.96%和15.91%。这些结果清晰地表明,微流控平台在检测多病毒指标时,具有高重复性和可接受的灵敏度。
《图4》

图4. 测试RTisochipTM-W系统的灵敏度和重复性。(a)对19种呼吸道病毒在芯片上的LOD进行检测;(b)H1N1 2009不同模板浓度下的典型扩增曲线以及与Tp值之间的线性拟合(n = 3);(c)SARS-CoV-2 S基因不同模板浓度下的典型扩增曲线以及与Tp值之间的线性拟合(n = 3);(d)使用三个批次的芯片对合成的H1N1 2009和SARS-CoV-2 S基因的RNA模板进行重复性测试(n = 10);(e)使用提取的RNA样本测试SARS-CoV-2 S基因和SARS-CoV-2 N基因的可重复性(n = 10)。所有误差线代表标准偏差。
《3.3. 评估 RTisochipTM-W 系统的鲁棒性和特异性》
3.3. 评估 RTisochipTM-W 系统的鲁棒性和特异性
鲁棒性是医学诊断平台的一项关键性能,尤其针对传染病的检测,临床样本可能以多种形式存在,并且包含多种扩增抑制剂,且这些扩增抑制剂无法通过核酸提取消除。在本研究中,咽拭子或其他类型的样本可能具有多种干扰物,包括微生物、血液以及患者在采样前服用的残留抗菌和抗病毒药物。因此,使用带有人工添加的干扰物的样本来评估平台的抗干扰能力。首先,如图 5(a)所示,我们发现,在混合有H1N1 2009、H3N2、乙型流感病毒、RSV、HPIV3和SARS-CoV-2 N基因 1000拷贝·mL−1的假病毒溶液中,添加黏蛋白至其终浓度为10 mg·L−1,对这6个靶标的扩增无负面影响,表现为Tp值无显著变化。接下来,我们准备了含有盐酸羟甲唑啉、地塞米松、干扰素、拉米夫定、金刚烷胺、薄荷醇、氯化钠和黏蛋白的混合干扰物质[图5(b)],以便更严格地评估该平台抗干扰能力。如图5(c)所示,添加这些混合干扰物质之后,H1N1 2009、H3N2、乙型流感病毒、RSV、HPIV3和SARS-CoV-2 N基因的Tp值无显著变化。总之,这些测试结果表明样本中存在的干扰物质对RTisochipTM-W平台无显著的负面影响。
由于RTisochipTM-W平台可以同时检测19种不同类型的病毒,因此需要对这些靶标之间的交叉反应进行详细的研究,避免出现假阳性的情况。在这里,我们准备了各包含一种假病毒模板(P1~P19)的19个样本和6个阴性对照(N1~N6)样本对系统进行测试。如图5(d)的热图所示,我们发现在所有25个样本中都没有检测到由交叉反应引起的非特异性扩增,表明 RTisochipTM-W系统的可靠性。接下来,我们注意到这19个不同靶标之间的竞争效应是该平台的另一个潜在风险。当单个样本中存在多个靶标模板时,由于来自非靶标RNA的干扰,系统的灵敏度可能不如一次仅检测一个靶标的高。为了评估这种竞争效应,我们准备了单一或混合RNA样本,将其稀释至终浓度为 5000拷贝·μL−1和500拷贝·μL−1。如图5(e)所示,对于H1N1 2009、H3N2、RSV、HPIV3、SARS-CoV-2 S 基因和SARS-CoV-2 N基因这6个靶标,分别单独检测的Tp值与从混合RNA样本中检测的Tp值无显著差异。尽管我们确实观察到由于非靶标RNA的干扰,在低浓度的混合样本中无法检测到乙型流感病毒,但是可以通过进一步优化乙型流感病毒的引物浓度和引物序列以解决此问题。总体而言,上述结果证明,RTisochipTM-W 系统具有良好的特异性和较强的鲁棒性,且可同时对16 个临床样本中的19种呼吸道病毒进行检测。
《图5》

图5. 测试RTisochipTM-W系统的抗干扰能力、交叉反应以及模板竞争效应。(a)在添加或不添加黏蛋白的样本中,针对7项所选靶标检测的Tp 值及扩增曲线图;(b)混合干扰物质中每种干扰物质的终浓度;(c)在添加或不添加混合干扰物质的样本中,针对7项所选靶标检测的Tp值;(d)对RTisochipTM-W系统进行交叉反应测试,阳性和阴性结果分别显示为橙色和蓝色正方形;(e)混合模板的竞争效应测试,测试了两种不同浓度下的单一模板或混合模板扩增情况,乙型流感病毒在500拷贝·μL−1浓度下无法检出。ns:无显著差异。
《3.4. 使用 RTisochipTM-W 系统对 SARS-CoV-2 和另外 18 种呼吸道病毒进行临床测试》
3.4. 使用 RTisochipTM-W 系统对 SARS-CoV-2 和另外 18 种呼吸道病毒进行临床测试
在SARS-CoV-2暴发前,我们通过使用RTisochipTM-W系统分析了大量临床样本,以跟踪18种呼吸道病毒在北京的流行趋势。在2019年12月27日至2020年1 月16日的流感季节,我们从北京清华长庚医院共收集了101份儿童咽拭子样本。与之对应,在2019年9月18日至11月7日非流感季节期间,我们从首都儿科研究所收集了100份儿童咽拭子样本。所有临床样本均通过RTisochipTM-W系统进行检测,结果列在附录A的表S2~S3 中。从这201份临床样本中,可以看到呼吸道病毒的阳性率在不同采样时间显示出很大的差异。如图6(a)所示,我们发现收集自流感季节的临床样本中几乎有 71.3%是流感病毒阳性,而来自首都儿科研究所的收集自非流感季节的临床样本中只有2.9%是流感病毒阳性。此外,在流感季节,RSV、HPIV1、HPIV2、HMPV、 HCoV-229E/NL63和HCoV-OC43/HKU1的阳性比例呈上升趋势,而流感季节的HRV、HPIV3和HPIV4的阳性率要低于非流感季节。呼吸道病毒阳性率随季节的显著变化强调了在临床中对呼吸道病毒进行多指标检测的重要性。
SARS-CoV-2暴发后,我们将SARS-CoV-2 S基因和 N基因的检测添加到系统中,并使用SARS-CoV-2临床样本对系统性能进行评估。首先,使用RTisochipTM-W 系统和商业RT-PCR试剂盒(BGI,深圳)并行测试14 个临床确诊的阳性样本和三个阴性样本。如图6(b)和附录A中的表S4所示,两种方法显示出100%的一致性,这表明RTisochipTM-W平台的检测性能与常规RT-PCR相当。为了进一步验证RTisochipTM-W平台在测试临床样本上的稳定性和可重复性,我们准备了3批不同批次生产的共25个微流控芯片来测试25个临床确诊样本。如图6(c)的热图所示,RTisochipTM-W系统报道的结果均与临床诊断结果一致,未发生假阳性或假阴性现象。经过这些小规模测试后,我们与广州医科大学附属第一医院(380例)、四川大学华西医院(63例)和首都医科大学附属北京佑安医院(171例)合作,从疑似或确诊的COVID-19患者中收集了614份临床拭子样本(列于附录A的表S5~S8中)。如图6(d)所示,我们报道的SARS-CoV-2、H1N1 2009、H3N2、HPIV、RSV和乙型流感病毒的阳性率分别为6.19%(38/614)、10.91% (67/614)、6.19%(38/614)、3.75%(23/614)、12.38% (76/614)和5.21%(32/614)。RTisochipTM-W系统与参考试剂盒(RT-PCR,之江生物科技股份有限公司,上海)在对SARS-CoV-2、H1N1 2009、H3N2、HPIV、 RSV和乙型流感病毒的诊断上的一致性分别为98.15%、 98.70%、99.35%、99.57%、97.61%和99.35%。在这些临床样本中,一些疑似COVID-19阳性患者最终被诊断为甲型流感病毒、乙型流感病毒或RSV阳性而非SARSCoV-2阳性。例如,四川大学华西医院的1号病例被诊断为甲型流感病毒阳性,这凸显了该平台在精确识别疾病确切原因方面的价值。在某些临床确诊的COVID-19 病例中,RTisochipTM-W平台和常规RT-PCR方法均无法检测到SARS-CoV-2,这可能是由于样本的病毒载量低所致。如此大规模的临床测试清楚地证明,RTisochipTM-W平台是在临床环境中检测呼吸道病毒的强大而可靠的诊断工具。
《图6》
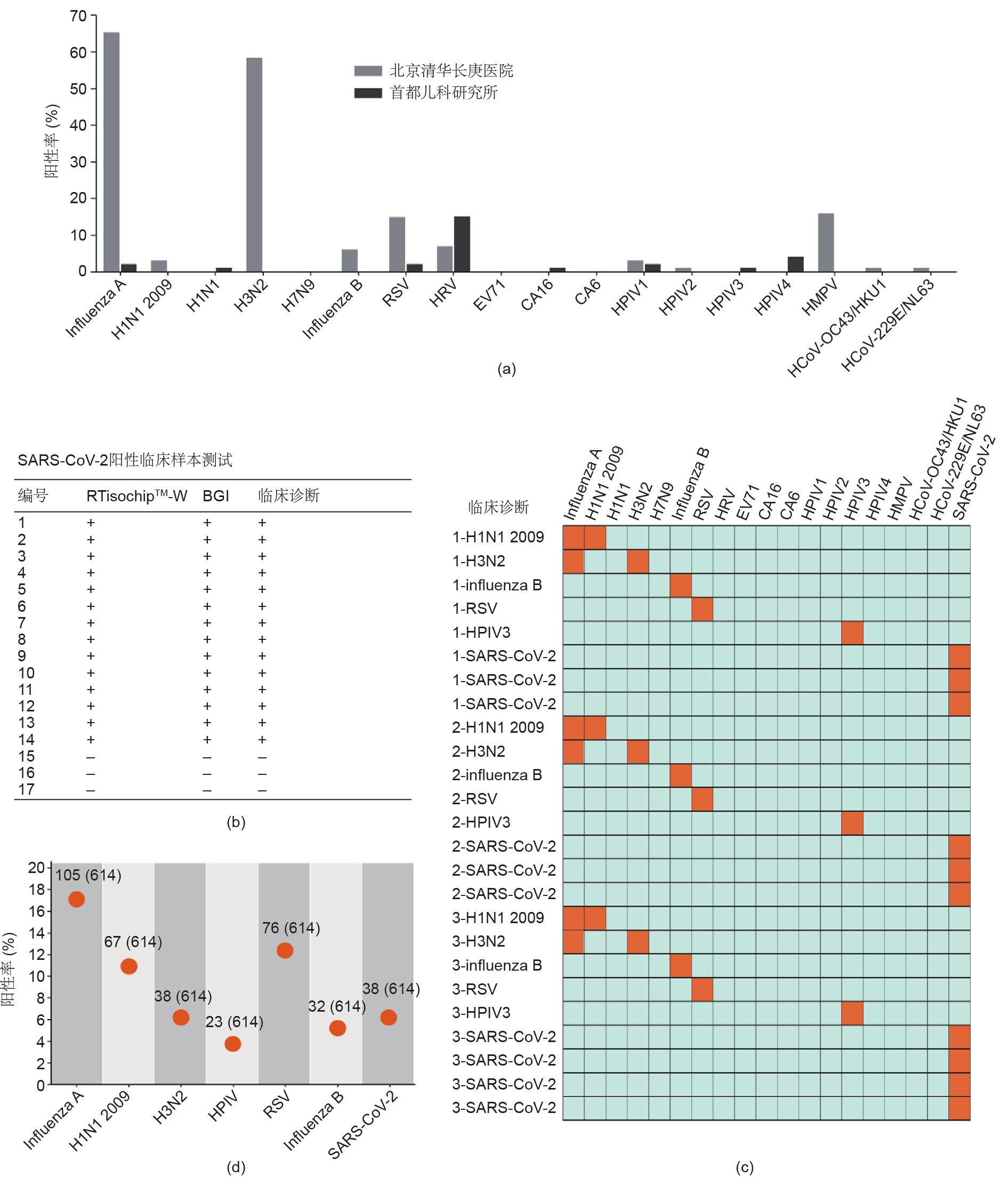
图6. 使用RTisochipTM-W系统对临床呼吸道样本进行鉴定。(a)2019—2020年收集的临床样本中每种病毒靶标的阳性率。来自北京清华长庚医院的临床样本(n =101)收集于2019—2020年的流感季节,来自首都儿科研究所的临床样本(n = 100)收集于2019年的非流感季节。(b)比较RTisochipTM-W系统和常规RT-PCR方法对SARS-CoV-2的诊断结果。“+”代表阳性结果,“−”代表阴性结果。(c)使用临床样本验证RTisochipTM-W系统的重复性。阳性和阴性结果分别显示为橙色和蓝色正方形。(d)使用RTisochipTM-W系统对614份疑似或确诊的COVID-19患者临床咽拭子样本进行检测。
《4. 讨论》
4. 讨论
目前针对COVID-19尚无有效药物,因此抗击 COVID-19唯一可行的方法是对患者进行及早诊断、分类和隔离。不幸的是,由于所有呼吸道感染疾病症状相似,因此很容易将有咳嗽和发烧症状的SARS-CoV-2 阴性患者与其他COVID-19患者一同送入重症监护室(ICU),在医疗资源紧张的情况下接受与COVID-19 患者同样的治疗。从这个角度出发,开发一种可以将 COVID-19患者与由其他病毒(如流感病毒、副流感病毒、腺病毒、呼吸道合胞病毒、鼻病毒和人偏肺病毒)引起的肺炎区别开来的核酸检测工具是极其有价值的。RTisochipTM-W系统能够在一次检测中识别19 种常见的呼吸道病毒,且具有以下优势:一次运行时间少于90 min,可灵活处理1~16个样本,以最少的人工操作即可完成多指标检测,检测灵敏度可与常规 RT-PCR相当以及对于各种干扰物的耐受性高。因此, RTisochipTM-W系统应该可以在抗击COVID-19大流行中发挥重要作用。
在COVID-19大流行的背景下,应重视RTisochipTM-W 系统在临床实践中的应用。在本文中,我们通过综合考虑所有分子诊断方法的利弊,提出了COVID-19检测指南。如图7所示,当有COVID-19症状的患者到达发热门诊时,首先可以进行常规的RT-PCR检测以快速确定患者(及其亲密接触者)是否感染了SARS-CoV-2。在大流行背景下,RT-PCR技术由于成本较低、通量较高,再辅以自动化技术,适合用来对大量临床样本进行筛查。如果患者被诊断为COVID-19,则可以将其转移到COVID-19定点医院。最新研究结果表明,患者体内的病毒载量可反映治疗结果[32–34]。因此在治疗过程中,可以使用可对病毒进行绝对定量的数字 PCR技术(dPCR)密切监测患者的病毒载量。如果患者的状况恶化,则可以使用RTisochipTM-W系统来识别是否发生由呼吸道病毒和细菌引起的医院获得性感染(HAI)。这种测试策略应该可以提高COVID-19患者的生存率。其次,如果发热门诊患者在SARS-CoV-2测试中为阴性,RTisochipTM-W系统可以很快识别出其症状是否是由该系统所能检出的其他病毒和细菌所引起。一旦确诊,可以将患者转移到医院的呼吸科,并通过 RTisochipTM-W系统进行密切监测。再次,如果通过 RTisochipTM-W系统检测后,结果仍为阴性,则可以使用第二代DNA/RNA测序技术来鉴定是否感染未知或罕见的病原体。然后,在呼吸科对患者进行相应的治疗,同时通过RTisochipTM-W系统监测是否有HAI的迹象。最后,康复的患者应在出院前再接受一轮RT-PCR 测试。同时,考虑到RT-PCR可能产生假阴性结果,应按照《新型冠状病毒肺炎诊疗方案(试行第七版)》[35] 的建议,联合使用基于免疫球蛋白M(IgM)和免疫球蛋白G(IgG)的检测,以提高检测的准确性。
根据此指南,RTisochipTM-W系统可用于以下情况:①快速诊断出引起类似于COVID-19症状的确切原因,防止发生误诊和交叉感染;②密切监测由大流行所造成的医疗状况的恶化进而导致在治疗期间发生的HAI。 RTisochipTM-W系统与其他体外诊断工具协同使用,将使我们更加高效和精准地战胜COVID-19。未来可以通过以下几个方面对该系统进行进一步改进:引入更多的病原体检测指标,集成样本处理过程使其成为一个“样本进-结果出”的系统,结合自动化操作进一步提高该系统的检测通量。
《图7》
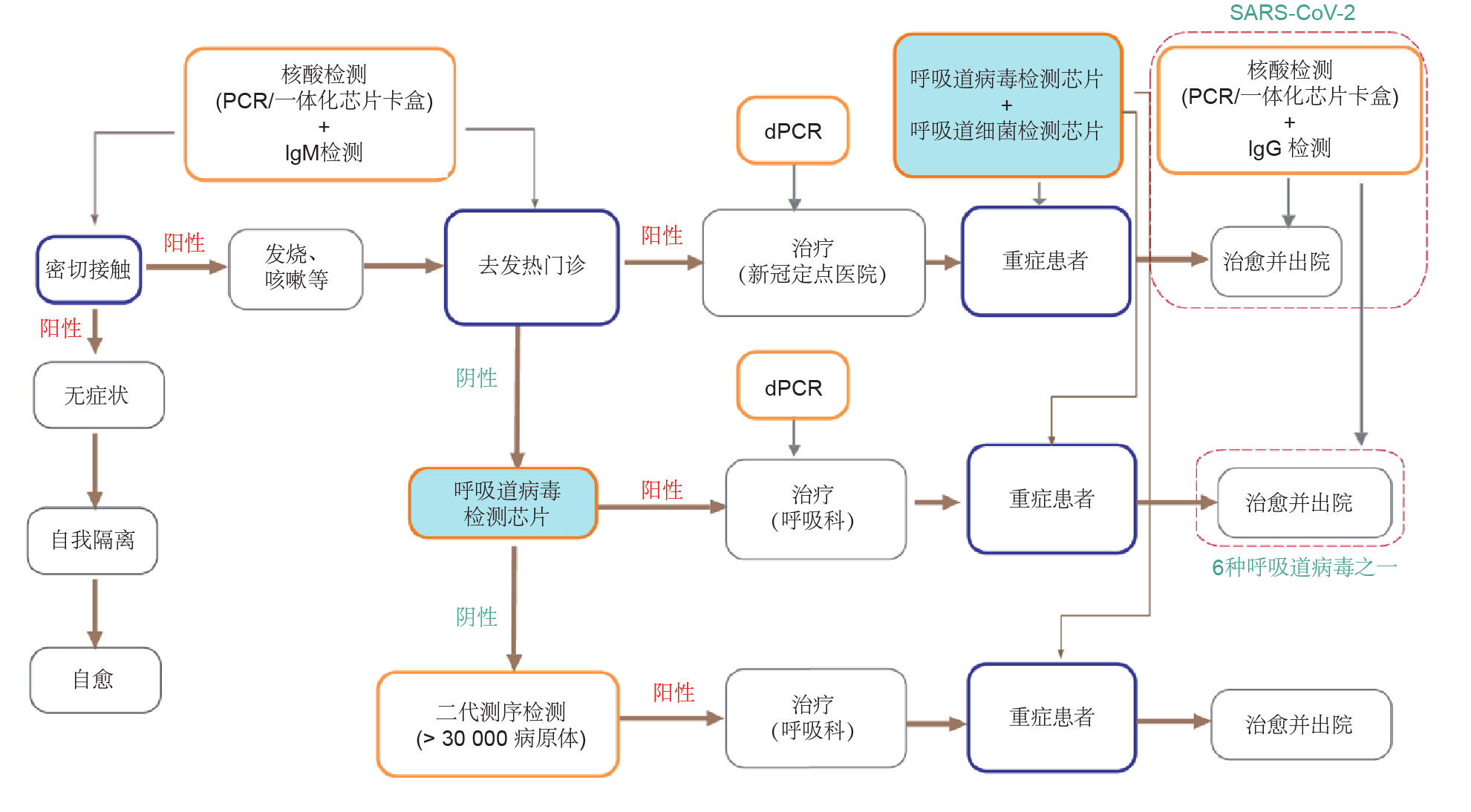
图7. COVID-19检测指南。NGS:第二代测序技术。
《5. 结论》
5. 结论
总之,我们成功开发了一款高通量核酸等温扩增系统,该系统能够在90 min内从16个临床样本中检测出包括SARS-CoV-2在内的19种常见的呼吸道病毒。通过大量临床试验证明了该检测系统具有灵敏度高、特异性好、鲁棒性强和重复性出色等特点,因此在急需知道导致肺炎的确切原因的发热门诊、ICU、医疗检疫区和其他场所,该系统是一个强大的可用作诊断和筛选包括 SARS-CoV-2在内的呼吸道病毒的工具。
《致谢》
致谢
感谢广州医科大学附属第一医院的钟南山院士及其同事提供灭活的病毒样本。感谢北京清华长庚医院的赵秀英医生及其同事,以及首都儿科研究所的崔小岱医生及其同事提供临床样本。本研究受科技部国家重点研究发展计划(2020YFC0847400)与清华大学(20201080055)和广州呼吸健康研究院(2020GIRHHMS02和 2020GIRHHMS03)预防与控制COVID-19科学技术应急响应项目的资助。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Wanli Xing, Yingying Liu, Huili Wang, Shanglin Li, Yongping Lin, Lei Chen, Yan Zhao, Shuang Chao, Xiaolan Huang, Shaolin Ge, Tao Deng, Tian Zhao, Baolian Li, Hanbo Wang, Lei Wang, Yunpeng Song, Ronghua Jin, Jianxing He, Xiuying Zhao, Peng Liu, Weimin Li, and Jing Cheng declare that they have no conflict of interest or financial conflicts to disclose.
《Appendix A. Supplementary date》
Appendix A. Supplementary date
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2020.07.015.













 京公网安备 11010502051620号
京公网安备 11010502051620号




