《1. 引言》
1. 引言
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)是血液肿瘤患者最重要的治疗选择。由于缺乏全相合供者(identical sibling donors, ISD)和非血缘供者(unrelated donor, URD) [1],单倍型造血干细胞移植(haploidentical hematopoietic stem cell transplantation, haplo-HSCT)已经成为中国最重要的替代供者选择之一[2,3]。前期研究通过体外去除T细胞[4,5]以及移植后高剂量环磷酰胺(post-transplantation cyclophosphamide, PTCY)等预处理方案成功克服了人类白细胞抗原(human leukocyte antigen, HLA)不合的屏障[6,7]。北京大学血液病研究所首创非体外去除T细胞的haplo-HSCT体系,通过抗胸腺球蛋白(antithymocyte globulin, ATG)和粒细胞集落刺激因子(granulocyte colony-stimulating factor, G-CSF)成功诱导免疫耐受(即“北京方案”)。“北京方案”已经成为中国最重要的haplo-HSCT方案[8–12],同时也在其他很多国家被成功推广[13–15]。因此,该方案被广泛用于国内外haplo-HSCT中[16]。
但是,复发仍然是导致移植失败最重要的原因之一 [17],因此如何早期识别复发高危患者显得尤为重要。我们发现,进展期急性白血病患者haplo-HSCT后的复发风险显著高于标危患者[18,19]。Armand等[20,21]建立了疾病危险度积分(disease risk index, DRI),通过移植时疾病类型和疾病状态对患者进行危险分层。几项研究已经发现DRI可以预测接受全相合、非血缘和脐带血移植患者的临床预后[22–25]。McCurdy等[26]报道了DRI可以有效地预测接受PTCY方案haplo-HSCT患者的临床预后。但是,DRI在接受“北京方案”的haplo HSCT患者中的有效性还没有得到验证。此外,DRI除疾病特征外,没有考虑患者移植前共患病的负担,主要反映和预测的是移植后疾病复发/进展的风险。
共患病是另一个可以显著影响移植预后的因素。很多研究报道了造血干细胞移植共患病指数(hematopoietic cell transplantation-specific comorbidity index, HCT-CI)可以预测移植患者的生存和移植相关死亡[27–32]。我们也证明HCT-CI可以预测接受“北京方案”haplo-HSCT 患者的临床预后[33]。但是,HCT-CI没有考虑原发疾病的特征,如疾病类型、移植前疾病状态或核型等。
因此,建立一个可以全面评估患者移植前状况(即同时考虑患者共患病和疾病相关特征)的预后积分系统,对于接受haplo-HSCT的患者具有很大的临床意义。 Bejanyan等[34]在接受全相合、非血缘外周血(peripheral blood, PB)或骨髓(bone marrow, BM)移植或脐带血移植的患者中,检验一个整合了DRI和HCT-CI的综合评估体系[即疾病危险度-共患病指数(disease risk comorbidity index, DRCI)]的预测效力。DRCI积分将患者分成6个亚组,两年总生存率(overall survival, OS)在DRCI极低危组和极高危组患者中分别为74%和34%,提示DRCI可以预测造血干细胞移植的预后。但是,这个研究并没有纳入haplo-HSCT的患者。因此,目前缺乏适合接受haplo-HSCT患者的DRCI。
因此,在这项研究中,我们基于一个接受“北京方案”haplo-HSCT的大型队列,验证DRI对移植预后的预测作用。此外,我们还将探讨建立一个适合haplo-HSCT 的DRCI(即haplo-DRCI)。
《2. 材料和方法》
2. 材料和方法
《2.1. 患者》
2.1. 患者
本研究纳入889名2015年1月至2016年12月在北京大学血液病研究所接受haplo-HSCT的血液恶性肿瘤患者。最后的随访日期是2018年12月31日。本研究方案遵从《赫尔辛基宣言》,并且获得北京大学人民医院伦理委员会批准。
《2.2. 移植方案》
2.2. 移植方案
主要的预处理方案包括阿糖胞苷、白消安、环磷酰胺、司莫司汀以及兔ATG [8–10,18,19,35]。25名患者接受基于全身照射(total body irradiation, TBI)的方案。对于难治/复发急性白血病患者,若移植后没有移植物抗宿主病(graft-versus-host disease, GVHD)或严重感染,可以在移植后45~60 d接受预防性供者淋巴细胞回输(见 Appendix A中的补充方法)。
《2.3. 供者选择》
2.3. 供者选择
供者的选择方法见补充方法[36,37]。
《2.4. 定义和评估》
2.4. 定义和评估
DRI的评估基于Armand等[21]提出的标准。对于初诊急性髓系白血病(acute myeloid leukemia, AML), t(8;21)、inv(16)或t(15;17)在不伴复杂核型时归为低危核型,复杂核型(≥4种异常)归为高危核型,中危核型包括正常核型或其他染色体异常。对于骨髓增生异常综合征(myelodysplastic syndrome, MDS)患者,高危核型包括7号染色体异常或复杂核型(≥4处异常),中危核型包括正常核型或其他染色体异常。对于MDS转化AML的患者,细胞遗传学风险依据MDS的标准评估。进展期疾病包括诱导治疗失败或者移植前复发状态,即包括疾病稳定(stable disease)和未接受治疗的复发。依据DRI,患者分为低危、中危、高危和极高危组。HCT-CI依据Sorror等[27]提出的标准进行评定。
复发定义为移植后骨髓原始细胞大于5%,外周血再次发现原始细胞,出现髓外病变或者移植前的染色体异常再次出现和(或)持续存在。非复发死亡(non-relapse mortality, NRM)定义为与疾病复发/进展无关的死亡。无病生存(disease-free survival, DFS)定义为持续缓解且生存的状态。OS的时间定义为从移植开始到死亡/随访终止的时间。
《2.5. 统计分析》
2.5. 统计分析
本研究的主要研究终点是DFS,次要研究终点包括OS、复发和NRM。未复发或死亡的患者截至最后一次随访日期。889名患者随机分入训练队列和验证队列,分别占总队列的67% (n = 593)和33% (n = 296)。我们通过训练队列建立haplo-DRCI,并通过验证队列评估 haplo-DRCI的有效性。DFS的风险比(hazard ratio, HR)是根据单因素和多因素Cox回归分析确定。基于预后因素对应的HR数值,给每个独立预后因素分配一个加权分数,构建haplo-DRCI评分系统并在训练队列中检验其预测DFS的能力。最后,我们在一个已经被Mo等[33] 报道过的独立历史性队列(n = 526)中,进一步验证 haplo-DRCI评分系统的有效性。
本研究通过Kaplan-Meier方法进行生存分析。通过竞争风险计算复发和NRM的累计发生率[38]。P值采用双侧检验。采用SPSS Statistics 20 (IBM, USA)以及R软件包(版本 2.6.1;http://www.r-project.org)进行数据统计分析。
《3. 结果》
3. 结果
《3.1. 患者》
3.1. 患者
表1展示了患者的特征。全部患者的中位随访时间为865 d(范围为18~1498 d),训练队列和验证队列分别为865 d(范围为18~1498 d)和875 d(范围为 24~1456 d)。单倍型移植后3年的累积复发率(cumulative incidence of relapse, CIR)和NRM率分别为15.6% [95%置信区间(confidence interval, CI),13.1%~18.1%]和 20.5% (95% CI, 17.8%~23.2%)。移植后3年的DFS和OS 率分别为64.0% (95% CI, 60.7%~67.3%)和66.8% (95% CI, 63.6%~70.0%)。训练队列和验证队列的临床预后相似(见Appendix A中的表S1)。
《表1》
表1 训练队列和验证队列之间的患者特征

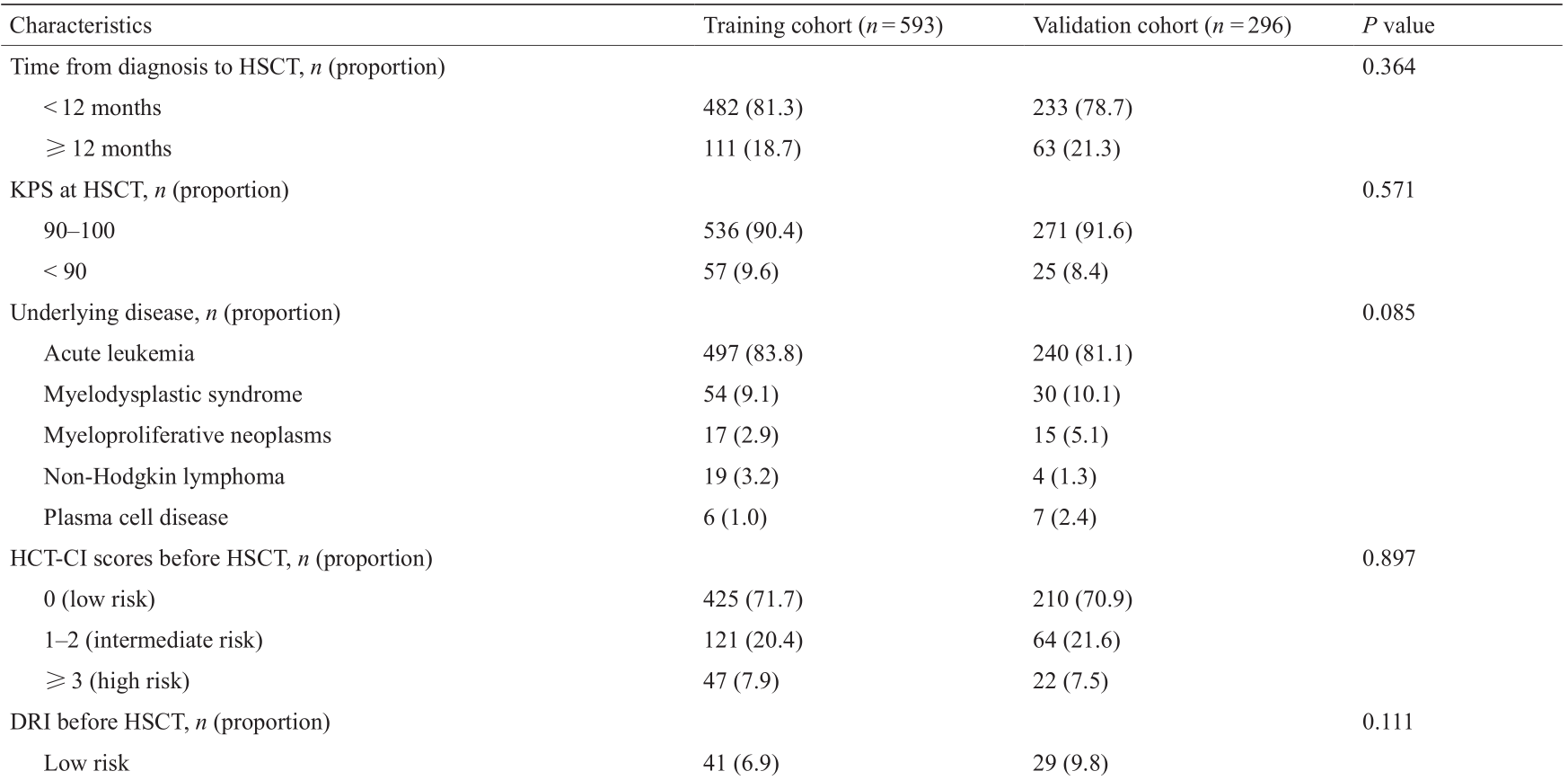


KPS: Karnofsky performance status.
a Minor ABO mismatched indicated that donor possessed isohemagglutinins against recipient red cells, including the following blood group combinations: O (donor) into A, B, or AB (recipient), and A or B (donor) into AB (recipient). Major ABO mismatched indicated that recipient possessed isohemagglutinins against donor red cells, including the following blood group combinations: A, B, or AB (donor) into O (recipient), and AB (donor) into A or B (recipient). Major–minor mismatched indicated that both donor and recipient possessed isohemagglutinins to each other: A into B and vice versa.
《3.2. 在单倍型移植受者中验证 DRI》
3.2. 在单倍型移植受者中验证 DRI
低危和中危DRI患者的临床预后相似。低危DRI患者的CIR、DFS和OS 均显著优于高危DRI患者。低危 DRI患者的所有临床终点均优于极高危DRI患者(见 Appendix A中的表S2)。因此,在之后的分析中,我们将低危和中危DRI患者进行了合并。
《3.3. 在单倍型移植受者中的 HCT-CI》
3.3. 在单倍型移植受者中的 HCT-CI
中危和高危HCT-CI患者移植后3年的DFS相似(P = 0.438),均显著不如低危HCT-CI患者(高危 vs 低危: P = 0.009;中危 vs 低危:P = 0.017)[见Appendix A中的图S1(a)]。中危和高危HCT-CI患者移植后3年的OS也相似(P = 0.203),均显著不如低危HCT-CI患者(高危 vs 低危:P = 0.003;中危 vs 低危:P = 0.033)[见Appendix A中的图S1(b)]。因此,在之后的分析中,我们将中危和高危HCT-CI患者进行了合并。
《3.4. haplo-DRCI 积分系统的建立和验证》
3.4. haplo-DRCI 积分系统的建立和验证
我们通过训练队列建立Cox比例风险模型。纳入的变量包括:移植时患者的年龄(<16岁 vs ≥16岁)、性别、 移植时的Karnofsky功能状态评分(90~100 vs <90)、移 植前的DRI(低危/中危 vs 高危 vs 极高危)、移植前 HCT-CI(低危 vs 中危/高危)、诊断到移植的时间(≥12 个月vs <12个月)、供受者性别关系(女供男 vs 其他)、 供受者关系(母亲供孩子 vs 其他)、供受者血型匹配(大 不合或大小不合 vs 相合或小不合)以及HLA不合(≤2 个位点 vs 3个位点)。
移植时的性别、DRI和HCT-CI在单因素分析中与DFS相关(见Appendix A中的表S3),这三个因素均纳入多因素分析中。多因素模型确认DFS仅有两个独立预测因素,即移植时的DRI和HCT-CI(表2)。因此,我们给极高危DRI赋值2分,给高危DRI以及中危和高危 HCT-CI均赋值1分(见Appendix A中的表S4),然后我们创建了haplo-DRCI积分系统,即低危(分数=0,n = 370)、中危(分数=1,n = 179)和高危(分数≥2,n = 44)。复发或死亡的HR(即由DFS定义的治疗失败),在中危组为1.76 (95% CI, 1.30~2.39),在高危组为4.22 (95% CI, 2.80~6.36) (均以低危组作为参照,总的P值< 0.001,见Appendix A中的表S5)。
在验证队列中,低危、中危和高危组移植后3年的累积DFS率分别为65.2% (95% CI, 58.2%~72.2%)、55.8% (95% CI, 44.9%~66.7%)和32.0% (95% CI, 5.8%~58.2%)(总的P值=0.005)。复发或死亡的HR(即由DFS定义的治疗失败)在中危组为1.40 (95% CI, 0.94~2.09),在高危组为 2.75 (95% CI, 1.41~5.37)(均以低危组作为参照,总的P值 =0.007,见表S5)。
《3.5. 总人群中验证 haplo-DRCI》
3.5. 总人群中验证 haplo-DRCI
我们将haplo-DRCI用于分析总人群的次要终点。我们观察到在总人群中,haplo-DRCI与复发(总P<0.001)、 NRM(总P<0.001)、DFS(总P<0.001)和O S(总 P<0.001)均显著相关[图1(a)~(d)]。在亚组分析中, haplo-DRCI不仅可以预测儿童(<16岁,总的P值=0.010) 和成人[≥16岁,总的P值<0.001,图S2(a)、(b)]的 DFS,还可以预测AML(总的P值<0.001)、急性淋巴细 胞白血病(总的P值<0.001)、MDS/骨髓增殖性肿瘤(总的P值=0.021)以及非霍奇金淋巴瘤/浆细胞性疾病(总的 P值=0.001)患者的DFS [图S3(a)~(d)]。
《表2》
表2 训练队列中DFS相关因素的多因素分析

《图1》

图1. 根据当前队列中的haplo-DRCI分组,各组haplo-HSCT后的临床结局。(a)复发;(b)NRM;(c)DFS;(d)OS。
《3.6. 在独立历史性队列中验证 haplo-DRCI》
3.6. 在独立历史性队列中验证 haplo-DRCI
我们还在一个独立历史性队列中验证了haplo-DRCI (n = 526)的有效性。这个历史队列的共患病负担显著高于现有队列。而且,高危和极高危DRI患者在历史队列中也更常见。患者的年龄、HLA不合以及供受者关系在现有和历史队列之间也存在显著差异(表S6)。但是,在这个独立的历史队列中,haplo-DRCI分数的增加同样与复发率升高(总的P值<0.001)、NRM升高(总的P 值=0.001)、DFS降低(总的P值<0.001)和OS降低(总 的P值<0.001)显著相关[图2(a)~(d)]。
《图2》

图2. 根据历史队列中的haplo-DRCI分组,各组haplo-HSCT后的临床结局。(a)复发;(b)NRM;(c)DFS;(d)OS。
《4. 讨论》
4. 讨论
在这项研究中,我们将DRI和HCT-CI有机结合建立的haplo-DRCI,可以有效预测haplo-HSCT患者的复发、死亡和生存,尤其是对于急性白血病患者。因此,本研究首先提出了一个全面的积分系统,可以同时评估接受 haplo-HSCT患者的共患病和疾病特征。
尽管HCT-CI和DRI均可以预测移植后的生存 [26,33],但是HCT-CI只关注了患者共患病的负担,而 DRI只关注了原发病的特征,因此单独使用DRI或 HCT-CI均不能全面预测移植预后。因为DRI和HCTCI是仅有的两个在多因素分析中可以独立预测DFS的因素,我们将它们有机整合,发现haplo-DRCI可以有效地区分低危、中危和高危患者之间的DFS。因此, haplo-DRCI有助更全面地评估接受haplo-HSCT患者的临床预后。
在高危haplo-DRCI组,复发率和NRM率分别为 36.6%和33.4%,DFS率仅为30.0%。这些患者在移植前患有进展期疾病(高危或极高危DRI)和高共患病负担(HCT-CI≥1),表明不仅他们的疾病进展的风险高,而且他们对药物毒性和移植并发症更加脆弱。类似地, Bejanyan等[34]报道了同时具备高危DRI和高危HCT-CI 的患者的OS最差。非清髓预处理方案可能有助于减轻预处理毒性;但是,接受非清髓预处理方案患者的复发率显著高于接受清髓预处理的患者,尤其是对于难治/ 复发白血病的患者[39,40]。因此,如何在控制预处理毒性的基础上预防移植后复发,对于改善高危haplo-DRCI 患者的预后十分重要。
欧洲血液和骨髓移植学会(European Group for Blood and Marrow Transplantation, EBMT)评分是用于预测allo-HSCT预后的常用评分系统。EBMT评分是基于接受移植的慢性髓系白血病(chronic myeloid leukemia, CML)患者提出[41],可用于预测多种血液恶性肿瘤患者的移植预后[42]。基于EBMT评分,Wang等[43] 提出了单倍型EBMT评分(即haplo-EBMT),其中包含移植前疾病状态、移植时患者的年龄、诊断到移植的时间、供受者性别组合以及HLA不合位点。移植前疾病状态是最重要的移植预后因素[18,19,44],但其他四个因素对移植预后的预测价值存有争议。一些研究发现诊断到移植时间、患者年龄、女性供者/男性受者以及HLA 不合并不会影响haplo-HSCT患者的生存[18,45–48],而我们当前的研究同样没有观察到这四个因素和DFS之间的相关性。因此,我们认为haplo-EBMT评分对预后的预测可能主要反映的是移植前疾病状态对预后的影响。另一方面,这表明共患病和DRI对于接受haplo-HSCT的患者具有更重要的预后价值,但这两个积分的大部分内容并没有包含于haplo-EBMT评分中。因此,EBMT和 haplo-EBMT风险评分不能全面反映接受haplo-HSCT患者的特征。
我们观察到低危和中危DRI患者复发、NRM和生存均相似。在Armand等[21]的研究中,低危DRI组的 OS显著优于中危DRI组(P<0.001)。但是,Beauverd等 [22]在接受非体外去除T细胞allo-HSCT的患者中观察 到,低危和中危DRI组的OS分别为63%和54%。Törlén 等[24]同样报道了低危和中危DRI组患者临床预后相 似,这两组中大部分患者的原发病为白血病(337/521), 而且接受ATG为基础的预处理方案(371/521)。 Paviglianiti等[25]的研究结果显示,接受清髓预处理 的低危和中危DRI患者的OS相似。因此,在本次研 究中,大部分患者为急性白血病患者,且都接受基于 ATG的清髓预处理方案,这或许可以解释低危和中危 DRI患者的临床预后相似。尽管McCurdy等[26]在一个haplo-HSCT队列中观察到,中危DRI组全因死亡的风险是低危DRI组的两倍(HR=2.11; P = 0.0009),但那个研究的所有患者均接受非清髓的PTCY预处理方案,并且只有1/3的患者原发病为白血病,这与本研究患者的特征存在显著差异。
我们已经报道了尽管HCT-CI可以预测haplo-HSCT 的临床预后,但是低危和中危HCT-CI组的复发、NRM 和生存率均相似[33]。但在本研究中,低危HCT-CI组的生存情况显著优于中危HCT-CI组。我们观察到当前队列的共患病负担比前期报道的历史队列低,这可能是因为基于前期的研究(表S6),我们加强了移植前共患病的筛查,一些有高共患病负担的患者不再接受 allo-HSCT。但即使这样,我们在共患病负担更高的历史队列中同样证实了haplo-DRCI的有效性。
这项研究有几点缺陷。首先,这是一个单中心研究,尽管纳入了889名患者,并通过一个较大的独立历史队列进行验证,但是极高危DRI患者的样本量仍较小,这可能会影响haplo-DRCI对临床结局预测的有效性。其次,超过80%患者的原发病为急性白血病,而其他疾病(如骨髓增殖性肿瘤、淋巴瘤和浆细胞疾病)患者的比例较低。因此,在这些患者中haplo-DRCI的有效性仍需要进一步验证。最后,一些分子标志可以预测急性白血病患者的复发和生存,它们可能有助于将正常核型患者进一步危险分层并优化haplo-DRCI。
《5. 结论》
5. 结论
上述结果证明haplo-DRCI可以有效地对接受haploHSCT的患者进行危险分层,积分系统计算方便,为预测哪些患者更能获益于haplo-HSCT提供了有力的工具。
《致谢》
致谢
作者感谢于文静医生在收集数据方面的帮助。这项工作得到国家重点研发计划(2017YFA0104500)、国家自然科学基金创新研究群体项目(81621001)、国家自然科学基金重点项目(81930004)、首都卫生发展科研专项(2018-4-4089)、中国医学科学院血液恶性疾病诊治关键技术创新单元(2019-I2M-5-034)、广东省科技计划(2016B030230003)、广州市卫生协同创新项目(201704020214)以及北京大学临床科学家计划(BMU2019LCKXJ003)的支持。
《作者贡献》
作者贡献
莫晓冬和黄晓军设计了该研究。许兰平、张晓辉、王昱、闫晨华、陈欢、陈育红、韩伟、王峰蓉、王景枝和刘开彦提供了研究数据。莫晓冬和黄晓军参与数据分析并完成文章的写作。所有的作者都在数据阐述、文章准备以及文章最后版本的敲定中作出了贡献。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Xiao-Dong Mo, Xiao-Hui Zhang, Lan-Ping Xu, Yu Wang, Chen-Hua Yan, Huan Chen, Yu-Hong Chen, Wei Han, Feng-Rong Wang, Jing-Zhi Wang, Kai-Yan Liu, and Xiao-Jun Huang declare that they have no conflict of interest or financial conflicts to disclose.
《Nomenclatures》
Nomenclatures
ALL acute lymphoblastic leukemia
Allo-HSCT allogeneic hematopoietic stem cell transplantation
AML acute myeloid leukemia
ATG antithymocyte globulin
BM bone marrow
CI confidence interval
CIR cumulative incidence of relapse
CML chronic myeloid leukaemia
DFS Disease-free survival
DRCI disease risk comorbidity index
DRI disease risk index
EBMT European Group for Blood and Marrow Transplantation
G-CSF granulocyte colony-stimulating factor
GVHD graft-versus-host disease
Haplo-HSCT haploidentical related donor hematopoietic stem cell transplantation
HCT-CI Hematopoietic Cell Transplantation-Specific Comorbidity Index
HLA human leukocyte antigen
HSCT hematopoietic stem cell transplantation
HR hazard ratio
ISD identical sibling donor
MDS myelodysplastic syndrome
NHL non-Hodgkin lymphoma
NRM non-relapse mortality
OS overall survival
PB peripheral blood
PTCY post-transplantation cyclophosphamide
TBI total body irradiation
URD unrelated donor
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2020.12.005.














 京公网安备 11010502051620号
京公网安备 11010502051620号




