《1. 研究背景》
1. 研究背景
在5-FU/亚叶酸钙作为转移性结直肠癌(metastatic colorectal cancer, mCRC)主要治疗方法的年代,患者的中位总生存期(overall survival, OS)停滞在约 8~12个月[1]。而随着2000年伊立替康和奥沙利铂这两种化疗药物的引入,奥沙利铂联合5-FU/亚叶酸钙的化疗方案(FOLFOX)以及伊立替康联合5-FU/亚叶酸钙的化疗方案(FOLFIRI)成为了mCRC的标准一线化疗[2]。此外,如抗血管生成受体(anti-VEGF,抗-VEGF)和抗表皮生长因子受体(anti-EGFR,抗-EGFR)等选择性作用于癌症进展过程中的关键途径的靶向生物治疗,也进一步延长了mCRC的生存期 [3‒5]。
在mCRC的治疗中的另一个重要进展是:通过外科切除局限肝转移病灶达到无瘤状态(no evidence of disease, NED)可获得长期生存[6,7]。在mCRC患者中,大约30%~50%的患者在疾病诊断或疾病复发时伴有肝转移,而其中约15%~25%的肝转移为初始可切除状态[7‒9]。根据回顾性研究结果显示,结直肠癌肝转移患者接受R0肝转移灶切除后五年总生存率超过50% [10,11]。另外,越来越多的证据表明对于肝转移灶无法切除或切除后复发的患者,可将射频消融(radiofrequency ablation, RFA)和立体定向放射治疗(stereotactic body radiation therapy, SBRT)作为合理的替代方案[12,13]。而且,对于mCRC肝转移的局部治疗手段目前也被常规应用于mCRC肺转移[14‒16]。但是,在当下,特别是在mCRC靶向治疗时代,对于 mCRC肝或肺转移的局部治疗仍缺乏随机研究证明其疗效,因为目前探讨该问题的随机临床试验既不符合伦理,也不可行。
随着上述在mCRC治疗手段的改进,在北美洲和欧洲一些国家的mCRC患者中可观察到治疗模式的改变[17,18]。在中国,真实世界的临床实践与mCRC 患者的临床标准治疗指南之间仍存在较大差距[19];同时,中国mCRC患者的生存结果较发达国家要差 [20,21]。然而,由于中国的mCRC患者缺乏高质量、大规模的真实世界证据,提高mCRC的治疗质量是否能够提高患者的生存和缩小与发达国家的差距,目前尚不明确。为此,我们进行了一项大规模的回顾性队列研究,旨在评估不同年份中mCRC患者的系统性治疗及局部治疗应用情况的变化趋势,并探讨不同年份间mCRC治疗手段的进步是否可带来患者生存的改善。
《2. 方法学》
2. 方法学
《2.1. 研究人群和数据提取》
2.1. 研究人群和数据提取
该研究是一项单中心回顾性队列研究。本研究纳入18岁及以上、经中山大学肿瘤防治中心病理确诊为mCRC患者。具体的纳排情况如附录A中的图 S1所示。
本研究考察的变量包括有患者年龄、性别、美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、确诊时间、原发灶位置、转移部位、鼠Kirsten肉瘤病毒致癌基因同源物(v-Ki-ras2 Kirsten rat sarcoma viral oncogene homolog, kras)或神经母细胞瘤ras病毒癌基因同源物(neuroblastoma ras viral oncogene homolog, nras)第2~4外显子以及鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog B1, braf)V600E位点的突变状态、手术、RFA、SBRT以及全身性治疗。本研究数据从整合了中国多家医疗中心以及医院信息的智能医疗数据平台结直肠癌大数据中心(Big-Data Alliance for Colorectal Cancer, BACC)(中国医渡云技术有限公司)中提取。该平台通过机器学习和人工智能算法将住院信息(如入院、出院、转科、监护等)、电子病历信息,以及放射和核医学影像、内镜、超声、心电图、病理和实验室检查信息模块化、标准化、集成化,整合成图表,研究者可以按时间轴查看患者的诊疗信息,这为临床诊疗常规工作及科研实践带来了便利。
本研究所有患者均签署了在医院数据库中储存和使用他们信息的知情同意书。本研究已获得中山大学肿瘤防治中心独立伦理委员会批准,并依据赫尔辛基世界医学协会宣言伦理标准进行。
《2.2. 结局指标》
2.2. 结局指标
本研究关注的结局指标是mCRC患者的OS以及全身性治疗和局部治疗使用率的时间变化趋势,其中考察的全身性治疗和局部治疗包括:①细胞毒药物(氟尿嘧啶类、奥沙利铂和伊立替康等);②靶向治疗药物[西妥昔单抗、贝伐珠单抗和(或)瑞戈非尼等];③肝转移、肺转移、肝外和(或)肺外转移病灶的局部治疗[手术切除、RFA和(或)SBRT];④初始接受局部治疗;以及⑤初始接受全身性治疗随后接受局部治疗。我们还评估了全身性治疗、局部治疗、联合全身及局部治疗后达到NED(即无瘤状态)患者比例的时间变化趋势。本研究收集了患者在本中心从首次诊断mCRC到末次就诊期间的治疗信息。OS的定义为从首次诊断mCRC开始到因任何原因死亡或末次随访时间之间的时间。
《2.3. 统计分析》
2.3. 统计分析
本研究应用Clopper-Pearson法确定治疗方式使用率的95%置信区间(confidence interval, CI),使用 Kaplan-Meier法绘制生存曲线,采用log-rank法检验不同生存曲线间的差异,并构建Cox比例风险模型,以评估校正年龄、性别、体能状态评分、原发灶位置、转移部位数目以及分子分型后的OS风险比(hazard ratio, HR)和相应的95% CI。
所有假设检验均为双侧检验,P < 0.05为有统计学差异。所有统计分析使用R(3.6.1版本)† 软件进行。† http://www.r-project.org
考察的OS指标包括中位OS和5年OS率。
《3. 结果》
3. 结果
《3.1. 患者基线特征及治疗情况》
3.1. 患者基线特征及治疗情况
本研究共纳入中山大学肿瘤防治中心2012年7 月至2018年12月3403名符合条件的mCRC患者(图 S1)。患者的基线特征总结如附录A的表S1所示。大部分研究对象为男性患者、年龄小于65岁、体力状况轻度下降、左半肠癌和(或)伴有肝转移。34.3% 的患者有检测ras/braf 基因是否突变,这部分患者中大部分为ras 突变。
本中心患者从首次诊断为mCRC到在本中心开始进行局部或全身性治疗的中位时间为1.0个月(四分间距是0.5~3.4)。43.4% mCRC患者在整个治疗过程中接受过转移灶局部治疗[即手术切除、RFA和(或) SBRT],包括肝转移(32.0%)、肺转移(12.1%)、肝外和(或)肺外转移(7.1%)。948名患者达到NED 状态(占所有患者的27.9%,占接受局部治疗患者的 64.2%)。接受全身性治疗患者(共2978人)接受的药物治疗情况如下:氟尿嘧啶类(99.2%)、奥沙利铂(94.1%)、伊立替康(56.7%)、贝伐珠单抗(38.5%)、西妥昔单抗(17.5%)、瑞戈非尼(4.8%)以及其他药物(9.3%)。
《3.2. 接受局部治疗与否的生存结局》
3.2. 接受局部治疗与否的生存结局
本研究的中位随访时间是32.8个月(95% CI, 31.5~33.9),整个队列的中位OS是42.8个月[95% CI, 40.7~46.6;图1(a)]。其中仅使用全身性治疗的患者中位OS是25.6个月(95% CI, 24.7~26.9);而接受局部治疗患者则尚未达到中位OS(95% CI, 78.6个月至未达到),5年OS率为59.8%(95% CI, 56.0%~63.9%)。转移灶局限于肝和(或)肺并接受局部治疗患者的 5年OS率是61.0%(95% CI, 56.9%~65.3%),而伴有肝外和(或)肺外转移并接受局部治疗患者5年OS 率是53.5%(95% CI, 43.9%~65.3%)(附录A中的图 S2)。此外,NED的患者5年OS率是72.8% [95% CI, 68.7%~77.2%;图1(b)]。
《图1》
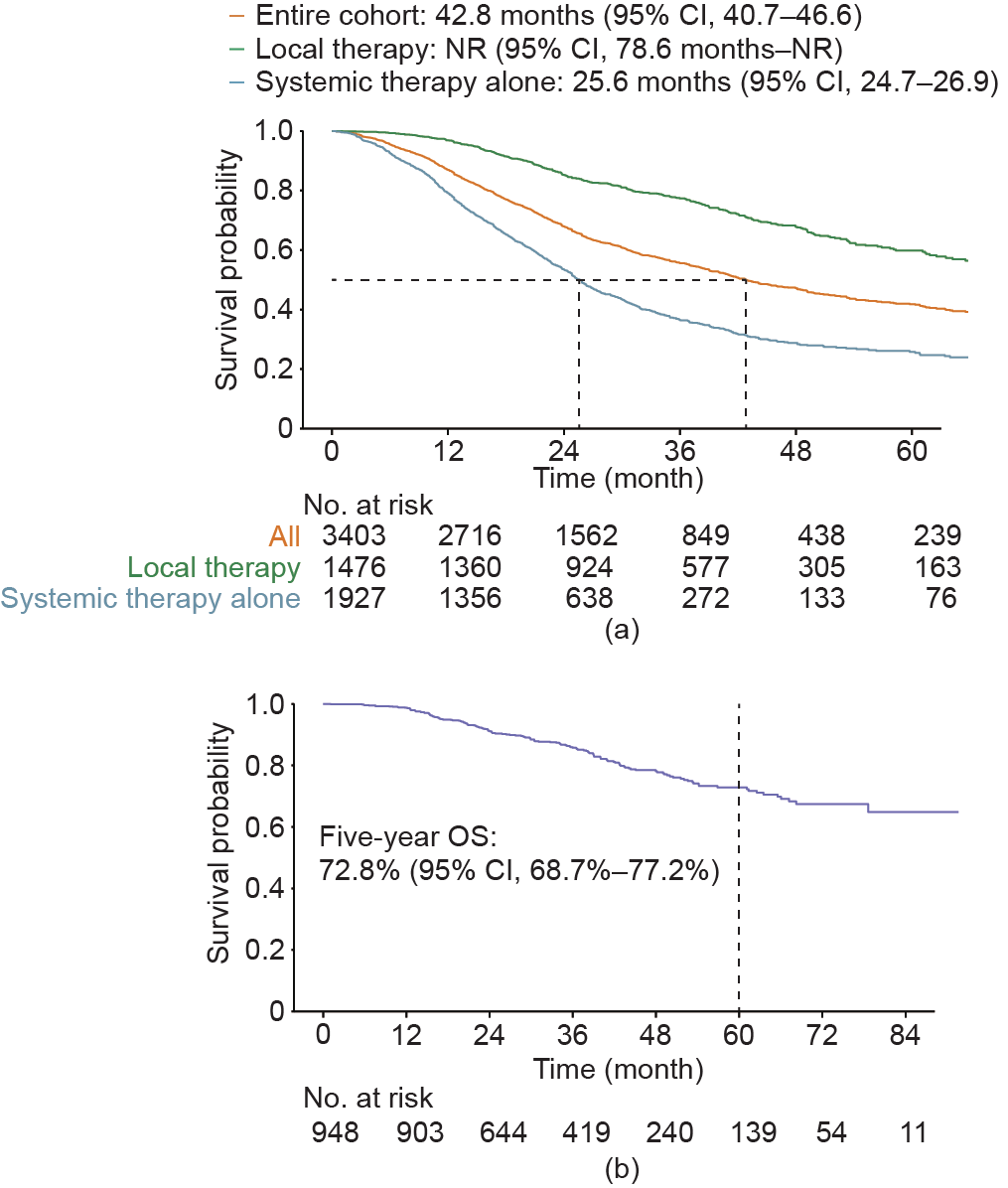
图1. (a)全组患者、接受了局部治疗的患者、仅接受了全身性治疗的患者的OS情况;(b)达到NED的患者的OS情况。NR:未达到。
《3.3. 全身性治疗和局部治疗的时间变化趋势》
3.3. 全身性治疗和局部治疗的时间变化趋势
为保证不同年份亚组的样本量可比性,本研究将纳入的患者按照诊断年份分组:2012—2014年(1044 人)、2015—2016年(1135人)、2017—2018年(1224 人)。由于本研究队列样本量较大,虽然不同年份亚组中体力评分和分子分型存在组间不均衡,但各年份亚组之间的绝对差值较小(附录A中的表S2)。
如图2(a)所示,3个年份组别均有超过50% 的患者接受过了全部3种细胞毒性药物治疗(即氟尿嘧啶类、奥沙利铂、伊立替康)。此外,西妥昔单抗和贝伐珠单抗任一种药物的使用率从2012— 2014 年的39.9%(95% CI, 36.7%~43.2%),略微增加至2015—2016年的43.2%(95% CI, 40.0%~46.4%),而到了2017—2018年则明显增至60.3%(95% CI, 57.3%~63.2%)。西妥昔单抗和贝伐珠单抗两种药物均使用过的患者比例也存在类似趋势。另外,瑞戈非尼使用率也不断升高。
如图2(b)所示,局部治疗的使用率不断升高, 2012—2014年的局部治疗使用率是37.9%(95% CI, 35.0%~41.0%),2015—2016年是44.6%(95% CI, 41.7%~47.5%),2017—2018年则增至46.9%(95% CI, 44.1%~49.7%)。其中,肝转移局部治疗率随年份不断升高,但3个不同年份亚组中肺转移或肝外和(或)肺外转移局部治疗的使用率则大致相当。此外,各年份亚组中接受局部治疗作为初始治疗的患者的比例较为接近,接受全身性治疗后再进行局部治疗的患者比例则不断上升,从2011—2014年的17.5%(95% CI, 15.3%~20.0%),增至2015—2016年的21.7%(95% CI, 19.3%~24.2%),2017—2018年则更进一步增长到28.2%(95% CI, 25.7%~30.8%)。而且,NED患者的比例也在不断上升,2012—2014年为23.4%(95% CI, 20.8%~26.1%),2015—2016年增至26.7%(95% CI, 24.1%~29.4%),2017—2018年则达到32.8%(95% CI, 30.1%~35.5%)[图2(b)]。
《图2》

图2. mCRC全身性治疗手段(a)及局部治疗手段(b)的使用率随年份变化的趋势。为保证各组样本量可比性,将患者按诊断年份分为2012— 2014年(n = 1044)、2015—2016年(n = 1135)、2017—2018年(n = 1224)三个时间组。系统治疗模式的时间变化分析仅纳入了接受了全身性治疗的患者(n = 2978)。
《3.4. 治疗模式的时间变化与生存结局之间的关系》
3.4. 治疗模式的时间变化与生存结局之间的关系
考虑到治疗模式和中位随访时间的时间变化,我们进一步定义了以下年份分组用于后续生存分析:①2012—2014年[对照组;中位随访65.3个月(95% CI, 63.3~66.7)];②2015—2016年[局部治疗的应用明显增多而靶向治疗的应用无明显增加;中位随访42.2 个月(95% CI, 40.9~42.8)];以及③2015—2018年[局部治疗和靶向治疗的使用率均增加;中位随访27.7个月(95% CI, 27.0~28.7)]。
与2012—2014年的患者相比,2015—2016年的患者的OS显著延长[42.1个月(95% CI, 37.9~50.0) vs 33.9个月(95% CI, 31.0~38.0);HR = 0.87 (95% CI, 0.78~0.99);P = 0.034;图3(a)]。然而,对于仅接受全身性治疗的患者,两组OS没有显著差异 [22.9个月(95% CI, 21.1~25.1)vs 24.4个月(95% CI, 22.6~26.1);HR = 0.99 (95% CI, 0.86~1.14);P = 0.889;图3(b)]。
《图3》
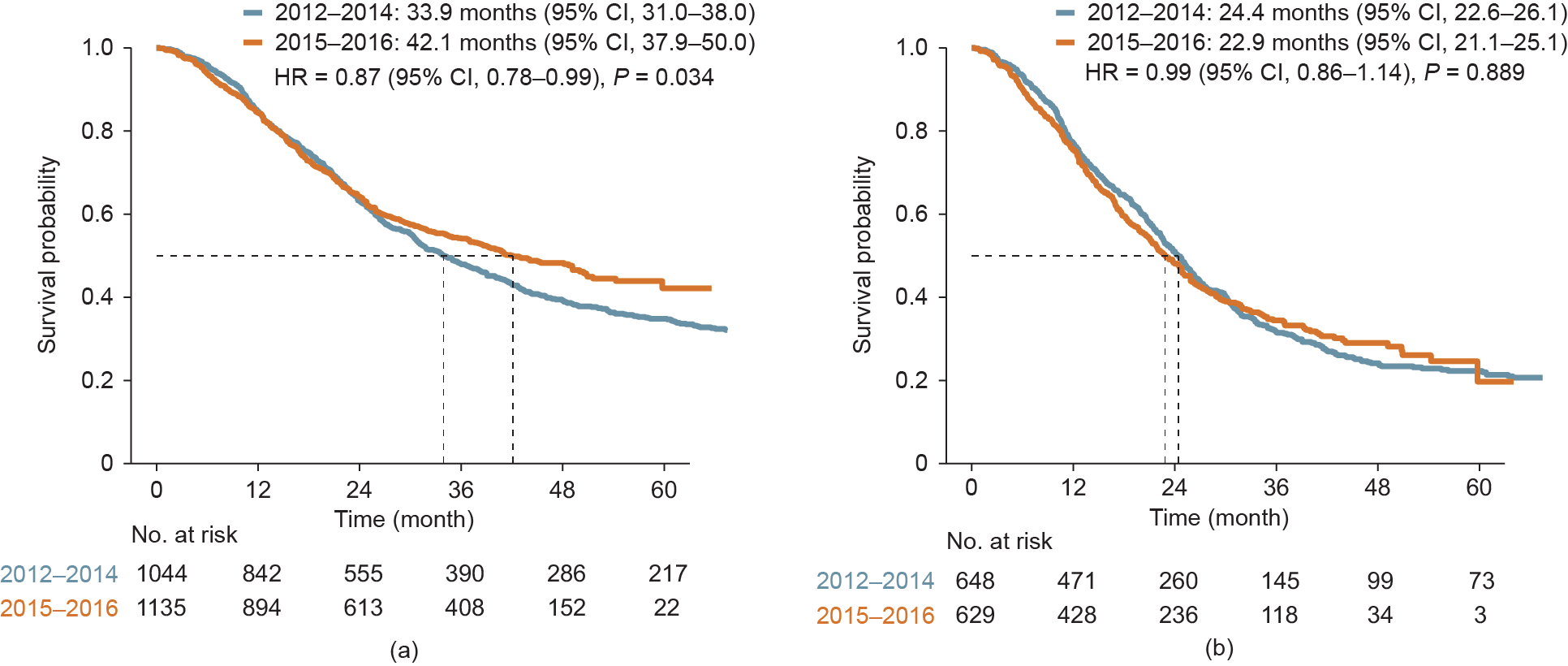
图3. 2015—2016年的mCRC患者与2012—2014年的患者的OS对比。(a)全人群;(b)仅接受全身性治疗的患者。
与2012—2014年相比,2015—2018年的患者的中位OS显著延长,达到51.6个月(95% CI,49.1个月至未达到)[HR = 0.75 (95% CI, 0.70~0.81); P < 0.001;图4(a)]。而对于仅接受全身性治疗的患者,与2012—2014年相比,2015—2018年患者的OS也显著延长[24.4个月(95% CI, 22.6~26.1)vs 26.5个月(95% CI, 25.0~29.3)] [HR = 0.83 (95% CI, 0.77~0.91); P < 0.001;图4(b)]。
《图4》
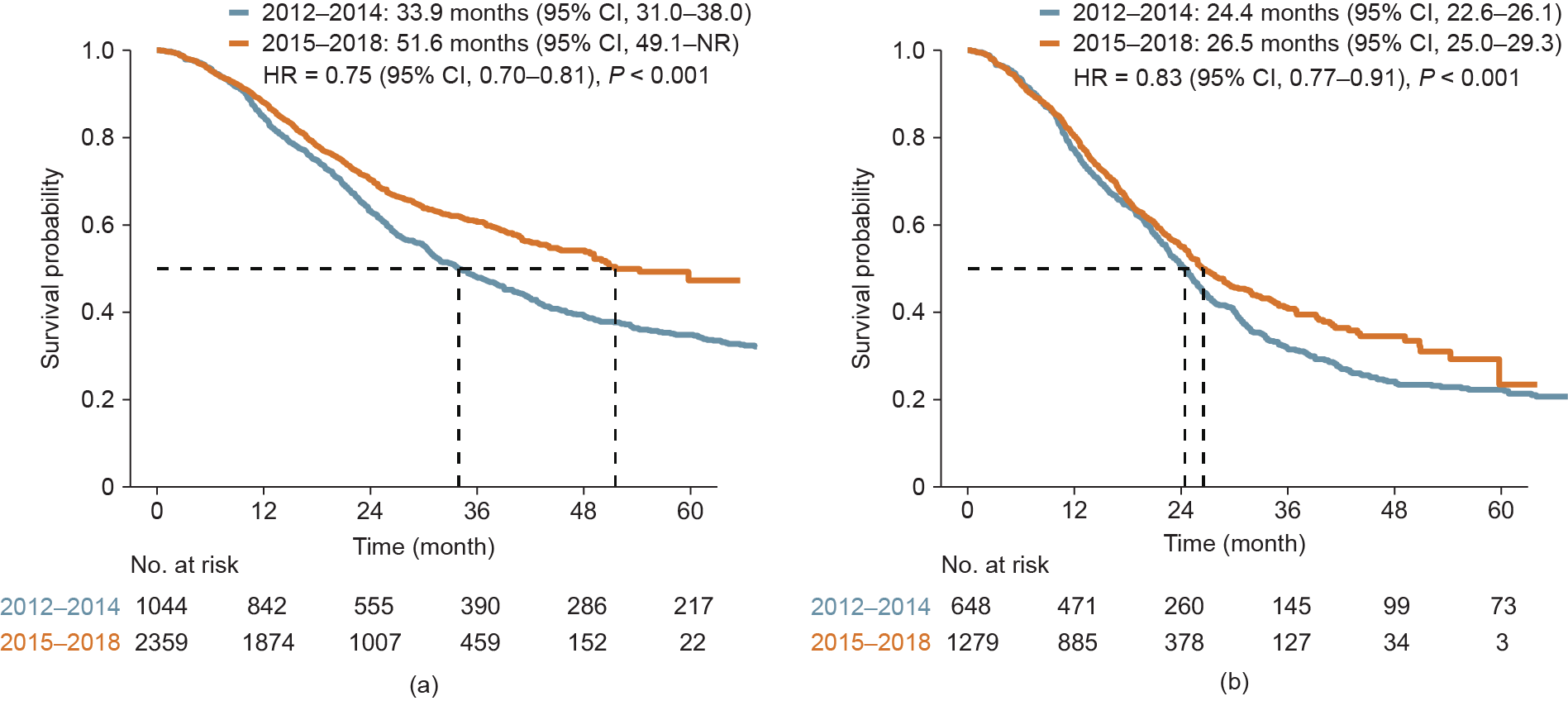
图4. 2015—2018年的mCRC患者与2012—2014年的患者的OS对比。(a)全人群;(b)仅接受全身性治疗的患者。
《3.5. 原发肿瘤部位的亚组分析》
3.5. 原发肿瘤部位的亚组分析
如图S3(a)所示,本研究队列中西妥昔单抗的使用率的增加主要限于左半肠癌的患者,而贝伐珠单抗的使用率在右半肠癌患者中的增加更为显著。此外,在左半和右半肠癌亚组中均观察到局部治疗使用率的增加[图S3(b)]。在2012—2014年和2015— 2016年,左半肠癌患者局部治疗的使用率高于右半肠癌患者;但随着时间的推移该差距逐渐缩小,到 2017—2018年左、右半肠癌亚组之间局部治疗的使用率大致相当(均大约为45%)[图S3(b)]。
总的来说,右半肠癌患者的中位OS显著低于左半肠癌患者[37.1个月(95% CI, 31.8~42.1)vs 43.4个月(95% CI, 40.7~48.5);HR = 1.21 (95% CI, 1.06~1.37); P = 0.005;图5(a)]。在仅接受全身性治疗的患者中,原发肿瘤部位仍然是一个重要的预后因素,右半肠癌患者的OS显著低于左半肠癌患者[21.7个月(95% CI, 19.8~24.2)vs 26.7个月(95% CI, 25.2~29.9);HR = 1.24 (95% CI, 1.07~1.44); P = 0.005;图5(b)],而接受局部治疗的左半肠癌患者与右半肠癌患者的OS则相当[HR = 0.92 (95% CI, 0.70~1.21); P = 0.571;图5(c)]。
《图5》
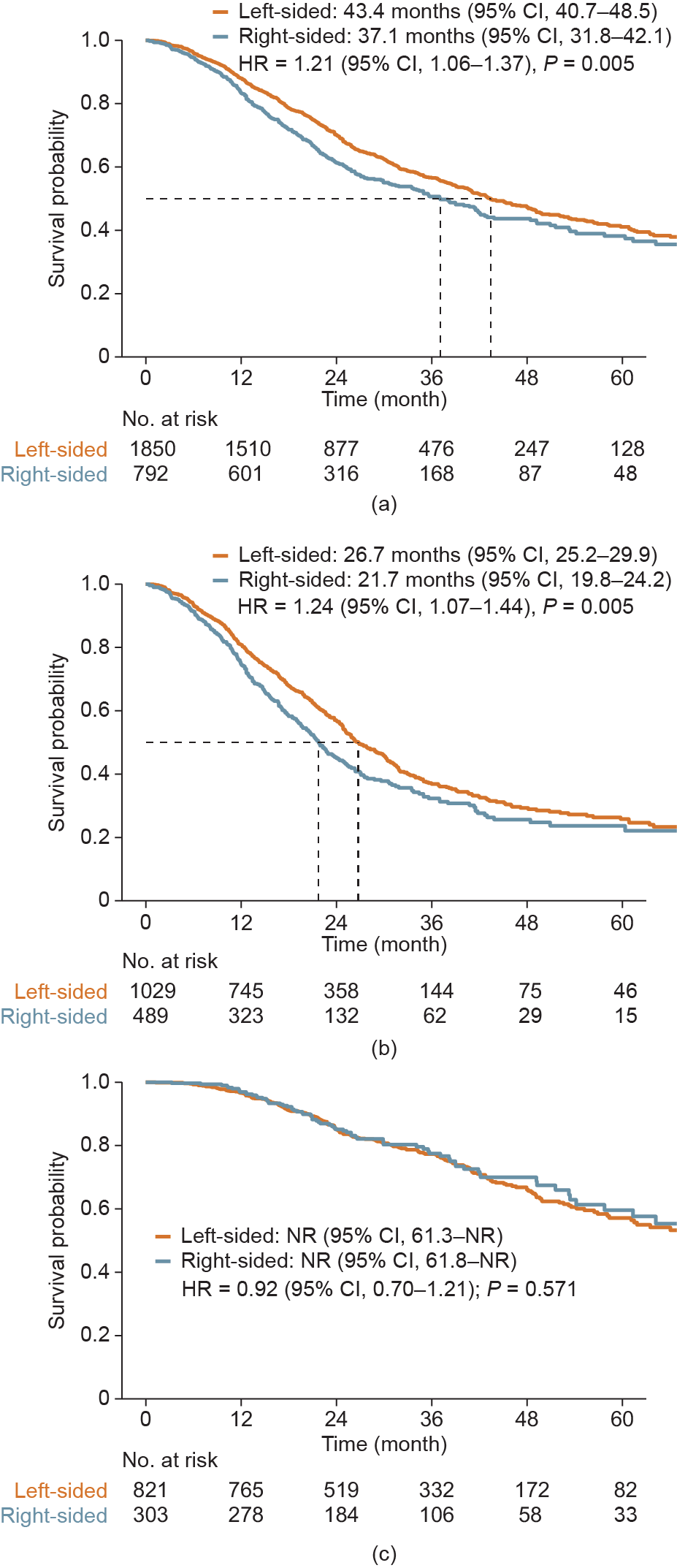
图5. 右半及左半肠癌患者的OS对比。(a)全人群;(b)仅接受全身性治疗的患者;(c)接受局部治疗的患者。
《4. 讨论》
4. 讨论
本项来自中山大学肿瘤防治中心的mCRC队列研究,是国内迄今为止最大规模的、拥有详细治疗和结局信息的mCRC队列研究。在此队列中,我们阐明了 mCRC治疗进展以及伴随的生存结果的改善主要发生在两个阶段。第一个阶段是2015—2016年,这个阶段局部治疗的使用率上升,但靶向治疗的使用率无明显增加。相应地,OS的改善仅在全部人群中观察到,而在仅接受了全身性治疗的人群中并未观察到。第二个阶段开始于2017年,该阶段中靶向治疗的使用率、全身性治疗后进行局部治疗的比例均明显升高;OS 的改善不仅在全人群中能观察到,在2015—2018年仅接受全身性治疗的人群中也能观察到。除了观察到的局部治疗和靶向治疗以及多模式治疗策略效用的增加之外,患者生存率的提高也一定程度上反映了中山大学肿瘤防治中心过去十年里在研发抗肿瘤新药、新治疗策略以及制定结直肠癌临床实践指南和共识这些方面的不懈努力[22‒29]。
对于mCRC肝转移的患者而言,仅有15%~25%的患者的肝转移病灶为初始可切除状态[7‒9]。转化治疗(无论是否加用抗-EGFR或抗-VEGF单抗)已经被证实可以将特定的mCRC肝转移患者从不可切除病灶转化为可切除,文献报道的转化率波动于13% 至超过40% [30‒33]。并且,尽管缺乏相关临床证据,对于mCRC肝转移的局部和转化治疗策略也被广泛应用于mCRC肺转移的患者。在本研究队列中,局部治疗[包括肝、肺或肝外和(或)肺外转移灶的外科切除、射频消融和(或)立体定向放疗等]作为初始治疗的使用率停滞在大约20%,而全身性治疗后再进行局部治疗的使用率则在2017年后持续上涨,在2017— 2018年局部治疗的使用率已达到47%。更为重要的是,随着全身性治疗和(或)局部治疗的进展,获得 NED患者的比例逐年上升,在2017—2018年已超过了30%;此外,这些达到NED的患者的五年生存率达到了73%,与接受R0肝切除术的仅有肝转移的mCRC 患者相当[10,11]。综上所述,这些发现提供了有力的临床证据,阐明了恰当的局部治疗可以使特定mCRC 患者实现长期生存;并凸显了多学科讨论及合作对于制定最佳的多模式治疗策略(如针对mCRC患者的全身和局部治疗的时机以及全身性治疗和局部治疗手段的选择)的重要性。
在过去的数十年中,越来越多的证据表明抗-EGFR治疗在右半肠癌中的疗效较左半肠癌差 [34‒37]。这些数据使得美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)结肠癌指南建议在ras 野生型的右半肠癌患者的一线治疗中避免使用抗-EGFR治疗[38]。值得注意的是,早在 NCCN指南更新这项建议之前,在本研究队列中已可观察到西妥昔单抗的使用率的增加主要限于左半肠癌的患者的现象,这反映了中山大学肿瘤防治中心对 mCRC的治疗水平已到国际先进水平[39]。此外,既往研究结果表明,无论全身性治疗的方案如何,原发肿瘤部位是mCRC患者生存结果的预测指标[34,40]。在本研究中,接受全身性治疗的右半肠癌患者的OS 显著低于左半肠癌患者,这与既往的研究结果相一致。但是对于仅接受了局部治疗的患者而言,右半肠癌和左半肠癌的OS相当,这也与既往研究中右半肠癌患者在根治性肝切除术后获得良好生存的结果相一致[41,42]。更为重要的是,即便在2017年前右半肠癌亚组接受局部治疗的比例较左半肠癌亚组低,到了2017—2018年左右半亚组的局部治疗的使用率已经相当(均大约为45%),这可能与全身性治疗手段和多学科管理的进步有关。
尽管既往有研究表明亚洲结直肠癌患者相较高加索患者可能有更长的OS [43],但先前的证据表明中国mCRC患者的生存结果明显比发展国家的患者差 [17,18]。一个可能的解释是经济情况的差异,即使在2017年(西妥昔单抗和贝伐珠单抗被纳入国家医保目录),这两种靶向药物在中国的使用率仍然低于发展国家[24]。并且,最近的一项多中心研究表明,中国的临床实践与mCRC的临床指南之间存在巨大差异 [19]。值得注意的是,本研究提供了令人鼓舞的数据:作为中国排名前两位的癌症中心之一,中山大学肿瘤防治中心经治的mCRC患者的中位OS已达到43个月。亚组分析结果则显示接受局部治疗的患者和仅接受全身性治疗的患者的生存结果与其他国际高水平癌症中心的结果相当[10,11,44‒46]。患者接受全部三种细胞毒药物的比例是与OS延长相关[47]的mCRC 治疗水平的一项评判指标——自2012年以来,中山大学肿瘤防治中心这部分患者的比例已经超过50%,这个数据与既往mCRC临床试验队列中的比例相当 [48,49]。以上结果表明,对肿瘤科医生围绕mCRC的规范治疗进行深入的教育和培训,对于在全国范围内提高mCRC患者的治疗水平以及缩小中国与发达国家之间的mCRC治疗水平差距至关重要。
本研究存在一定局限性。首先,尽管BACC平台几乎完整收集了中山大学肿瘤防治中心临床实践中的影像信息、病理报告、实验室检查以及用药和手术记录,患者就诊前的mCRC相关的治疗或检测等管理信息只能从现病史中提取,这可能导致某些变量(如 ras/braf 突变状态)存在大量缺失值。未来,机器学习和自然语言处理的人工智能技术的发展以及前端电子病历系统的改进,可有望缓解这一困境。其次,即使BACC平台现在覆盖了我国超过25家医院,但目前只有中山大学肿瘤防治中心的数据足够成熟、可以进行详尽的分析。未来基于该平台的多中心队列研究将进一步评估本研究结论在中国其他中心的普适性。最后,尽管我们的时间趋势分析可避免回顾性比较是否使用靶向或局部治疗的患者生存结局可能带来的选择偏倚,不同年份亚组之间仍可能存在一些未纳入考察的不均衡的协变量,这可能也会给我们的研究结果带来潜在偏倚。
《5. 结论》
5. 结论
这项来自国内的大规模回顾性队列研究表明 mCRC全身性治疗及局部治疗的普及以及合理应用可以为患者带来生存获益。研究结果也证实了促进多学科讨论和合作、完善多模式治疗策略以及为肿瘤科医生提供深入教育和培训,对于在全国范围内提高 mCRC患者的治疗水平至关重要。
《致谢》
致谢
本研究获得了国家自然科学基金(81930065)、广东省自然科学基金(2014A030312015)、广东省科技计划项目(2019B020227002)以及广州市科技计划项目(201904020046, 201803040019, 201704020228)的资助。我们感谢中国医渡云技术有限公司在数据提取及处理方面给予的支持。我们感谢中山大学肿瘤防治中心的语言编辑Christopher Lavender先生在语言编辑方面的协助。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Zi-Xian Wang, Yi-Chen Yao, Zong-Jiong Mai, WuHao Lin, You-Sheng Huang, Ying Jin, Hui-Yan Luo, Dong-Sheng Zhang, Feng-Hua Wang, Feng Wang, Gong Chen, Pei-Rong Ding, Yun-Fei Yuan, Yu-Hong Li, JinHua Huang, Zhi-Zhong Pan, and Rui-Hua Xu declare that they have no conflict of interest or financial conflicts to disclose.
《Appendix A. Supplementary data》
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2020.10.017.













 京公网安备 11010502051620号
京公网安备 11010502051620号




