《1. 引言》
1. 引言
近年来,基于非共价键相互作用的超分子化学引起了广泛关注[1–4]。稳定的超分子体系,包括由静电相互作用、主-客体作用、范德瓦耳斯力、氢键作用、π-π 相互作用和亲疏水相互作用等构成的配合物与组装体,在自愈合材料、生物传感器和药物纳米载体等领域展示了一系列应用潜能[5–7]。在各种非共价键相互作用中,基于大环主体分子和客体分子的主-客体相互作用表现出了与众不同的识别特性。这一相互作用类似于“锁” 和“钥匙”的关系[5]。带有空腔的大环主体分子可以识别特定的客体单元,允许嵌入包括有机化合物、大分子、金属离子甚至纳米粒子(NP)等在内的多种客体分子[8,9]。利用主-客体相互作用构筑超分子组装体有诸多优点。例如,主体分子或客体分子可以根据需求进行定制。此外,利用这种动态、可逆的相互作用构筑的多层级组装结构,在外部(如光、氧化还原剂和化合物等)刺激下可实现组装和解组装的可逆转换[5,8]。迄今为止,基于大环主体分子,如冠醚、葫芦[n]脲、环糊精、柱[n]芳烃和杯芳烃等构筑的超分子组装体,已在智能软物质材料、超分子聚合和分子机器/开关等领域表现出广泛的应用前景[10–16]。
液-液界面,一般指油-水界面,为材料的组装和界面组装体的构筑提供了一个柔性平台[17]。通过在界面上组装不同的基元可赋予界面组装体相应的功能,进而用于封装、微反应器和药物递送等领域[18–23]。目前,许多研究致力于通过静电或氢键相互作用来构筑超分子界面,并取得了重要进展[24–30]。另外,主-客体化学为构建具有多重刺激响应性的动态界面体系提供了一种更加灵活的策略。近年来,研究人员利用修饰有主、客体单元的胶体粒子或聚合物,基于油-水界面成功制备了二维界面膜、微胶囊和结构化液体等,在材料工程和生命科学等领域显示出巨大的应用潜力[31–33]。本文主要综述了基于主-客体分子识别的超分子界面体系的研究进展,包括超分子胶体界面、超分子聚合物界面以及超分子阻塞胶体界面的制备、性质及其应用。
《2. 超分子胶体界面》
2. 超分子胶体界面
Ramsden [34]和Pickering [35]最早发现并对Pickering乳液进行研究。通常,在典型的油-水Pickering乳液体系中,胶体粒子倾向于迁移到界面,形成油包水(water-in-oil, w/o)或水包油(oil-in-water, o/w)乳液,进而降低体系自由能[36]。根据Pieranski [37]建立的热力学模型,单个粒子移动至界面,降低的自由能(∆E)可用下式表示:
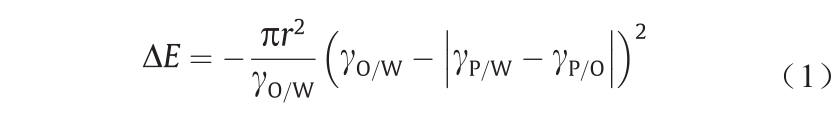
式中,r是粒子的有效半径;γO/W、γP/W、γP/O分别为油水两相、粒子与水相以及粒子与油相的界面张力。式(1)表明∆E随粒子半径的增大而增大。NP粒径较小(吸附于界面后∆E与热能相当),热运动极易使其从界面上脱附,使得NP在体相与界面之间存在动态吸附平衡[38]。
因此,抑制NP在界面上的脱附对于实现稳定的NP 组装体的构筑至关重要。迄今为止,采用开环易位聚合、 “点击”化学和配位化学等方法将界面上的NP进行共价交联,为实现这一目标提供了可行的策略[39–43]。另外,利用动态可逆的非共价键,如主-客体相互作用亦可在界面实现NP的稳定组装。
在早期的研究中,Wang等[31]利用水溶性β-环糊精(β-CD)和油溶性金刚烷羧酸氯修饰的CoPt3 NP之间的主-客体相互作用,在油-水界面原位制备了宏观NP单层薄膜。此外,通过在β-CD上引入功能化基团,可进一步实现NP多层膜的制备。与二维薄膜相比,微胶囊在生物医学、微反应器等领域具有更广泛的应用空间 [44–46]。在本节中,我们将介绍两种以胶体粒子为构筑基元,利用油-水界面的主-客体相互作用制备稳定微胶囊的方法。
《2.1. 乳液模板法制备微胶囊》
2.1. 乳液模板法制备微胶囊
Patra等[47]以Pickering乳液为模板,利用β-CD和金刚烷(ADA)在甲苯-水界面上的分子识别制备了刺激响应型微胶囊。通过剪切含有β-CD修饰的金(Au)NP 水溶液和含有金刚烷修饰的Au NP甲苯溶液,NP可在油-水界面进行非共价交联,实现稳定微胶囊的制备[图 1(a)、(b)]。不同于共价交联制备的微胶囊,主-客体相互作用赋予了微胶囊的动态响应性,可以通过引入竞争性的客体分子金刚烷四甘醇(ADA-TEG-OH)来调控微胶囊尺寸的大小。如图1(c)所示,随着ADATEG-OH的加入,微胶囊的界面发生部分解组装并融合,其尺寸由小变大。
《图1》
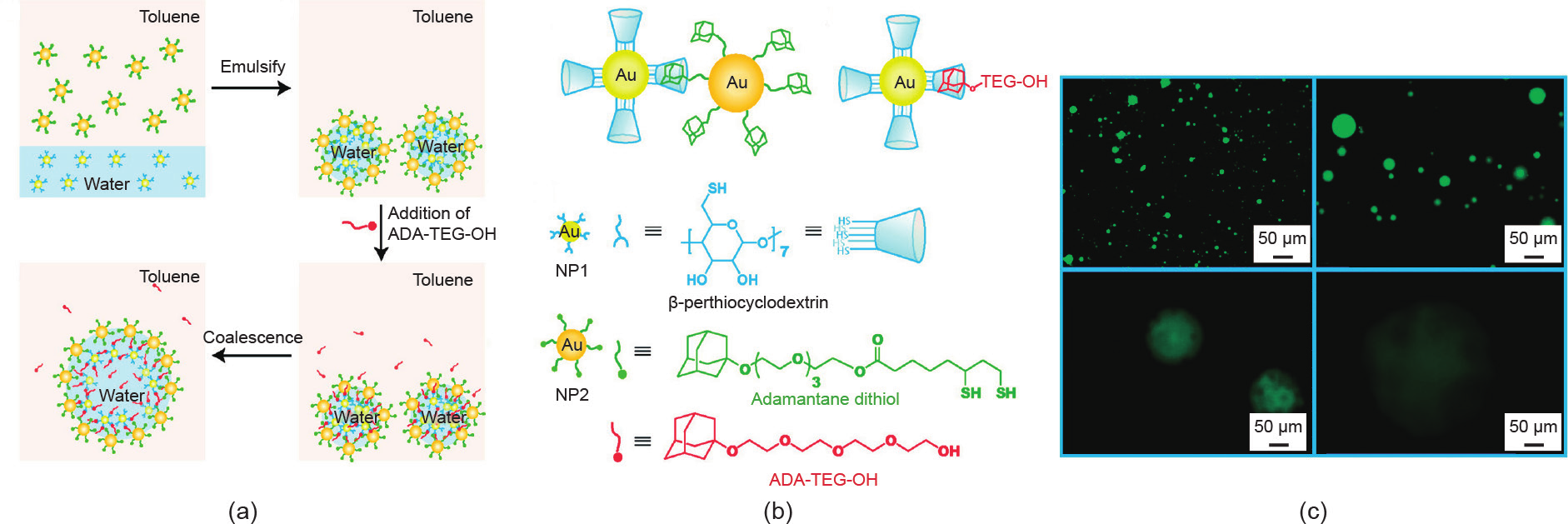
图1.(a)、(b)利用乳液模板法制备动态响应型微胶囊的示意图;(c)加入竞争性客体分子后微胶囊的尺寸变化。转载自参考文献[47],经 American Chemical Society许可,© 2009。
除环糊精外,葫芦[n]脲(CB[n], n = 5~8, 10)也是一类被广泛应用的大环分子。CB[n]是甘脲的环状低聚物,其内部空腔疏水,上下边缘具有羰基。不同结构和尺寸的CB[n]可以与不同的客体分子实现特定的主-客体络合[1,9]。Meethal等[38]利用CB[7]介导的分子识别,基于氯仿-水界面制备了胶体薄膜和微胶囊。在这项研究中,分散在氯仿中由客体分子修饰的Au NP(HexAuNP)与溶于水相的主体分子CB[7]在界面上相互作用,显著提高了NP的界面结合能,并在剪切作用下形成了稳定的微胶囊[图2(a)]。由于界面上的Hex-AuNP携带阳离子,因此其可以将带负电荷的大分子吸附在微胶囊的表面。图2(b)显示了微胶囊双重负载的能力,接枝荧光基团的牛血清白蛋白(BSA)选择性地吸附在微胶囊的外壳上,而疏水的尼罗红则被包裹在微胶囊内部。通过引入与CB[7]有更高亲和力的竞争性客体分子金刚烷胺盐酸盐,可以实现微胶囊的动态响应性。例如,当使用阿霉素作为模型药物时,微胶囊的结构可被竞争性客体分子破坏,实现阿霉素的释放[图2(c)~(e)]。
《图2》

图2.(a)基于CB[7]和Hex-AuNP的分子识别制备微胶囊的示意图;(b)微胶囊的双重负载能力;(c)~(e)加入竞争性分子后微胶囊的解组装和药物的释放。转载自参考文献[38],经American Chemical Society许可,© 2018。
利用特定的主-客体相互作用,可以有效调控微胶囊的机械强度。Jeong等[48]使用分散在水中的β-CD修饰的Au NP与溶于油相中的不同客体分子,制备了具有不同表面微结构的聚合物微球[图3(a)、(b)]。以客体分子AB-Hex-AB为例,油相中的客体分子与分散于水相中的NP通过主-客体相互作用在界面交联,形成稳定微胶囊[图3(d)]。当使用客体分子、双环戊二烯和催化剂的混合溶液作为油相时,双环戊二烯发生聚合,产生具有表面褶皱结构的聚合物微球(由于体积收缩) [图3(c)、(e)]。这一周期性褶皱的特征长度与主体分子和客体分子之间的亲合力有关,通过数值模拟可估算微球表面NP薄膜的弹性模量。
《图3》

图3.(a)微胶囊制备示意图;(b)β-CD修饰的Au NP和不同的客体分子结构;(c)通过聚合内相制备具有褶皱表面的微球;(d)氯仿中微胶囊在干燥前(上图)后(下图)的光学显微镜图像;(e)使用不同客体分子制备的聚合物微球的扫描电子显微镜(SEM)图像(顶部:AB-HexAB;中间:AB-Hex-AD;底部:AD-Hex-AD)。AB:偶氮苯;AD:金刚烷;DCPD:双环戊二烯;pDCPD:聚双环戊二烯; = E/(1 − ν2 ),其中E为弹性模量,v表示泊松比,下标f和s分别代表薄膜和衬底;liq.:液相(liquid);cat.:催化剂(catalyst)。转载自参考文献[48],经WILEY-VCH Verlag GmbH & Co. KGaA许可,© 2014。
= E/(1 − ν2 ),其中E为弹性模量,v表示泊松比,下标f和s分别代表薄膜和衬底;liq.:液相(liquid);cat.:催化剂(catalyst)。转载自参考文献[48],经WILEY-VCH Verlag GmbH & Co. KGaA许可,© 2014。
《2.2. 微流控装置制备微胶囊》
2.2. 微流控装置制备微胶囊
一般来讲,利用经典乳化法制备的胶体微胶囊具有比较宽的尺寸分布[49]。为了减小微胶囊的尺寸分布,研究人员开始使用微流控装置来制备微胶囊[50–52]。 Zhang等[32]报道了一种利用主-客体化学和四通道微流控装置一步生成均匀微胶囊的方法。在他们的研究中,通过使用油相剪切包含CB[8]、甲基紫精(MV)功能化的Au NP以及萘酚功能化的聚合物的水相溶液,可得到尺寸均一的微胶囊[图4(a)]。在此过程中,CB[8]、甲基紫精功能化的Au NP以及萘酚功能化的聚合物在水相中形成三元复合物,并在界面张力驱动下被吸附到油水界面,形成微胶囊的外壳。单分散的微胶囊在脱水过程中可以保持结构稳定,并可通过再水化恢复其原始结构[图4(e)、(f)]。利用微胶囊可以实现不同货物的高效封装[图4(b)~(d)]。同时,由于主-客体分子识别的动态可逆性,微胶囊的超分子外壳会在外界刺激下被破坏,从而达到控制释放的目的。
《图4》
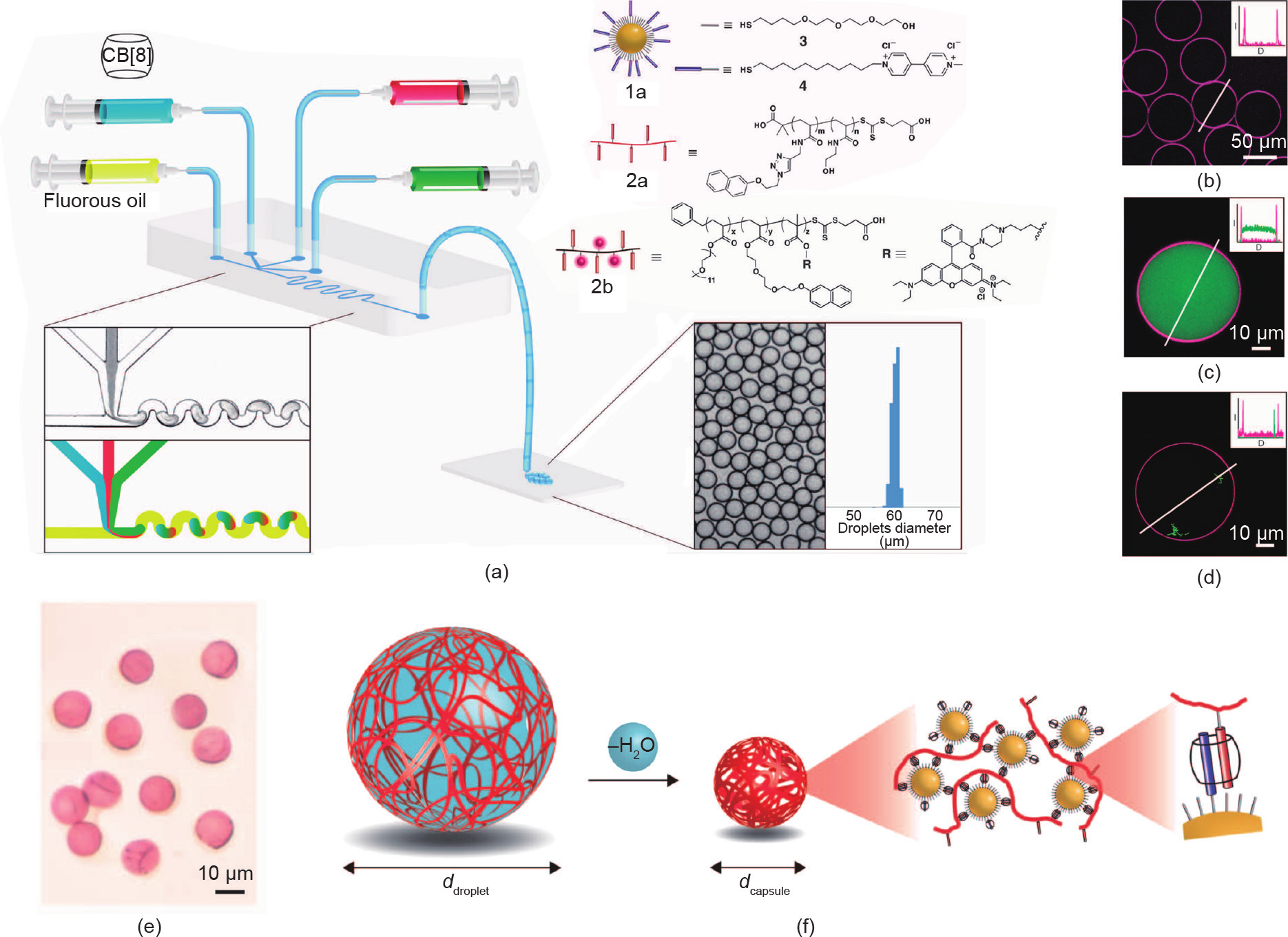
图4.(a)微流控装置制备微胶囊的示意图;(b)微胶囊的激光共聚焦显微镜图像;(c)、(d)封装有FITC-葡聚糖(上图)或大肠杆菌细胞(下图)的微胶囊的激光共聚焦显微镜图像;(e)微胶囊的光学显微镜图像;(f)微胶囊的脱水过程示意图。转载自参考文献[32],经American Association for the Advancement of Science许可,© 2012。
随后,研究人员[53]将该方法扩展到其他由CB[8] 介导的超分子体系,他们利用CB[8]、萘酚功能化的聚丙烯酰胺以及甲基紫精功能化的NP在油-水界面上形成的超分子复合物,制备了对竞争性客体分子响应的微胶囊。水溶性的物质可以被封装于微胶囊内部,通过加入竞争性客体分子,超分子微胶囊的外壳可被破坏,从而触发微胶囊内部物质的释放。研究人员还进一步制备了双响应型超分子胶体微胶囊[54]。在该研究中,微胶囊的外壳仍然是CB[8]介导的超分子复合物,粒子表面修饰有温敏的聚异丙基丙烯酰胺(PNIPAM)和甲基紫精客体分子[图5(a)]。在PNIPAM的最低临界溶解温度(LCST)以上,粒子随温度的升高而收缩,产生更大的间隙,导致封装货物的释放[图5(b)]。此外,偶氮苯功能化的聚乙烯醇赋予了微胶囊光响应性。在紫外线(UV)照射下,偶氮苯的光异构化导致界面上超分子复合物的解组装,进而触发了货物的释放[图5(c)]。
《图5》
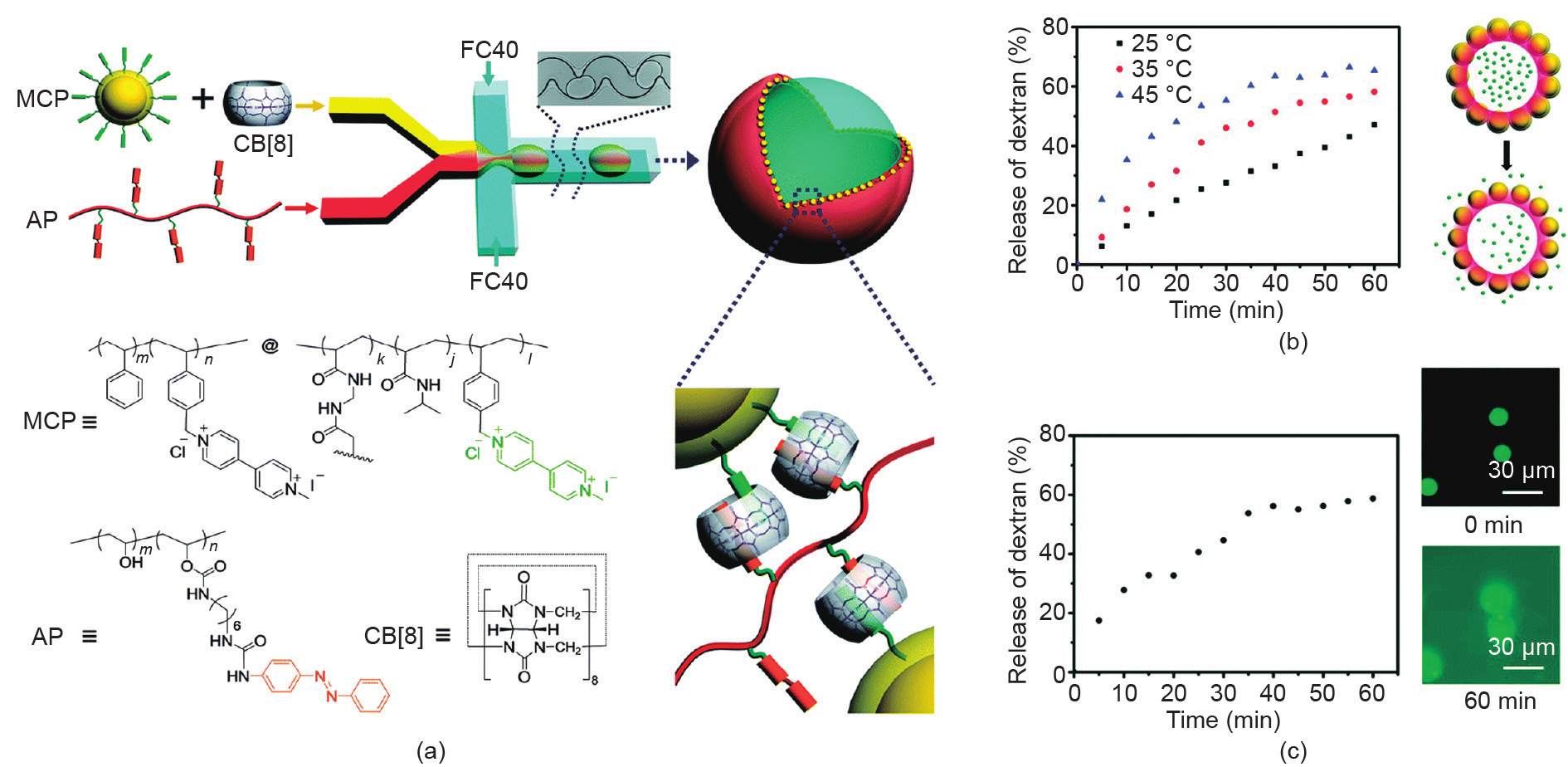
图5.(a)CB[8]介导的双响应型微胶囊示意图;(b)温控释放;(c)光控释放。FC40: flouriner FC-40 (3M, USA)。转载自参考文献[54],经Royal Society of Chemistry许可,© 2016。
《3. 超分子聚合物界面》
3. 超分子聚合物界面
近年来,聚合物凭借其化学结构的高度可调节性及功能多样性等优点促进了聚合物基微胶囊的出现。基于静电相互作用、氢键、碱基对相互作用或主-客体相互作用驱动的层层(LbL)自组装技术已经成功构筑了聚合物基微胶囊[55–60]。然而,采用典型的LbL方法制备微胶囊通常过程繁琐且耗时。Zheng等[61]利用CB[8]介导的主-客体相互作用和微流控装置,实现了两种不同客体分子修饰的聚合物的界面自组装以及超分子微胶囊的制备。在这一研究中,P1(含甲基紫精的共聚物)和 CB[8]溶于水相,P2(含萘酚的共聚物)溶于氯仿,它们可在界面处形成三元超分子复合物,并通过微流控装置形成水包油型和油包水型微胶囊[图6(a)、(b)]。激光共聚焦显微镜图像表明,荧光素标记的P1(绿色荧光)和罗丹明B标记的P2(红色荧光)富集在液滴表面,形成微胶囊的外壳[图6(d)]。此外,当使用高度支化的 H1取代P2时,由于H1具有独特的3D树枝状纳米结构,因此所产生的微胶囊外壳可用于包埋亲水小分子[图6 (c)]。在紫外线照射下,由于偶氮苯发生光异构化,因此微胶囊的超分子外壳发生解组装,可实现包埋分子的释放。由于聚合物化学结构的多样性,微胶囊壳体厚度、渗透性等参数可被有效调控。此外,这一研究为定量研究聚合物在界面上的分子识别和动力学机制提供了有力的支持,在化学和生物领域具有重要意义。
《图6》
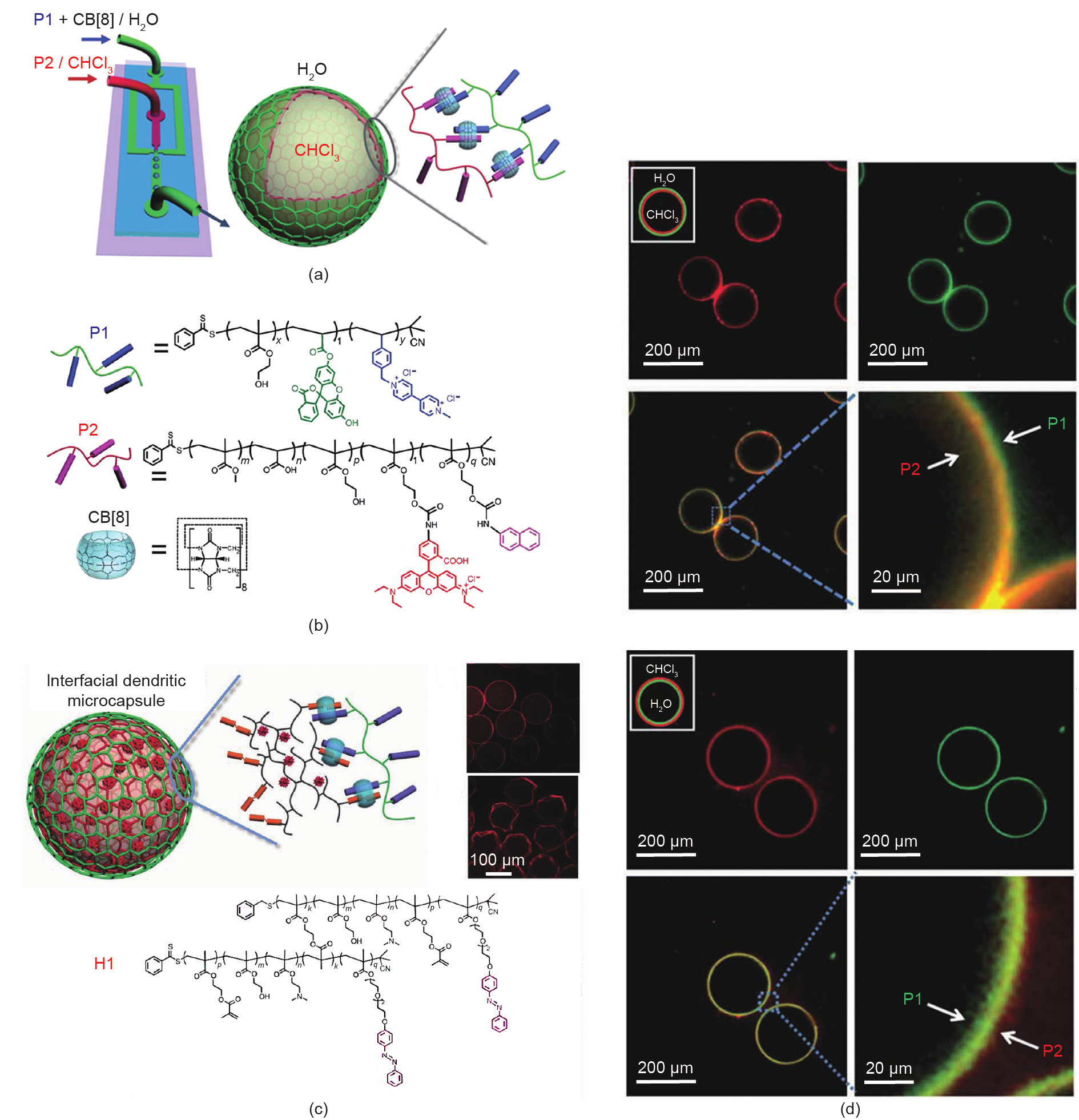
图6.(a)微胶囊制备示意图;(b)P1、P2和CB[8]的结构;(c)以树枝状共聚物H1作为基元制备微胶囊的示意图;(d)水包油或油包水型微胶囊的激光共聚焦显微镜图像。转载自参考文献[61],经Springer Nature许可,© 2014。
Parker等[62]报道了另一种构筑超分子聚合物微胶囊的方法。在这项研究中,研究人员首先使用微流控装置制备了油包水液滴,其中连续相(油相)含有带电荷的表面活性剂,分散相(水相)含有客体分子修饰的带电荷聚合物和CB[8] [图7(a)、(b)]。低浓度的聚合物溶液可以有效防止加入CB后水相的凝胶化[8]。在该体系中,油相中的表面活性剂首先聚集在油-水界面上,使界面带正电荷或负电荷。随后,带有互补电荷的聚合物由于静电相互作用被吸附到界面,形成微胶囊的外壳 [图7(c)]。如图7(d)、(e)所示,当水相中含有阴离子聚合物1A(−)时,随着油相中带正电荷的表面活性剂 K(+)浓度的增加,越来越多的1A(−)被吸附到界面。然而,当油相中仅有带负电荷的表面活性剂K(−)时,1A(−)则会均匀分布在液滴中,说明聚合物的界面组装由静电相互作用驱动。当水相中有CB[8]、1A(−)和1B(−)时,随着带正电荷的表面活性剂K(+)浓度的增加,微胶囊的外壳逐渐形成并最终实现微胶囊的构筑[图7(e)]。此外,当水相中有带不同电荷的聚合物时,通过选择表面活性剂的类型可以获得不同的组装结构。如图7(f)所示,当 1A(−)、1B(−)、2A(+)、2B(+)、CB[8]溶于水相,而电中性表面活性剂溶于油相中时,无法形成微胶囊的外壳。而将K(+)溶解在油中,可制备以1A(−)-CB[8]-1B(−)为外壳的微胶囊,用K(−)代替K(+)则可以制备以2A(+)-CB[8]-2B(+) 为外壳的微胶囊。
《图7》
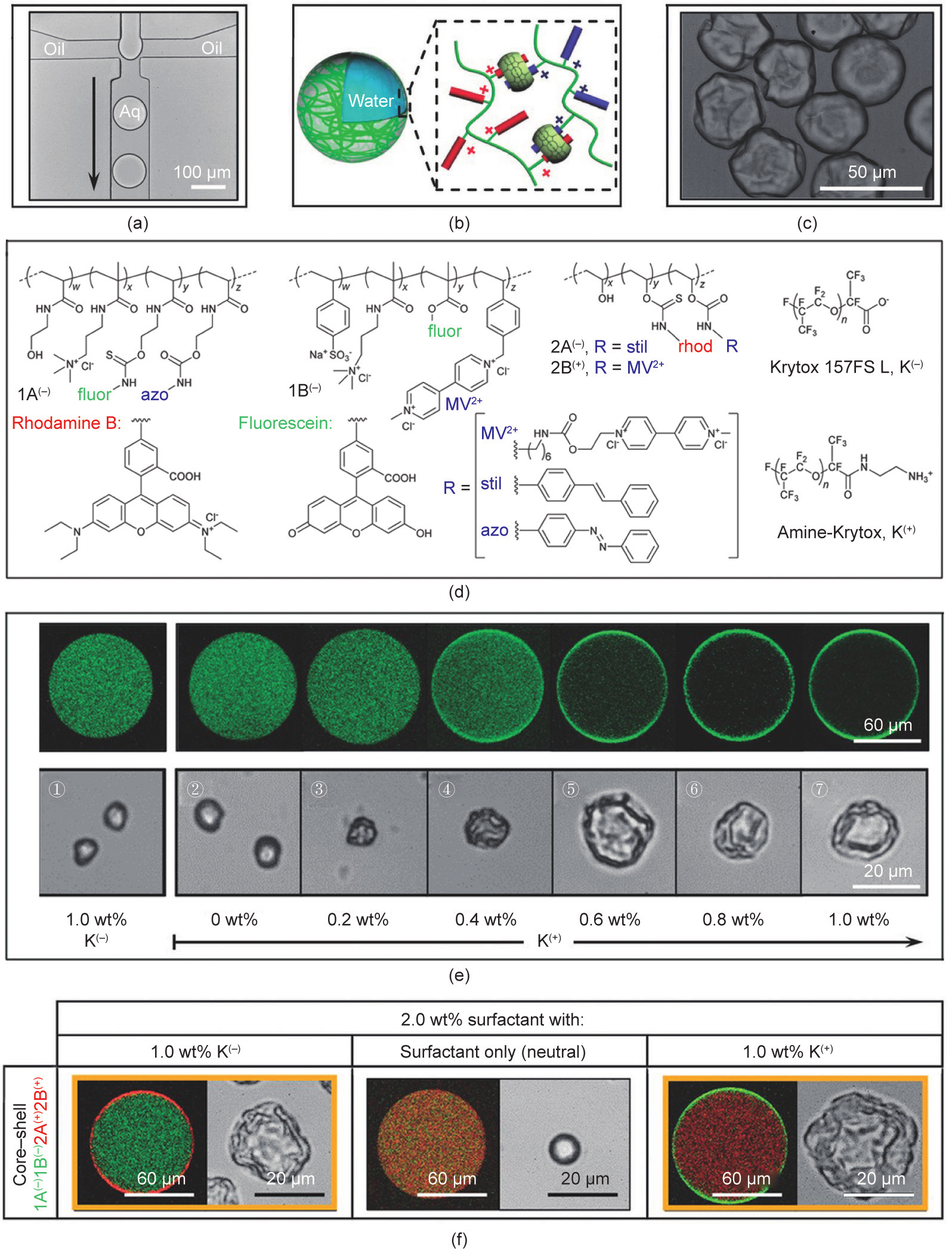
图7.(a)利用微流控装置制备微胶囊的光学图像;(b)微胶囊结构示意图;(c)微胶囊在干燥后的光学显微镜图像;(d)聚合物和表面活性剂的结构示意图;(e)随着K(+)浓度的增加,含有1A(−)液滴的激光扫描共聚焦显微镜图像(上图)以及随着K(+)浓度的增加,含有1A(−)、1B(−)和CB[8] 的液滴在蒸发过程中的光学显微镜图像(下图);(f)使用激光扫描共聚焦显微镜(左)和光学显微镜(右),表征接枝了不同荧光分子的聚合物,在微液滴内的分布情况,其中水相中溶解有1A(−)、1B(−)、2A(+)、2B(+)、CB[8],油相中溶解有带不同电荷的表面活性剂。转载自参考文献[62]。
Yu等[63]采用类似的策略,以油-水界面静电作用力为驱动,利用CB[8]和蒽的主-客体相互作用制备了一种光刺激响应型聚合物微胶囊。通过向该体系添加竞争性的金刚烷胺客体分子,可实现微胶囊中封装货物的控制释放[图8(a)~(d)]。此外,在紫外线照射下,嵌入CB[8]的两个蒽分子可转化为[4 + 4]-光二聚体。通过调节CB[8]内蒽的交联程度,可以对微胶囊壳层的渗透性进行调控。如图8(e)、(f)所示,通过延长紫外线照射时间可提高蒽的交联程度(微胶囊壳层的渗透性下降),进而显著降低封装物质的释放速率。
《图8》
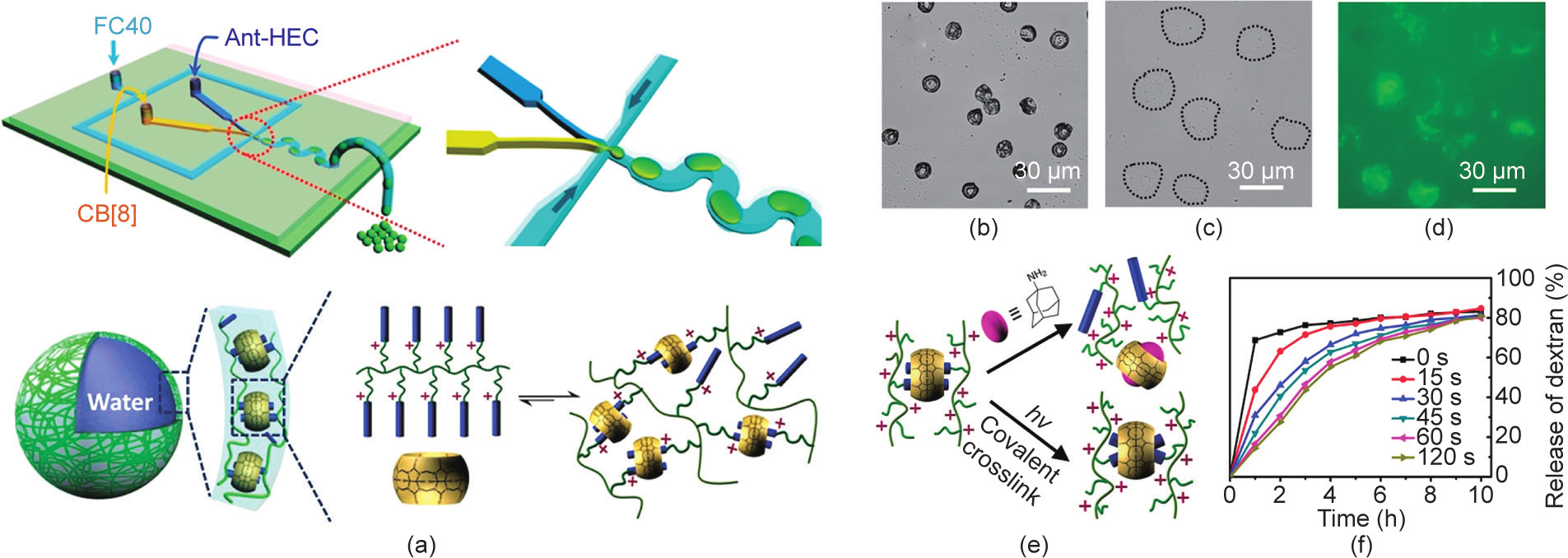
图8.(a)微胶囊制备示意图(Ant-HEC:蒽官能化的羟乙基纤维素);(b)微胶囊干燥过程中的光学显微镜图像;加入竞争性客体分子后微胶囊的光学显微镜图像(c)和荧光显微镜图像(d);(e)界面组装体在加入金刚烷胺之后的解组装示意图以及蒽基在CB[8]空腔中的光二聚反应示意图;(f)不同紫外线照射时间下封装物质的释放速率。转载自参考文献[63],经Royal Society of Chemistry许可,© 2015。
聚合物胶束和超分子聚合物也可以在静电作用驱动下被吸附到油-水界面,并通过CB[8]介导的主-客体相互作用形成微胶囊壳层[64,65]。Yu等[64]通过利用两亲性嵌段共聚物自组装形成的聚合物胶束制备了微胶囊 [图9(a)]。这一微胶囊具有双重负载的能力:一方面,在水中形成胶束时,疏水物质(尼罗红,红色荧光)可被封装于胶束内部;另一方面,胶束在自组装形成微胶囊的过程中,水溶性物质(FITC-葡聚糖,绿色荧光)可被封装于微胶囊内部[图9(b)~(d)],从而实现多重刺激下疏水物质和亲水物质的选择性释放。
《图9》
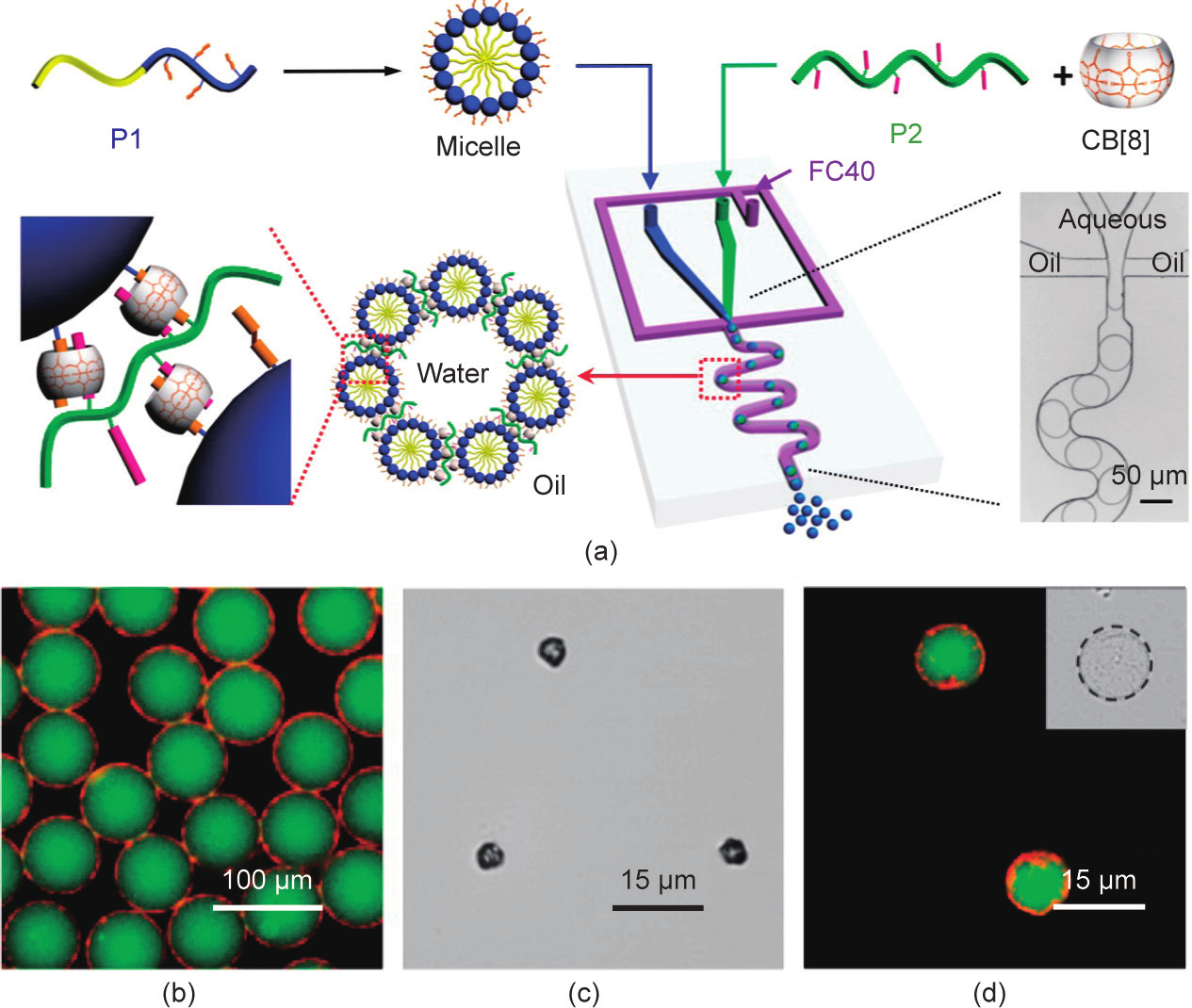
图9.(a)具有多层级结构的超分子微胶囊示意图;(b)微胶囊对于疏水性尼罗红和亲水性FITC-葡聚糖的双重负载能力;微胶囊在去水化后的光学显微镜图像(c)和再水化后的激光共聚焦显微镜图像(d)。转载自参考文献[64]。
Groombridge等[65]基于超分子聚合物的油-水界面组装制备了一种动态响应型微胶囊。当油相中溶解有带负电荷的表面活性剂时,利用微流控装置,可将带正电荷的超分子聚合物吸附于界面形成界面凝胶[图10(a) ~(d)]。通过对悬挂的液滴进行回吸,发现液滴表面在很短的时间(约2 s)内出现褶皱现象,说明界面处发生了超分子凝胶转变[图10(e)]。由于超分子凝胶的自调节性,褶皱界面在1 min内恢复到光滑的状态。此外,加入金刚烷胺盐酸盐作为竞争性客体分子后,超分子聚合物被破坏,回吸液滴时无法观察到褶皱现象。此外, Salmon等[66]同样证实界面上的相变(凝胶化)是在液滴体积收缩条件下发生的,从而导致褶皱的产生。随液滴体积的减少,界面膜的密度和厚度不断增加,最终达到临界值。
《图10》
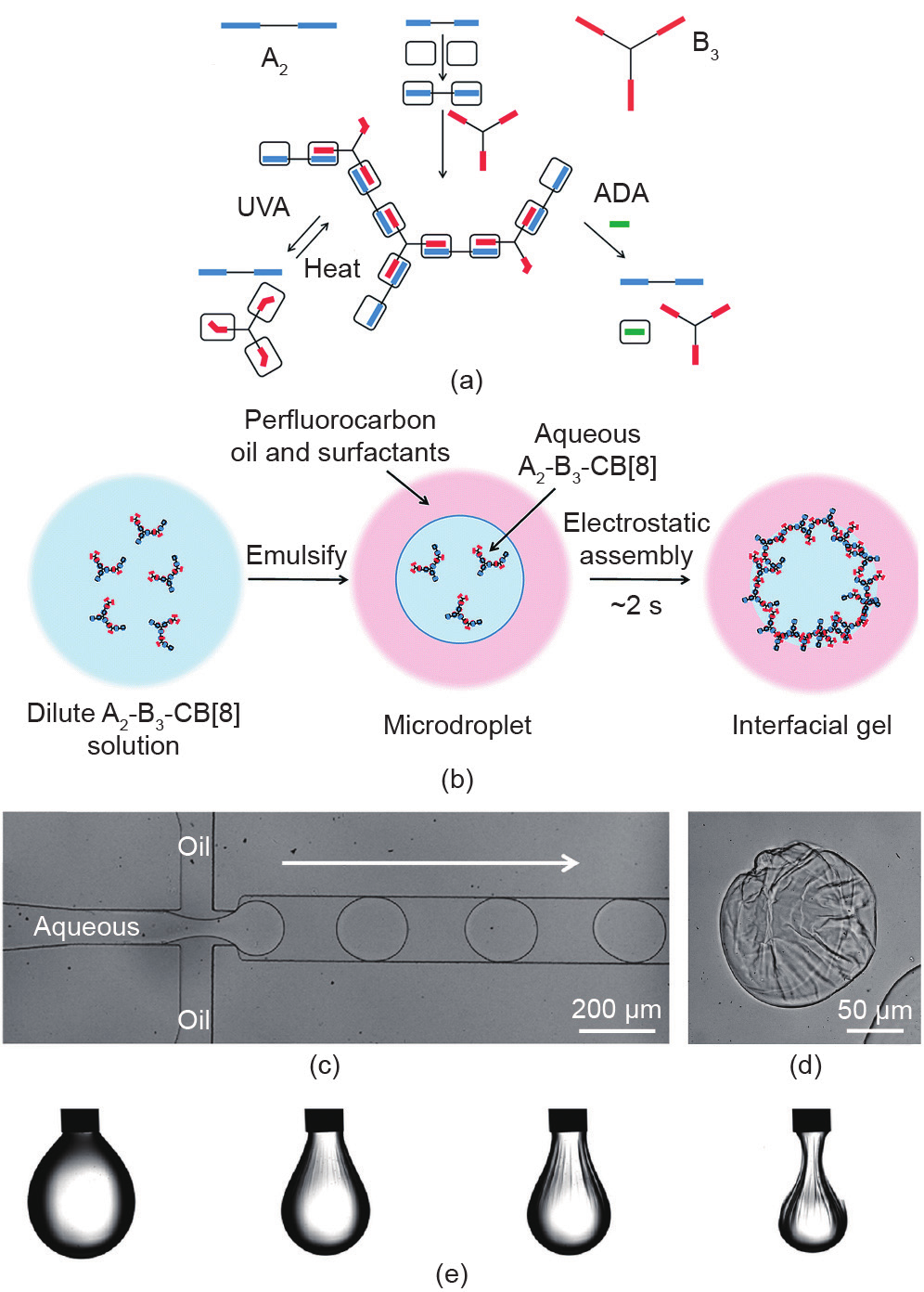
图10.(a)超分子聚合物的制备示意图;(b)基于超分子聚合物构筑界面凝胶示意图;(c)利用微流控装置制备微胶囊示意图;(d)微胶囊在干燥过程中的光学显微镜图像;(e)液滴在收缩过程中的形态演变。转载自参考文献[65],经Royal Society of Chemistry许可, © 2017。
图案化微阵列为自组装提供了一个重要平台 [67,68]。Zhang等[69]制备了一种可用于递送和传感的图案化微胶囊阵列。在这项工作中,含有CB[8]的高度支化聚轮烷(HBP-CB[8])和萘酚功能化的羟乙基纤维素(HEC-Np)首先通过主-客体相互作用在附着于基底的液滴阵列中形成带正电荷的超分子复合物,当使用带负电荷的表面活性剂的油相对液滴进行覆盖时,水相中的超分子复合物受到静电吸引,运动至油-水界面并形成微胶囊外壳[图11(a)~(c)]。研究表明,由高度支化的HBP-CB[8]形成的微胶囊阵列,在外部刺激下表现出良好的缓释效果[图11(d)]。此外,当微胶囊阵列的衬底附着Au NP时,微胶囊基质材料及其所负载物质的拉曼特征峰信号均得到了增强。
《图11》
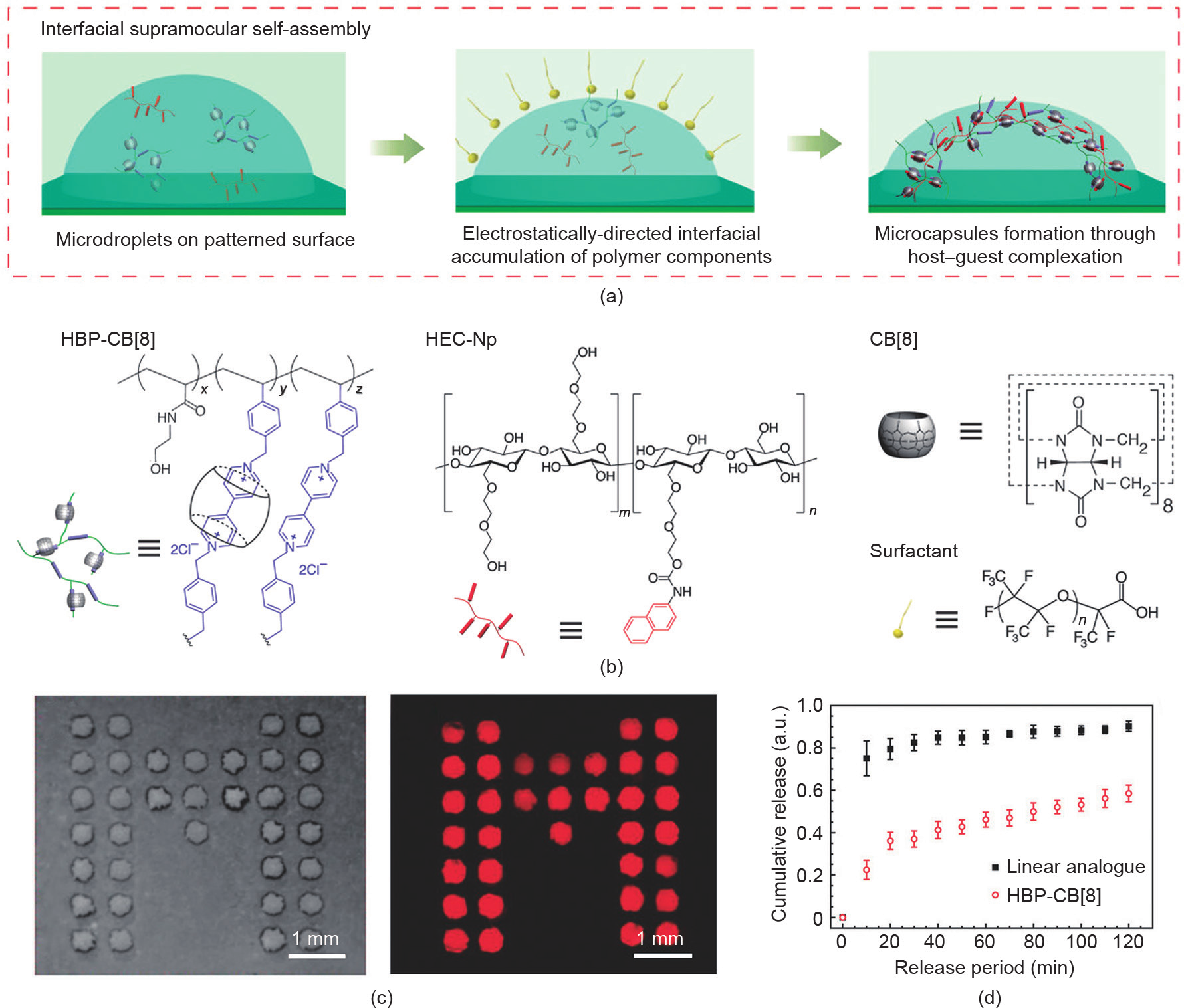
图11.(a)图案化微胶囊阵列的制备示意图;(b)HBP-CB[8]、HEC-Np、CB[8]和带负电荷的表面活性剂的结构示意图;(c)微胶囊阵列的光学图像和荧光图像;(d)微胶囊阵列的控制释放性能。转载自参考文献[69]。
《4. 超分子阻塞胶体界面》
4. 超分子阻塞胶体界面
界面阻塞是由于液-液界面上胶体粒子密度的增加而引起的,粒子间的自由体积减小,抑制了粒子在界面的自由运动[26]。界面粒子从一种类似于流体的状态转变为类似于固体的状态,使组装体变得具有刚性,抑制了界面张力驱动的两相系统的形态变化,为液体的塑形或结构化提供了可能[70–74]。近年来,利用NP与聚合物配体在油-水界面协同组装构建NP表面活性剂(nanoparticle surfactant, NPS)的策略,为结构化液体的构筑提供了一种简单易行的方法,在药物封装、递送和全液相微流控等领域表现出巨大的应用前景[24,75–81]。然而,现阶段NPS主要基于静电相互作用构建,刺激响应性较为单一(仅有pH、离子强度和温度响应性)。
最近,Sun等[33]报道了一种基于主-客体化学的新型光响应型NPS,实现了光响应型结构化液体的构筑。在这项工作中,分散在水中的α-CD修饰的Au NP与溶解在油相中的偶氮苯封端的聚苯乙烯(Azo-PS)或偶氮苯封端的聚丙交酯(Azo-PLLA),通过主-客体作用在界面处形成NPS [图12(a)]。研究发现,两种高分子配体均可通过主-客体作用与Au NP进行协同组装,并在油-水界面原位形成NPS。但基于Azo-PS构建的NPS 界面活性较低,主-客体作用的触发仅取决于主体NP和客体高分子配体在界面的无规碰撞。另外,由于AzoPLLA与水分子和α-CD之间可形成氢键,其本身表现出一定的界面活性,可将Au NP吸附至界面附近,有效增强了主体NP和客体高分子配体之间的碰撞概率,进而诱导主-客体作用的快速触发[图12(b)]。通过构筑褶皱液滴(NPS在界面处于阻塞状态),研究人员系统研究了NPS和宏观液滴的光响应行为。如图12(c)、(d)所示,在可见光照射下,trans-Azo-PLLA与α-CD发生主-客体作用,构建的NPS可稳固吸附于界面,并赋予 Au-NP足够的结合能以抵抗两相界面在缩减过程中产生的挤压应力,使褶皱液滴在长时间内保持稳定形态;在紫外线照射下,trans-Azo-PLLA发生顺反异构,形成的 cis-Azo-PLLA从α-CD的空腔中脱落,Au NP在界面的结合能随之下降,部分Au NP从界面脱附,液滴发生松弛,表面的褶皱逐渐消失。此外,通过构筑形貌更为复杂的结构化液体,这种光响应行为依然可以实现[图12 (e)]。
《图12》
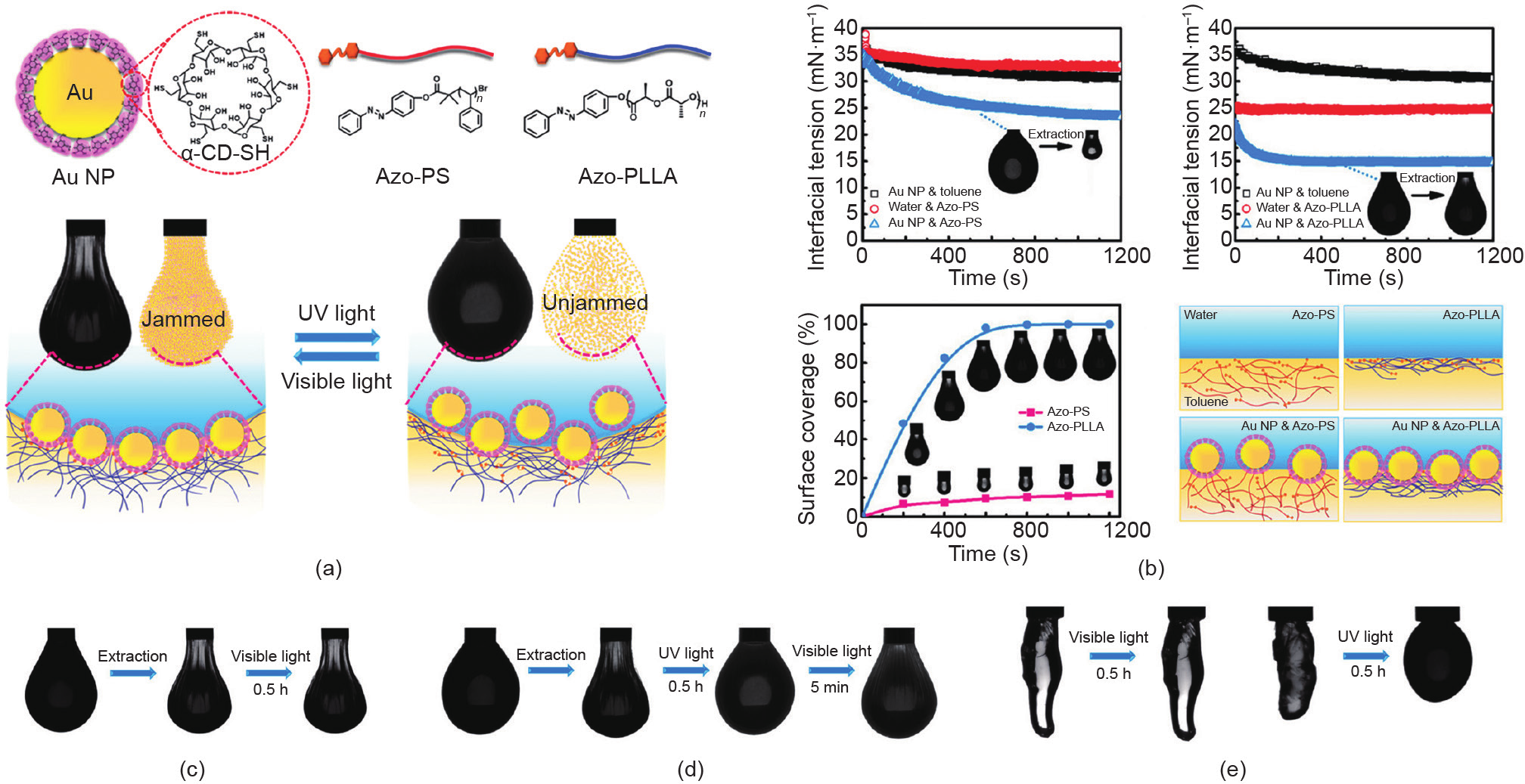
图12.(a)光响应型NPS的形成示意图;(b)不同高分子配体和Au NP的界面组装动力学研究;(c)~(e)光响应型结构化液体。α-CD-SH:巯基功能化的α-环糊精。转载自参考文献[33],经American Chemical Society许可,© 2020。
《5. 结论与展望》
5. 结论与展望
本文总结了近年来基于液-液界面的主-客体分子识别的研究进展,概述了各种超分子界面(包括胶体界面和聚合物界面)的自组装策略,并重点介绍了其在药物封装和递送等方面的应用。简而言之,主-客体分子识别为构筑具有多重刺激响应性、不同尺寸和形状的智能超分子界面系统提供了重要方法。
目前,对于液-液界面主-客体分子识别的研究还十分有限,制备具有明确结构、渗透性和机械强度的超分子界面体系仍然面临挑战。例如,采用Pickering乳液或微流控技术制备的超分子微胶囊的尺寸通常较大,一定程度限制了药物的递送效率,制备更小尺寸(如纳米级)的微胶囊有望解决这一问题;除了油-水体系,双水相系统(aqueous two phase system, ATPS)由于较低的界面张力和良好的生物相容性,在生物、化妆品和食品等领域有着广阔的应用前景,而将主-客体分子识别应用于双水相体系则能进一步拓宽ATPS的应用范围。此外,基于胶体粒子的界面阻塞和主-客体化学,利用全液相 3D打印或全液相模塑成型等方法可构筑具有多重刺激响应性的复杂流体器件。总之,这些研究在制备下一代功能型软物质材料方面有着十分重要的意义。
《致谢》
致谢
本研究得到了国家自然科学基金(51903011)的支持。Thomas P. Russell获得了美国能源部的支持。
《Compliance with ethics guidelines》
Compliance with ethics guidelines
Beibei Wang, Hao Chen, Tan Liu, Shaowei Shi, and Thomas P. Russell declare that they have no conflict of interest or financial conflicts to disclose.













 京公网安备 11010502051620号
京公网安备 11010502051620号




