《1. 引言》
1. 引言
癌细胞从原发肿瘤部位向远处器官的扩散是恶性肿瘤最具破坏性的病理和生理特征[1]。胰腺癌由于临床预后差,转移扩散远且迅速等,被认为是致命和最具侵袭性的恶性肿瘤之一[2]。胰腺导管腺癌(PDAC)占所有胰腺肿瘤的绝大部分(92%),临床治疗[3‒4]的5年生存率不足6%。PDAC倾向于转移到肝脏[5],有极高的手术后临床死亡率。最近,各种研究表明,在胰腺癌的肿瘤细胞到达肝脏之前,肝脏内微环境在早期已选择性地进行细胞和基质组织的重组,使其更有利于播散性癌细胞的植入和生长[6],从而形成了一个定义为“转移前生态位”的概念。高转移性胰腺肿瘤细胞能够选择这些具备“转移前生态位”的微环境进行定殖,以适应特定的器官环境[7]。越来越多关于器官趋向性以及分子机制的研究揭示了胰腺肿瘤细胞转移到特定器官的方式的关键细节[8‒9],例如,鉴定在特定器官中准备“转移前生态位”的各种关键细胞因子,并确定为治疗干预提供有吸引力可选择的新靶点[10]。虽然目前关于肿瘤转移及其微环境重塑已有许多假设,但“种子和土壤”以及“转移前生态位”的理论在胰腺癌进展中得到了振奋人心的验证[11]。但器官特异性转移的潜在机制仍有待阐明。
外泌体通过其囊泡内容物传递信息,被认为是细胞间交流的一种新型的信号机制[12]。肿瘤来源的外泌体作为细胞间通信的信号信使,包含供体癌症细胞分泌的大量信号分子和功能蛋白[10],有助于激活各种宿主细胞,如免疫细胞[13]、癌症相关成纤维细胞(CAF)和巨噬细胞,这些细胞重塑了局部微环境和细胞间的基质[14]。值得注意的是,通过外泌体对这些宿主细胞的调节和重编程,可以在肿瘤细胞的靶位点[15]中为其创造一个转移偏好环境。肿瘤来源的外泌体可以通过与靶细胞表面结合或与细胞膜结合,在原发性肿瘤细胞形成之前重塑特定位点[13,16]。例如,外泌体内的整合素通过与宿主靶细胞以组织特异性方式融合来指导器官特异性定殖,从而启动“转移前生态位”的形成[17]。研究表明,PDAC来源的外泌体可能会增加未成年小鼠的肝转移负担,从而促进胰腺癌的特异性肝转移[18]。然而,肿瘤源外泌体参与并影响肝“转移前生态位”形成的确切机制仍不清楚。
CD44 (Cluster of differentiation 44)是跨膜糖蛋白家族[19‒20]的成员,其表达调控与受体酪氨酸激酶(receptor tyrosine kinase, RTK)[21]的激活有关。此外,它作为RTK的共受体,介导与细胞迁移相关的信号通路,如c-Met信号[22]。除了调节各种细胞、生理和病理过程外,CD44还作为细胞外基质成分[23],特别是透明质酸(HA)的受体,激活细胞骨架蛋白,从而促进细胞运动[24]。许多研究表明CD44在胰腺癌中显著过表达[25‒26]。CD44作为具有黏附功能的跨膜蛋白,可以连接细胞-细胞和细胞-细胞外基质[27]。CD44在肿瘤细胞膜表面的定位和高表达均有助于促进癌细胞获得黏附和迁移等特性[24,28]。因此,了解CD44在胰腺癌进展过程中的分子调控,以及其通过外泌体传递CD44的细胞间交流机制,将为肿瘤转移机制提供新的见解。
在本研究中,我们证明了CD44表达与胰腺癌预后呈正相关。CD44与整合素α6β4相互作用,通过调节大鼠肉瘤(Ras)和细胞外信号调节激酶(ERK)信号通路,促进肿瘤细胞的增殖、迁移和侵袭。此外,我们发现胰腺肿瘤细胞来源的外泌体可以将CD44转移到靶细胞,并与肝细胞中的α6β4协同工作。因此,外泌体CD44通过上调靶肝细胞中的CD133、α-平滑肌肌动蛋白(α-SMA)和白细胞介素-6(IL-6)等分子,产生一种促进特异性肝部器官转移的前转移环境。探索和鉴定PDAC外泌体CD44在肝转移中的调控机制,为开发胰腺癌早期诊断标志物和进行肿瘤恶性转移的临床分子治疗提供理论依据。
《2. 材料和方法》
2. 材料和方法
《2.1. 患者样本采集》
2.1. 患者样本采集
来自早期或晚期胰腺癌患者的血清样本来自上海交通大学医学院附属瑞金医院。
《2.2. 细胞培养》
2.2. 细胞培养
肿瘤细胞系PANC-1、Capan-1、PANC-1 CD44敲除(P-CD44kd)、PANC-1 β4敲除(P-β4kd)、Capan-1 CD44敲除(C-CD44kd)和Capan-1 β4敲除(C-β4kd)在含有10%胎牛血清(FBS; Gibco, USA)和1%青霉素/链霉素(P/s; Gibco, USA)的Dulbecco改良Eagle培养基(DMEM; Gibco, USA)中培养。LX-2细胞购自Life Technologies,并在Roswell Park Memorial Institute (RPMI)培养基(美国Gibco)中培养,含10% FBS。所有细胞系均在37 ℃、含5% CO2的增湿培养箱中培养。对于含有各种肿瘤源性外泌体的人LX-2细胞的体外培养,将细胞在含有500 µg∙mL-1外泌体的培养基中培养7 d。
《2.3. 基因敲除细胞系的建立》
2.3. 基因敲除细胞系的建立
分别进行短发夹状RNA (shRNA)-CD44和shRNA-β4克隆的转染和选择。载体表达的短发夹状RNA购自Stana Cruz Biotechnology(美国),RNA-CD44寡核苷酸序列(意义:GACAGAGAAGCAAGGGACTCAAGGA)和HuSH shRNA绿色荧光蛋白(GFP)克隆载体(pGFP-V-RS-Vector; Origene,美国)含有非有效shRNA盒的基因被用于敲除CD44表达。RNA-β4寡核苷酸(意义:ATCGAAGCATTCAGAGAGAGATGCATTCATCATACTTG)和含有无效shRNA盒的pGFP-V-RS载体被用于敲除CD44和β4表达。
《2.4. 免疫标记》
2.4. 免疫标记
对于外泌体标记,在磷酸盐平衡PBS溶液(PBS, 1:10 000; Invitrogen, USA)中,用200 μL荧光膜示踪剂3,3′-二十八烷基-5,5′-二(4-磺基苯基)-氧卡氰钠盐(SP-DioC18, Invitrogen, USA)标记1 mg外泌体25 min。将标记的外泌体洗涤两次,并在黑暗中与去除外泌体的胎牛血清(FCS; Gibco, USA)孵育30 min,以便游离染料能够与FCS中的蛋白质结合。用PBS洗涤后,通过离心收集染料标记的外泌体。如前所述,使用40%蔗糖溶液纯化标记的外泌体颗粒。染料标记的外泌体储存在-80 °C,直到进一步使用。为了染色细胞膜蛋白,细胞用4%多聚甲醛固定15 min,用0.5% TritonX-100(美国西格玛)渗透20 min。固定细胞用抗CD44、抗α6β4、抗α3β1、抗基质金属蛋白酶(MMP)-9、抗MMP-13、抗上皮细胞黏附分子(EPCAM)、抗波形蛋白、抗Src和抗Ezrin抗体(Abcam,中国)在4 ℃下过夜,随后与荧光共轭Alexa Fluor 488和Alexa Fluor 555二级抗体(Thermo Fisher Scientific,美国)孵育。
《2.5. 蛋白质印迹分析》
2.5. 蛋白质印迹分析
用补充有蛋白酶和磷酸酶抑制剂的放射免疫沉淀法(RIPA)分析缓冲液裂解细胞和外泌体。双金鸡纳酸(BCA)测定用于测量样品蛋白质的浓度。将所有蛋白质样品的浓度校正为1 μg∙μL-1。通过Western blotting评估CD44、α6β4、MMP-2、MMP-9、MMP-13、EPCAM、波形蛋白、Src、Ras和ERK的表达水平,并将蛋白表达标准化为β-肌动蛋白。蛋白质样品(每个20 μg)通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(非还原)进行分离。然后将蛋白质样品转移到聚偏氟乙烯(PVDF)膜上。在室温下用5%无脂奶粉溶液封闭膜1 h,并在4 ℃下用抗CD44、抗α6β4、抗MMP-2、抗MMP-9、抗MMP-13、抗EPCAM、抗波形蛋白、抗Src、抗Ras、抗ERK和抗β肌动蛋白抗体(Abcam,中国)孵育过夜。免疫印迹通过增强化学发光(ECL)检测系统显示。
《2.6. 蛋白质复合物免疫沉淀》
2.6. 蛋白质复合物免疫沉淀
将PANC-1、Capan-1、P-CD44kd细胞和外泌体在裂解缓冲液[N-2-羟乙基哌嗪-N′-2-乙基磺酸(HEPES)缓冲液中与1% Brij96]中在4 ℃下均质60 min。样品分别为融合了抗体的细胞裂解液或外泌体裂解液,首先,在4 ℃下过夜孵育;随后,用5%蛋白-G琼脂糖(美国Invitrogen)进行1 h的样品旋转沉淀。配合物用裂解缓冲液洗涤三次。所有的液体都是用一根35 g的针连在真空泵上除去的,以确保最低限度的背景值。
《3. 实验结果》
3. 实验结果
《3.1. CD44表达与胰腺癌的进展呈正相关》
3.1. CD44表达与胰腺癌的进展呈正相关
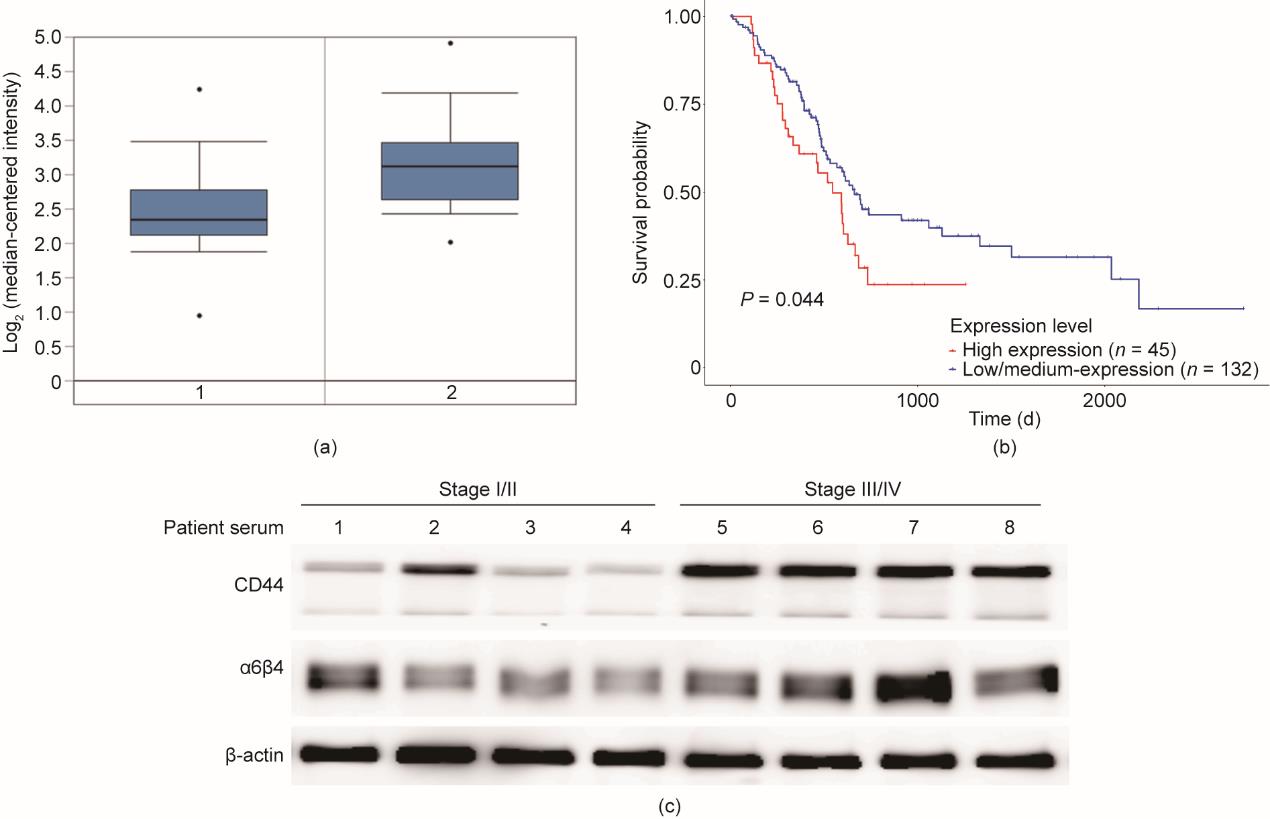
CD44是一种多功能的细胞表面膜蛋白,参与各种生物过程,对癌细胞的病理活动至关重要[26]。为了探讨CD44与胰腺癌转移的关系,我们首先在XENA数据库和Onomine数据库中比较了正常人和胰腺癌患者之间的CD44表达水平。从XENA数据库获得的结果表明,胰腺癌患者的CD44表达高于正常人[图1(a)]。为了进一步确定CD44在肿瘤转移中的作用,我们还分别分析了原发性和转移性肿瘤不同级别患者的CD44表达(见Appendix A中的图S1)。此外,UALCAN数据库†用于分析癌症基因组图谱(TCGA)数据库中高或低/中CD44表达水平患者的生存曲线。显然,与CD44低/中表达水平的患者相比,CD44高表达水平的患者预后较差[图1(b)]。研究表明,整合素受体通过其细胞外结构域介导细胞外基质的激活,并促进细胞黏附[29]。这种整合素特有的细胞外结构域和与细胞骨架蛋白相互作用的细胞内结构域与配体结合[30]。有趣的是,我们还发现胰腺癌中CD44的表达与α6β4呈正相关,α6β4是一种与细胞膜结合的整合素。我们评估了早期和晚期胰腺癌患者血清样本中CD44和α6β4的表达水平。我们发现晚期癌症患者的血清样本中CD44和α6β4的表达水平高于早期癌症患者的血清样本。值得注意的是,在晚期癌症患者的血清样本中,CD44与α6β4整合素呈正相关,而在早期癌症患者的血清样本中,CD44与α6β4之间的相关性不强[图1(c)]。这些来自临床样本的结果与数据库的分析结果一致。因此,CD44可能是胰腺癌潜在的预后生物标志物,并且可能与细胞黏附分子α6β4相关。
《图1》
图1 CD44与胰腺癌的分期、肿瘤状态、浸润和不良预后呈正相关。(a)通过挖掘肿瘤数据库,使用XENA数据集,在患者样本的正常组织和转移组织之间差异表达CD44。正常组织用1表示,肿瘤患者组织用2表示。*:P < 0.05。(b)Kaplan‒Meier生存曲线显示患者的总体生存率(从TCGA数据库检索数据,并使用UALCAN根据CD44表达水平进行分类)。(c)免疫共沉淀检测患者血清中CD44和α6β4的表达水平。
《3.2. CD44调节胰腺癌α6β4的表达》
3.2. CD44调节胰腺癌α6β4的表达
在肿瘤转移过程中,肿瘤细胞通常获得增强的迁移和侵袭特性,上皮-间质转化(EMT)也被视为早期肿瘤转移的初始标志[16]。CD44分子包含一个胞外结构域,该结构域在细胞膜表面高表达,并参与细胞运动[31]。因此,我们探讨了CD44在胰腺肿瘤细胞迁移和侵袭中的作用。两种胰腺癌细胞系(PANC-1和Capan-1)被用来检测CD44和其他细胞运动相关基因之间的关联。考虑到患者样本中CD44和α6β4之间的相关性,我们首先检测了这两种细胞系中CD44和α6β4的表达水平。CD44和α6β4在这两种细胞系中均高表达[图2(a)]。为了进一步评估CD44在肿瘤转移中的作用,分别使用PANC-1和Capan-1细胞系建立了CD44敲除(shRNA-CD44)细胞系。当CD44表达受到抑制时,α6β4的表达水平下调[图2(b)],表明CD44可以直接调节α6β4的表达。为了探索CD44和α6β4之间的相互作用,我们进行了免疫共沉淀(Co-IP)实验,以确认CD44是否能在PANC-1和Capan-1细胞系中与α6β4形成复合物[图2(c)]。此外,在P-CD44kd和C-CD44kd细胞系中也发现调控其他细胞运动的相关基因,包括Src、EPCAM和Ras这些信号通路在CD44敲除株显示表达下调,这意味着CD44可能通过调节各种信号级联参与细胞迁移和侵袭[图2(d)]。此外,CD44的抑制下调了各种金属蛋白酶;如图所示,在P-CD44kd和C-CD44kd细胞系中,MMP-9的下降最为显著,而MMP-2和MMP-13的表达水平分别下降了约40%和60% [图2(d)]。Src(一种与细胞骨架重塑相关的蛋白酪氨酸激酶)的表达在P-CD44kd和C-CD44kd细胞系中也降低,表明CD44调节Src表达以改变细胞骨架的结构和细胞骨架与细胞膜之间的接触位置,从而促进细胞迁移[图2(d)]。此外,进行细胞膜免疫荧光染色以评估CD44和某些其他EMT相关蛋白的共定位。P-CD44kd中CD44和EMT相关蛋白的共定位明显降低,尤其是CD44和α6β4的共定位。值得注意的是,CD44与MMP-9以及波形蛋白和Ras在肿瘤细胞系的细胞表面膜上显著共定位;然而,这些蛋白质在P-CD44kd和C-CD44kd细胞系中的共定位降低。这些结果表明,CD44表达的降低可以下调Src和Ras信号通路。因此,细胞膜上蛋白质CD44及其相关蛋白的共定位表达量的减少可能影响肿瘤转移过程的早期阶段,包括调控肿瘤细胞发生黏附和迁移[图2(e)]。
《图2》
图2 CD44调节胰腺癌中α6β4的表达。(a)利用两种胰腺癌细胞系PANC-1和Capan-1,通过免疫共沉淀检测CD44和α6β4的表达。(b)shRNA-CD44被用于通过沉默CD44的表达来降低PANC-1和Capan-1细胞系中的CD44表达。(c)CD44和α6β4复合物共定位实验结果表明,在PANC-1和Capan-1细胞系中,CD44直接与α6β4结合,形成CD44-α6β4复合物,免疫球蛋白G(IgG)用作对照。(d)提取总蛋白质并进行分析,以检测PANC-1、P-CD44kd、Capan-1和C-CD44kd细胞系中EMT相关蛋白的表达。(e)共聚焦显微镜确定了CD44和EMT相关蛋白质的定位,并证明了评估细胞表面CD44-α6β4复合物的能力。使用共焦显微镜获得图像,并合并以评估蛋白质定位(比例尺:50μm)。
《3.3. CD44影响细胞增殖和活力》
3.3. CD44影响细胞增殖和活力
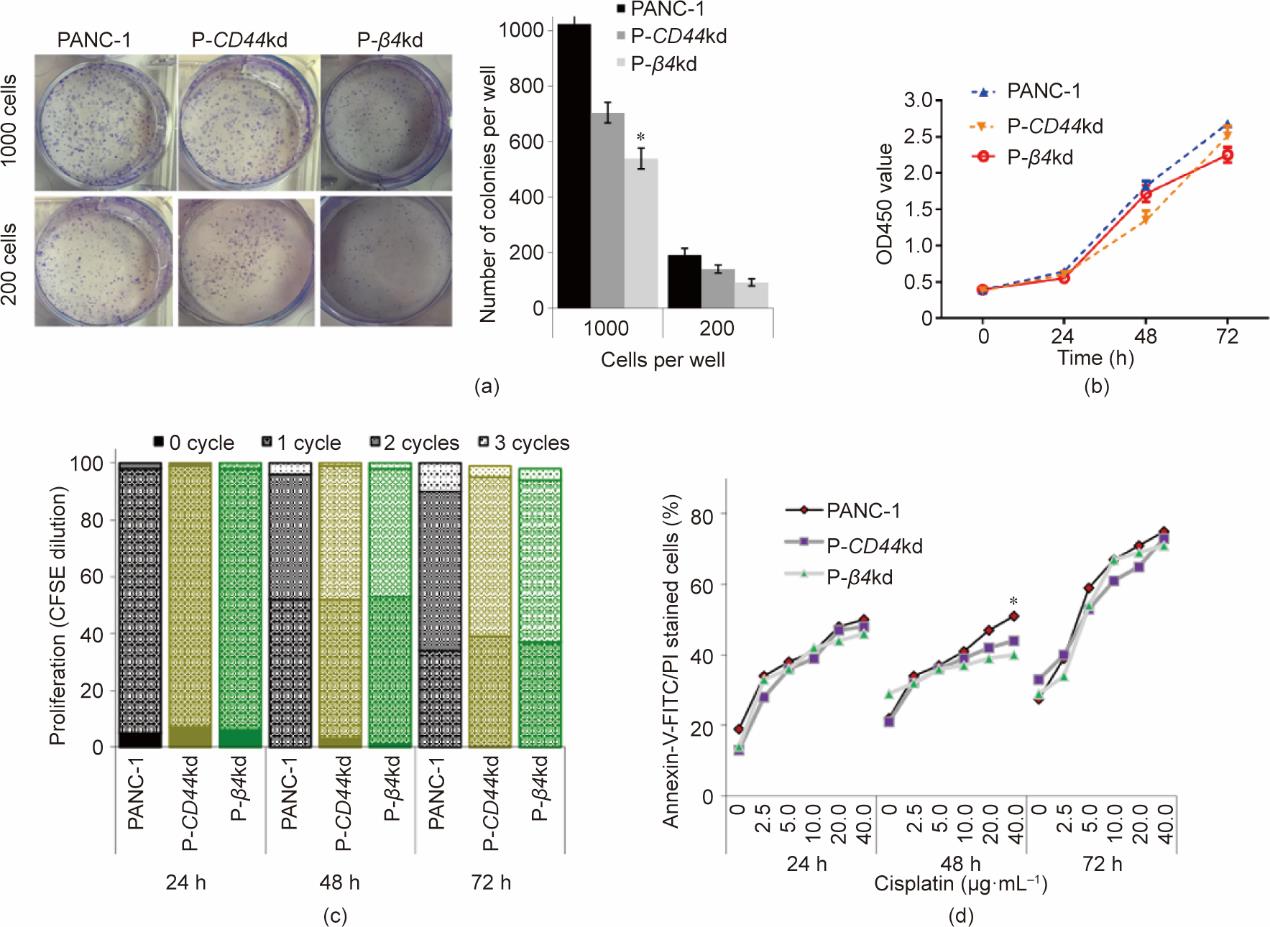
异常细胞增殖是肿瘤生长和侵袭性的重要特征。因此,我们评估了CD44对肿瘤细胞增殖的影响。为了阐明CD44与β4之间的关系,我们利用shRNA-β4建立了β4 knockdown (β4kd)细胞系。将shRNA-β4转染至PANC-1和Capan-1细胞株(分别为P-β4kd和C-β4kd)后,进行克隆形成试验以评估胰腺癌细胞的生存能力。将PANC-1、P-CD44kd和P-β4kd(每个细胞系的200个和1000个细胞)接种在一个六孔培养皿中,培养10 d后计数细胞集落数。我们观察到PANC-1的细胞克隆数量最多,而P-CD44kd和P-β4kd细胞系中的克隆数量分别减少约30%和50% [图3(a)]。进行CCK-8细胞生长实验,以监测不同细胞系中的细胞生长,数据显示肿瘤细胞系和敲除细胞系之间的差异很小[图3(b)]。通过CFSE标记对PANC-1、P-CD44kd和P-β4kd细胞系进行细胞周期分析,结果发现,培养72 h后进入第三个周期的P-CD44kd和P-β4kd细胞数量少于肿瘤细胞数量,表明CD44和β4不影响细胞增殖和细胞周期[图3(c)]。Annexin-V-FITC/PI染色检测CD44和β4异常表达的肿瘤细胞在24 h、48 h和72 h的凋亡情况。结果表明,在三种细胞系中,随着顺铂浓度的增加,凋亡细胞的数量增加。与PANC-1细胞相比,P-CD44kd和P-β4kd在所有三个测试时间点的抗凋亡能力均降低,其凋亡率增加了约10% [图3(d)]。
《图3》
图3 CD44表达与细胞增殖和生存能力。(a)克隆形成试验检测CD44和β4降低对细胞生长的影响。将细胞(每个细胞系200个细胞和1000个细胞)接种在6个孔板中;培养10天后计数菌落。*:P <0.05。(b)用CCK-8法检测肿瘤细胞和敲除细胞的增殖情况。在指定的时间点测量细胞,并使用CCK分析细胞的增殖能力。(c)用CFSE标记细胞,显示不同细胞周期的细胞比例,并用流式细胞仪进行分析。(d)用梯度浓度的顺铂处理细胞,通过Annexin-V-FITC/PI染色评估细胞凋亡,并用FITC进一步染色以评估荧光,结果通过FACS分析。*:P <0.05。
《3.4. CD44-α6β4复合物影响细胞迁移和侵袭》
3.4. CD44-α6β4复合物影响细胞迁移和侵袭
肿瘤细胞通过改变细胞膜结构和细胞肌动蛋白来实现运动和侵袭;这导致周围组织的渗透,并促进肿瘤的侵袭和转移[32]。因此,我们测定了PANC-1、Capan-1、P-CD44kd、C-CD44kd、P-β4kd和C-β4kd细胞系中的细胞黏附和结构调节。将这些细胞接种到96孔板中;培养4 h后,将细胞洗涤两次以去除非黏附细胞。通过对黏附细胞进行结晶紫染色来评估细胞黏附。酶联免疫吸附试验(ELISA)结果显示,约50%的肿瘤细胞黏附在平板上,而只有约30%的CD44kd细胞黏附在平板上。值得注意的是,只有10%的β4kd细胞黏附在平板上。这些结果表明,CD44kd和β4kd细胞系中的黏附降低[图4(a)],这意味着CD44和β4的表达降低导致细胞失去连接和黏附能力。为了从形态学角度进一步研究细胞黏附,进行了鬼笔环肽染色测定以确定细胞结构的调节。使用共聚焦显微镜观察细胞触角,并采集图像进行分析。共聚焦显微镜图像显示,与肿瘤细胞相比,P-CD44kd、C-CD44kd、P-β4kd和C-β4kd细胞的细胞触角减少[图4(b)]。虽然我们没有检测CD44和α6β4与细胞黏附的相关性,但我们研究了CD44和α6β4与这些细胞系中细胞迁移的相关性。
《图4》
图4 CD44-α6β4复合物影响细胞黏附和侵袭。(a)通过细胞结合试验评估CD44对肿瘤黏附的影响。6个细胞系在96孔培养皿中接种4 h。细胞被洗涤并用结晶紫染色。黏附细胞百分比的平均值±SD如图所示。*:P <0.05。(b)评估CD44对肿瘤触角的影响。将细胞接种在盖玻片上,并用异硫氰酸荧光素-鬼笔环肽染色。共聚焦显微镜用于采集代表性图像。(c)通过transwell分析评估CD44对肿瘤迁移的影响。将细胞接种在上部transwell腔室中,底部孔中细胞的结晶紫染色显示出迁移能力。*:P <0.05。
细胞迁移是一个复杂的过程,涉及细胞骨架的剧烈重塑以及细胞骨架与细胞膜之间的相互作用[27]。CD44可介导细胞骨架相关蛋白,参与细胞骨架重塑过程[22]。因此,我们接下来想研究CD44和α6β4是否也有助于细胞迁移。将细胞接种到transwell迁移培养皿中,24 h后对迁移细胞进行评估。为了分析细胞的运动能力,细胞用结晶紫染色并在光学显微镜下观察。Transwell分析结果显示,迁移至底部孔的CD44-α6β4敲除(CD44-α6β4kd)细胞数量减少,表明CD44-α6β4kd削弱了这些细胞的迁移能力[图4(c)]。我们还对细胞进行了基质胶侵袭试验,发现CD44缺失的细胞在肿瘤细胞侵袭中显著减少(见Appendix A中的图S2)。所有这些实验表明,CD44-α6β4复合物在肿瘤转移过程中影响细胞迁移和侵袭。
《3.5. CD44在肿瘤源性外泌体中与α6β4协同作用》
3.5. CD44在肿瘤源性外泌体中与α6β4协同作用
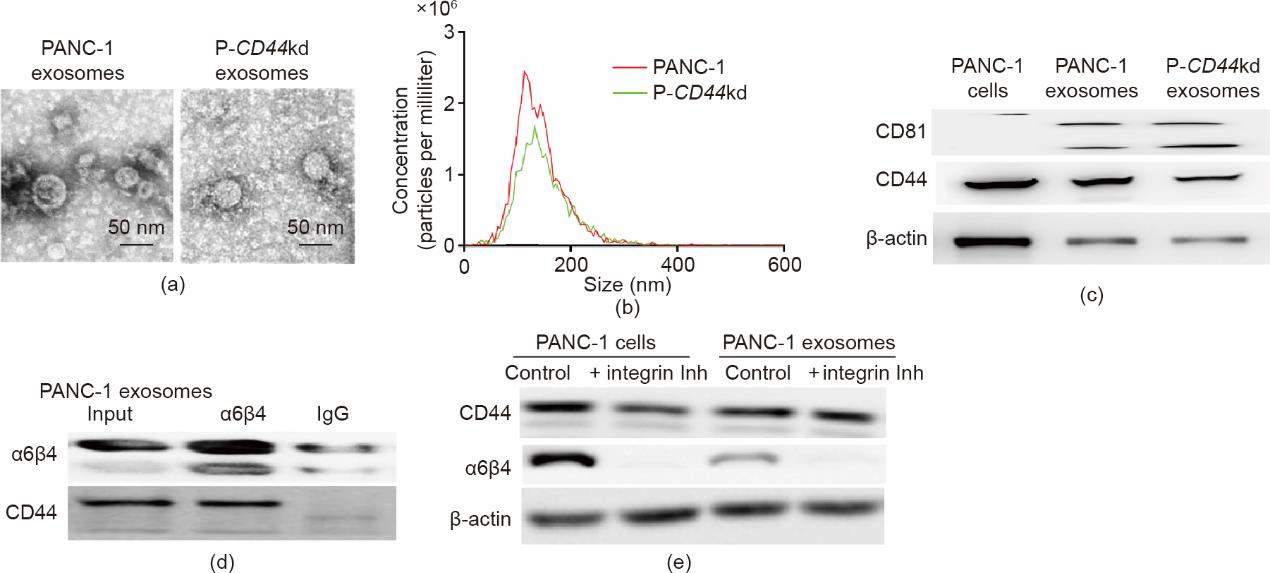
外泌体从供体细胞转移生物活性分子,这些分子被邻近组织吸收[33];因此,它们调节靶细胞的行为。采用密度梯度超速离心法提取PANC-1和P-CD44kd外泌体,并用扫描电镜观察外泌体的形态。PANC-1和P-CD44kd外泌体均显示杯状纳米结构,尺寸和质量相似[图5(a)]。纳米颗粒追踪分析(NTA)显示了肿瘤和CD44kd细胞外泌体的粒径[图5(b)]。免疫共沉淀印迹结果显示,P-CD44kd外泌体中CD44的表达水平低于PANC-1外泌体中的表达水平,这表明P-CD44kd外泌体携带的供体细胞CD44膜蛋白较少[图5(c)]。这些结果表明,与供体细胞相比,肿瘤来源的外泌体含有相似的蛋白质及其复合物。
《图5》
图5 CD44和α6β4在外泌体中相互作用。(a)、(b)通过超速离心分离PANC-1和P-CD44kd细胞分泌的外泌体,并通过TEM成像;进行纳米粒子追踪分析以确定外泌体的大小。(c)免疫印迹分析显示,P-CD44kd外泌体中CD44的表达水平低于PANC-1外泌体中的表达水平。(d)采用Co-IP实验检测PANC-1外泌体中CD44和α6β4的整合。以IgG作为对照。(e)免疫印迹分析显示抑制剂预处理后PANC-1细胞和外泌体中CD44和α6β4的表达。用抑制剂预处理PANC-1细胞48 h以阻断整合素表达,并从抑制剂处理的肿瘤细胞中分离出PANC-1衍生的外泌体。在体外,PANC-1外泌体中的CD44可与α6β4相互作用形成复合物抑制物。
考虑到由于供体细胞表面的内吞作用,CD44在外泌体生成过程中,经由胞吞胞吐作用在外泌体中富集,我们接下来评估了外泌体携带的CD44和α6β4之间的相互作用。也就是说,我们对外泌体携带CD44是独立作用于肿瘤转移微环境形成,还是通过CD44-α6β4复合物进行肿瘤微环境重塑,进行了细致的机制实验。为了验证CD44和α6β4是否可能形成复合物并释放到细胞外空间,进行Co-IP分析以评估肿瘤来源的外体[图5(d)]。此外,使用诸如西仑吉特和Cyclo等抑制剂的组合消除了PANC-1和P-CD44kd细胞系中整合素α6β4的表达水平。从这些细胞中分离出外质体并用抑制剂预处理。我们观察到,分别阻断β4在细胞和外泌体中的表达后,CD44的表达水平没有显著变化[图5(e)]。这些结果表明CD44可能不受整合素的调节。因此,我们将进一步分析外泌体携带CD44是否与肝脏靶细胞进行整合素α6β4的协同作用。
《3.6. 外泌体CD44通过肝细胞活化促进转移》
3.6. 外泌体CD44通过肝细胞活化促进转移
外泌体可以在靶器官中形成“转移前生态位”,从而促进靶区域的转移[34‒35]。因此,我们想要通过实验证明CD44高表达的肿瘤外泌体对靶细胞摄取的影响。用荧光染料diosp-18对PANC-1和P-CD44kd细胞分泌的外泌体进行染色,然后将染色标记的外泌体与宿主细胞LX-2 [人类肝星状细胞(HSC)系]一起孵育。HSC主要将信号从窦状细胞传输到肝实质,支持促炎细胞因子和趋化因子的激活。为了检测外泌体CD44在细胞摄取中的作用,将PANC-1肿瘤和P-CD44kd外泌体与LX-2细胞孵育48 h。通过荧光显微镜对比野生型和CD44敲除株来源的两种外泌体在LX-2细胞内部的摄取效率:发现大多数PANC-1外泌体进入LX-2细胞,而P-CD44kd外泌体仅附着在靶LX-2细胞表面并进入细胞外空间,表明P-CD44kd外泌体失去了被靶细胞黏附并摄取的能力[图6(a)]。接下来,我们进行了transwell分析,以评估肝细胞调节的肿瘤外体的侵袭能力。用PANC-1外泌体和P-CD44kd外泌体分别孵育LX-2细胞,检测LX-2细胞的迁移率。将外体调节的LX-2细胞接种到上transwell培养皿中,培养24 h后,用结晶紫对迁移细胞进行染色[图6(b)]。显微镜图像显示,与P-CD44kd外泌体的孵育组相比,PANC-1外泌体的LX-2细胞共孵育组中进入底部孔的细胞数量增加。
《图6》
图6 CD44-α6β4复合物影响靶细胞的迁移和侵袭。(a)肿瘤源性外泌体调控靶细胞;将每个100 μg·mL-1的PANC-1外泌体和P-CD44kd外泌体与LX-2细胞共培养24 h。绿色荧光区显示的染料标记的外泌体是从PANC-1和P-CD44kd细胞系分泌的。图像通过共焦显微镜获得。将绿色荧光与亮场(BLF)合并,同时观察细胞和外质体。(b)通过transwell分析确定外泌体对靶细胞迁移的影响。用结晶紫对迁移至底部孔的LX-2细胞进行染色。计数细胞数作为评价侵袭能力的指标。未经外体培养的LX-2细胞作为空白对照。(c)评估靶细胞中细胞因子和生长因子的表达水平。用肿瘤来源的外泌体预处理细胞。LX-2细胞与PANC-1和CD44kd外泌体一起孵育,并评估指示蛋白质的表达水平。以无外泌体孵育的LX-2细胞为空白对照组。β-肌动蛋白被用作蛋白质负载控制。
在胰腺肿瘤细胞转移到肝脏之前,肝脏肿瘤相关微环境的生成与成纤维细胞活化蛋白(FAP)的表达增加呈正相关,这种高表达的FAP能够促进“转移前生态位”的建立[36]。FAP的过度表达增加了CD44的表达[37]。因此,我们分别评估了对照LX-2、PANC-1外泌体调节和P-CD44kd外泌体调节LX-2细胞中α-SMA、FAP和CD44的表达[图6(c)]。免疫共沉淀实验分析显示,LX-2细胞中细胞因子和生长因子的表达水平上调,提示胰腺肿瘤外体激活了肝细胞。值得注意的是,CD44活性外泌体显示出比CD44kd外泌体更强的调节靶LX-2细胞分子的能力,尤其是肝细胞生长因子(HGF)、α-SMA、透明质酸(HA)和CD133的表达水平[38],表明外源性CD44在肿瘤从原发部位到靶器官的转移过程中起着关键作用[图6(c)]。这些结果表明外泌体如果携带高表达的CD44,该胰腺癌来源的外泌体将对靶细胞的侵袭能力有促进作用。
《4. 讨论》
4. 讨论
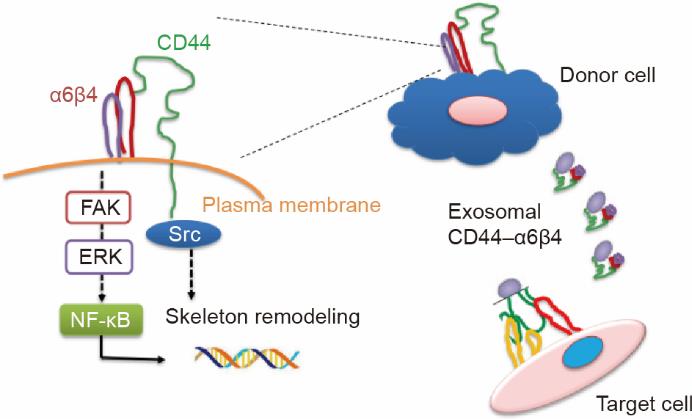
胰腺癌是一种侵袭性恶性肿瘤,五年死亡率为97%~98% [7,39]。60%~70%的胰腺癌患者在手术时有腹膜转移尤其是肝转移。因此,迫切需要为胰腺癌的早期检测和预后识别敏感和特异的生物标志物[40]。据报道,CD44是一种潜在的生物标志物,与各种癌症的进展和不良预后相关[41]。尽管最近的研究表明高水平的CD44表达与多种类型的癌症(包括胰腺癌)有关,但CD44在胰腺癌转移中的作用机制以及整合素α6β4是否与CD44相互作用仍在很大程度上未知。在本研究中,我们验证了CD44高表达水平与胰腺癌发病率和预后之间的正相关关系。此外,利用临床样本,我们发现α6β4的表达水平与胰腺癌的分期呈正相关。此外,我们的实验表明,CD44可以与α6β4结合形成复合物,可以调节信号通路,如Src和ERK通路。同时,黏着斑激酶(FAK)是一种非RTK,对整合素介导的信号转导和细胞功能至关重要。FAK也是多种信号通路的汇聚点,尤其是与肿瘤运动和致癌转化相关的核因子κ(NF-κB)。CD44和α6β4的结合也促进了肿瘤细胞迁移、侵袭、增殖和凋亡。我们发现胰腺癌来源的外泌体携带的CD44可以与α6β4相互作用,从而调节靶细胞的运动。外泌体CD44-α6β4复合体不仅在胰腺癌细胞膜上起作用,而且在邻近细胞摄取外体的过程中也起作用(图7)。
《图7》
图7 外泌体携带的CD44通过与整合素相互作用在胰腺癌肝转移中的分子作用的示意图。
肿瘤细胞转移到骨、肺、肝和脑等重要器官是绝大多数PDAC死亡的原因[42]。人们已经清楚地认识到,转移性播种和生长是由肿瘤细胞的固有遗传特性和基质微环境的局部特征决定的[43]。了解转移相关信号通路的器官特异性功能可能为不同器官的治疗靶向转移提供新的机会。人类胰腺癌肝转移的研究由于一些困难而变得复杂[8,44]。因此,对体内选定的胰腺癌细胞系高转移性变体进行最小功能基因组分析,可以识别不同的器官特异性(如骨、肺和脑)转移基因集[45]。在本研究中,我们重点研究了淋巴归巢肿瘤中的一个上调基因CD44 [14,20]。CD44是一种跨膜蛋白,以前曾参与正常淋巴细胞向淋巴结的归巢。CD44可诱导许多与肿瘤转移过程相关的活动,如不受控制的细胞生长、细胞骨架重组和密集的细胞迁移[46]。例如,CD44-Ras途径参与细胞增殖的激活,CD44-Rho家族途径与细胞迁移相关,CD44-Akt途径与细胞存活相关[31]。最近的研究也报道了CD44可以与不同类型的膜蛋白相互作用形成复合物,从而促进恶性级联反应。宿主器官和肿瘤细胞中黏附分子及其相应配体的明确表达支配着器官和选择性非随机肿瘤抑制[47]。例如,E-钙黏蛋白-整合素串扰调节上皮细胞-细胞黏附和细胞-基质黏附信号之间的动态相互作用,促进肿瘤细胞的可塑性,推动有效的迁移和侵袭。CD44和整合素可以介导类似蛋白质的表达,如Rho家族和Src [30]。CD44已被证明是整合素αvβ3的关键共受体,介导Runx2和Smad5的磷酸化,并且是前列腺癌转移期间NF-κB配体信号的受体激活剂。因此,CD44决定了整合素和其他受体之间的关联[48]。因此,有必要探讨CD44和整合素是否能够相互作用以增强它们在肿瘤转移中的功能。在此,我们的研究表明,CD44可以与整合素α6β4相互作用,形成CD44-α6β4复合物。
外泌体是细胞衍生的微囊泡,富含供体细胞的特定蛋白质、脂质、mRNA和miRNA [43],系统地充当细胞间通信器[11]。几项研究表明,肿瘤外泌体携带的整合素可以通过与器官特异性驻留细胞融合来确定嗜器官转移,从而建立转移前生态位[49‒50],进而显示对次级靶点的各种亲和力,以及非随机的扩散模式。探索外源分子对靶器官转移的影响可以为开发诊断标志物和治疗方法以阻止转移扩散铺平道路。先前的研究已经报道,CD44作为一种跨膜蛋白,在多种类型癌细胞分泌的外泌体中表达,包括乳腺癌、卵巢癌和胰腺癌[51]。外体CD44可激活MMP-9(一种金属蛋白酶),从而促进细胞外基质降解,促进细胞运动[14]。因此,有必要探索CD44参与外体传递的机制。CD44直接参与细胞外基质重塑,并作为许多细胞外基质成分(如HA)的跨膜受体[51]。CD44和HA的结合不仅可以促进肿瘤细胞的阻滞和外渗,还可以改变周围的基质以支持细胞定殖,从而促进细胞增殖[52]。我们的研究表明,外体CD44不仅可以激活基质蛋白,还可以与整合素α6β4相互作用形成复合物,并介导下游信号通路[47],如c-Src和Ras级联,从而影响细胞迁移。
总之,我们从两个角度证明了CD44-α6β4复合物与肿瘤转移过程之间的联系。首先,CD44-α6β4复合物可直接介导细胞骨架相关蛋白激活下游信号通路并促进胰腺癌转移;其次,肿瘤细胞来源的外泌体CD44可以与受体肝部素质细胞上的α6β4整合,以传递与肿瘤侵袭相关的信息。因此,我们的研究为CD44和相关整合素在肿瘤转移过程中的作用提供了新的见解。此外,CD44可能是胰腺癌新的预后标志物和潜在的治疗靶点。
《Authors contribution》
Authors contribution
Wei Mu, Yang Ge, and Wenbo Wang performed and analyzed experiments; Pengfei Gu and Yajie Xu performed the experiments and data analysis. Wei Mu and Hui Wang wrote the manuscript, and Yang Ge corrected the manuscript draft. All authors approved the manuscript. All authors approved the manuscript.
















 京公网安备 11010502051620号
京公网安备 11010502051620号




