《1. 引言》
1. 引言
芯片实验室(LoC)是指将多种实验室技术集成到一块几平方厘米的芯片上的设备,在化学[1‒3]和生命科学的各个领域都具有巨大的应用潜力,如在罕见细胞捕获领域[4‒5]。在这些应用中,捕获循环肿瘤细胞(CTC)是医学生物学领域最具挑战性的任务之一[6‒7]。肿瘤来源的上皮细胞的检测被认为是确定肿瘤转移潜能最经济的方法之一,血样中是否存在此类细胞以及存在的数量是帮助诊断和预后的指标[8]。将LoC技术融入即时医疗(POC)设备用于CTC检测是床旁癌症诊断和精准医疗的热门话题[9]。这项技术最近才出现,是一种可以用于对数量日益增加的患者进行大规模筛查的宝贵工具。在这一方面,许多检测已经通过智能手机等用户友好的工具融入日常生活中[10]。这些检测包括通过特定的专用软件进行的心血管疾病血液检测[11‒12]、芯片核磁共振(NMR)和表面增强拉曼光谱(SERS)分析[13‒14],以及芯片细胞识别[15],同时这些软件可以提供计数、检测和形态测量参数[16]。
鉴于POC设备的广泛使用,近年来聚合物LoC因其在生产成本、生产时间以及将想法转化为物理芯片的实用性方面具有竞争力而引起了人们极大的兴趣[17‒18]。研究人员可以采用不同的技术实现聚合物LoC的快速原型制作[19]。其中,由于分辨率较高(< 50 nm),软光刻技术成为用于微流控应用的聚合物微/纳米图案原型制作最广泛的方法之一[20]。这项技术需要制造模具,通常采用光刻法,其几何结构取决于整个设备的目标应用、复制和组装。这项技术的重要局限性是其所使用的材料;聚二甲基硅氧烷(PDMS)在微通道中受到高液压的作用会变形[21]。此外,与所有基于光刻法的技术一样,软光刻是一个耗时的过程,这往往限制了原型或迭代设计的优化。在设计一种新设备时,基于基板直接制作微结构的技术——不需要模具的技术——要方便得多。这些技术包括激光直写(DLW)方法和三维(3D)打印等。考虑在LoC领域的应用潜力,从计算机模型一步制造真3D微流控设备的可能性,以及桌面打印机的低价格,后者具有明显的吸引力。尽管有这些优势,但在分辨率方面3D打印结构目前还无法与其他直接结构化技术产生的结构竞争。事实上,由于技术上无法在合理尺寸的设备中可靠地打印尺寸小于几百微米的微流通道,3D打印的适用性受到限制。人们也担心维度保真度(dimensional fidelity)、形状一致性、表面质量、光学透明度和材料可用性方面的问题[22]。相反,超快激光技术的灵活性使具有复杂微流通道网络的LoC设备的原型制作和高精度微制造成为可能[23‒24],而不需要光刻工艺所需的昂贵掩膜和设备。此外,飞秒(fs)激光脉冲能够“冷”切割照射区,从而避免碎片和重铸层,且不受基材的限制,这使得该技术的成本即使高于其他传统技术,仍特别适合微流控设备制造[25‒28]。与DLW技术相比,机械微铣削技术更便于大结构使用[29],并且是一种灵活、经济的快速聚合物设备原型技术;然而,该技术导致表面质量较差,不适用于微通道的光学检测[30]。
无论微流控模式如何制造,下一步需要将结构基板或基层与盖板键合,以获得有效密封的微通道。本文提出了使用复杂设备控制溶剂的蒸发,以便实现有助于聚合物热辅助密封的表面改性[31]。其他研究小组利用了热退火、黏合剂涂敷、表面等离子体激活和后来的加压焊接[32‒34]。例如,研究人员已经发表了一种键合PMMA-PMMA设备的溶剂辅助方法,该方法基于将基板暴露于丙酮蒸气中。然而,作者报道,因这种溶剂的使用而引起的粗糙度改性影响了这种设备作为微流控工具的应用[33]。
Volpe等[35]证明了通过fs-激光焊接技术键合聚合物LoC的可行性。在他们的研究中,聚焦于两个透明基板界面的激光束产生非线性吸收,从而导致材料局部熔融和再凝固。虽然这些方法都有效,但它们不适合需要昂贵设备和(或)复杂调准程序的低成本快速制造。另一方面,虽然热键合方法是一种极低成本的替代方法,但它们基于聚合物熔融,不适合键合通道尺寸极小的图案化基板,因为在加热过程中通道很可能变形或堵塞。因此,低温(90 °C以下)工艺是首选[36]。
在本研究中,我们开发并测试了一种快速制作细胞捕获PMMA LoC原型的新智能程序,利用fs-激光技术对入口和出口连接的微通道进行机械微铣削,并通过热键合来完成该设备。在微流控所用的许多不同聚合物中,PMMA最常用。PMMA具有良好的光学、力学和化学特性,包括透明性、良好的热稳定性、化学惰性、高疏水性,以及在激光烧蚀和微铣削工艺中的力学稳定性[37]。
在计算机辅助设计(CAD)文件中,fs-激光烧蚀和微铣制造技术的结合充分适合快速创建和测试不同的流体设计以及优化细胞捕获策略,在保持可持续开发成本的同时,利用了超短脉冲微制造的微米级精度和高灵活性。
该方案还包括一种简单且经济有效的热辅助和溶剂辅助键合方法,用于组装聚合物芯片[38],它展示了这种低成本和简单程序的一些创新特点。该程序在普通溶剂、低温和低压下使用,为PMMA-PMMA而建立。该程序的使用可以获得具有较强黏合力且坚固的设备,同时保留制作微通道所需的形状和透明度。
作为一个应用证明,该设备对于从血细胞中无标记捕获和鉴别肿瘤细胞很有用。为了实现这个目标,在制作蛇形微通道后,我们使用抗上皮细胞黏附分子(EpCAM)抗体对通道内壁进行了“流入”生物功能化,从而能够通过识别口腔鳞状细胞癌上皮细胞膜的抗原,并将其阻挡在通道壁上,来区分癌细胞与非癌细胞。原则上,整个设备完全透明,使得可以识别通道内固定的细胞,而不需要用荧光抗体进一步标记。事实上,被捕获细胞的表征取决于通道壁上的固定抗体。我们的研究表明,只有肿瘤细胞会被一种针对癌症典型膜抗原的抗体识别,并且可以在通道中清楚地看到肿瘤细胞。蛇形通道使样品沿长路径通过,这有助于最大限度地增加细胞和抗体之间的相互作用。在给定时刻通道内所含样品的总体积非常小(几微升),但考虑到流入操作,这种配置对于芯片上收集罕见细胞和从较大体积(即毫升)开始富集样品具有重要作用。
《2. 材料与方法》
2. 材料与方法
《2.1. 材料》
2.1. 材料
该设备在具有光学表面质量[测量表面粗糙度(Ra)< 5 nm]的PMMA基板(Vistacryl CQ;英国Vista Optics公司)上制造。该基板为正方形,长度和宽度均为25 mm,顶层厚度为5 mm,底层厚度为1 mm。
对于微通道功能化,我们使用3-氨丙基三乙氧基硅烷(APTES; 5%)乙醇溶液、戊二醛(0.05%)水溶液、牛血清蛋白(BSA)(1%)和吐温-20(0.05%)的磷酸盐缓冲盐水(PBS)溶液及抗EpCAM小鼠单克隆抗体(所有试剂均来自美国西格玛奥德里奇公司)。抗EpCAM抗体特异识别在上皮细胞表面上表达的人的EpCAM,与正常细胞或瘤性非上皮细胞无反应。
OECM-1人口腔鳞状细胞癌细胞株(购自美国SCC公司/美国西格玛奥德里奇公司)适合于癌细胞信号转导、上皮间充质转化(EMT)、转移、侵袭和癌细胞干性。Jurkat细胞株(购自美国ATCC公司)是人类血液(白血病T细胞淋巴母细胞)来源的细胞。
《2.2. 芯片实验室的制造、功能化和测试》
2.2. 芯片实验室的制造、功能化和测试
蛇形通道使用Rhinoceros 5 CAD软件(美国Robert McNeel & Associates公司)设计,并根据啁啾脉冲放大技术使用1030 nm激光超快固态激光系统(改良TruMicro Femto Ed.;德国TRUMPF GmbH + Co. KG公司)制造。激光源提供线性偏振的近衍射极限光束(M2 < 1.3)的脉冲持续时间为900 fs。四分之一波片圆偏振光束,然后聚焦并通过配备远心透镜的振镜扫描头(IntelliSCANNse 14;德国SCAN-LAB公司)进入聚合物表面,焦距为100 mm,聚焦点的光斑直径约为25 μm。虽然PMMA在激光波长下几乎透明,但由于聚焦fs-激光脉冲的高峰值通量,非线性多光子吸收介导激光与透明聚合物的耦合,使薄表面层沿辐照路径温和地烧蚀。逐层铣削程序是通过叠加两个垂直的扫描图案进行的。两条平行扫描线之间的横向距离为5 μm。重复频率(RR)为50 kHz,脉冲能量为12 μJ,扫描速度为40 mm·s-1。微制造过程后,用蒸馏水超声波清洗10 min,去除松散附着的碎片。用光学显微镜(Eclipse ME600;日本尼康公司)和ContourGT InMotion光学轮廓仪(美国布鲁克公司)分别测量fs-激光铣削显微特征的尺寸和铣削表面的平均粗糙度(Ra)。
采用Rhinoceros 5 CAD软件设计入口和出口,利用CAD-计算机辅助制造(CAM)软件将CAD信息转移到机器代码文件中进行微铣削控制。利用微型铣床(Mini-Mill/GX;美国Minitech Machinery公司)上的摄像机使入口和出口对准蛇形通道。使用400 μm工具以20 000 r·min-1铣削PMMA层,同时使用空气冷却。
为了键合PMMA层,在平底基板上以2000 r·min-1使用旋转涂布机10 s将热的纯异丙醇(70 °C)留存在受保护的环境中;多余液体用吸墨纸除去。然后组装两个PMMA切片。用长尾夹固定位置,然后立即将设备转移到60 °C的烘箱中,在不增压的情况下保持20 min。
组装好的设备连接到具有微铣削形状入口和出口的完美吻合的毛细管,同时也连接到微流控设备。使用的Elveflow微型泵系统(法国Elvesys公司)配备一个OB1基础模块、两个用于压力控制器的MkIII+通道,以及两个微流控流量传感器。向蛇形通道中注入一系列溶液,首先注入APTES (5%)乙醇溶液。这一步使胺官能团掺入以及PMMA表面具有亲水性。通过表面与APTES的硅醇基团的缩合反应接枝PMMA,从而生成胺官能团化的PMMA (PMMA-NH2)。这使得PMMA通道具有亲水性,因而后续的水溶液能更容易流动。用水清洗通道后,注入戊二醛(0.05%),与胺活化基团相互作用生成PMMA-戊二醛。在随后的阶段,后者与抗体的胺基发生亚胺偶联反应,从而使抗EpCAM抗体固定[39‒40]。用封闭缓冲液(BSA-吐温-20的PBS溶液)进行钝化步骤,以防止非特异性细胞吸附。在捕获测试中,采用奥林巴斯IX81倒置显微镜(日本)进行实时采集。这个设备包括一个Okolab系统,配有一个温控箱和一个摄像头。细胞培养物在37 °C、5% CO2的培养箱中培养,并在RPMI 1640完全培养基(美国西格玛奥德里奇公司)的悬浮液(Jurkat细胞)中培养;或在完全杜尔贝科改良伊格尔培养基(DMEM;美国西格玛奥德里奇公司)的黏附液(OECM-1细胞)中培养;培养基每两天更新一次。在捕获实验前几分钟,使用0.05%胰蛋白酶悬浮和收获癌细胞。分离后,清洗细胞,并以适当的稀释度使细胞重悬于DMEM培养基中。从烧瓶中收集Jurkat细胞,离心、计数以及以适当的稀释度重悬。然后使用微流控设备以7 μL·min-1的流速将溶液装入毛细管中。
《3. 结果》
3. 结果
《3.1. 芯片实验室设备的制造》
3.1. 芯片实验室设备的制造
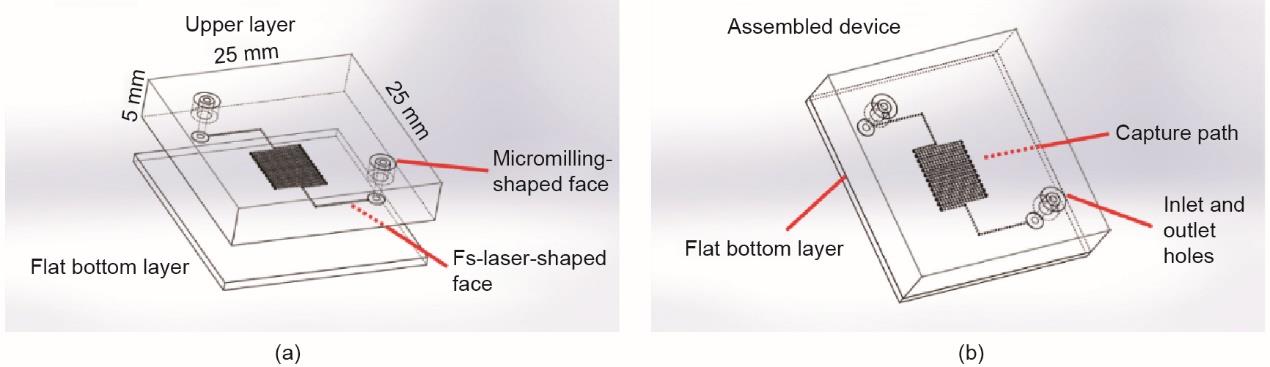
实现该设备的第一步是其元件的CAD,然后以机器代码的形式转移到所用的制造仪器。图1(a)、(b)图示了提出的几何形状。为了优化制造、键合及最终应用的参数,设计并测试了各种不同的设备结构。本文讨论了该设备的最终布局,它基于一个正方形截面(每条边长100 μm)、总长度为180 mm的蛇形微通道,以增加活动路径,从而增加捕获细胞的概率。使用两个PMMA基板,以最大限度地减小组装设备的尺寸并获得透明度。上基板[图1(a)]分别在两个面加工。在下面,蛇形通道通过fs-激光烧蚀制作,以微米级精度逐层轻轻地去除材料,直到达到设计深度。上面使用微型铣床钻制进孔和出孔。底层是一个平面光滑的PMMA基板,仅用于密封通道[图1(a)]。
《图1》
图1 (a)PMMA设备的模块:上层两侧铣削,底部有fs-激光蛇形通道,顶部有微型铣床的进孔和出孔。平滑的PMMA切片密封蛇形通道。(b)组装设备的结构。
经过仔细对准对面的蛇形端,入口和出口利用安装400 μm工具的机械微型铣床制作。根据Reichenbach等[41]的研究,空气冷却的铣床以100 mm·min-1进料速度和20 000 r·min-1的主轴转速完成。入口和出口是同心的圆柱体孔,与毛细管的外部和内部尺寸完美匹配。从这些圆柱体的中心,产生直径为600 μm、长度为5 mm的通道,使得从对面注入的流体能够到达蛇形通道。
图2(a)显示微制造蛇形通道的立体图像。图2(b)突出显示了该设备的特定部分。通道边缘没有可能阻碍密封程序的裂缝、毛刺或重铸层。通道底部的粗糙度(Ra)约为2 μm。相较通道高度,这个值可忽略不计;因此,它不影响细胞的流体运输。基板用紫外线(UV)等离子体处理,以去除铣削过程的残留物并产生亲水性。
《图2》
图2 (a)激光微制造样品的立体图像;(b)蛇形通道的微观3D详图。
《3.2. 设备的键合和功能化》
3.2. 设备的键合和功能化
我们开发了一种热辅助和溶剂辅助键合方法来组装微流控设备。热异丙醇留存在平滑基板的受保护环境内。然后将两个PMMA切片放在一起;用夹子固定它们的位置,再立即将设备移入烘箱。一旦设备组装好,就通过毛细管与微型泵系统相连;从图3(a)中可以看出,水密封不需要额外的胶水、鲁尔配件或垫圈。通过这种方式,实现了即插即用的操作系统,避免了微流控设备的典型密封问题。通过蛇形通道进行流入功能化,然后进行光学显微镜监测[图3(b)中的序列]。该设备的完全透明使试验的重现性和流动注射的在线监测成为可能。我们优化了PMMA通道功能化的具体方案,包括填充APTES (5%)乙醇溶液,然后注入戊二醛(0.05%)水溶液,再注入抗-EpCAM抗体的PBS溶液。由于通道的蛇形形状,结合溶液的较慢流速(7 μL·min-1)和填充的实时监测,我们可以获得一种能够利用抗体活性结合位点极高表面积/体积比的工具,从而具有出色的细胞捕获能力。
《图3》
图3 (a)最终设备微流控连接到微型泵和流量传感器的图像。(b)在光学显微镜下监测流入微通道的流量。在注入过程中产生的气泡序列(红色箭头所示)有助于跟踪蛇形通道的功能化。
《3.3. 循环肿瘤细胞捕获实验》
3.3. 循环肿瘤细胞捕获实验
本节对微流控设备区分癌细胞和正常细胞的能力进行了测试。为此,我们在最后一步固定了抗-EpCAM抗体。该抗体能够识别人的EpCAM,这是一种通常存在于上皮型癌细胞表面的膜生物标志物[42‒43]。然后进行了最后的钝化步骤,以避免非特异性细胞吸附,其中涉及用含牛血清蛋白(1%)和吐温-20(0.05%)的PBS缓冲液冲洗,再用PBS冲洗。为了证明我们设备的有效性并提供组装设备的应用证明,我们在培养基样品中添加了两种不同的细胞群体(血液和肿瘤细胞),以模拟复杂的真实样品的内容。尤其,我们使用了Jurkat细胞(血液来源细胞)和OECM-1人口腔鳞状细胞癌细胞株(人口腔癌的上皮样细胞)。我们分别制备了5 mL Jurkat细胞株和OECM-1细胞株的细胞悬液,细胞含量分别为1 ×106个·mL-1和1 × 104 个·mL-1。细胞悬液以7 μL·min-1的流速缓慢流过蛇形微通道。通过优化流体的低速、通道的大小和蛇形形状,最大限度增加细胞与内壁的相互作用。而固定在内壁表面的抗体可以识别表达膜上皮抗原的细胞。
在有Jurkat细胞的情况下,用PBS溶液洗涤后,通道中很少或没有细胞被识别(图4)。事实上,Jurkat细胞不在细胞膜表面表达EpCAM抗体;因此,它们无法被通道壁上固定的抗体识别固定。为了证明蛇形通道中存在Jurkat细胞,我们在蛇形通道的中间另开了一个微铣削孔,此处Jurkat细胞在流体力的作用下迅速聚集(图5)。
《图4》
图4 Jurkat细胞流动和PBS洗涤后的PMMA微通道。沿着微通道的通路很少或没有可见的细胞。(a)、(c)表示不同放大倍数下的蛇形环路;(b)、(d)表示不同放大倍数下通道的直线部分。
《图5》
图5 图中显示了在蛇形通道中间故意形成的孔中聚集的Jurkat细胞,以证实这种细胞不会黏附在生物功能化通道表面,而是由微流控力拖动到另一个出口。
相反,在使用细胞OECM-1悬液的情况下,大量细胞在内壁被捕获;PBS洗涤后,发现这些细胞黏附在表面。如图6所示,通过透明的PMMA设备,细胞清晰可见,同时还证实了这种工具可以作为诊断仪器,以无标记的方式固定并区分癌细胞和正常细胞,不需要荧光检测器或复杂仪器。
《图6》
图6 PBS洗涤后有堵塞OECM-1细胞的PMMA微通道的显微图像。大量细胞在通道内表面被捕获,如(a)和(b)中沿通道直线部分的红色箭头所示;(c)是(b)在更高放大倍数下的图像;(d)蛇形环路中的细胞;(e)是(b)的放大区域;(f)是(e)的放大区域。
如高倍放大图像所示,通道外有一些明显的褶皱。这是在溶剂辅助键合热塑性材料中发生的典型问题;如参考文献[33]所述,褶皱可能是由于溶剂和温度处理的结合引起的应力导致的。在许多报道的案例中,由于裂缝的存在非常明显,以致于通道结构受到影响,这一点限制了该设备的适用性。然而,在本研究中,褶皱仅存在于设备表面和蛇形微通道外部,这是因为我们只用异丙醇旋涂了平滑的PMMA基板,没有旋涂上层[图1(a)]。因此,在键合过程中异丙醇并没有填充通道,而只作用于铣削板的未改性部分,即那些支持黏附的部分。
《4. 讨论》
4. 讨论
在本研究中,我们实现了微流控PMMA设备,并测试了它在流动中直接捕获肿瘤细胞的功能。该设备采用了智能灵活的流程,具体分为三步:①利用结合fs-激光和机械微铣削技术的混合微制造平台制作微流控网络;②采用简便、低成本的热辅助和溶剂辅助键合方法组装和密封设备;③获得的微通道的流入和片上功能化。采用这一流程可以很容易为许多不同应用制作设备原型。本研究中提出的设备可用于许多令人关注的情况。它不仅是可用于细胞简单研究的有用工具,如果嵌入一个较复杂的设备,也可用于现场诊断。事实上,通过与光学系统适当集成,整个平台在不久的将来有可能转移到便携式系统中,以提供高像素密度、更快的聚焦和图像稳定[44]。
这种混合微制造平台得益于两种先进的制造技术(超快激光和机械微铣削技术)的结合,这两种技术极其灵活,特别适合定制LoC原型的快速制作。由于它是非接触技术,fs-激光烧蚀可以制造复杂的几何特性,而对周围材料的间接损害可忽略不计;此外,由于激光辐射聚焦在衍射极限光斑的可能性,该技术能够提供微米级精度。此外,机械微铣削技术的使用可以大大减少制造时间,特别是在制造不需要高水平精度的大特性和(或)简单特性(如孔)时。微流控芯片入口和出口的主要缺点之一是,在不依靠添加鲁尔配件、胶水或其他避免泄漏连接的策略的情况下,通常很难完美密封管,而添加这些物品可能会影响显微镜观察。本研究中通过定制带内孔的微铣削孔来完美密封管,因此圆柱孔驱动毛细管连接,而无需任何其他密封。
这两种技术的结合可以克服其他更常用于LoC原型快速制造的技术的局限性。事实上,与软光刻技术不同,提出的方法适用于任何类型的材料且不需要模具;因此,在原型制作阶段会有更大的灵活性。此外,采用这种方法获得的结构可能远比3D打印精确,而且制造时间较短。
我们还描述了一种简单但值得注意的低成本键合方法,不需要胶水或额外的垫圈,而且在具有腐蚀性溶剂或温度的情况下,这不是一个破坏性过程。由于其成本低,人们有强烈的兴趣选择PMMA作为制造整个设备的材料。PMMA也因此特别适合工业开发。与用于微流控设备的其他聚合物(如PDMS)相比,PMMA更硬,从而能确保微流控网络具有更好的力学稳定性、再现性和耐久性。有一个不可忽视的方面是PMMA的生物相容性,这使得从LoC [45]到假肢制造[46]的生物应用工具得以实现。
此外,该设备在整个制造期间都保持完全的透明度,实现在多步过程中的完美调准以及实验的实时监测。这一特性对检查通道是否正确填充以及是否遵从在显微镜下的所有实验步骤至关重要。
作为一个概念证明,我们使用组装的设备作为CTC检测工具。血液中的CTC数量变化很大,取决于肿瘤的分期和侵袭性;尽管如此,这些细胞的早期检测仍被认为是临床医生决策的关键因素。这种分析属于液体活检,其目的是开发有创性越来越低的分析方法,并提高患者的依从性。为了创造一个CTC检测工具,我们通过快速原型制造方法实现了微流通道,并利用抗-EpCAM抗体使其功能化,而该抗体可结合在大多数上皮恶性组织表面高度表达的膜蛋白[47]。已识别的EpCAM抗原对细胞-细胞黏附强度和组织可塑性有调节作用,并且在上皮细胞增殖和分化中起着重要作用。该设备在上皮细胞的研究、癌症诊断和疾病进展预测方面是很有用的工具[43]。能够以无标记的方式识别出CTC将是液体活检领域的一项重大成就。目前,细胞分离/计数需要细胞计数法的复杂分析,并且需要借助于笨重且昂贵的仪器以及样品富集和标记的各种步骤[48]。本研究使用微流控技术从OECM-1细胞培养液的加标悬浮液中功能化和捕获人口腔鳞状细胞癌细胞,并通过固定化抗体的存在实现阳性选择方法。正如预期的那样,血液来源的Jurkat细胞流过蛇形通道而没有被捕获抗体识别,捕获抗体只能结合癌细胞。样品的起始体积为5 mL,表明我们设备(总体积为2 μL)可用于稀释溶液的富集和浓缩。这一研究结果在液体活检领域具有很高的影响。在液体活检领域,CTC的数量预计非常低,因为能够在小体积或空间内收集这类细胞,就有可能获得一致的生物材料做进一步分析。此外,原则上,微流控设备的结构可以定制,例如,为了识别多种膜生物标志物的表达,可使更多的通道实现不同的功能化;然后可以对结果进行整理,以匹配不同通道的更多信息。
《5. 结论》
5. 结论
本文描述了用于捕获CTC的智能、可定制塑料LoC原型的快速制作方法。这种设备创新地结合了高精准性的fs-激光烧蚀、简易机械微铣削以及节省成本的PMMA基板的溶剂辅助密封方法,从而确保了微流控分析的可靠性。此外,由于入口孔和出口孔的特殊设计,该工具有助于外部微流控连接,从而允许在用户友好的即插即用设备中进行毛细管水密连接。此外,该优化流程产生了一个完全透明的工具,适用于直接光学研究和蛇形通道的专用生物功能化。该工具的目的是以完全无标记的方式从生物样品中选择性地捕获和富集肿瘤细胞。移动电话、平板电脑或低成本互补型金属氧化物半导体(CMOS)设备可进一步集成,以方便检测CTC,从而引领个性化医学和现场诊断领域向前迈进一步。
《Authors’ contribution》
Authors’ contribution
Plan and design of the work: AV, MSC, EP, AA, and FF; experimental activity: AV, UK, MSC, and FF; responsible for experimental setups: AA and FF; implementation of the research, main conceptual ideas, and proof outline: MSC and FF; analysis of results: MSC, EP, and FF; writing of the manuscript: AV, MSC, and FF; manuscript revisions: AV, UK, MSC, EP, AA, and FF; project supervisors and funding responsibilities: MSC and FF.


















 京公网安备 11010502051620号
京公网安备 11010502051620号




