《1、 引言》
1、 引言
继发性淀粉样变性是一种全身代谢性疾病,是在急性和慢性炎症反应中肝细胞过度分泌血清淀粉样蛋白A 1(serum amyloid A 1, SAA1)而引起的并发症[1‒2]。淀粉样蛋白可在多个器官中沉积,引起多种致命性疾病,如严重的慢性感染、肿瘤、肝脏和肾脏衰竭,甚至继发性引起类风湿性关节炎(rheumatoid arthritis, RA)[3‒7]。RA是一种慢性系统性自身免疫性疾病,可引起骨破坏、长期疼痛、严重并发症,甚至最终发展成残疾,影响患者的生活质量,并造成重大社会负担[8]。遗传因素在RA的发病中起着关键作用。大约60% RA病例的发生与遗传因素有关[9]。然而,RA的致病基因仍然不明,这阻碍了RA的早期诊断和有效治疗。有报道显示,当RA患者伴随淀粉样蛋白A(AA)型淀粉样变性时,会引发感染和肾功能衰竭等严重并发症[1,7,10]。然而,因RA与SAA1之间的关系尚不清晰,所以血清SAA1检测尚未成为类风湿性关节炎患者的常规检查指标。
前期使用全外显子组测序方法,在58例RA患者的外周血单个核细胞中鉴定出多个含异常突变的基因[11],其中在SAA1.2基因中发现了一个新突变位点,可导致SAA1.2蛋白的氨基酸序列发生变化。SAA1有5种亚型[12];SAA1.1及SAA1.4与疾病之间的关系的相关报道甚少,而有临床报道指出SAA1.3及SAA 1.5与RA发病相关[2,13‒14]。日本一项关于RA临床队列的研究显示,SAA1.3与AA型淀粉样变性和疾病发病以及不良预后密切相关[7]。相反,SAA1.5的致病性较弱[15]。截至目前,SAA1的各个亚型包括SAA1.2的生物学作用尚未被阐明。
本研究旨在阐明SAA1.2、SAA1.3和SAA1.5在RA发病及发展中的作用及机制。实验以重组腺病毒为载体,将载有SAA1.2、SAA1.3、SAA1.5基因序列的载体注射至小鼠膝关节内,并在不同时间点检测小鼠的骨质量指标、SAA1表达水平、相关炎症细胞及炎症因子水平等,为阐明SAA1.2在RA发病发展中的机制提供科学的研究数据。
《2、 材料与方法》
2、 材料与方法
《2.1 腺病毒载体和实验动物》
2.1 腺病毒载体和实验动物
将人SAA1亚型SAA1.2、SAA1.3和SAA1.5全长的cDNA克隆至重组腺病毒内,并携带增强型绿色荧光蛋白(EGFP)报告基因,以EGFP作为对照(VectorBuilder,美国)。
将无特定病原菌(specific pathogen free, SPF)级C57BL/6雌性小鼠(10~14周龄)适应性饲养一周后,随机平均分成4组(每组10只),分别为SAA1.2组、SAA1.3组、SAA1.5组和EGFP对照组。然后,在每组小鼠的右侧膝关节外侧注射1 × 108噬菌斑形成单位(pfu)的腺病毒液。分别于注射后1、2、4、6周进行取材。实验得到了实验动物机构福利伦理认证工作委员会的批准。小鼠经12 h光/暗循环,并对其提供不限量的标准啮齿动物饲料(5053-PicoLab Rodent Diet 20;LabDiet,美国)和纯净水。
《2.2 微型计算机断层扫描(micro-CT)分析》
2.2 微型计算机断层扫描(micro-CT)分析
将小鼠麻醉后固定于CT扫描槽,由micro-CT(Bruker,比利时)扫描膝关节。扫描层厚9 μm。X射线管电流为441 μA,电压为43 kV。根据文献[16]中的方法,采用放射学评分系统对骨骼受到侵蚀的严重程度进行评分。同时,使用CT-Analyzer软件计算骨骼的三维微观结构特性。使用自主建立的micro-CT评分系统进行骨破坏评估。该评分系统包含与骨骼micro-CT分析结果相关的5个指标,包括骨小梁骨密度(bone mineral density, BMD)、组织矿物质密度(tissue mineral density, TMD)、骨小梁数(trabecular number, Tb.N)、总孔隙率(total porosity, TOT)、骨小梁体积率(trabecular volume rate, BV/TV)。由于这5项指标(X)随着关节炎的发展而同步变化(但方式不同),因此,将公式修改并归一化为(X - min) / (max - min)或1 - (X - min) / (max - min)。然后以这5项得分的平均值作为最终的micro-CT评分。此外,根据micro-CT评分设定骨破坏水平,可更直观、更直接地评估损伤程度。
《2.3 组织学评分》
2.3 组织学评分
将膝关节样本用4%多聚甲醛固定,用10%乙二胺四乙酸(EDTA)脱钙4周,然后进行脱水、石蜡包埋、矢状切片,并进行苏木精和伊红(hematoxylin and eosin, HE)染色。依据参考文献[17]报道的组织学评分中的重要指标评估滑膜炎症,以滑膜增生、纤维化、炎症、关节软骨损伤、骨侵蚀损伤为指标进行评分(表1 [17])。
《表1》
表1 使用定性评分系统对小鼠膝关节滑膜炎程度进行评分。经American College of Rheumatology, © 2010许可,转载自参考文献[]
| Critical criteria | Grade | Degree |
|---|---|---|
| Synovial lining cell hyperplasia | 0 | Absent |
| 1 | < 50% of the synovial lining shows change | |
| 2 | > 50% of the synovial lining shows change | |
| Fibrosis | 0 | Absent |
| 1 | Histiocytes | |
| 2 | Intermediary | |
| 3 | Marked | |
| Inflammation | 0 | Absent |
| 1 | Histiocytes | |
| 2 | Intermediary | |
| 3 | Marked | |
| Articular cartilage destruction | 0 | Absent |
| 1 | < 1/3 small focal damage | |
| 2 | < 1/2 small focal damage | |
| 3 | < 2/3 small focal damage | |
| 4 | Small stove-like destruction | |
| Bone erosion damage | 0 | Absent |
| 1 | Superficial destruction | |
| 2 | 1/2 of the deep cartilage layer | |
| 3 | Deep cartilage |
《2.4 免疫组化(IHC)分析》
2.4 免疫组化(IHC)分析
将石蜡包埋样本切成5 μm厚的切片。一抗选用SAA1(Abcam,英国),观察SAA1的分布。洗涤后,以辣根过氧化物酶(horseradish peroxidase, HRP)[BioSite Histo Plus (HRP) polymer anti-mouse kit; Nordic BioSite,瑞典]孵育10 min。用二氨基联苯胺(diaminobenzidine, DAB)显色,然后用苏木精进行核复染。
《2.5 流式细胞检测分析》
2.5 流式细胞检测分析
根据文献[18]报道,采用CD4+ 和CD8+ 染色法检测T细胞百分比的变化。将小鼠脾脏和外周血单个核细胞重悬于100 μL的1×染色缓冲液中,并在细胞悬液中加入抗CD4+和抗CD8+荧光标记抗体。采集至少100 000个有效细胞,用流式细胞仪(BD FACSCalibur,美国)进行定量分析。
《2.6 实时聚合酶链反应(RT-PCR)》
2.6 实时聚合酶链反应(RT-PCR)
膝关节样本取自离股骨头5 mm和胫骨头5 mm之间的组织,并去除周围肌肉及结缔组织。样品中加入液氮进行研磨。使用TRIzol试剂(Invitrogen,美国)提取RNA。使用NanoDrop 2000系统(ThermoFisher Scientific,美国)检测RNA的浓度。cDNA合成用cDNA合成试剂盒(Roche,德国)。cDNA扩增的引物(GenePharma,中国)见附录A中的表S1。CT值采用ViiATM7高效实时定量PCR系统(Life Technologies,美国)进行测定。
《2.7 酶联免疫吸附试验(ELISA)》
2.7 酶联免疫吸附试验(ELISA)
使用ELISA试剂盒测定小鼠血清中SAA和炎症因子白细胞介素(interleukin, IL)-6、IL-22、基质金属蛋白酶(matrix metalloproteinase, MMP)-3、MMP-9、IL-17、IL-23和粒细胞集落刺激因子(granulocyte-colony stimulating factor, G-CSF)的浓度(R&D,美国)。根据产品说明书,血液样本在室温(24 ~ 26 ℃)下凝固2 h,然后以3000 r·min-1的速度离心20 min;取出血清,立即或在低于零下20 ℃的条件下保存后进行分析。样品和标准样品均设置三个复孔。
《2.8 蛋白免疫印迹分析》
2.8 蛋白免疫印迹分析
肝脏、肾脏和肺部组织用预冷的放射性免疫共沉淀分析(radio immunoprecipitation assay, RIPA)裂解液(ThermoFisher Scientific,美国)裂解。将蛋白质样品进行电泳分离并转移到硝化纤维素膜上。将纤维素膜与一抗在4 ℃下孵育一夜,然后与二抗在室温下孵育1 h。使用美国LI-COR Odyssey扫描仪进行扫描。人SAA1一抗购自英国Abcam公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)一抗购自美国Cell Signaling Technology公司,以Image J软件分析灰度值。
《2.9 统计分析》
2.9 统计分析
所有数据均以平均值±标准差(SD)或标准误(SEM)表示。用Graph Pad Prism 5软件对显著性差异进行分析。
《3、 结果》
3、 结果
《3.1 在小鼠膝关节内转染SAA1不同亚型后可引起骨破坏》
3.1 在小鼠膝关节内转染SAA1不同亚型后可引起骨破坏
实验中通过动态观察动物的病理改变以确定SAA1不同亚型在关节炎症中的作用[见附录A中的图S1(a)]。分别对小鼠右侧膝关节单次注射转染后的4个时间点(注射后1、2、4、6周)进行分析,然后进行micro-CT评分并取材。在这6周的时间内,各组小鼠的体重没有发生变化,表明重组腺病毒载体adSAA1未引起明显毒性反应[图S1(b)]。
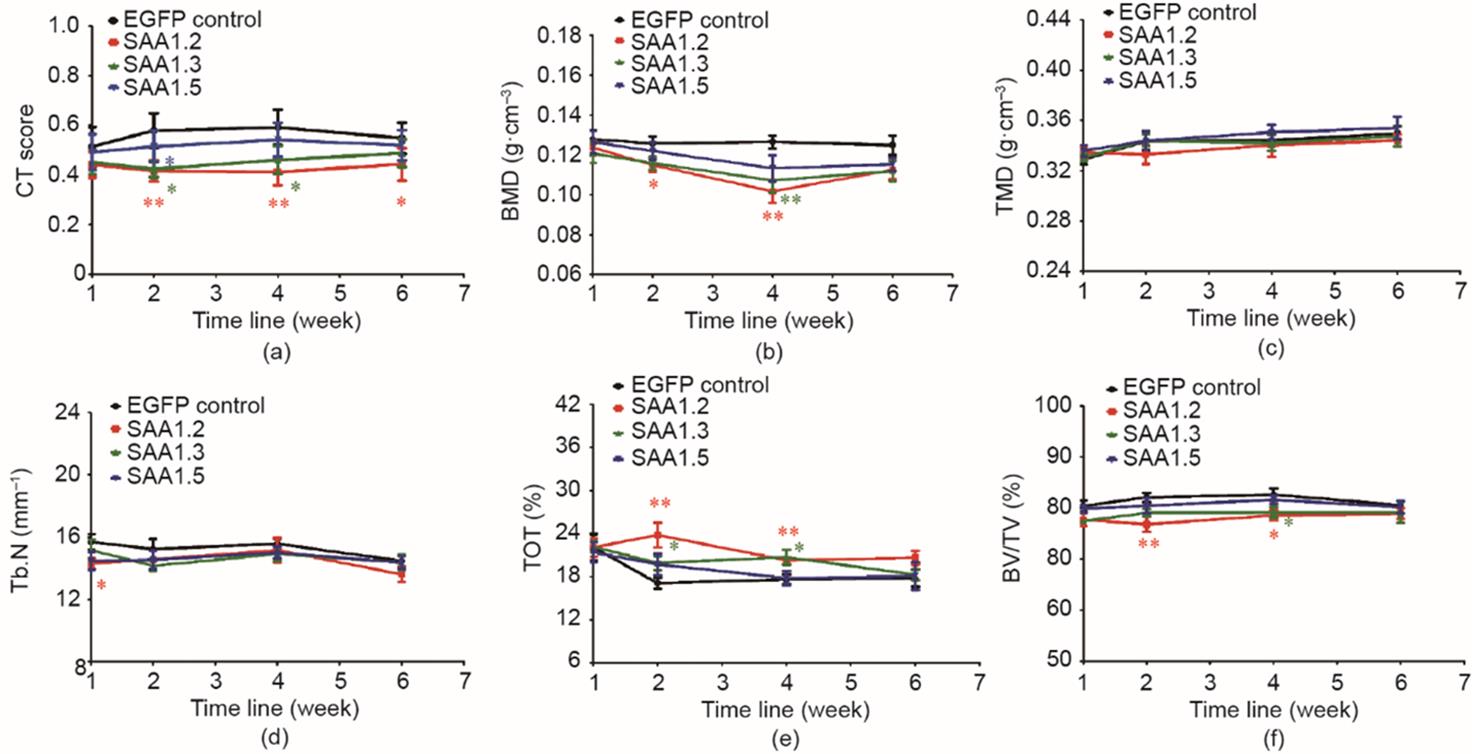
利用micro-CT分析小鼠双侧膝关节的BMD、TMD、Tb.N、TOT、BV/TV。在第2~4周观察到小鼠右侧膝关节的骨破坏,在第6周又逐渐恢复。与EGFP对照组相比,SAA1.2、SAA1.3和SAA1.5组在第2周时的CT评分分别减少了27.8%、26.7%和10.9%。在第6周时恢复至8.7%、15.8%和5.8%。SAA1.2组的BMD在第2周减少了8.7%,SAA1.2组和SAA1.3组的BMD在第4周分别减少了12.3%和11.3%,并在第6周恢复至与对照组无差异。除了TMD以外,其他参数在第2周变化最显著(图1)。为了更客观地评价骨破坏程度,重建小鼠胫骨的三维模型,并观察到SAA1组中腓骨的骨小梁显著减少,特别是SAA1.2组在注射后第4周最明显(见附录A中的图S2)。小鼠身体应激性反馈调节使其骨破坏在第6周时减轻,这与SAA1水平下降的变化趋势一致。
《图1》
图1 注射腺病毒后,通过轴向micro-CT定量分析骨骼变化。(a)与EGFP对照组对比,SAA1各亚型组micro-CT评分的变化趋势(n = 8)。(b)~(f)各组小鼠右侧(注射测)膝关节的BMD、TMD、Tb.N、TOT、BV/TV的动态变化趋势(n = 8)。数值用平均值±标准误(mean ± SEM)表示。*代表SAA1各亚型组与EGFP对照组之间的差异对比,用p值表示。*: p < 0.05; **: p < 0.01。
《3.2 SAA1亚型诱发滑膜炎症与全身炎症反应》
3.2 SAA1亚型诱发滑膜炎症与全身炎症反应
实验通过组织学评分[17]和滑膜炎症程度定性评分评估滑膜炎症的严重程度(表1)。结果显示,在第2周,SAA1.2组和SAA1.3组的关节炎评分上升。在第4周,只有SAA1.2组的差异仍具有统计学意义,提示SAA1.2可能主导RA的进展。在第6周后,关节炎评分下降[图2(a)]。转染一周后,所有SAA1组的关节软骨都出现了炎症反应,表现为免疫细胞浸润的增加和滑膜细胞的增殖(HE染色结果见附录A中图S3~S5)。在第4周,SAA1.2组出现表层滑膜炎症,而EGFP对照组没有明显变化。通过IHC分析,可知从第1周到第4周,SAA1蛋白表达在滑膜、生长板,甚至骨髓中明显增加 [见图2(b)~(e)和附录A中的图S3~S5]。
《图2》
图2 adSAA1感染膝关节的多个部位,使SAA1亚型的过度表达导致滑膜炎症。(a)根据滑膜细胞增生、纤维化、炎症、关节软骨破坏和骨侵蚀随时间的变化情况,对各组小鼠膝关节滑膜炎症进行评分(n = 5)。(b)~(e)注射4周后,各组膝关节切片的HE和IHC结果。其中,黑色箭头表示SAA1各组小鼠的关节软骨的表面侵蚀;红色箭头表示SAA1在滑膜细胞中的阳性表达;黄色箭头表示SAA1在生长板中的表达;蓝色箭头表示在骨组织中的表达。
《3.3 SAA1亚型诱导T细胞介导免疫反应和关节促炎症细胞因子的释放》
3.3 SAA1亚型诱导T细胞介导免疫反应和关节促炎症细胞因子的释放
RA的特点是滑膜T细胞浸润[19]。流式细胞分析结果显示,在第2周,SAA1.2组小鼠脾脏中CD8+ T细胞数量下降10.9%,CD4+ T细胞数量上升11.3% [见图3(a)和附录A中的S6(a)],CD8+ / CD4+ 比值增加。在6周的动态观察中,在其他组的脾脏中没有观察到CD8+或CD4+ T细胞数量的明显变化。相反,与EGFP对照组相比,在第4周,SAA1各亚型外周血中均出现CD4+和CD8+ T细胞数量的变化[见图3(b)和附录A中的S6(b)]。
《图3》
图3 SAA1亚型对血液及脾脏中T细胞的影响。(a)流式细胞仪分析SAA1组与EGFP对照组在4个不同时间点脾脏和外周血中CD4+和CD8+ T细胞的数量以及CD8+ / CD4+的比值(n = 8);(b)流式细胞仪分析SAA1.2组、SAA1.3组、SAA1.5组(与EGFP对照组相比)在4个不同时间点脾脏和血液中CD4+和CD8+ T细胞的百分比(n = 8)。
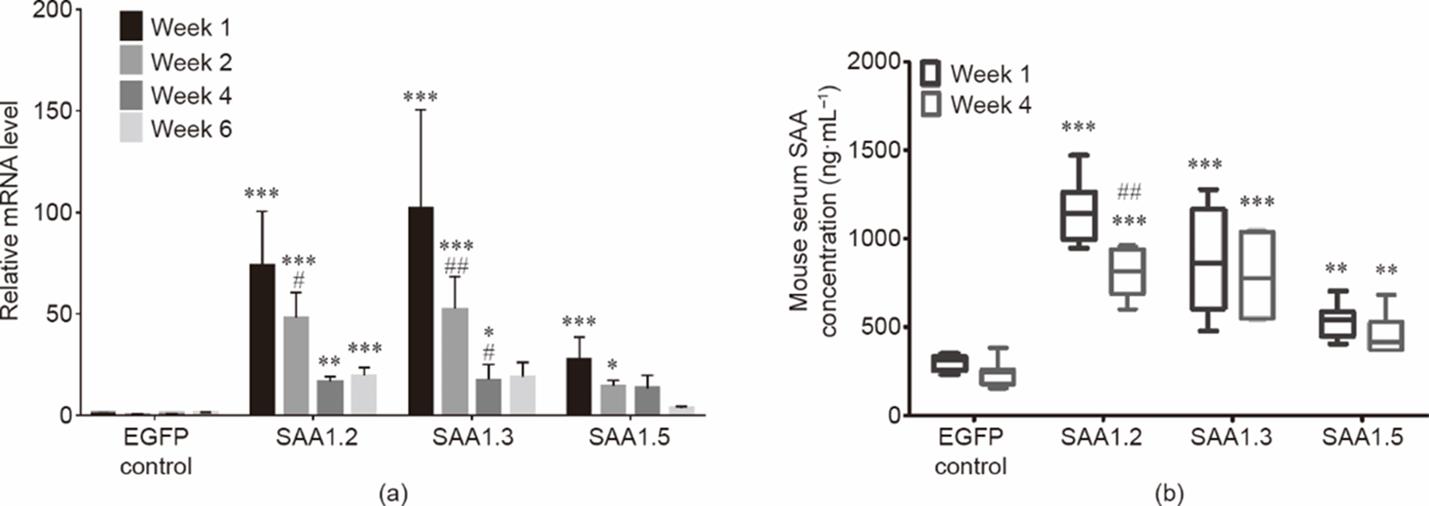
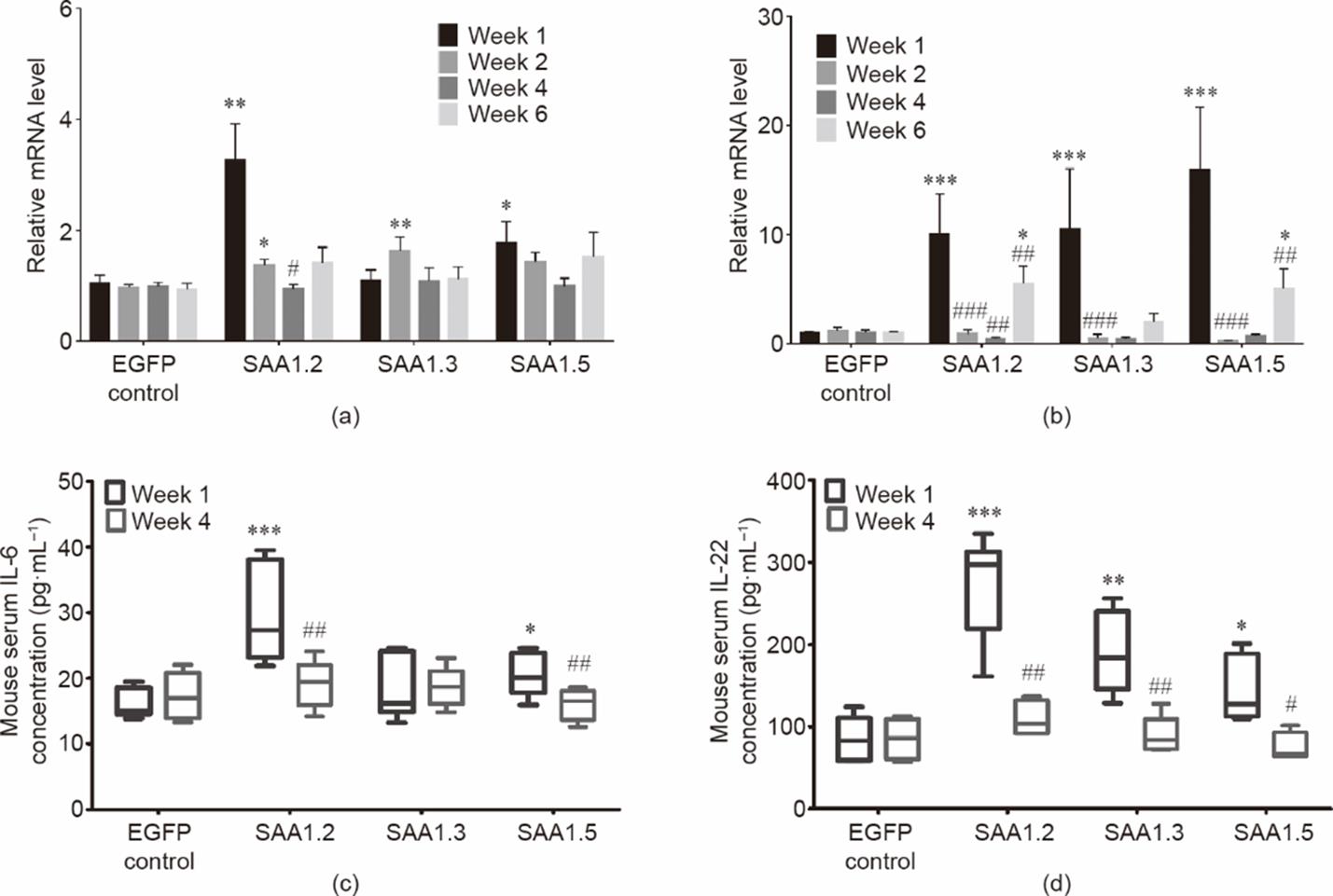
RT-PCR和ELISA结果显示,转染一周后,在小鼠的右侧膝关节和外周血中,IL-6和IL-22的表达明显上调[图4(a)和图5]。这与最近的一项研究结果一致,即IL-22的大量表达诱导SAA1的表达以及炎症反应[20],说明SAA1.2能够引起最严重的骨损伤[图1(c)、(d)]。已有研究报道,这些细胞因子可以使T细胞分化为T辅助细胞的不同亚群[21],从而进一步产生不同的细胞因子[22]。本文的研究结果也表明,IL-17、IL-23 [见附录A中的图S7(a)、(b)]、肿瘤坏死因子(TNF)-α、IL-1β和G-CSF [见图6和附录A中的图S7(c)]表达上调。有文献报道TNF-α或IL-17上调可诱导关节骨降解过程中基质MMP的产生,最终导致关节破坏[23‒25]。本文的研究结果也显示,转染后关节和外周血分泌的MMP-3和MMP-9水平增加(图7)。与此同时,金属蛋白酶组织抑制因子1(tissue inhibitor of metalloproteinases 1, TIMP-1;见附录A中的图S8部分)的表达水平则下降。
《图4》
图4 SAA1亚型诱导SAA1在右侧膝关节中的表达以及SAA在外周血中的含量。(a)利用RT-PCR分析右侧膝关节中SAA1的表达(n = 5~6)。(b)利用ELISA分析血清中SAA的浓度(n = 5~6)。数值用平均值±标准误表示。#表示SAA1等位基因随时间变化的显著性差异,用p值表示。#:p < 0.05; ##:p < 0.01; ***:p < 0.001。
《图5》
图5 SAA1亚型诱导的右侧膝关节中促炎细胞因子IL-6和IL-22相关的mRNA表达和血清含量变化。(a)右侧膝关节中IL-6相关的mRNA表达;(b)右侧膝关节中IL-22相关的mRNA表达;(c)血清中的IL-6浓度;(d)血清中的IL-22浓度。n = 5~6。数值用平均值±标准误表示。###: p < 0.001。
《图6》
图6 SAA1亚型诱导右侧膝关节中的促炎细胞因子TNF-α、IL-1β和G-CSF相关的mRNA表达。(a)右侧膝关节中TNF-α相关的mRNA表达;(b)右侧膝关节中IL-1β相关的mRNA表达;(c)右侧膝关节中G-CSF相关的mRNA表达。n = 5~6。数值用平均值±标准误表示。
《图7》
图7 SAA1亚型诱导右侧膝关节中MMP-3和MMP-9相关的mRNA表达和血清水平的变化。(a)右侧膝关节中MMP-3相关的mRNA表达;(b)右侧膝关节中MMP-9相关的mRNA表达;(c)血清中MMP-3浓度;(d)血清中MMP-9浓度。n = 5~6。数值用平均值±标准误表示。
《3.4 SAA1亚型诱导左侧膝关节骨破坏和炎症,并导致SAA1蛋白在重要器官中积聚》
3.4 SAA1亚型诱导左侧膝关节骨破坏和炎症,并导致SAA1蛋白在重要器官中积聚
研究结果发现,在第1周时,三种SAA1亚型蛋白全部在左侧膝关节中表达,并且直到第4周时仍保持高表达水平(见附录A中的图S9和图S10)。由于未进行左侧膝关节转染,因此未在左侧膝关节活检中观察到明显的骨侵蚀(见附录A中的图S9和图S10),但观察到了骨破坏。在第4周时,BMD在SAA1.2组和SAA1.3组中明显降低,分别下降了13.2%和14.7%。在第6周,这些值恢复到正常水平,表明SAA1蛋白在血液循环中诱导系统性炎症反应,这与RA患者的症状相似[见附录A中的图S11(a)、图S12、图S13]。此外,在左下肢也观察到类似的细胞因子升高[见附录A中的图S11(b)和图S12];在肝脏、肺部和肾脏中观察到SAA1蛋白的积聚[见附录A中的图S11(c)、(d)]。
《4、 讨论》
4、 讨论
RA是一种复杂且难以治愈的自身免疫性疾病,其发病机制仍不明确,缺乏有效的药物靶点[26]。临床继发性淀粉样变性常见于风湿性关节炎和其他风湿性疾病,可导致严重的并发症[27]。RA患者出现继发性淀粉样变性的概率为7%~26% [28],但迄今为止,RA患者淀粉样变性的发病机制和预后在很大程度上尚不清楚。SAA1的亚型曾被报道与RA相关,然而,它们的病理作用尚不明确。SAA1.2是我们首次在RA患者的全外显子组测序中发现的 [11‒12]。据报道,SAA1.3是与AA淀粉样变性密切相关的一个危险因素,对RA患者的预后产生不利影响。在日本的一项临床队列研究中,有因SAA1.3基因表达异常导致患者死亡的案例,表明SAA1的潜在重要性[7]。与其他亚型相比,SAA1.5显示出较慢的SAA血清清除率,表明其产生较少的淀粉样蛋白[15]。另外,SAA1.5诱导产生炎症细胞因子的能力有限,可能会减轻炎症反应[29]。因此,本文使用了SAA1.3作为阳性对照,SAA1.5作为阴性对照,对比研究SAA1.2的功能。本研究设计了所有SAA1亚型的氨基酸序列(见附录A中的图S14),阐明这三种SAA1等位基因产物诱导RA相关关节炎症产生的机制,并说明SAA1.2的致病性最高。
经典佐剂诱导的关节炎模型和胶原诱导的关节炎模型不适合用于研究单基因的病理作用[30]。本研究应用了载体转染的方法,将腺病毒载体adSAA1通过关节内注射转染关节腔组织,将突变位点整合到小鼠基因中,观察其对SAA1的表达活性的调控[31‒32]。通过时间点观测能更全面地反映该基因在RA发生发展中的作用,并可动态观察和解释其中的机制。通过动态观察病程进展,发现第2~4周时的疾病表型最明显。在第6周,SAA1的表达仍然处于较高水平,这可能是由于关节炎症反应的反馈机制进一步促进炎症的发生[28]。
滑膜免疫细胞浸润是引起滑膜炎症的重要因素。白细胞在滑膜中的积聚不是由局部细胞增殖引起的,而是由白细胞通过激活的滑膜微血管内皮细胞对黏附分子和趋化因子的反应而向远处迁移所引起的[33]。血液中的免疫反应与脾脏相比存在时间滞后,表明T细胞分化首先发生在脾脏中,然后活化T细胞进入血液循环。RA是复杂的自身免疫疾病,涉及先天性和适应性免疫系统两种炎症过程[34];特征性症状表现为关节滑膜炎、肿胀和损伤。先天性免疫系统涉及成纤维细胞样滑膜细胞与先天性免疫系统其他细胞的相互作用。关节内滑膜中的细胞浸润物包括粒细胞、单核细胞/巨噬细胞、自然杀伤(NK)细胞、B细胞、CD4+和CD8+ T细胞,所有这些细胞都会产生大量的趋化因子和促炎细胞因子[19,21,35]。大量证据表明RA发病过程中先天性免疫系统被持续激活[36]。本研究观察到炎症细胞因子,如TNF-α、IL-6、IL-22 和 G-CSF的上调表达,这些细胞因子会导致关节内免疫系统激活并加重关节炎症。IL-22的大量释放诱导SAA1的产生和炎症反应[20],而TNF-α或IL-17的增加可增强MMP(如MMP-3和MMP-9)的产生,导致关节骨退化,最终破坏关节结构[23‒25]。
前期研究已经应用分子对接的方法比较了野生型SAA1和SAA1.2的蛋白质结构[11]。SAA1.2突变发生在α-helix 3中,该突变导致蛋白质构象发生变化(蛋白质结构更加紧密)。这种突变可能导致较高的SAA1聚集潜力,诱导更严重的炎症反应。其他SAA1亚型仅有一个氨基酸与野生型SAA1的不同,但也表现出严重的炎症反应,表明在以后的研究中,在患者体内发现新的SAA1亚型或突变体十分重要。
本研究明确了SAA1.2、SAA1.3和SAA1.5在RA发病机制中的作用,以及下游促炎机制。其中以SAA1.2诱发的RA 症状最严重,并累及多个器官。SAA1亚型在RA中的发病机制可能是SAA1蛋白表达始于滑膜成纤维细胞和右膝的软骨,然后在血液中循环并到达脾脏,引发未成熟的T细胞分化和成熟的T细胞活化,最后进入血液循环诱发多处炎症反应。研究发现活性细胞毒性CD8+ T细胞在血液中循环并分泌多种促炎细胞因子,导致骨破坏(图8)。总的来说,本究揭示了SAA1亚型在 RA 的发生和发展过程中的重要作用,SAA1.2可能会成为 RA治疗的新靶点。
《图8》
图8 SAA1亚型诱导关节炎机制示意图。关节腔内注射adSAA1后,SAA1首先转染到滑膜细胞中,然后被抗原呈递细胞呈递给未成熟的T细胞。刺激T细胞活化并分化为Th1、Th17、Th22或 CD8+ T细胞,导致IL-6和IL-22等细胞因子的释放并激活巨噬细胞。此外,adSAA1转染巨噬细胞并分泌SAA1到滑膜中,激活免疫细胞以分泌促炎细胞因子,如 TNF-α、IL-6、IL-17和IL-22。在这些条件下,成纤维细胞分泌的TNF-α、IL-1b或IL-6可以激活破骨细胞,破骨细胞前体分化为破骨细胞。这些细胞因子也会激活软骨细胞,使其分泌MMP降解软骨。这个过程始于软骨和骨骼之间的交界处。此外,adSAA1转染到滑膜血管,促进内皮细胞分泌SAA1,从而激活脾脏中的T细胞。最后,T细胞活化和分化产生细胞因子,进入血液循环进一步促进关节炎症。IFN:干扰素。


















 京公网安备 11010502051620号
京公网安备 11010502051620号




