《2、 可控的细胞重新定向》
2、 可控的细胞重新定向
精确的细胞定向对于细胞显微注射、精确地将物质送入细胞,以及研究细胞转染、信号通路和细胞器功能来说是必要的[42‒45]。为了能够在胚胎的特定位置进行注射,并避免对特定的内部细胞器造成任何损害,过去需要手动调整细胞的位置和姿势,导致效率低和成功率低[31]。目前,自动化程序正逐渐取代现有的人工重新定向策略。例如,由直流(DC)电机驱动的闭环控制机械手[5,46]可以提供空间分辨率大于0.1 μm的可重复和快速的细胞定位,这是人工操作难以实现的。
《2.1 机械接触方法》
2.1 机械接触方法
机械接触方法利用安装在控制器上的工具(如具有一定制造规格的微吸管),直接与靶细胞相互作用,实现细胞的移位或重新定向。与需要高度熟练的操作者的人工重新定向方法相比,控制器和控制系统的使用使机械接触方法能够简化操作过程并减少细胞损伤[4‒5,47]。
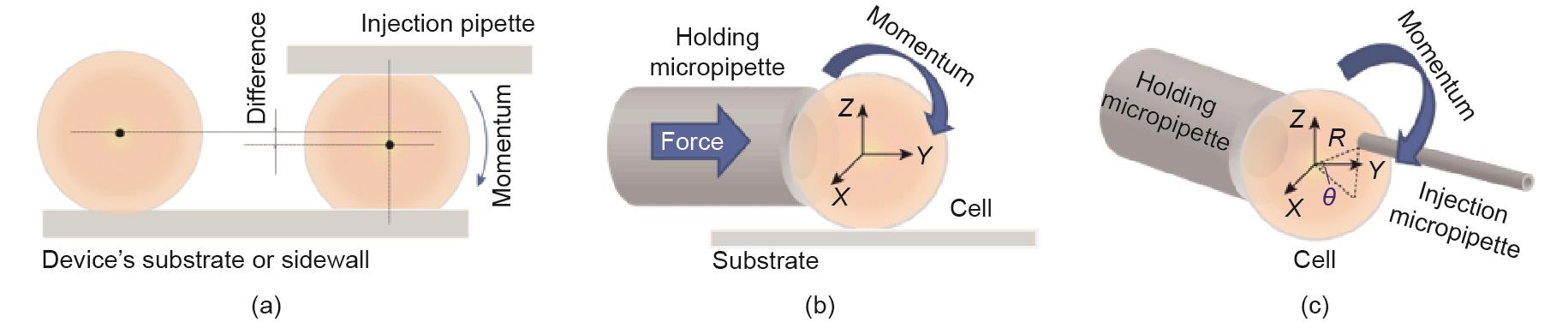
绝大多数机械接触方法的目的是用微型机器人代替操作员(表1 [4,46‒52])。例如,Wang等[46]提出了一种实时识别和重新定向胚胎方向的方法,其中靶细胞的重新定向是由与细胞变形有关的摩擦力驱动的[图2(a)],有2°的旋转自由度,成功率高达97.50%。此外,如图2(b)所示,由程序控制的推力[48]可以在旋转角度误差为5°的情况下定位细胞,尽管这种方法的自由度(DOF)被限制为1。另外,如图2(c)所示,多个微吸管可以发挥类似“手指”的作用[4],靶细胞由一个手指夹住,由另一个手指旋转,可以将旋转误差减少到1.2°左右。基于最小旋转力模型,根据细胞变形施加不同的扭矩来旋转靶细胞,可成功地将对细胞活力产生的副作用降到最低(尽管对控制效率产生一定的影响)。最近,一种改进的方法[49]被开发出来,该方法优化了注射微吸管的方向,并将处理时间大大降低到5 s·cell-1。同时,用两根微吸管,系统[50]的成功率可高达92.5%,最大误差为0.3°。
《表1》
表1 使用机械接触方法进行细胞重新定向的相关文献
| Authors | Rotational DOF | Speed | Rotation angle error | Success rate | Rotating object | Application |
|---|---|---|---|---|---|---|
| Zhao et al. [ | 1 | 28.6 s·cell-1 | 1.2° | 93.3% | Porcine oocytes | Nuclear transplantation |
| Wang et al. [ | 3 | 31 s·cell-1 | 0.3° | 92.5% | Zebrafish embryos | Cellular structure recognition |
| Wang et al. [ | 2 | In-plane: 1 s·cell-1 Out-of-plane: 4 s·cell-1 | 0.5° | 97.5% | Zebrafish embryos | Cellular structure recognition |
| Wang et al. [ | 3 | Out-of-plane: 2 s·cell-1 | — | 96.25% | Mouse oocytes | Polar body biopsy |
| Zhuang et al. [ | 2 | 44 s·larva-1 | 0.5° | Zebrafish larva body | Organs injection | |
| Ajamieh et al. [ | 1 | — | 5° | — | Mouse embryos | Cell biopsy procedure |
| Zhao et al. [ | 1 | 23.6 s·cell-1 | — | 93.3% | Porcine oocytes | Nuclear transplantation |
| Aishan et al. [ | 3 | — | 0.72° | — | Xenopus oocyte | Full surface cell observation |
《图2》
图2 不同机械接触方法的示意图。(a)基于摩擦力的技术,使用摩擦力来驱动靶细胞的旋转;(b)基于推力的技术,使用推力来旋转基质上的靶细胞;(c)基于抓取的技术,使用微吸管作为机器人的手指来旋转靶细胞。R:半径;θ:角度。
目前,基于机械接触的方法被广泛用于细胞的重新定向,尽管它们有物理损伤和不期望的刺激的风险[51]。这些方法允许相对较高的空间分辨率(高达0.01 μm)进行粒子的重新定向和操作,确保类似定向操作的可重复性。此外,基于机械接触的技术已经实现了0.3°的旋转精度,这比其他人工方法(8.3°)小得多[4]。尽管已经对控制系统进行了许多改进,以提高操作的稳定性和精确性,但最小的适用尺寸被限制在大约100 μm。
与细胞的直接旋转相比,通过微流控设备进行旋转控制要简单得多,并且也更容易进行细胞观察。Aishan等[52]通过结合基于热膨胀的玻璃-穹顶结构制造技术[53]和超薄玻璃熔接技术[54],制造了一个全封闭的玻璃室,建立了一个观察平台,实现了观察角度的高精度控制,误差为0.72°。靶细胞被放置在一个封闭的玻璃室中,以减少观察过程中外部污染的风险,并消除僵硬的致动器可能造成的物理损伤;然而,全封闭的微环境限制了细胞手术等其他应用。
《2.2 光场方法》
2.2 光场方法
继Ashkin等[56‒57]首次研究之后,OT已经成为应用于细胞旋转的最常用的基于光场的技术之一。高度集中的激光束作为一个光学陷阱,对感兴趣的粒子施加捕获力和扭矩,允许对捕获的微米级电介质粒子进行无标签操作[58‒62]。与机械接触方法相比,OT的硬度和作用力的大小随激光束的强度而变化,OT的捕获力在从飞牛顿到纳牛顿的范围内变化,使得它们很适合用于捕获不同尺寸和质量的微米级粒子[63‒64]。此外,双光束光学捕获器已经显示了细胞重新定向的能力[65‒66],其自组织特性[67‒68]已经用反传播的激光束进行了验证。Kreysing等[69]和Dasgupta等[70]的研究描述了为控制红血球和癌细胞而选择适当的激光束。此外,在我们团队过去的研究[71‒72]中,发现聚焦的飞秒激光束可以在不产生任何热效应的情况下诱发冲力,从而实现非接触式的细胞操作。虽然关于OT对细胞旋转的相关研究较少,但这个话题可能会成为一个未来的研究趋势。
《2.2.1. 光学捕获力和细胞折射》
2.2.1. 光学捕获力和细胞折射
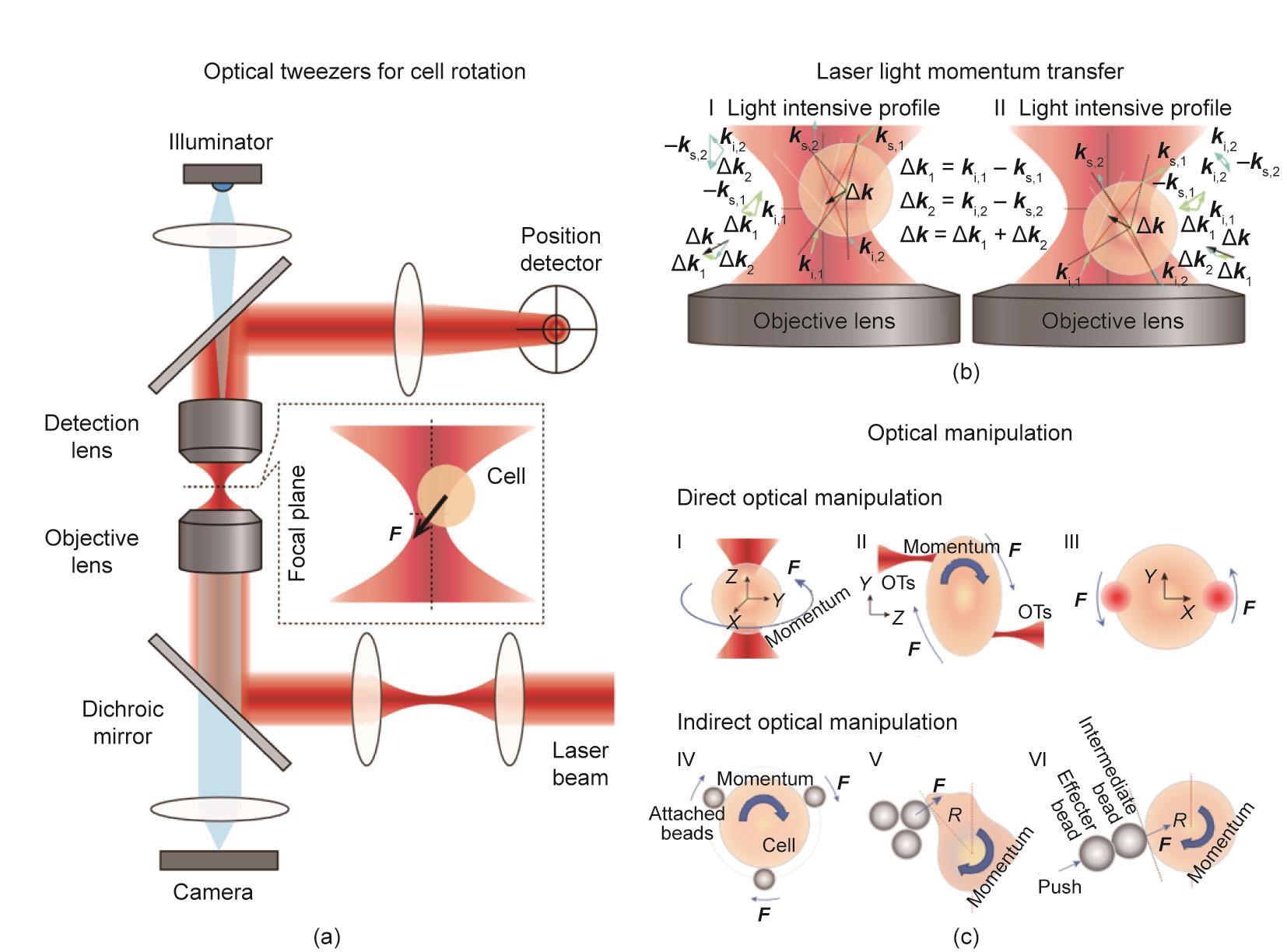
光学捕获力是由聚焦的激光与被捕获物体之间的相互作用而产生,在普通的商业显微镜下,通过OT可以实现靶细胞的旋转。用于光学操作的典型仪器[图3(a)]主要包括一些光学元件,如带有明场或照明的显微镜、高数值孔径(NA)物镜和聚光检测镜。通常情况下,所应用的激光束的波长位于近红外区,可以避免各种生物的光损伤,并且很容易与其他可见光形式[73]结合在成像系统中。此外,激光捕获器可以与单模光纤耦合,产生一个干净的光束轮廓,然后被空间光调制器(SLM)分割成多个同时捕获的光束。因此,利用全息OT可以并行地对多个细胞进行操作。
《图3》
图3 用于细胞旋转和控制的光学技术。(a)用于细胞生物光学旋转的仪器图。(b)激光对靶细胞的动量转移。I:靶细胞被放置在焦平面的右上方;II:靶细胞被放置在焦平面的右下方。(c)不同光学旋转策略示意图。I~III:直接使用OT控制细胞;IV~VI:间接光学旋转方法。
图3(b)说明了激光束进入细胞前后传播路径的变化,并显示了在细胞表面发生的动量转换。根据Snell定律,折射改变了两束入射激光(i,1和i,2)的传播方向。入射光束s,1和出射光束s,2之间的动量关系可以表示如下:
(1)
根据动量守恒定律,两束激光的动量,即Δ1和Δ2被转移到靶细胞。因此,被捕获的粒子经过一个补偿性的动量Δ,指向焦点,如图3(b)所示。由于散射力的作用,OT能够通过高度集中的激光束捕获微米级电介质粒子,并将它们捕获在焦平面后面的一点上[图3(b)]。
《2.2.2. 用于细胞重新定向的光镊》
2.2.2. 用于细胞重新定向的光镊
图3(c)中的I~III显示了直接光学旋转细胞的方案,这种方法由于精确度高而引起了研究人员广泛的关注[9,67]。Xie等[74]最近回顾了过去几十年机器人辅助OT系统的快速发展,其中说明了多个激光束用于细胞旋转的操作。在闭环系统的辅助下,Xie等[5,75]还通过控制两个激光镊的轨迹或距离,实现了对靶细胞在XY平面或YZ平面的旋转控制[图3(c)中的II~III)]。机器人辅助的方法有高可靠性,适用于更高要求的任务,如细胞的旋转和轨道旋转。在Chen等[65]的研究中,两个位移为10 μm的OT可以以大约72.2(°)·s-1的速度旋转红细胞;然而,当位移增加到15 μm时,细胞将沿着椭圆轨道移动[150.7(°)·s-1],而自旋速度为57.3(°)·s-1。
OT的局限性在于易造成光学损伤。一项研究指出,相对较高的光学峰值强度(> 105 W·cm-2)[76]是产生稳定陷阱的必要条件;然而,如表2 [5,65,75,77‒80]所示,这种高度密集的激光照射[81]可能导致细胞或组织的光损伤[82]。更具体地说,激光直接照射可能导致单细胞水平的各种副作用,如局部过热[83]、细胞代谢的变化[84]、分子光形变[81,85]、蛋白质变性[86]和光力学应力[87],所有这些最终导致细胞活力的丧失。因此,尽管OT提供了非常精确的旋转控制,但必须考虑光损伤。激光直接照射的其他不利影响包括布朗运动和热扰动[88],可以进一步干扰被捕获的粒子。
《表2》
表2 使用光场方法进行细胞旋转的相关文献
| Authors | Method | Rotational DOF | Angular velocity ((°)·s-1) | Photo-damage occurrence rate | Optical beam number | Rotating object | Application |
|---|---|---|---|---|---|---|---|
| Chowdhury et al. [ | Pushing-based method | 1 | — | 0 | 2 | Dictyostelium discoideum cells | Migration study of cells |
| Chowdhury et al. [ | Topological gripper | 1 | 14.32 | 33% | 3‒6 | Dictyostelium discoideum cells | Noninvasive transportation of cells |
| Thakur et al. [ | Pushing-based method | 1 | — | 0 | 2 | Yeast cells | Cell translocation |
| Cheah et al. [ | Topological gripper | 1 | — | 33% | 6 | Silicon beads | Grasping and manipulating a microscopic particle |
| Xie et al. [ | Direct rotation | 2 | 8.59 | 67% | 2 | Yeast cells | Single-cell surgery |
| Chen et al. [ | Direct rotation | 2 | Spin: 72.19; orbital: 151.26 | 67% | 2 | Red blood cell | Simultaneous spin and orbital rotation |
| Xie et al. [ | Direct rotation | 2 | 9.74 | 67% | 2 | Acute promyelocytic leukemia cells | Cell surgery |
另外,间接光学旋转可以避免直接激光照射的这些副作用,并减轻光损伤。表2总结了每种光学旋转方法的光损伤发生率。如图3(c)中的IV~VI所示,可以将这些方法分为三类:拓扑抓取器、基于推力的方法和附着粒子。例如,拓扑抓取器[5,78,80]是由几个粒子形成的[图3(c)中的IV],并由多个激光束控制;它们可以将细胞上的激光照射强度减少90%。一些细胞对剩下的10%的激光照射仍然很敏感,在拓扑抓取器使用过程中,它们的生理特征会发生变化。这个问题可通过在靶细胞和光学控制的粒子之间放置一个中间粒子来处理[77,79],如图3(c)中的V~VI所示,光学捕获的粒子作为一个非接触的执行器,几乎消除了激光对靶细胞的所有副作用。
OT旋转的另一个限制是缺乏选择性和排他性。换句话说,OT会捕获激光焦点附近的任何电介质粒子[89]。因此,需要相对较低浓度的细胞,以防止其碰撞和捕获额外的粒子。为了削弱高浓度对细胞操作的影响,研究人员已经进行了大量研究[90‒92]。例如,通过轨迹规划算法来优化细胞操作。此外,基于光学的旋转技术的应用受限于OT的低输出力。例如,单光束光学旋转能产生的捕获力只能旋转约10 μm的细胞,而不足以旋转更大的细胞,如卵母细胞(> 100 μm)[93]。
本节回顾了两种旋转技术——光学旋转和机器人辅助的力学旋转——用于以精确角度(不是旋转速度)控制的细胞重新定向。可控的细胞旋转对于其他一些情况也是必要的,如细胞的旋转特性分析和3D光学重建,这将在下面进行介绍。
《3、 可控的细胞旋转》
3、 可控的细胞旋转
此处的细胞旋转是指靶细胞以稳定和可控的速度旋转。精确的单细胞旋转对生物技术的许多应用都很重要,如细胞表征[94]、药物发现[95‒96]、肿瘤异质性分析[97‒98]和细胞成像[1,10]。在本节中,细胞旋转是由非接触的物理场,如电场、磁场、声场和流体动力场驱动[图l(a)]。
《3.1 电场方法》
3.1 电场方法
细胞可以在旋转的电场中旋转,其中旋转扭矩是由细胞的偶极矩和旋转电场之间的相位差产生的。此外,在非旋转电场中,旋转运动可以被不均匀的或随时间变化的电场所刺激。在交流(AC)场中,通过改变场强、频率或电极的几何形状,由介电泳(DEP)引起的电转矩能够控制尺寸从几纳米到几百微米的粒子。DEP [99‒101]有许多独特的特点,包括成本低、效率高和损伤率低。此外,不同的粒子对电场的反应可能不同。例如,Janus粒子的旋转方向与AC频率有关[102],导致粒子在低AC频率下共场旋转,反之亦然。同时,DEP能够根据细胞的运动来区分和分离不同类型的细胞,这与细胞的电介质特性有关。
《3.1.1. 介电泳和电旋转》
3.1.1. 介电泳和电旋转
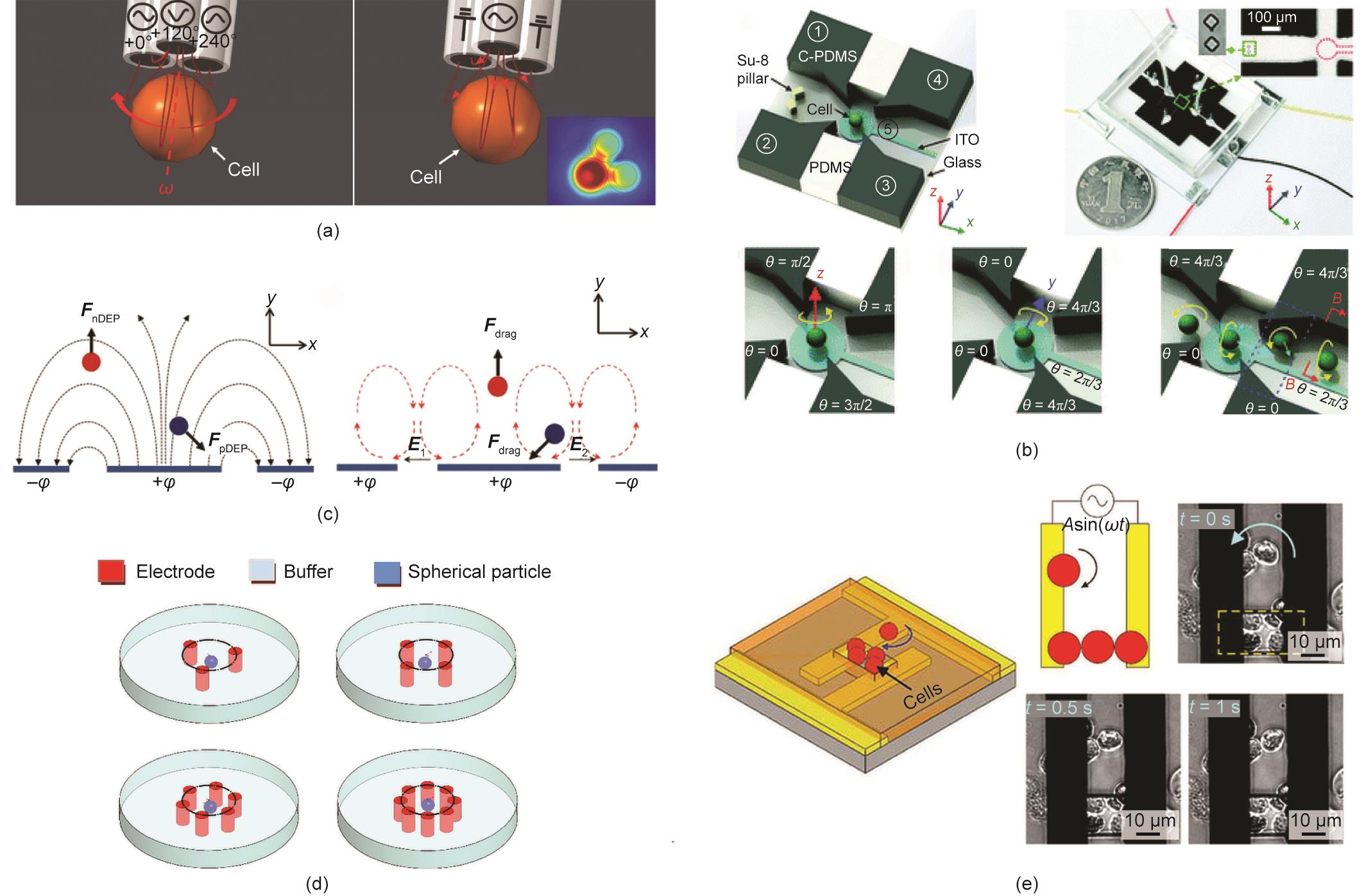
文献[99‒101,103]已经很好地描述了DEP力的基本原理。理论上,一个细胞可以在非均匀电场中被极化[104]。如果它的极化程度高于介质,就会产生一个朝向强电场的净力,被称为正DEP,反之亦然。基于这一理论,Chow等[105‒106]设计了一个充满液态金属的多功能微吸管,通过在细胞表面的不同位置形成不平衡的力矩,实现四维(4D)单细胞旋转[图4(a)[106]]。
《图4》
图4 基于电场的可控细胞旋转策略。(a)移液器尖端附近的4D电旋转示意图;(b)用于3D细胞电旋转的微型装置以及单细胞加载和3D旋转的工作原理图;(c)共面电极上的电场线和旋转策略图;(d)多个电极的分布;(e)用于旋转操作的电极和绝缘层上的细胞捕获操作方案。θ:AC信号的相位;+φ:正电极;-φ:负电极;
在均匀电场中,半径为R的均质球形细胞相当于一个具有力矩相位的偶极子[图4(b)[7] ]。在DEP生物芯片[107]中,偶极子将与外部电场相互作用并产生DEP力,如下图所示:
(2)
式中,DEP力(DEP)与复数Clausius-Monssotti因子(fCM)的实数部分成正比,并且εm和εp分别是介质介电常数和粒子介电常数。*代表复数变量,复数许可率ε*与旋转电场的物质许可率(ε)和角频率(ω)呈线性关系。此外,Re(∙)代表复数变量的实部,σ是介质电导率,i是虚数单位。
在旋转电场中,细胞旋转可以由电旋转扭矩(ROT)得出:
(3)
式中,ROT与复数Clausius-Monssotti因子的虚数部分成正比;是电极表面的单位向量法线;Im(∙)代表复数变量的虚数部分。电偶极子和外场之间的相位延迟导致了两个旋转扭矩之间的相对滞后角。在稳态平衡条件下,旋转速度或角速度[15]可以定义如下:
(4)
式中,旋转速度(αROT)与复数Clausius-Mossotti因子的虚数部分成正比;ζ是一个与黏度(η)和电场强度有关的比例系数[108‒109](通常是一个常数)。
《3.1.2. 细胞旋转的电场》
3.1.2. 细胞旋转的电场
Walid和Dutta [110]通过一个具有时变频率的AC信号实现了细胞在静止电场中的旋转,其中通过形成一个非均匀的电场来极化靶细胞[图4(c)]。他们发现,静止电场中的旋转速度与AC频率紧密相关(尽管其基本机制还没有被完全理解)。此外,细胞的稳定旋转不仅与其规则形状有关,而且还受细胞内低导电性的偏心包裹体的影响[111]。目前,使用固定的电场进行细胞旋转仍然受到速度控制精度低的限制。
另外,Han等[15]设计了一个基于ROT的微芯片,用于利用电信号捕获和旋转细胞(表3 [7,15,102,105‒106,110‒114]),其中细胞旋转的速度和方向是细胞的电介质特性[36](如电导率和介电常数)的敏感函数。利用4个电极形成细胞旋转所需的随时间变化的电场,每个电极被具有不同相位延迟的AC信号通电。也有研究人员建议[112],在实际应用中不应该超过4个电极。虽然旋转电场的面积随着电极数量的增加而扩大[图4(d)[112] ],但中心电场的强度保持不变,多个电信号的控制变得更加复杂[115]。因为电场的均匀性得到了改善,所以多个电极的唯一好处是最大限度减少电场分布对细胞旋转的影响。
《表3》
表3 使用电场方法进行细胞旋转的相关文献
| Authors | Electric field type | Rotational DOF | Cell trap | Mechanisms | Manipulating tool | Rotating object | Applications |
|---|---|---|---|---|---|---|---|
| Han et al. [ | Rotational | 1 | Yes | DEP; ROT | nQDEP; ROT signals | Human leukocytes and cancer cells | Measuring cellular dielectric properties |
| Benhal et al. [ | Rotational | 1 | Yes | DEP; ROT | 3‒8 electrodes | — | Finite-element analysis |
| Walid et al. [ | Stationary | 1 | No | DEP | AC electroosmotic flow | Barium titanate particles | Microfluidic device design |
| Huang et al. [ | Rotational | 1 | Yes | ROT | nQDEP; ROT signals; shaped channels | HeLa cells | Microfluidic device design |
| Chen et al. [ | Rotational | 1 | Yes | DEP; ROT | nQDEP; ROT signals | Pt-silica Janus particles | Analysis of the rotation direction |
| Zhao et al. [ | Stationary | 1 | No | DEP | AC electroosmotic flow | Rat adipose stem cells | Analysis of the rotation under DEP |
| Huang et al. [ | Rotational | 3 | Yes | DEP; ROT | nQDEP; ROT signals | Mammalian cells | Measuring cellular biophysical properties |
| Chow et al. [ | Rotational | 1 | Yes | 3D DEP; ROT | Liquid metal electrode pipette | HeLa cells | Microfluidic device design |
| Huang et al. [ | Rotational | 1 | No | ROT | Parallel and planar electrodes; polarized cells | HeLa and HepaRG cells | Polarized cells as electrodes |
此外,建议细胞不要在中心电场中旋转,因为这可能会破坏电场,甚至可能使实验终止。为了稳定旋转运动,Huang等[114]报道了一种新设计的DEP平台,该平台可以捕获单细胞并同时实现3D旋转。通过调整AC信号的配置,可以实现细胞的稳定旋转,控制过程也大大简化。为了进一步简化这种微型设备并扩大应用范围,Huang等[7]提出了一种新的基于芯片的电旋转技术[图4(b)]。这种方法在执行3D旋转方面具有优势,即能够以可控的方向、速度和旋转轴,在单个具有典型结构的微芯片上进行3D旋转,如上述的结构。基于同样的设计,Huang等[116]实现了自适应空间定位控制和单细胞的3D形态学重建。与多电极设计相比,Huang等[113]和Feng等[117]发现偏振细胞也可以像电极一样工作;这种新颖的电旋转机制大大简化了基于DEP的微芯片的设计[图4(e)[113] ]。Chow等[105‒106]制造了一种由液体金属填充的多功能微吸管,用于在液体中旋转细胞[图4(a)];该微吸管可以同时产生一个3D DEP陷阱和一个一维(1D)ROT。这种方法的一个独特优势是,不需要微加工或光刻步骤以形成电极,简化了制造过程和降低了制造成本。
总的来说,可以得出结论:电场方法适用的尺寸范围(即0.001~1000 μm)要比其他方法宽得多(关于范围的叙述见后面第4节)。到目前为止,大多数研究都集中在只随一个DOF的细胞旋转,而不是沿多轴的细胞旋转(目前仍然是一个挑战)(表3);只有Huang等[7]在电场中借助4个电极成功实现了随3个DOF的细胞旋转。
《3.2 磁场方法》
3.2 磁场方法
基于磁场的镊子[118‒120](简称磁镊)是研究生物微分子(如由核酸和蛋白质组成的单分子)力学特性的可靠工具。放在磁场中的磁性物体将承受一个磁力和(或)磁力矩(数量级为皮米牛顿到纳米牛顿)。与电镊不同(电镊容易引起不希望发生的电化学反应[121]并损害细胞的活力),磁场对生物样品几乎没有影响。然而,这种方法的局限性之一是,被研究的生物分子或细胞必须附着在磁性粒子上进行运输、分离和检测[122‒125]。图5(a)[13]显示了一个T细胞附着在磁性Janus粒子上并由外部磁场旋转的例子[13]。鉴于靶细胞需要预处理,一些研究表明,其生理特征可能会因为附着的磁珠而发生改变[126‒127]。另一个问题是,在测量完细胞的力学性能后很难释放附着的磁珠。
《图5》
图5 基于磁镊的可控细胞旋转策略。(a)使用磁性Janus粒子对T细胞进行旋转控制。经WILEY-VCH Verlag GmbH & Co. KGaA, ©2016许可,转载自参考文献[
磁镊[图5(b)]是在对微米级磁性粒子施加外部磁力矩[89]时形成的。这种技术经常与OT一起使用,将目标粒子捕获在特定的地方,克服了OT对生物样品操作的限制(即光损伤和热效应)。例如,Ye和Sitti [88]提出将这两种技术结合起来,创造一个局部涡流,以此沿圆形路径运输附近的微生物。然而,Romodina等[122]认为,激光诱导的局部过热将打破旋转粒子和旋转磁场之间的同步状态,原因是旋转运动会被与热有关的Brownian扭矩所延迟。在这种情况下,除了光学捕获外,还可以使用流体捕获,该技术目前已经在镍纳米线[128‒129] [图5(c)]和哑铃形磁驱动器[图5(d)[130] ]的基础上实现。这两种方法都能在旋转磁场下产生移动的微涡流,细胞被捕获在其中,旋转速度分别高达399.92(°)·s-1和324.87(°)·s-1。
在磁场中,理论上施加在磁偶极上的ROT被定义为ROT = × ,其中是粒子的磁偶极矩,是外部磁场。在磁扭矩的影响下,磁性粒子将旋转,直到偶极子的方向与磁场对齐。因此,随时间变化的磁场可以使磁粉在二维(2D)表面上以稳定的速度旋转。到目前为止,研究人员已经做了大量工作,对在时变磁场下施加于细胞、DNA等的扭矩[131‒132]或力[120]进行测量。然而,如前所述,Brownian运动可能会破坏同步状态,而且由于磁珠之间的磁化差异,磁镊施加的扭矩并不恒定[133],这使得磁力难以得到精确量化。
与基于DEP的旋转类似,大多数基于磁场的研究都实现了单一的旋转自由度,而不是3D控制。在Berndt等[134]的研究中,发现磁场能够控制活体标本在3D空间的旋转,而不需要附着任何磁珠[图5(e)]。然而,这种方法有损害测试样本的风险(因为控制时施加了过大的磁力)。相比之下,哑铃形流体镊[图5(d)]是一种更安全的实现细胞旋转的方法,通过非接触控制(即移动的微涡流)实现相对快速的旋转。然而,单个细胞的旋转速度不稳定,并随时间变化而变化。迄今为止,对于磁镊来说,精确的细胞操作对于细胞旋转或重新定向仍然是一项艰巨的任务;因此,除了在发育生物学中常用的较大的模式生物体,以及需要高驱动力矩的驱动,仍然不建议在这两种情况下使用磁镊。
《3.3 声场方法》
3.3 声场方法
基于声场的镊子(即声镊)可以通过声波与固体、液体和气体之间的相互作用来实时控制物体,这是由首次提出的,用于捕获和线性转移270 μm的乳胶粒子和蛙卵。可以将这项技术用于控制多种尺寸范围(0.1~1000 μm)的生物粒子。根据工作原理,可将声镊大致分为三类:①驻波镊;②行波镊;③声流镊。其中,前两类是直接利用外部声辐射力进行控制,而最后一类是由流体流动诱导的间接控制手段。
《3.3.1. 驻波镊》
3.3.1. 驻波镊
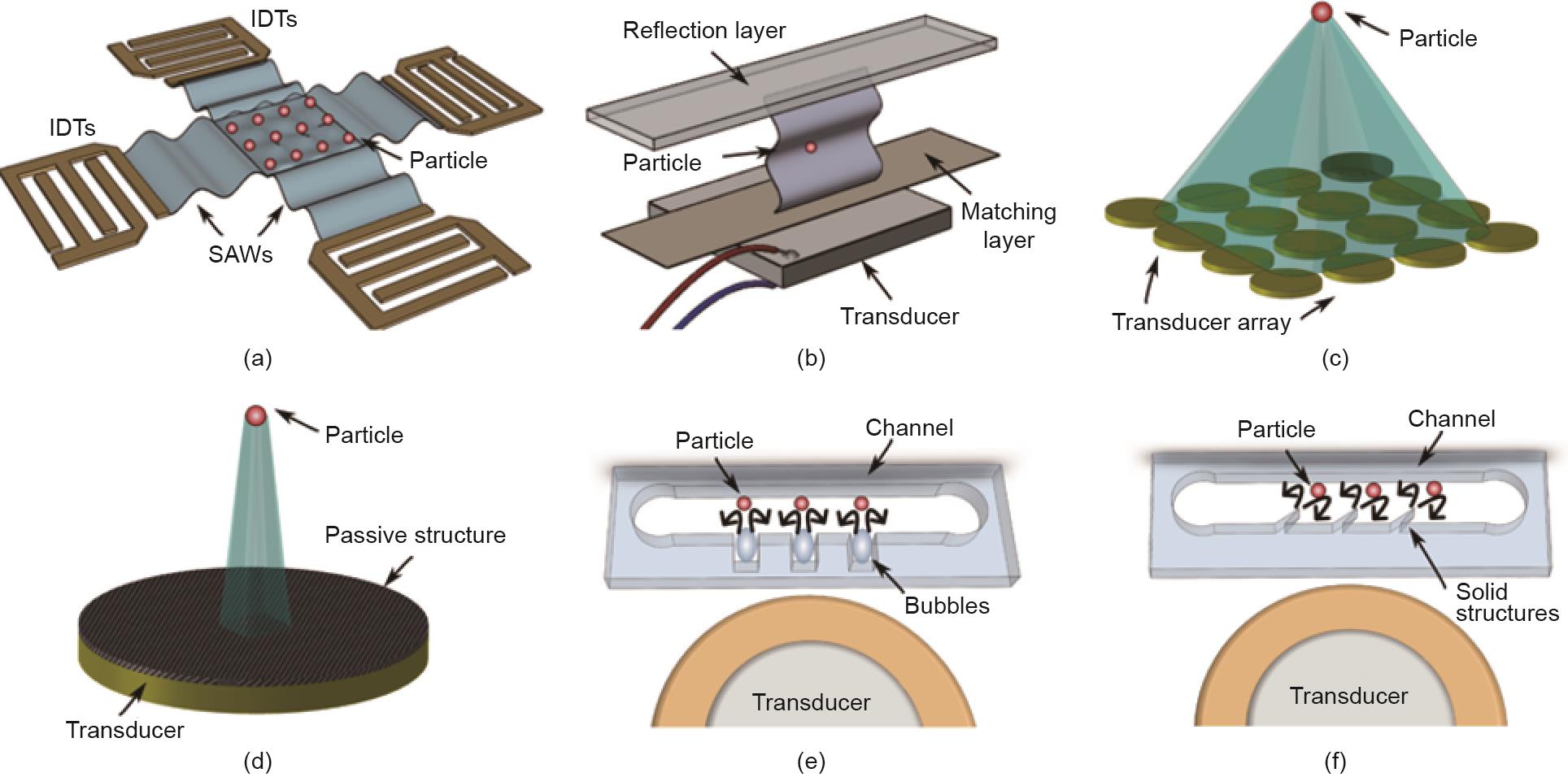
驻波的特点是能够形成一个稳定分布的声势能场和力学场。根据声波的产生方法,可以进一步将驻波分为两种亚型:声表面波(SAW)和体声波(BAW)。
声表面波(SAW)通常是在数字间转换器(IDT)上产生,沿着弹性材料的表面进行传播。这种传感器可以将电信号转换为SAW,并产生周期性分布的机械力。SAW可以像OT一样精确地移动粒子、细胞或微生物,声场中的粒子被推到声压节点(即最小压力区)或压力反节点(即最大压力区),这取决于粒子的密度和可压缩性[图6(a)[136] ]。此外,这种技术不但可以单独地控制粒子形状,并可同时控制许多粒子;这两种类型的控制对OT来说都是不可能的[39]。此外,SAW可被用于粒子对准。Bernard等[137]认为,非球形粒子容易旋转并与各向异性的势阱对齐。SAW的适用环境并不局限于黏性条件,如液滴。Yu等[138]认为,可以形成具有环形图案的SAW场。在这样的液滴中,声势能的分布随着声振幅的变化而变化,而内部粒子表现出不同的动态变化,如旋转和移位。Guo等[139]利用这一现象实现了大量粒子的聚集,形成特定的形状,并将聚集的粒子重新定向到信号输入的方向。
《图6》
图6 各种声镊技术的说明。(a)基于SAW的驻波镊;(b)基于BAW的驻波镊;(c)主动行波镊;(d)被动行波镊;(e)声流镊;(f)基于固体结构的声流镊。经Nature Methods, ©2018许可,转载自参考文献[
与通常用于控制单细胞的OT和电镊相比,声镊能够并行旋转大量的细胞。此外,与磁镊(50 pN)或OT(10 pN)相比,声镊(如在小于5 μm的粒子上为150 pN)对相同大小的粒子具有更大的输出力[39]。值得注意的是,为了稳定地控制亚微米级粒子,声波的应用波长必须与粒子的大小相当。
BAW是在压电换能器上产生,通常在微通道内使用。如图6(b)所示[136],反射器上的反射波与原波相互作用,在通道内产生压力节点和反节点,以实现多细胞控制。而且,这些节点的数量可以通过调整相对于通道几何尺寸的电压频率而发生改变[140]。目前,这种技术通常用于细胞分离或聚焦,而很少用于细胞的平移和旋转。
《3.3.2. 行波镊》
3.3.2. 行波镊
如图6(c)、(d)[136]所示,行波镊主要用于声学悬浮。根据Ozcelik等[136]的论述,基于所应用的发生器,可以将行波镊大致分为两类:主动行波镊和被动行波镊。二者的区别关键在于所使用的传感器的数量。对于前者,声波之间的相对相位延迟由传感器阵列产生,并用于形成灵活的压力节点;对于后者,只有一个传感器足以实现复杂的声场分布和粒子的动态控制。
更具体地说,在2015年,Marzo等[141]确定了几种主动方法,并认为粒子可以悬浮在半空中,通过调整每个换能器之间的相位延迟,利用程序控制实现粒子的旋转或平移。此外,对于流体中的应用,Franklin等[142]提出了一种简单而紧凑的换能器,可以产生稳定的3D声学陷阱,帮助粒子克服流体中的重力。这些研究人员实现了平移控制。在Andrade等[143]的研究中,声学悬浮法被描述为具有将物体固定在一个具体位置,并在3D空间中旋转和平移物体的能力。
2016年,Melde等[144]提出了一些被动的方法,其中粒子可以在声学全息图中被捕获和转移,但无法对其进行旋转控制。最近,Muela-Hurtado等[145]报道了一种有效的方法,即利用螺旋式主动衍射光栅在空气中产生声学贝塞尔漩涡,进而实现精确控制。在此研究的基础上,Li等[146]进一步分析了一阶和二阶声学贝塞尔涡流束的声学辐射扭矩,并实现了对不同形状物体的高速、灵活的旋转控制。由于分辨率有限、可控性低、换能器尺寸大,行波镊还不能用于控制微米级粒子[147]。
《3.3.3. 声流镊》
3.3.3. 声流镊
声学镊是由声学和微流体融合构成的,可以通过液体所吸收的声能来旋转细胞或小生物。如图6(e)、(f)所示[136],可控声流通常在高频振荡的微气泡或微结构周围形成。例如,放置在微流控环境中的振荡固体结构可以产生局部声流,如图7(a)所示,允许控制附近的粒子或细胞,这些粒子或细胞在声学涡流下被捕获并旋转。此外,一个高频振荡结构可以由外部高频声波驱动。例如,Huang等[148]认为,通过调整施加在压电传感器上的输入电压,微通道中尖锐边缘周围诱发的微涡流的流速是可编程的[图6(f)]。到目前为止,Ozcelik等[17]已经实现了细胞在尖锐边缘周围的可控旋转,旋转速度与电压信号和尖锐边缘结构有关:角度较小或长度较长的边缘可以促成较高的旋转速度。此外,Feng等[149]认为,不对称的微观结构有助于在显微镜下进行平面内或平面外的3D旋转操作。在他们的研究中,Feng等成功地保持了猪卵细胞的旋转速度不变,并使用数值仿真来研究卵细胞在声流中的旋转机制。除了具有尖锐边缘的微结构,微气泡也可以发挥类似的功能,在微通道中形成局部微涡流;Hashmi等[150]总结了微流控设备中振荡微气泡的功能和应用[图6(e)]。值得注意的是,施加在生物样本上的力取决于样本的大小,这意味着大的微生物比小的细胞容易受到更大的旋转扭矩。此外,有研究表明,细胞的旋转速度随着驱动电压的平方函数而变化[16]。因此,从理论上讲,在相同的激励电压下,由声流引起的细胞或粒子的旋转速度可能有助于区分它们的大小。然而,从长远来看,微气泡的声学参数不稳定,因为微气泡的大小和几何形状很容易发生改变。另外,这两种结构(即微气泡和锐边结构)的空间分辨率都很低,这限制了它们的实际应用。
《图7》
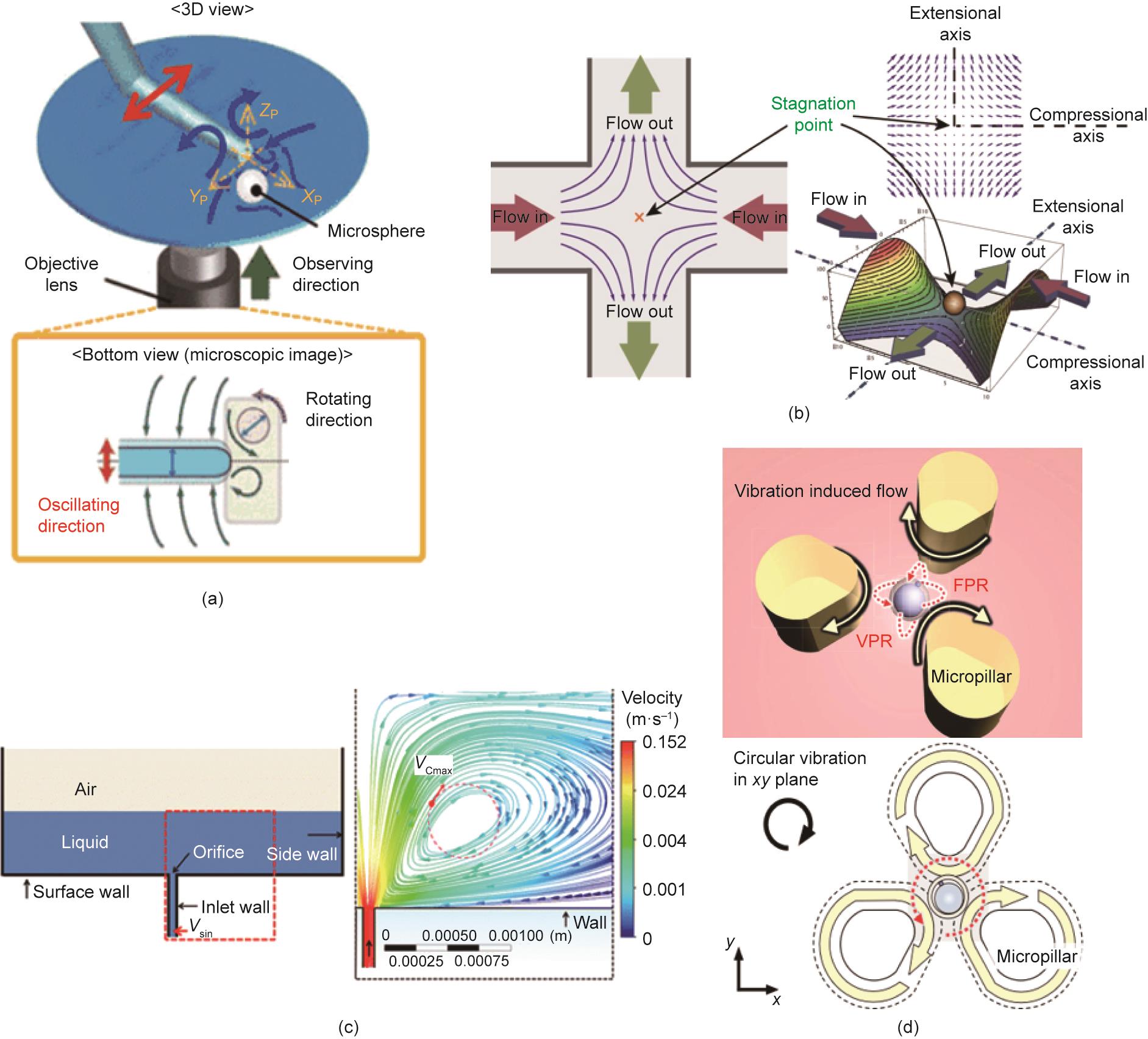
图7 基于流体动力场的可控细胞旋转策略。(a)微球垂直旋转的流动模式示意图;(b)在两个垂直的微通道交界处的平面延伸流场产生一个水动力陷阱;(c)2D仿真域示意图和再循环区的模拟结果;(d)基于振荡诱导涡流的细胞旋转。VSin:模拟的入口速度;VCmax:通过模拟计算出的细胞-流体最大速度;FPR:焦平面旋转;VPR:垂直平面旋转。(a)经Springer Nature, ©2018许可,转载自参考文献[
《3.4 流体动力场方法》
3.4 流体动力场方法
基于流体动力场的方法可以通过各种方式产生微米级的流体场(表4 [16‒17,19,93,149‒155]),如振荡压电致动器[图6(e)、(f)],在旋转磁场中旋转磁性微珠[88,122,156],或控制微吸管内的流速[18‒19]。
《表4》
表4 使用流体动力场方法进行细胞旋转的相关文献
| Authors | Method | Rotational DOF | Angular velocities ((°)·s-1) | Rotating object | Applications |
|---|---|---|---|---|---|
| Shelby et al. [ | Recirculation flow in the micro-vortex | 1 | 200 | Mouse B-lymphocyte cells | Orientation control of single DNA molecules |
| Hashmi et al. [ | Bubble-induced acoustic streaming | 1 | < 1 080 | Silica particles | Drug and gene delivery |
| Hayakawa et al. [ | Vibration-induced flow by three micropillars | 3 | Vertical: 3.5; focal: 63.7 | Mouse oocytes | 3D cell observation |
| Torino et al. [ | Rotation caused by the speed difference between two sides | 1 | — | Yeast cells | 3D shape imaging |
| Ozcelik et al. [ | Sharp-edge-induced acoustic streaming | 3 | > 84 000 | HeLa cells; | Organism studies |
| Ahmed et al. [ | Bubble-induced acoustic streaming | 1 | < 18 000 | HeLa cells; | Organism studies |
| Zhang et al. [ | Swirling flow induced by two microtubules | 1 | Irregular: 343.77; regular: 171.88 | Shrimp eggs; silica particles | Analysis of pressure and velocity distributions |
| Yalikun et al. [ | Micro-rotational flow induced by flow at the orifice | 3 | 3 600 | Single pronuclear zygotes | Oocyte all-surfaces’ imaging |
| Fuchiwaki et al. [ | Vibration-induced flow by oscillating pipettes | 3 | Vertical: 34.8; focal: 188 | Egg cell | Multi-axial rotation |
| Liu et al. [ | Vibration-induced flow by pipette circular vibration | 1 | 291.1 | Mouse egg cell | 3D cell observation |
| Feng et al. [ | Sharp-edge-induced acoustic streaming | 3 | 3 000 | Swine oocytes | In-plane and out-of-plane rotational manipulation |
本文对球形或不对称粒子在剪切流下的旋转运动的现象和基本理论进行了详细的研究。由于作用在靶细胞周围的流体动力的不平衡,可以在其周围形成旋转扭矩。不同的细胞在旋转运动方面对不平衡的扭矩有不同的反应。例如,在Shelby和Chiu [19]的研究中,发现施加在半封闭腔内旋转细胞上的扭矩与细胞的特性和流体的黏度有关。在这种情况下,压力引起的流体脱离发生在半封闭腔的开口处,并为放置在这种腔中的细胞或粒子提供动力,使其旋转。此外,Torino等[151]研究了不对称细胞在直线通道中的旋转机制,发现旋转速度与细胞相对于流体流动的方向以及细胞与通道壁的距离有关。放置在微通道中的不对称细胞的两侧(一侧靠近通道壁,另一侧靠近通道中心)将经历不同的流速,因此诱发细胞旋转。这种差异对于不对称细胞来说很明显。
此外,当控制微通道内的流速时,随着流速的增加,流体动力的影响变得非常大。Tanyeri等[157‒158]设计了一个用于捕获粒子的微流体装置,其中两个对立的层流在交汇点相遇,并形成一个清晰的流场来捕获粒子。如图7(b)[157]所示,不同大小和形状的单细胞可以被捕获和旋转,但旋转运动是不可控制的。此外,受喷泉原理的启发,Yalikun等[18,152,159‒160]提出了一种片上喷泉,通过将高速流动的微流体从微孔结构推到微流控芯片的顶部表面来实现细胞旋转,如图7(c)所示。被捕获的靶细胞在一个圆形区域内旋转[图7(c)],圆形区域和旋转速度由三个因素主导:微孔结构的大小、微流体的流速,以及与液体表面的距离。同样地,Zhang等[153]提出使用两个并行的微管,在它们之间产生一个漩涡。这样的漩涡有能力输出更大的驱动力,使半径在几微米到几百微米之间的粒子旋转。两个微管的流体流速越大,粒子的旋转速度越快。流体动力场诱导的细胞旋转与细胞形态密切相关;对于一个不规则的细胞,旋转扭矩随时间变化,导致旋转速度变化。
类似的功能也可以通过高频振荡获得。例如,一个连续振荡的圆柱体可以产生稳定的涡流,并捕获圆柱体附近的细胞。如图7(a)所示,Fuchiwaki等[154]用一个微吸管作为一个振荡圆柱体。在这种情况下,一旦细胞被圆柱体顶端附近的涡流捕获,该细胞将在一个固定点上围绕垂直轴稳定地旋转;而被圆柱体两侧产生的漩涡捕获的细胞将相应地围绕水平轴旋转。在此基础上,Liu等[161]进一步分析了输入电压、捕获面积和传输速度之间的关系,并成功地改善了由连续振荡的圆柱体诱导的细胞旋转的可控性。此外,Hayakawa等[93]提出了一个带有三个微柱的开放型细胞旋转芯片[图7(d)],其中振荡微柱成功地在中心区域诱导了合理的流动,并在焦平面[ (63.7 ± 4.0) (°)·s-1 ]或垂直平面[ (3.5 ± 2.1) (°)·s-1 ]旋转小鼠卵细胞。该方法允许在一个开放的芯片上观察3D细胞,使其适用于需要外部探头的访问。
《3.5 多细胞旋转》
3.5 多细胞旋转
在过去的几十年里,各种类型的细胞旋转和重新定向的方法已经被开发出来,用于单细胞分析,其中一些也可以用于多细胞旋转。将流体动力场与外部驱动技术结合,可以产生一个强大的工具,用于旋转多个细胞。例如,流体动力可以使一群细胞在焦平面和垂直平面上以非常高的速度(> 14000 r·min-1)并行旋转,特别是当流体动力与声场结合时。此外,流体动力有能力在连续流动的过程中旋转非球形细胞[162],如红细胞,成功率为98.7% ± 0.3%。在机器人的帮助下,流体动力旋转甚至可以在液滴中进行[93],从而使开放空间中的应用成为可能,如需要某些设施(如微管)才能进入旋转区域的细胞手术。然而,上述方法的应用受限于旋转速度和旋转中心的不稳定性。漩涡对大量细胞的捕获和旋转也可以由微气泡[图8(a)[34] ]或具有尖锐边缘的物体[如微吸管(图8(b)[154] ]的高频振荡引起。然而,这两种控制方法都不稳定,因为不同位置的细胞以不同的速度旋转;特别是在前一种方法中,微气泡的大小不同,对细胞的旋转有很大影响。
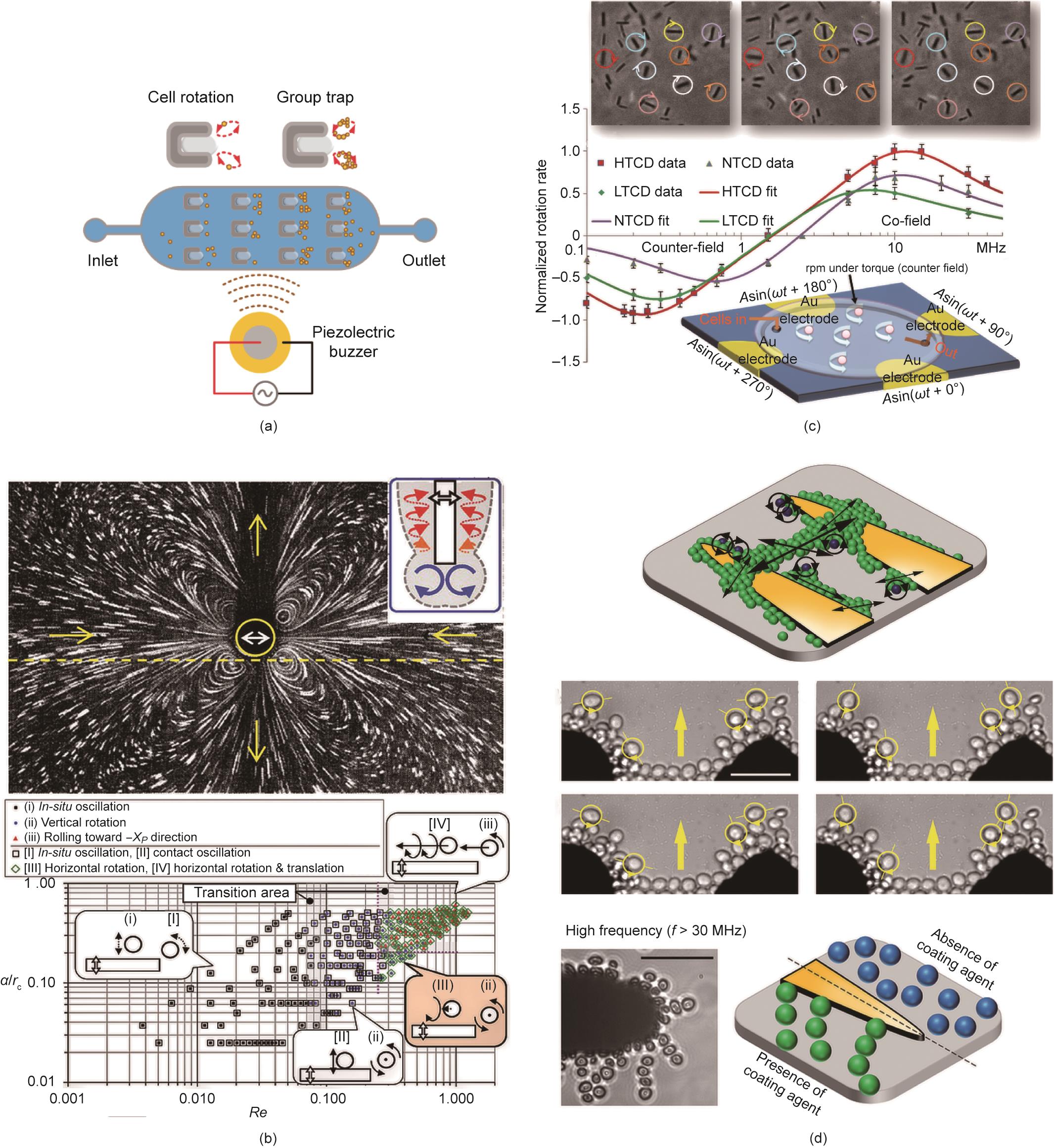
《图8》
图8 由声学或流体动力学方法激活的多细胞旋转控制。(a)在不同的时间点用四极式电极控制多细胞的旋转速度;(b)微气泡诱导的多细胞旋转;(c)位置依赖的多细胞旋转是由流体动力围绕微吸管得出的;(d)在DEP的影响下,细胞群的局部运动。α:振荡幅度的一半;Re:雷诺数;rc:圆柱体的半径。HTCD:高致毒艰难梭菌(Clostridioides difficile);NTCD:非致毒艰难梭菌;LTCD:低致毒艰难梭菌。(a)经Biomedical Microdevices, ©2020许可,转载自参考文献[
与声学-流体动力学控制方法相比,电旋转具有更好的空间分辨率(0.1~1 μm)。当在四极式电极上施加宽频范围(50~30 MHz)的AC电场时,被旋转电场激活的细胞在与场强相对应的不同速度下表现出同场或反场旋转。该旋转机制已通过多种药物的复用和自动并行测试[163] [图8(c)],被用于实现病原微生物抗生素敏感性的快速评估。然而,很明显,所有的样品在旋转电场中是随机分布的,一些样品在旋转过程中可能会相互碰撞,导致多细胞并行分析的失败。为了重新排列所有细胞,Soffe等[101]研究发现,当激励电压频率增加到大于30 MHz时,细胞链被拉长,细胞间的距离增加,导致沿电场方向形成松散连接的细胞链[图8(d)]。因此研究人员就能够控制重新排列的细胞链外层上的细胞团的旋转。这种旋转运动可以通过调整所施加的正弦AC信号的频率和电压进行调制。在这种情况下,尽管细胞不太可能相互碰撞,但旋转速度在很大范围内变化,并且只有外层的细胞可以旋转。考虑到这是最近报道的唯一成功的电场多细胞旋转的研究,以及在DEP下大多数细胞的旋转运动是不可控的,本文将电场方法标记为单细胞旋转技术,如图1(a)所示。
为了实现高效的多细胞分析,控制技术必须具有同时重新排列和旋转细胞的能力。OT可能有潜力满足这两个要求。这是因为一束激光可以通过计算机生成的全息图[164]被分割成多个组成部分,这束激光可以完全控制每个单独光束的焦点位置;每个被分割的光束作为一个“光学手指”发挥作用,实现多个细胞的旋转。受控细胞的数量只受被分割的光束的数量的限制,一般在100个左右。此外,这些“光学手指”能够在所需的位置形成光学陷阱,并重新安排一群细胞,以避免单个细胞之间的碰撞,从而有助于实现控制的高空间分辨率。然而,到目前为止,关于使用多个激光束进行多细胞旋转的研究很少,这可能是因为激光束会对细胞造成光学损伤。
《4、 结论和展望》
4、 结论和展望
本文综述了基于非接触场或微型机器人的细胞重新定向和高速旋转的6类主要方法。表5总结了这些方法的优缺点[4,9,16‒17,46‒48,52,56‒57,67,99‒101,118‒120,136,152,159‒160,165‒166];选择一个合适的方法取决于应用的具体要求。
《表5》
表5 粒子(包括生物和合成的)旋转方法
| Approaches | Size range (μm) | Spatial resolution | Rotational DOF | Advantage | Disadvantage | Mechanisms (principles) | Additional system requirements |
|---|---|---|---|---|---|---|---|
| Optical field [ | 0.1‒100 | 0.1‒1 nm | 1‒3 | Low noise; low drift; precise rotation | Expensive optics; sample invalidity; sample heating; weak force | Trapping force and torque | High-powered laser; high numerical aperture lens |
| Mechanical contact [ | 100‒1000 | 0.01‒1 μm | 1‒3 | Precise reorientation; stable performance | Complex operation; low success rate; cell deformation; high risk of cell damage; complex system; modified tool fabrication is required | Mechanical contact | Micropipettes; micro gripper |
| Electric field [ | 0.001‒1000 | 0.1‒1 μm | 1‒3 | Low cost; highly efficient; precise rotation | Potential electrochemical reactions | DEP force | AC electric signal |
| Magnetic field [ | 1‒10 | 1‒10 nm | 1 | Force-clamp; magnetic bead rotation; specific interactions | Cell pretreatment; contamination | Magnetic gradient field force | Permanent magnet; magnetic beads |
| Acoustic field [ | 0.1‒1000 | 1‒10 μm | 1‒3 | Low cost; massive particle rotation; low number of injuries | Limited precise cell rotation; cell stimulation | Axial acoustic force | Acoustic source |
| Hydrodynamic field [ | 0.1‒1100 | 1‒10 μm | 1‒3 | Low cost; simple operation; low number of injuries | Limited precise cell rotation | Hydrodynamic effects | Special structure; multi-pressure regulators; flow-control algorithms |
对于较小的细胞(即大小为100 μm以下的细胞),要想精确地将其重新定向到一个特定的角度,基于光场的方法是最合适的选择,因为这些方法是非接触控制的。此外,借助手术机器人系统和封闭式控制系统,可以进一步提高细胞重新定向的可控性和精确度。为了尽量减少激光的直接照射,降低对细胞的光损伤风险(表2),可以采用基于激光的非直接方法或机械接触方法(对于小于100 μm的细胞)来重新定向靶细胞的方向。对于基于磁性的方法,只有一项研究曾报道过在一个全封闭的微管中成功实现了细胞定向,但研究人员还没有通过实验在开放芯片上实现细胞分析。这种非侵入性的方法还不能用于细胞或其他样本的重新定向[134],还需要进一步对其进行探究。
旋转的细胞对细胞成像有优势,因为在细胞观察过程中旋转的细胞呈现零盲点。流体动力场方法对于可控的细胞旋转来说非常适用,因为它们不会造成不必要的物理或化学干扰。当使用流体动力时,旋转速度变得越来越快,旋转方向和旋转轴的可控性也变得越来越高。通过将流体动力场与声场整合在一起,在微通道中形成声镊,实现了多个样品的并行旋转;这有可能加速大量样品旋转模式的成像和分析。粒子或生物样品的旋转模式根据其质量和形状等物理特征表现出一些差异,但基于旋转模式观察的细胞分类尚未得到验证。
对于单细胞分析,许多实验[36,107]表明,细胞的介电特性可以通过电镊来测量,因为细胞的介电特性(如电导率和介电常数)与非均匀电场中的旋转速度和方向直接相关。电镊已经被用于开发旋转纳米电机[167],实现每小时高达16 000转的连续可调旋转。参考文献[167]中的研究也实现了对多个纳米电机的相同控制。然而,对细胞的类似研究仍然停留在单细胞分析层面。对于多细胞旋转,目前流行的方法仍然是流体动力场或声场方法,这两种方法都缺乏精确控制细胞的能力,只适合于多角度细胞成像。
本文总结了用于单细胞或多细胞旋转和定向的各种方法,但实现多细胞并行旋转的例子相对较少,可能是因为很难在特定的扭矩下精确旋转一群细胞。事实上,由于细胞的旋转运动与细胞状态和某些生物物理特性有关,因此对这种技术有迫切的需求。迄今为止,基于AC电动力学的微流控平台和机器人辅助的多OT都是很有潜力的工具,可以满足并行旋转控制要求。未来对这些方法的研究将是一项有趣的课题,有助于有效加速对一群细胞的分析,并根据其旋转特性区分异质细胞。














 京公网安备 11010502051620号
京公网安备 11010502051620号




