《1、 引言》
1、 引言
发酵乳杆菌形态细长,呈杆状,不运动,产气,是一种革兰氏阳性细菌,是乳杆菌属下的一个种。它普遍存在于发酵蔬菜、种子、牛奶、奶酪、手工发酵剂、人类唾液、人类阴道以及人和动物的肠道等环境中[1‒2]。2008年,第一株进行基因组测序的发酵乳杆菌为发酵乳杆菌IFO3956,至今已有65株发酵乳杆菌的基因组可以从国家生物技术信息中心(NCBI)微生物基因组数据库获取†[3]。发酵乳杆菌基因组的大小约为(2.1±0.1) Mb,平均GC含量约为51% ± 1%。随着全基因组测序技术的出现,发酵乳杆菌基因组中一系列与产生功能分子[胆盐[4]、胞外多糖[5]、短链脂肪酸(SCFA)[6]等]相关的基因被鉴定出来。
与一些有基因组数据的乳杆菌,如植物乳杆菌(467)、鼠李糖乳杆菌(178)、副干酪乳杆菌(178)相比,完成基因组测序的发酵乳杆菌数量相对较少。系统发育和比较基因组分析表明,乳酸菌在与它们的栖息地共同进化的过程中发生了大量的基因丢失和横向基因转移[7]。预测乳酸菌的某些遗传变异是为了提供适应不同生境的能力,人们付出大量的努力探索基因组进化与生态多样性之间的联系[8]。参与糖代谢、蛋白质水解系统和胆盐水解的基因被证明与乳酸菌适应特定的生境,如人类肠道或乳制品有关[9]。
到目前为止,研究主要集中在植物乳杆菌[10]、罗伊氏乳杆菌[11]、鼠李糖乳杆菌[12]和干酪乳杆菌[13],且已有的证据表明,这些物种与它们的生境如宿主物种共同进化[14]。然而,据我们所知,对于发酵乳杆菌菌株进化特性的研究非常有限。基于11个管家基因序列对203株发酵乳杆菌进行多位点序列分型分析,结果表明,来自相同地域食物来源发酵乳杆菌分离株具有相似的进化方向[15]。通常,发酵乳杆菌存在于发酵制品中,它也是人类肠道中常驻的共生体[16]。宿主的地理位置、性别、族群和年龄对发酵乳杆菌菌株进化的影响有待进一步研究。
越来越多的研究表明发酵乳杆菌对其宿主的健康有益[17‒18]。其可以拮抗致病菌[19],减轻酒精性肝病[20]、心血管疾病[21]和结肠炎[22]等。发酵乳杆菌在2013年被美国食品和药物管理局(FDA)认定为“一般认为安全的”(GRAS)物质。基于动物模型的实验结果表明,发酵乳杆菌可以抑制结肠组织中促炎因子的表达和NF-κB通路的激活,在改善溃疡性结肠炎中发挥了重要的作用[23]。发酵乳杆菌CECT5716被报道可以恢复结肠炎小鼠小肠内容物中的短链脂肪酸浓度,并改善右旋糖苷硫酸钠(DSS)诱导的小鼠结肠炎肠道菌群失调[24]。与此相反,另一项研究表明,从一名81岁患有胆囊炎的男性患者的胆囊造口引流液中通过厌氧条件下血培养分离出致病性发酵乳杆菌[25]。Anderson等也指出,人口腔分离出的发酵乳杆菌AGR1487可通过增加结肠炎症细胞(巨噬细胞、淋巴细胞和中性粒细胞),诱导结肠髓过氧化物酶和血浆淀粉样蛋白A,并激活toll样受体信号通路,在无菌大鼠中参与促炎反应[26]。这些研究表明发酵乳杆菌的抗炎作用具有菌株特异性。缺少BSH基因的多形拟杆菌突变株可降低小鼠肝脏和血浆脂质水平[27],缺少支链短链脂肪酸合成基因的产芽孢梭菌突变株可调控小鼠体内免疫球蛋白A相关的免疫细胞[28]。有研究表明,发酵乳杆菌基因组中负责编码胆盐水解酶的基因bsh与其降胆固醇活性有关[29]。罗伊氏乳杆菌JCM 1112基因组中编码罗氏菌素和钴胺素的基因簇pdu-cbi-cob(pdu,丙二醇脱水酶基因;cbi,钴啉醇酰胺生物合成基因;cob,钴酰胺生物合成基因)被报道与其抗菌特性相关[3]。这些报道表明,乳杆菌的功能与基因存在紧密联系,与发酵乳杆菌抗炎症性疾病相关的重要基因有待进一步研究。
本研究中,我们从中国人群粪便样本中分离到105株发酵乳杆菌,并获得了这些菌株的基因组草图序列。本研究的目的是评估来自不同地理区域的发酵乳杆菌菌株是否存在基因组差异和不同生理特征,揭示系统发育树不同支系上的发酵乳杆菌对溃疡性结肠炎的缓解作用,并分析可能与发酵乳杆菌抗炎作用相关的功能基因。
《2、 材料与方法》
2、 材料与方法
《2.1 化学药品和试剂》
2.1 化学药品和试剂
葡聚糖硫酸钠(DSS,分子质量为36~50 kDa)购自美国MP公司;Fast DNA spin kit for feces购自美国MP Biomedicals公司;TRIzol试剂购自美国Invitrogen公司;QIAquick Gel Extraction Kit购自德国QIAGEN公司;BCA蛋白定量试剂盒和RIPA裂解液购于北京天根生物有限公司;超纯RNA提取试剂盒购自中国康为世纪科技有限公司(CWBIO);蛋白酶抑制剂混合液和磷酸酶抑制剂混合液I购自美国MedChemExpress生物科技公司;反转录第一链cDNA合成试剂盒购自美国Thermofisher公司;iTaq Universal SYBR Green超混合液购自美国伯乐公司;ELISA试剂盒(IL-10、IL-6、IL-4、IL-1β和肿瘤坏死因子α)购自美国R&D公司;NF-κB p65抗体和磷酸化NF-κB p65抗体购自英国Abcam公司;山羊抗兔IgG抗体、山羊抗小鼠IgG(H&L)抗体和β-Actin抗体购自中国金斯瑞生物科技股份有限公司;乳酸脱氢酶检测ELISA(酶联免疫吸附测定)试剂盒购自上海酶联生物科技有限公司(MLBIO)。
《2.2 发酵乳杆菌的培养条件》
2.2 发酵乳杆菌的培养条件
分离筛选发酵乳杆菌用改良的LAMVAB培养基(乳杆菌厌氧MRS培养基添加万古霉素和溴甲酚绿),由我们实验室自己改良(未发表数据,见附录A中的表S1)[30]。我们从安徽、福建、湖南、广东、广西、江苏、江西、宁夏、青海、山东、四川、新疆、内蒙古、上海、重庆的人群粪便样本共筛选到105株发酵乳杆菌(附录A中的表S2)。对于体外实验,将发酵乳杆菌在MRS培养基中,于37 ℃下培养18~24 h。对于动物实验,准备终浓度为5×109 CFU∙mL-1生理盐水的发酵乳杆菌溶液,灌胃体积为每只小鼠100 μL。
《2.3 发酵乳杆菌的比较基因组和系统发育分析》
2.3 发酵乳杆菌的比较基因组和系统发育分析
采用PGAP 1.2.1分析109个发酵乳杆菌基因组(其中4个为NCBI网站下载,105个基因组为本实验室筛选测序所得)的泛基因,用Python分析平均核苷酸一致性(ANI)。采用Glimmer v 3.02预测蛋白质编码序列(CDS),用OrthoMCL 1.4的最大似然法对所有发酵乳杆菌核心基因进行系统发育分析,用MAFFT v 7.313构建所有发酵乳杆菌基于11个管家基因的最大似然进化树[15]。为了鉴定菌株之间的功能基因差别,使用CAZy数据库BLAST比对分析发酵乳杆菌碳水化合物活性酶基因,使用COG数据库BLAST比对注释发酵乳杆菌直系同源基因[31]。
《2.4 动物实验设计》
2.4 动物实验设计
动物实验方案经江南大学伦理委员会批准(JN. No 20180615b0950901 [164])。本实验使用BALB/C小鼠(雄性,8周龄,上海斯莱克实验动物有限责任公司)作为实验小鼠,每组包含10只小鼠。小鼠经过的1周的适应期后开始实验。实验期间为10天,除正常组给予无菌水外,其他组小鼠每天自由饮用4%(m/V)的DSS溶液。此外,正常组和DSS造模组每天灌胃100 μL 0.85%生理盐水,4组发酵乳杆菌干预组每天灌胃100 μL 5×109 CFU∙mL-1生理盐水的发酵乳杆菌液体[32]。
实验期间,每天测量小鼠的体重和评价粪便指标。实验结束时,小鼠腹腔注射1%戊巴比妥钠溶液并安乐死[33]。测量小鼠结肠长度,取部分结肠用于组织学观察,其余部分保存在-80 ℃。小鼠的疾病活动指数(DAI)的评估参考之前的研究[34]。
《2.5 组织病理观察》
2.5 组织病理观察
参考之前的报道[35],结肠远端切片的组织学评估基于苏木精和伊红(H&E)染色。组织学评分是根据炎症浸润、杯状细胞损失和黏膜增生进行评估的,由两名研究人员进行,他们对每个切片的细节不知情。
《2.6 ELISA和免疫印迹法》
2.6 ELISA和免疫印迹法
采用R&D公司ELISA试剂盒测定小鼠结肠组织中白细胞介素IL-4、IL-6、IL-1β、IL-6、IL-10和肿瘤坏死因子TNF-α的含量。采用Western blot检测小鼠结肠中p65和磷酸化p65(p-P65)的水平,方法参考文献[36]。使用AlphaView软件3.4.0.0对蛋白表达进行可视化。
《2.7 小鼠结肠紧密连接蛋白表达》
2.7 小鼠结肠紧密连接蛋白表达
用RNA试剂盒(CWBIO)提取小鼠结肠总RNA,然后用逆转录试剂盒(美国赛默飞世尔科学公司)合成互补DNA。通过实时荧光定量PCR检测紧密连接蛋白occludin、claudin-1、ZO-1和ZO-2基因在结肠中的表达[37]。引物序列见表1。
《表1》
表1 qPCR引物
| Gene | Forward (5′-3′) | Reverse (5′-3′) |
|---|---|---|
CTTCTCTTGCTGGCCCTAAAC AACGGATGCTGGAAGTTAAT CACACTTGCTTGGGACAGAG GATGTGGATGGCTGTCATTG GGCTGTATTCCCCTCCATCG | TGGCTTCACTTGAGGTTTCTG TCTGCTTGCTGTCTCTCAACA TAGCCATAGCCTCCATAGCC CCTGGCCAAATTCATACCTG CCAGTTGGTAACAATGCCATGT |
《2.8 短链脂肪酸分析》
2.8 短链脂肪酸分析
用气相色谱-质谱联用(GC-MS)测定结肠内容物中短链脂肪酸(乙酸、丙酸、戊酸、丁酸和异丁酸)的浓度,方法参考文献[38]。
《2.9 小鼠肠道菌群测定》
2.9 小鼠肠道菌群测定
用粪便DNA提取试剂盒提取小鼠粪便样本中细菌总DNA,按照文献的方法对16S rRNA基因序列V3~V4区进行PCR扩增,产物纯化[39]。利用MiSeq Illumina平台对DNA扩增子进行测序,并使用UCLUST v 11以97%的相似度识别存在的OTU。
《2.10 种特异性qPCR》
2.10 种特异性qPCR
采用特异性荧光定量PCR方法检测小鼠粪便中发酵乳杆菌的总量[40]。荧光扩增曲线显示了Ct值与发酵乳杆菌细胞数量关系。每只小鼠称取0.04 g粪便样本,按2.9节的方法提取小鼠粪便细菌DNA [41]。
《2.11 发酵乳杆菌对胃肠道环境耐受性》
2.11 发酵乳杆菌对胃肠道环境耐受性
研究了发酵乳杆菌菌株对酸和胆盐的耐受性[42]。菌悬液离心收集菌体(6000 r∙min-1, 2 min),用无菌生理盐水洗涤后重新收集菌体。将菌体重悬于模拟胃液(3 g∙L-1胃蛋白酶溶解在无菌生理盐水,pH 3.0)培养3 h后,置于8 mL模拟小肠液(胰蛋白酶1 g∙L-1和胆汁盐3 g∙L-1溶于无菌生理盐水,pH 8.0)培养4 h。分别于0、3 h、7 h测定活菌数。
《2.12 体外测定发酵乳杆菌产乳酸》
2.12 体外测定发酵乳杆菌产乳酸
乳酸产量的定量测定参考文献[43]。发酵乳杆菌在MRS肉汤培养基中,于37 ℃下活化培养48 h,活化二代。用乳酸酶联免疫吸附测定试剂盒(MLBIO)定量上清液中的乳酸浓度。
《2.13 统计分析》
2.13 统计分析
数据采用均数±标准误差(SEM)描述。小鼠DAI值和小鼠体重的差异分析采用单因素方差分析(ANOVA)和Dunnett检验。其他指标的差异分析采用单因素方差分析(one-way ANOVA)和Tukey检验(P < 0.05, P < 0.01, P < 0.001)。本研究使用GraphPad Prism 6.0版本进行统计分析。
《3、 结果》
3、 结果
《3.1 发酵乳杆菌的遗传多样性和进化》
3.1 发酵乳杆菌的遗传多样性和进化
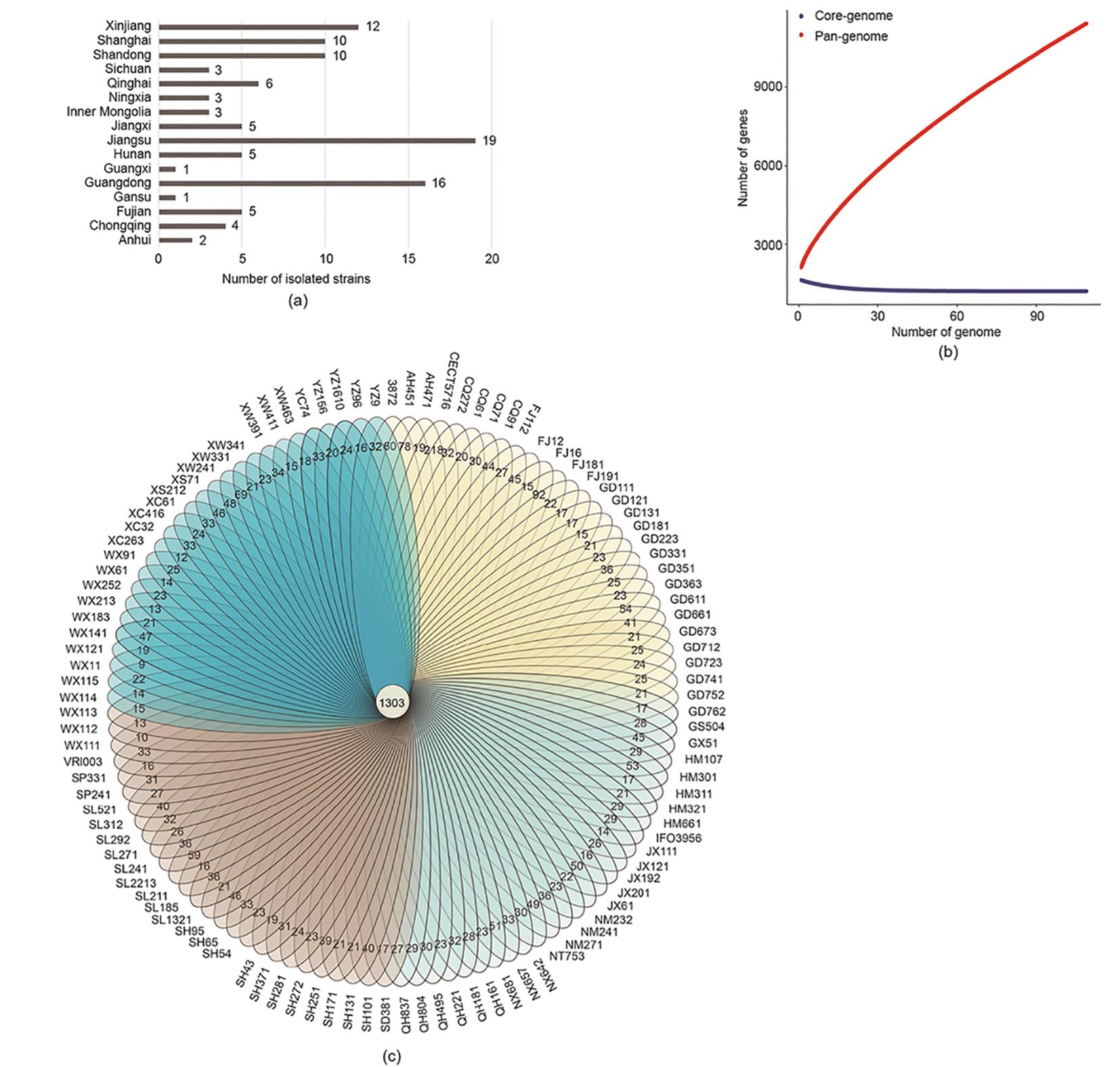
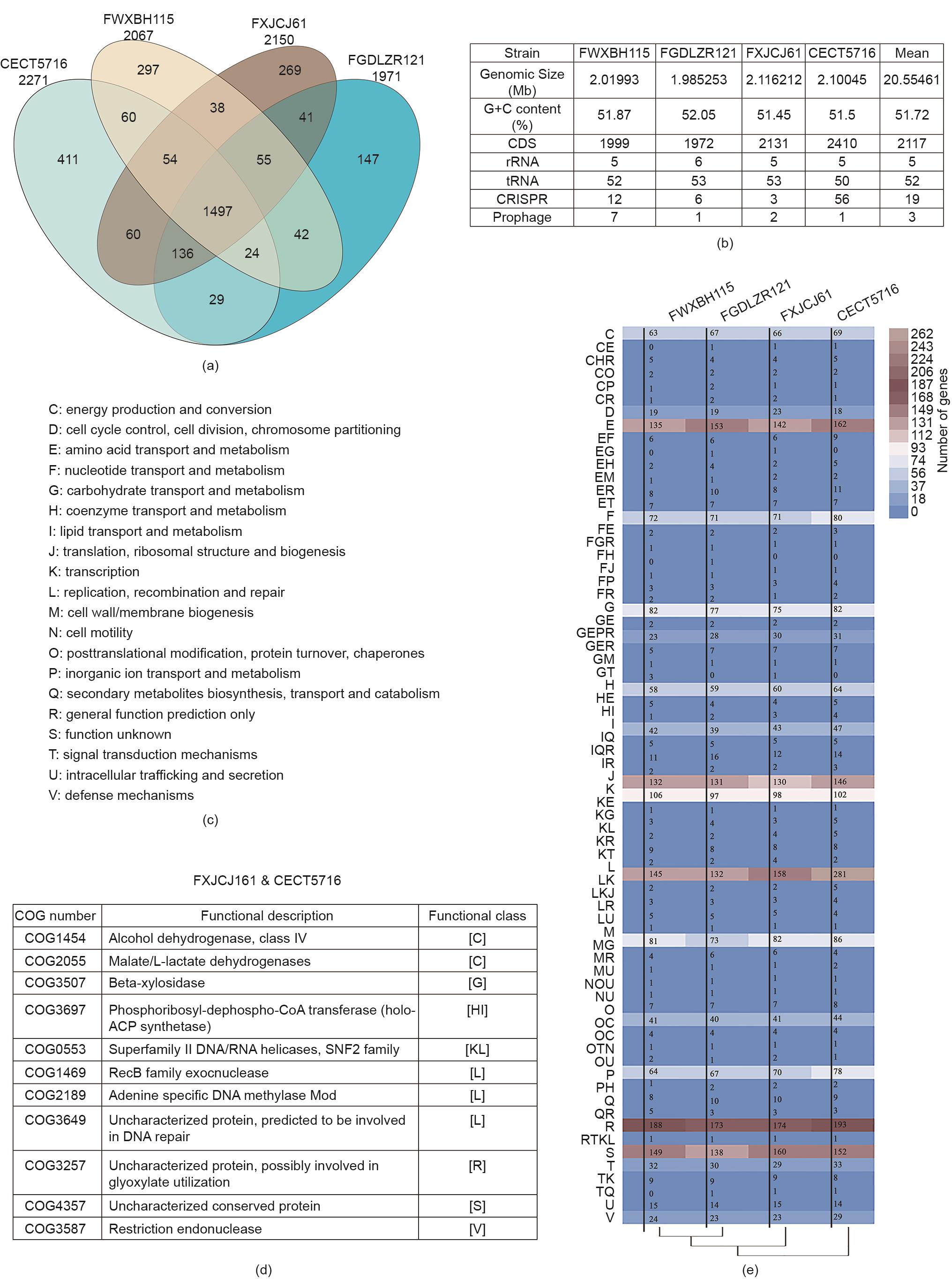
105株发酵乳杆菌菌株(男,41株;女,62株;不详,2株;年龄0~100岁)分离于中国健康人群的粪便样本,发酵乳杆菌的基因组信息和详细来源见图1(a)和附录A中的表S2。加上4株模式菌株(3872、CECT5716、IFO3956和VRI003),这些发酵乳杆菌基因组大小约为2.0 Mb(G+C含量为50.56%~52.50%)。泛基因组分析表明,109株发酵乳杆菌基因组中共有20 505个泛基因,随着发酵乳杆菌基因组数量的增加,泛基因的数量急剧增加。相反,随着基因组数量的增加,核心基因数量逐渐减少,109个基因组中核心基因为1179个[图1(b)]。ANI分析结果表明这109个发酵乳杆菌中每两个基因组之间的核苷酸一致性均大于97%(附录A中的图S1)。
《图1》
图1 从中国人群粪便样本分离的发酵乳杆菌菌株的基因和遗传特征。(a)从不同省或市人群粪便样本分离的菌株数量;(b)泛基因组和核心基因组(曲线表示发酵乳杆菌泛基因组和核心基因组与基因组数量的比值);(c)韦恩图展示菌株同源基因的交集和核心基因(外圈的数字表示每个菌株中特定基因的数量)。
109株发酵乳杆菌共有1303个同源基因[图1(c)]。基于11个管家基因对发酵乳杆菌进行系统发育分析,以不同的形状和颜色进行标注,分别代表地理位置、性别、族群和年龄等因素。具有共同特征的发酵乳杆菌没有聚类在一起,这表明发酵乳杆菌菌株的基因组进化与宿主的地理位置、性别、族群和年龄无关[图2(a)、(b)]。基于109株发酵乳杆菌基因组的1303个核心基因进行的系统发育分析结果表明,虽然这些发酵乳杆菌被划分为3个支系,但没有发现单个可以显著影响它的进化趋势的选择压力因子[图2(c)]。选取不同支系上的3株发酵乳杆菌(FWXBH115、FGDLZR121和FXJCJ61,图1和图2中分别简写为WX115、GD121和XC61)和发酵乳杆菌模式菌株CECT5716(黑色枫叶标记),研究它们对DSS诱导BALB/c小鼠结肠炎的作用。
《图2》
图2 109株发酵乳杆菌的系统发育分析。(a)基于11个管家基因的最大似然树(注释有不同形状和颜色的标签对应着特定的特征;树的分支上标记了Bootstrap置信度值;I、II、III代表三个独立的进化枝);(b)11个管家基因信息;(c)基于109个菌株1303个核心基因的最大似然系统发育分析[每个外圈用不同的形状和颜色标注对应特定的特征,圆圈从内到外:地理位置(华中、华东、华南、西南、华北和东北)、性别(女、男)、省份(安徽、重庆、内蒙古、福建、湖南、广东、广西、江苏、江西、宁夏、青海、山东、四川、上海、新疆)、族群(汉族、回族、蒙古族、苗族、维族、藏族)、年龄(以外圈灰色柱子的长度表示)]。
《3.2 发酵乳杆菌对DSS诱导结肠炎小鼠体重、DAI指数和结肠病理的影响》
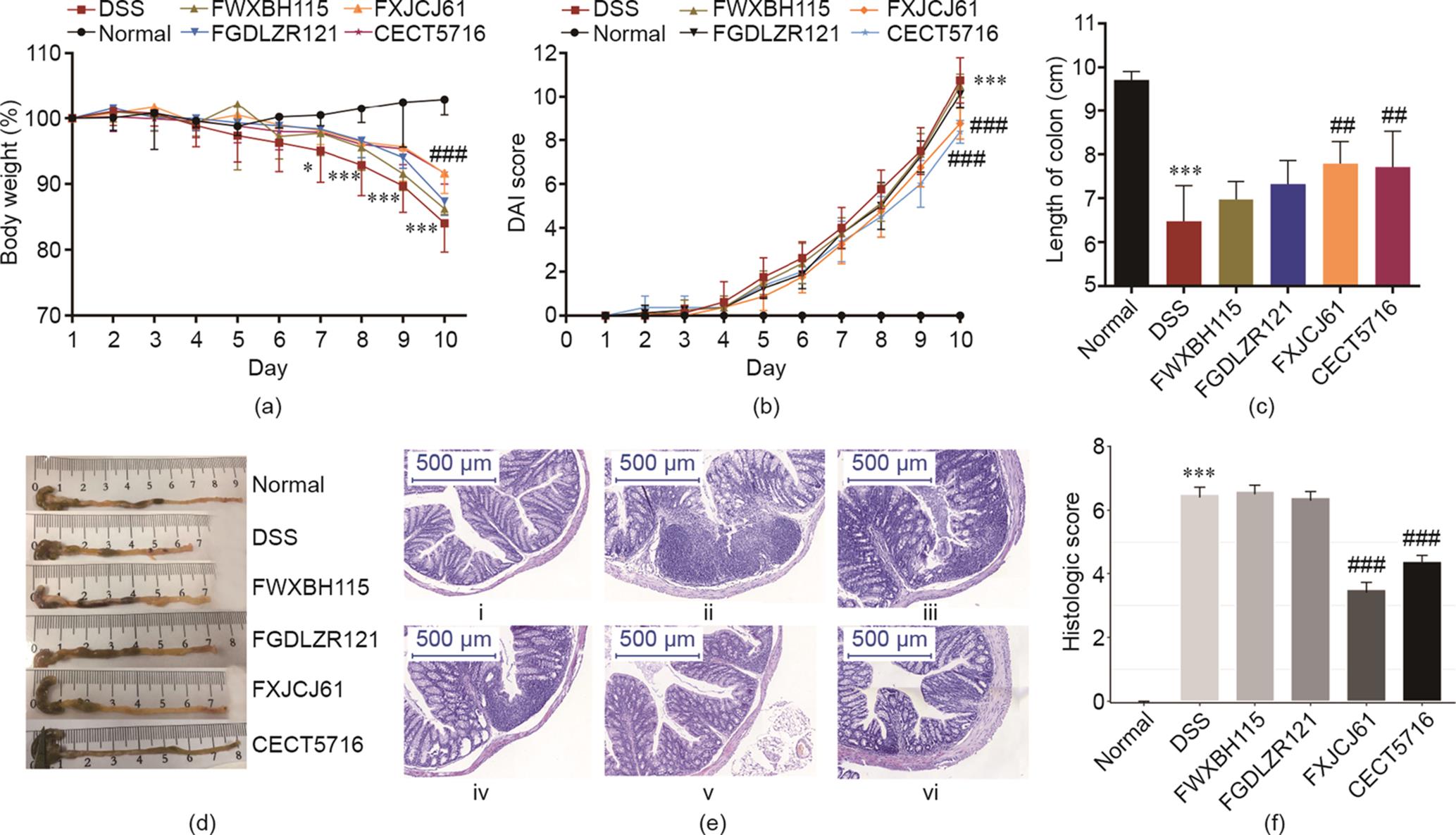
3.2 发酵乳杆菌对DSS诱导结肠炎小鼠体重、DAI指数和结肠病理的影响
DSS诱导小鼠结肠炎可以导致小鼠体重减轻、腹泻、直肠出血。DSS诱导还会显著提高小鼠DAI评分[图3(b)]和缩短结肠长度[图3(c)]。灌胃发酵乳杆菌FXJCJ61和CECT5716可以显著改善小鼠的上述症状。与发酵乳杆菌CECT5716相比,发酵乳杆菌FWXBH115和FGDLZR121对DSS诱导的小鼠症状影响不大。
《图3》
图3 发酵乳杆菌对DSS诱导结肠炎小鼠的影响(n = 8)。(a)实验期间小鼠的体重变化。数据为实验期间各组平均体重的变化;(b)实验期间小鼠的疾病活动指数(DAI)(DAI根据体重变化、直肠出血和腹泻情况进行评估);(c)小鼠结肠长度;(d)代表性结肠图片;(e)远端结肠组织病理切片图:(i)正常组、(ii)DSS造模组、(iii)发酵乳杆菌FWXBH115处理组、(iv)发酵乳杆菌FGDLZR121处理组、(v)发酵乳杆菌FXJCJ61处理组、(vi)发酵乳杆菌CECT5716处理组(图像放大20倍,比例尺500 μm);(f)结肠组织学评分。所有数据采用均数±SEM表示。*和#分别表示与正常组和DSS造模组比较差异显著(*P < 0.05, ***P < 0.001, #P < 0.05, ##P < 0.01, ###P < 0.001)。
造模组DSS诱导小鼠结肠隐窝数量减少,炎症细胞浸润明显[图3(e)]。发酵乳杆菌FXJCJ61和CECT5716干预明显减轻了DSS诱导小鼠的结肠病理损伤,而其他两株菌株未能提供类似的保护作用[图3(f)]。
《3.3 发酵乳杆菌对DSS诱导结肠炎小鼠结肠炎症细胞因子和NF-κB信号通路的影响》
3.3 发酵乳杆菌对DSS诱导结肠炎小鼠结肠炎症细胞因子和NF-κB信号通路的影响
与DSS造模组相比,发酵乳杆菌FXJCJ61和CECT5716干预明显降低了小鼠结肠中TNF-α的浓度,但不影响小鼠结肠IL-6、IL-4和IL-1β的浓度(图4)。与模式菌株CECT5716不同,发酵乳杆菌FWXBH115和FGDLZR121对TNF-α和IL-1β没有调节作用,但增加了结肠中IL-6的浓度(图4)。与DSS造模组相比,4个发酵乳杆菌干预均能引起小鼠结肠抗炎细胞因子IL-10的上调[图4(f)、(h)]。
《图4》
图4 发酵乳杆菌对结肠炎小鼠结肠细胞因子和NF-κB信号通路的影响(n = 8)。细胞因子浓度:(a)TNF-α、(b)IL-6、(c)IL-1β、(d)IL-10、(e)IL-4;(f)Western blot检测p65和p-p65蛋白水平;(g)p65的表达;(h)p-p65的表达。以正常组β-actin作为参照对总蛋白归一化;OD:光密度。对于(a)~(e)的箱线图,中线为中位数;方框表示四分位范围(IQR);误差条表示最小值到最大值。(g)、(h)中的所有数据用均值±SEM表示。*和#表示与正常或DSS处理组相比有显著差异(*P < 0.05, **P < 0.01, ***P < 0.001, #P < 0.05, ##P < 0.01, ###P < 0.001)。
与正常组相比,DSS暴露后小鼠结肠组织中p65蛋白表达显著增加。与DSS造模组相比,发酵乳杆菌FXJCJ61和CECT5716显著降低了DSS诱导结肠炎小鼠结肠中p-P65的水平。而发酵乳杆菌FWXBH115和FGDLZR121对DSS诱导结肠炎小鼠结肠p-p65蛋白的表达没有明显影响[图4(f)、(h)]。
《3.4 发酵乳杆菌对DSS诱导结肠炎小鼠肠道短链脂肪酸的影响》
3.4 发酵乳杆菌对DSS诱导结肠炎小鼠肠道短链脂肪酸的影响
发酵乳杆菌干预对DSS诱导结肠炎小鼠SCFA浓度的影响如图5所示。与正常组相比,DSS造模组小鼠肠道丙酸和戊酸的水平显著降低。与DSS造模组相比,发酵乳杆菌干预组均显著(P < 0.05)提高了小鼠肠道内容物乙酸和丙酸的浓度[图5(a)和5(b)]。发酵乳杆菌FXJCJ61对小鼠肠道内容物短链脂肪酸的调节作用与CECT5716最相似,它对小鼠肠道戊酸和丁酸水平的提高效果最显著。
《图5》
图5 发酵乳杆菌对结肠炎小鼠肠道短链脂肪酸的影响(n = 8)。(a)乙酸;(b)丙酸;(c)戊酸;(d)丁酸;(e)异丁酸。中线为中位数;方框表示四分位范围(IQR);误差条表示最小值到最大值。*和#表示与正常或DSS处理组相比有显著差异(*P < 0.05, ***P < 0.001, #P < 0.05, ##P < 0.01, ###P < 0.001)。
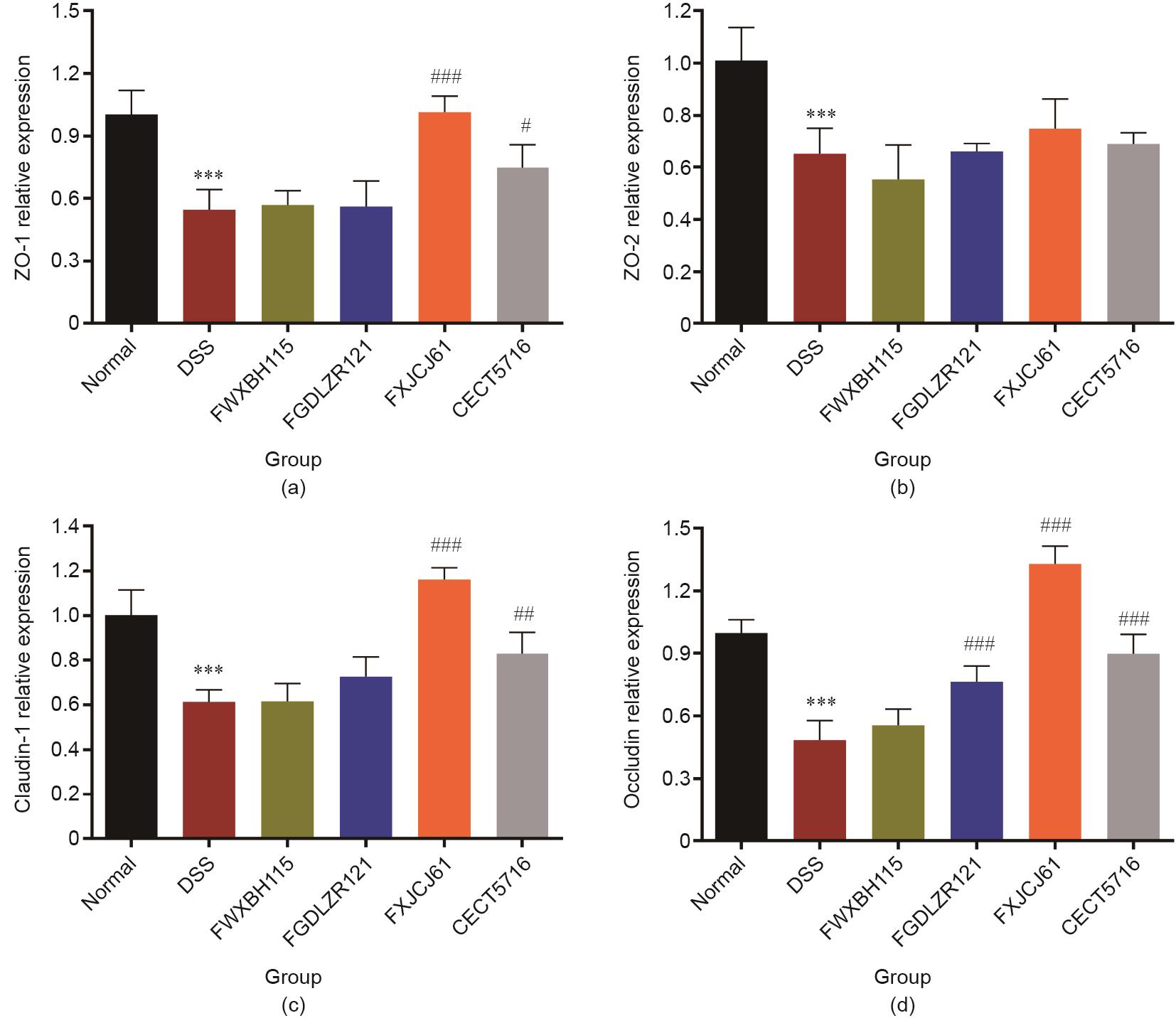
《3.5 发酵乳杆菌对DSS诱导结肠炎小鼠紧密连接蛋白occludin、claudin-1、ZO-1和ZO-2表达的影响》
3.5 发酵乳杆菌对DSS诱导结肠炎小鼠紧密连接蛋白occludin、claudin-1、ZO-1和ZO-2表达的影响
与DSS造模组相比,发酵乳杆菌FXJCJ61和CECT5716干预使DSS诱导结肠炎小鼠结肠occludin、claudin-1和ZO-1的表达显著提升。而发酵乳杆菌FWXBH115和FGDLZR121对结肠炎小鼠结肠ZO-1和claudin-1的表达没有显著影响。发酵乳杆菌FXJCJ61干预组小鼠结肠claudin-1和ZO-1的表达量增加明显,比发酵乳杆菌CECT5716干预组更明显。所有发酵乳杆菌对小鼠结肠ZO-2的表达均没有显著影响(图6)。
《图6》
图6 发酵乳杆菌对结肠炎小鼠结肠4种紧密连接蛋白mRNA表达的影响(n = 8)。(a)ZO-1;(b)ZO-2;(c)claudin-1;(d)occludin。所有数据采用均数±SEM表示。*和#分别表示与正常组和DSS造模组比较差异显著(*P < 0.05, ***P < 0.001, #P < 0.05, ##P < 0.01, ###P < 0.001)。
《3.6 发酵乳杆菌对DSS诱导结肠炎小鼠肠道微生物的影响》
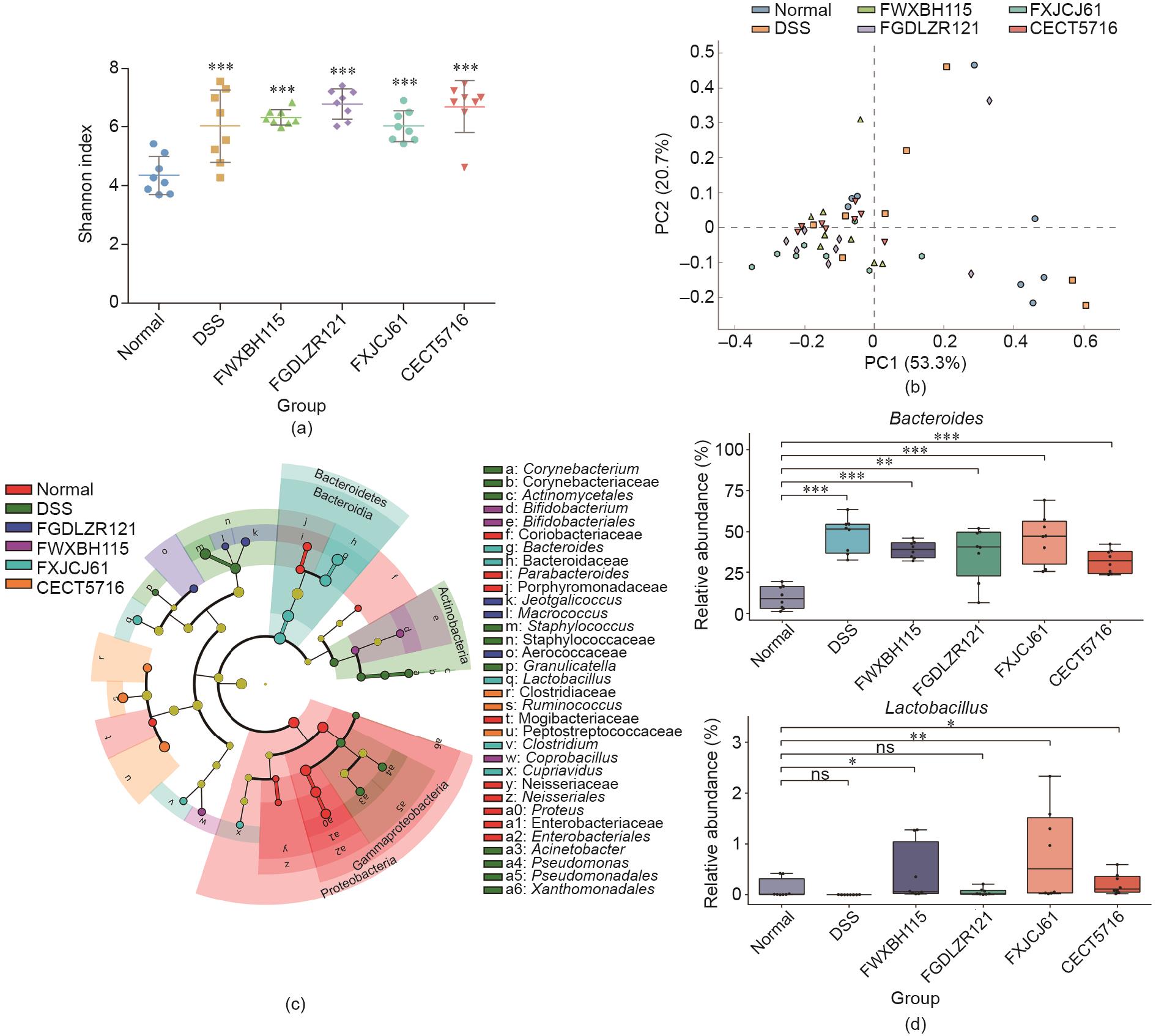
3.6 发酵乳杆菌对DSS诱导结肠炎小鼠肠道微生物的影响
Shannon指数表明,与正常组相比,DSS造模组和发酵乳杆菌干预组的alpha多样性显著增加[图7(a)]。虽然主成分分析结果显示正常组、DSS造模组和发育乳杆菌干预组之间均没有明显差异,但Adonis多元方差分析[又称样品组间差异显著性分析及事后两两比较(PERMANOVA and pairwise comparison)]结果表明,与DSS造模组相比,发酵乳杆菌FWXBH115、FXJCJ61和CECT5716干预显著改变了肠道菌群结构[图7(b)和附录A中的表S3]。LEfSe分析结果显示,6个实验组共有33个优势操作分类单元(OTU)[图7(c)]。在属水平上,发酵乳杆菌FXJCJ61干预显著提高了DSS诱导结肠炎小鼠肠道内容物乳酸菌属和拟杆菌属的水平[图7(c)]。
《图7》
图7 发酵乳杆菌对DSS诱导结肠炎小鼠肠道菌群的影响(n = 8)。(a)Shannon指数;(b)肠道菌群PCoA图;(c)微生物组成柱状图(Lefse分析);(d)发酵乳杆菌对DSS处理小鼠粪便菌群属水平(拟杆菌、乳杆菌)的影响。*表示差异显著(*P < 0.05, **P < 0.01, ***P < 0.001);ns:不显著。
《3.7 比较基因组分析4株发酵乳杆菌的特有基因》
3.7 比较基因组分析4株发酵乳杆菌的特有基因
从图8(a)中可以看出,4株发酵乳杆菌基因组中两两共有的基因数量在1635(1635/3160, 51.74%)和1747(1747/3160, 55.28%)之间,这些菌株的核心基因数量为1497。4株发酵乳杆菌基因组平均大小为205 5461 bp,G+C含量为51.72% [图8(b)]。发酵乳杆菌基因组在COG数据库的预测结果表明,发酵乳杆菌FXJCJ61和CECT5716基因组中的特有基因有11个,发酵乳杆菌FXJCJ61基因组特有基因有17个[图8(c)~(e)和附录A中的表S4]。平均182个基因被分配到COG“一般功能预测”之外,预测的基因主要与氨基酸代谢、翻译、复制和修复有关。基于碳水化合物活性酶数据库,我们研究发现发酵乳杆菌FXJCJ61基因组中存在大量的糖基转移酶(GH2, GH25, GH43, GH78)和糖基转移酶(GT14, GT83)基因(附录A中的图S2)。
《图8》
图8 发酵乳杆菌比较基因组分析。(a)发酵乳杆菌FWXBH115、FGDLZR121、FXJCJ61和CECT5716的核心基因数和特有基因数韦恩图;(b)发酵乳杆菌FWXBH115、FGDLZR121、FXJCJ61和FXJCJ61的基因组信息(CDS:编码序列;rRNA:核糖体RNA;tRNA:转运RNA;CRISPR:聚集的规则间隔短回文重复序列);(c)基于COG数据库的功能注释;(d)发酵乳杆菌FXJCJ61和CECT5716中特有的COG基因;(e)发酵乳杆菌FWXBH115、FGDLZR121、FXJCJ61和CECT5716的COG数据库注释结果(4株菌注释为COG各功能分类的基因数量)。
《3.8 小鼠粪便发酵乳杆菌定量分析》
3.8 小鼠粪便发酵乳杆菌定量分析
荧光扩增曲线显示,采用荧光定量检测小鼠肠道内容物中发酵乳杆菌的检出限为104 CFU∙mL-1(附录A中的图S3)。在正常组、DSS造模组和发酵乳杆菌FWXBH115干预组中均未检测到发酵乳杆菌,而在发酵乳杆菌FXJCJ61、FGDLZR121和CECT5716干预组中检测到发酵乳杆菌。发酵乳杆菌FXJCJ61干预后小鼠肠道内容物中发酵乳杆菌的丰度显著高于其他组(表2)。
《表2》
表2 小鼠粪便中发酵乳杆菌定量( = 5)
| Group | Lg (CFU∙g-1 of feces) a | Group | Lg (CFU∙g-1 of feces) a | Group | Lg (CFU∙g-1 of feces) a |
|---|---|---|---|---|---|
| Normal | < 6.3 | FWXBH115 | < 6.3 | FXJCJ61 | 8.435 ± 0.034 |
| < 6.3 | < 6.3 | 8.122 ± 0.034 | |||
| < 6.3 | < 6.3 | 8.386 ± 0.033 | |||
| < 6.3 | < 6.3 | 8.992 ± 0.071 | |||
| < 6.3 | < 6.3 | 9.012 ± 0.099 | |||
| DSS | < 6.3 | FGDLZR121 | < 6.3 | CECT5716 | < 6.3 |
| < 6.3 | < 6.3 | < 6.3 | |||
| < 6.3 | 8.547 ± 0.021 | 8.308 ± 0.031 | |||
| < 6.3 | 8.317 ± 0.025 | 8.846 ± 0.036 | |||
| < 6.3 | 8.267 ± 0.073 | 8.621 ± 0.049 |
《3.9 发酵乳杆菌对模拟胃液和模拟肠液的耐受性》
3.9 发酵乳杆菌对模拟胃液和模拟肠液的耐受性
发酵乳杆菌FWXBH115、FGDLZR121、FXJCJ61和CECT5716依次暴露于模拟胃液和模拟小肠液中。采用平板计数法测定菌株活细胞数,并通过菌株实验初始点活菌数与模拟胃液和模拟小肠液处理后的活菌数进行比较,计算出菌株存活率。如表3显示,所有发酵乳杆菌均对模拟胃液具有较大的耐受性(存活率均大于85%),其中发酵乳杆菌XJ61在模拟胃液中的存活率最高,为98.33% ± 3.51%。模拟小肠液耐受结果表明,发酵乳杆菌FXJCJ61对3 g∙L-1胆盐的耐受性显著高于其他菌株。发酵乳杆菌FGDLZR121在模拟小肠液中的存活率显著高于发酵乳杆菌CECT5716(表3)。
《表3》
表3 发酵乳杆菌在模拟胃液和肠液中的存活率
| Strain | Viable cell count for Control (0 h) (Lg (CFU·mL‒1)) | Simulated gastric juices (pH 4, 3 h) | Simulated small intestinal juices (pH 8, 4 h) | ||||
|---|---|---|---|---|---|---|---|
| Viable cell count (Lg (CFU·mL‒1)) | Survival rate (%) | Viable cell count (Lg (CFU·mL‒1)) | Survival rate (%) | ||||
| FWXBH115 | 9.21±0.03 | 9.14±0 | 85.33±3.71 | 7.99±0.02 | 7.00±0.57dc | ||
| FGDLZR121 | 9.17±0.12 | 9.12±0.11 | 87.67±4.16 | 8.11±0.03 | 10.00±1.53d | ||
| FXJCJ61 | 8.96±0.02 | 8.96±0.02 | 98.33±3.51 | 8.34±0.02 | 24.33±2.33b | ||
| CECT5716 | 9.45±0 | 9.41±0.02 | 91.67±7.02 | 7.9±0.06 | 3.33±0.33c | ||
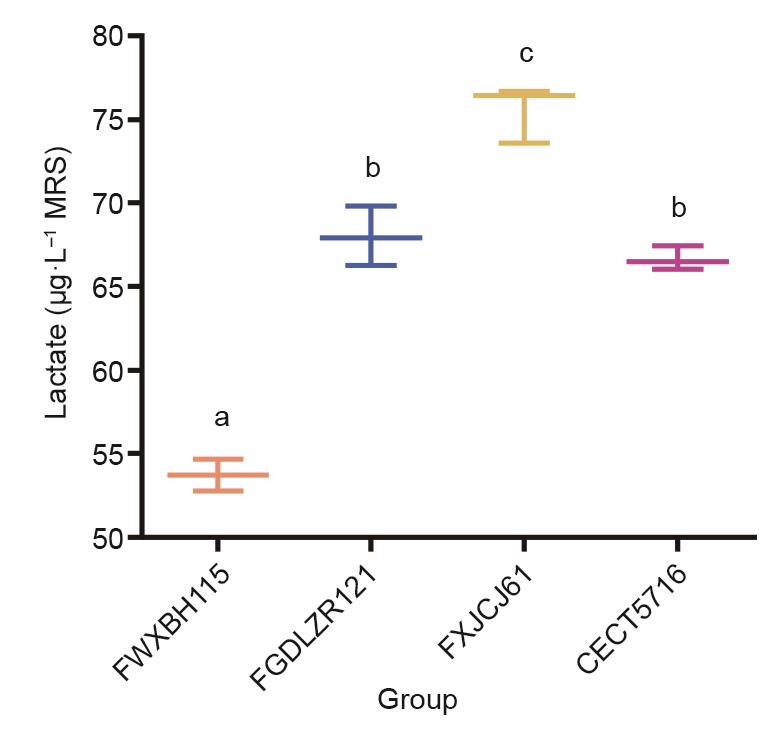
《3.10 发酵乳杆菌体外产乳酸的定量研究》
3.10 发酵乳杆菌体外产乳酸的定量研究
对4株发酵乳杆菌的体外乳酸产量进行了测定,发酵乳杆菌FWXBH115的乳酸产量最低。与发酵乳杆菌FWXBH115相比,发酵乳杆菌FGDLZR121和CECT5716产乳酸浓度更高(大于65 μg∙L-1 MRS)。产乳酸盐浓度最高的是发酵乳杆菌FXJCJ61(75 μg∙L-1 MRS)。
《4、 讨论》
4、 讨论
本研究中,我们分别基于1303个核心基因和11个管家基因对109株发酵乳杆菌(其中,105株分离于中国人群粪便样本,4株是NCBI数据库上的菌)进行了种群基因结构和系统发育分析。系统发育分析表明,发酵乳杆菌在系统发育树上的分布与其宿主的地域、性别、年龄和族群都无关。来自不同地理位置的样本数量不均等可能不是导致结果偏差的原因,因为来自同一地区(如江苏、广东或新疆)的样本在系统发育树中没有明显的聚类趋势。Oh等[14]对罗伊氏乳杆菌进行的种群基因结构和系统发育分析表明,尽管来自不同宿主的样本数量[人(n = 35)、小鼠(n = 35)、大鼠(n = 26)、猪(n = 41)、鸡(n = 26)、火鸡(n = 5)]不等,但罗伊氏乳杆菌的谱系表现出宿主适应性进化方向。这与以前的报道一致,即食物来源的发酵乳杆菌并没有表现出与其地理位置或食物类型有关的协同进化的趋势[15]。之前的研究表明,只有一小部分肠道微生物群(如幽门螺杆菌、罗伊氏乳杆菌、约氏乳杆菌和嗜酸乳杆菌)表现出宿主协同进化趋势,而其他的肠道微生物群(如植物乳杆菌、干酪乳杆菌和鼠李糖乳杆菌)则没有[44‒45]。
本研究的结果表明,这些发酵乳杆菌菌株在系统发育上被分为三个亚型。系统发育和功能基因分析表明,不同系统发育分支的乳酸菌具有不同的代谢类型、生态位以及生活方式[46]。基因差异已被证明与菌株的某些特征有关,并导致不同的表型[31]。例如,对39株来自人类和其他哺乳动物肠道的Akkermansia muciniphila菌株进行系统发育分析,发现其基因组可划分为三个系统群,其中,两个系统群与宿主肥胖相关[47]。Ottman等[48]研究表明,A. muciniphila菌中被注释为假定蛋白的Amuc_1100是一种外膜绒毛样蛋白,它可以通过激活toll样受体2和toll样受体4来诱导IL-8、IL-1β、IL-6和IL-10的产生,从而调节免疫和代谢反应。
基于1303个核心基因的系统发育分析结果表明,发酵乳杆菌FWXBH115、FGDLZR121和FXJCJ61分布在不同的系统发育支系上,被随机挑选在DSS诱导结肠炎小鼠模型中进行下一步研究。口服发酵乳杆菌FXJCJ61和CECT5716对DSS诱导的小鼠的肠道炎症具有保护作用,表现为降低疾病活动指数评分,缓解组织病理学症状(图3),调节相关炎症因子和抑制NF-κB的表达(图4)。有意思的是,属于同一进化支系的发酵乳杆菌FXJCJ61和CECT5716对DSS诱导的结肠炎具有相似的保护作用,但是基于11个管家基因构建的最大似然树分析显示,这两株菌株并没有聚类在一起(图2)。这可能是因为基于所有核心基因的系统发育分析更加全面和有代表性。
研究表明,降低结肠炎小鼠结肠中促炎细胞因子(TNF-α、IL-6、IL-1β和IL-4)的表达可能是溃疡性结肠炎治疗的一个理想靶点[49]。发酵乳杆菌FXJCJ61和CECT5716大大降低了促炎细胞因子(TNF-α)的浓度,并增加了抗炎细胞因子(IL-10)的浓度(图4)。T细胞产生的细胞因子,如干扰素γ(IFN-γ)和TNF-α,可以上调炎症性肠病(IBD)小鼠肠上皮TLR4的表达,介导上皮细胞死亡并与免疫病理相关[50]。另一篇报道表明,通过下调活化T细胞核因子的转录活性,可以阻断TNF-α的产生,这可以作为治疗肠道炎症的一种方法[51]。此外,由T细胞、树突状细胞、巨噬细胞和B细胞产生的细胞因子IL-10已经被证明在免疫调节过程中可以抑制TNF-α的表达[52]。也有研究表明,肠上皮细胞中NF-κB的持续激活可以促进炎症的发生,而TNF-α可以激活NF-κB信号通路[53]。这说明,这些菌株在炎症性疾病方面可能具有潜在的益生作用。
在本研究中,发酵乳杆菌FXJCJ61和CECT5716处理组显示出NF-κB表达下调(图4),这可能部分解释了这些菌株缓解DSS诱导的结肠炎的调节机制。综合考虑上述的体内生物学指标,发酵乳杆菌FXJCJ61和CECT5716降低DSS诱导的结肠炎效果明显比其他测试菌株显著。这些发现对未来这些菌株在临床上的应用具有指导意义。我们的研究结果表明发酵乳杆菌FXJCJ61在治疗结肠炎方面具有临床应用潜力。
比较基因组学已经普遍用于探索基因的特定功能,如细菌的转运蛋白和分解酶编码基因[54]。比较基因组分析43株尿路致病性大肠杆菌(分离自14名尿路感染患者)的结果显示,来自不同系统发育分支的大肠杆菌的致病性不同[55]。
在本研究中,我们比较了两株具有显著抗炎能力的发酵乳杆菌FXJCJ61和CECT5716的基因组,以及两株没有抗炎效果的发酵乳杆菌FWXBH115和FGDLZR121的基因组。如图8所示,发酵乳杆菌FXJCJ61和CECT5716基因组中的特有基因有11个。这些特有的基因被注释与特定的通路有关。首先,我们来分析了3个与短链脂肪酸和乳酸生成相关的基因。β-木糖苷酶(COG3507)是产生木糖单体的主要酶,Yang等[56]表明,喂食低聚木糖纤维可以增加小鼠粪便中短链脂肪酸的含量。乙醇脱氢酶(COG1454)和醛脱氢酶(ALDH)与细菌代谢乙醇产乙酸相关[57]。与这些研究一致,本研究发现发酵乳杆菌FXJCJ61和CECT5716可以有效地恢复小鼠结肠中短链脂肪酸的浓度(图5)。由于短链脂肪酸在调节宿主代谢及降低癌症和糖尿病上也发挥着重要的作用[58‒59],发酵乳杆菌FXJCJ61和CECT5716有望在这些疾病中发挥保护作用。
从机制上看,细菌发酵产生的短链脂肪酸可以增加CD4+ T细胞数和IL-10的水平进而抑制肠道炎症水平[60]。丁酸盐、乙酸盐、丙酸盐能够通过增加紧密连接和降低肠上皮通透性来保护肠上皮免受炎症损伤[61‒63]。本研究发现,与DSS诱导的结肠炎小鼠相比,发酵乳杆菌FXJCJ61和CECT5716干预都增加了小鼠结肠occludin、claudin-1和ZO-1的mRNA表达,这可能与这些菌株增加短链脂肪酸的产生有关联(图6)。这些发酵乳杆菌菌株是否也能增加正常小鼠肠道紧密连接蛋白的表达尚不清楚,需要进一步研究。肠道中紧密连接蛋白也与肠易激综合征(IBS)和关节炎相关,这表明这些菌株在未来可能具有潜在的临床应用前景[64‒65]。
苹果酸/L-乳酸脱氢酶(COG2055)合成基因已被证明在乳酸合成和乳酸菌分泌乳酸中发挥重要作用。据报道,乳酸对肠道损伤有保护作用[66],它也是生成乙酸盐、丙酸盐或丁酸盐的前体之一。此外,研究表明乳酸可以通过TLR-4和TLR-5通路调节肠上皮细胞产生的促炎细胞因子[67]。本研究的体外实验证实发酵乳杆菌FXJCJ61比其他菌株具有更强的产乳酸能力(图9)。
《图9》
图9 发酵乳杆菌体外乳酸产量定量。上标字母a、b和c表示统计学差异显著(P < 0.05)(单因素方差分析和Tukey检验)。每个处理都有重复样品且实验重复了三次。所有数据采用均数±SEM表示。
发酵乳杆菌XJ61和CECT5716独有的基因中,注释为COG0553、COG1468、COG2189和COG3587的基因被报道与DNA的防御机制、复制、重组和修复有关,涉及细胞在环境中的存活[68]。注释为苹果酸二异丙酯/高柠檬酸/柠檬酸合成酶(COG0119)和5,10-亚甲基四氢叶酸还原酶(COG0685)的基因被报道参与氨基酸的运输和代谢(附录A中的表S4)。此外,COG0685可能与菌株产蛋氨酸有关,COG0119被证实参与赖氨酸的生物合成[69]。研究还表明,干酪乳杆菌能分解甲硫氨酸合成半胱氨酸,这一代谢途径与细菌对胆盐抗性有关[70]。肠道微生物赖氨酸代谢通路被阻断会影响菌株的肠道竞争能力[71]。良好肠道耐受性是益生菌进入宿主肠道环境中生存并对肠道发挥益生作用的前提[72]。因此,这些特有基因可能与发酵乳杆菌和FXJCJ61和CECT5716的抗炎作用有关。
与上述分析一致,小鼠粪便样本中发酵乳杆菌的定量检测结果表明,与模式株发酵乳杆菌CECT5716相比,发酵乳杆菌FXJCJ61具有更强的肠道定殖能力(表2)。这个结果与发酵乳杆菌FXJCJ61对模拟胃肠道环境的高耐受性也一致(表3)。
细菌对低聚糖(如木聚糖)的利用可以促进其在宿主中抗氧化和免疫调节活性的发挥,利用更多碳源的能力与微生物的适应能力有关[73]。发酵乳杆菌FXJCJ61的基因组中含有多个涉及特定碳水化合物活性酶合成的基因(图S2)。此外,发酵乳杆菌FXJCJ61中发现了合成COG5416和COG5523的特有基因(表S4),这些基因或与内在膜蛋白相关,或功能有待进一步研究。
综上所述,本研究发现不同系统发育支系上的发酵乳杆菌对DSS诱导结肠炎的缓解作用具有菌株特异性。发酵乳杆菌FXJCJ61和CECT5716的缓解效果明显好于另外两株菌。菌株可能是通过抑制NF-κB信号通路来减少溃疡性结肠炎小鼠模型中炎性细胞因子的分泌和缓解疾病症状的。我们的研究进一步表明,发酵乳杆菌FXJCJ61和CECT5716基因组中存在的特定基因与其在结肠产短链脂肪酸及其对胃肠道环境的耐受性有关。这可能是发酵乳杆菌FXJCJ61和CECT5716对DSS诱导的结肠炎小鼠模型具有保护作用的原因。

















 京公网安备 11010502051620号
京公网安备 11010502051620号




