《1、 引言》
1、 引言
类风湿关节炎(rheumatoid arthritis, RA)的治疗策略是一经确诊立即根据疾病活动情况启动治疗,并以临床缓解为治疗目标[1‒3]。尽管生物制剂疗法在一定程度上提升了RA患者疗效,但仍有部分患者存在疗效应答不佳的情况[4];在中国仅10%的患者达到了临床缓解[5]。此外,由于缺乏反映RA疾病活动度和评估疗效的生物标志物,使RA的治疗决策主要受临床症状、副作用、患者偏好和药物经济成本的影响[6]。目前临床使用的炎性指标血沉(ESR)和C反应蛋白(CRP)反应了RA的疾病活动度,但两个指标均受年龄和性别干扰[7]。因此,探索新的RA药物治疗策略,发现可用于药效评价的生物标志物,是亟待解决的医学需求。
青藤碱(sinomenine, SIN)是从青风藤中提取的单体化合物,以青藤碱为主要活性成分的药物正清风痛宁已获得国家药品监督管理局批准用于治疗类风湿性关节炎,并列入中国国家医保目录,但其有效性和安全性仍需更多证据。在我们前期的研究中,甲氨蝶呤(methotrexate, MTX)和SIN的联合治疗显示出与MTX和来氟米特(leflunomide, LEF)相当的疗效,但副作用更小[8]。此外,根据包含10个随机对照试验(randomized controlled trial, RCT)的荟萃分析[9],发现MTX和SIN联合治疗比单独使用MTX更有效;SIN在联合使用中体现对RA治疗的优势,但仍然缺乏SIN单药治疗RA的有力证据。
调节精氨酸代谢可改变骨骼中的细胞代谢水平,进而影响关节炎进展[10‒11]。补充精氨酸被证实可减少骨骼中破骨细胞的数量,从而减少骨损伤[12]。SIN上调精氨酸酶1的基因表达水平,这可能减少精氨酸而产生抗关节炎效应[13]。为此,我们进行了一项为期24周的多中心、随机、安慰剂对照、双盲临床试验,以评估SIN在RA受试者中的有效性和安全性。我们同时假设SIN对精氨酸代谢有调节作用,在使用SIN治疗RA受试者的血清中检测精氨酸代谢相关的血清代谢物,如鸟氨酸、瓜氨酸和精氨酸等,可发现预测RA治疗应答的候选生物标志物。
《2、 方法》
2、 方法
《2.1 研究设计》
2.1 研究设计
本研究为一项多中心、随机、安慰剂对照、双盲、双模拟、为期24周的临床试验,由陆军军医大学西南医院牵头,协同重庆市长寿区人民医院、重庆垫江县中医院共同完成。本研究获陆军军医大学西南医院医学伦理委员会批准(2015-65),并完成了世界卫生组织(WHO)临床试验登记(No.ChiCTR-IPR-16008793)。所有临床参与患者均签署了书面知情同意书。
《2.2 研究人群》
2.2 研究人群
纳入标准:受试者年龄18岁以上;符合2010年美国风湿病学会(American College of Rheumatology, ACR)/欧洲抗风湿病联盟(European League Against Rheumatism, EULAR)RA的分类诊断标准[14];轻中度活动度患者,2.6<DAS28 (28-joint disease activity score) ≤5.1;至少一个月没有服用任何合成慢作用药物(conventional synthetic disease-modifying anti-rheumatic drug, csDMARDS)、生物制剂、SIN制剂或中药。
排除标准:血清天冬氨酸转氨酶或丙氨酸转氨酶大于正常上限的1.5倍;血清肌酐水平高于正常值上限;白细胞计数小于3.0×109 L-1;血红蛋白小于80 g∙L-1;或血小板计数小于8.0×1010 L-1;有严重的进行性心脏、肝脏、肾脏疾病或精神疾病的病史;其他自身免疫性疾病;急慢性感染;恶性肿瘤。
《2.3 随机化和盲法》
2.3 随机化和盲法
我们按照区组随机的方式对患者进行了随机分配。随机序列由世界中医药学会联合会医疗管理中心使用统计分析系统(SAS)软件生成,随机数字进行分装盲编,每6个序号为一区组,并对受试者和研究者双盲分配。根据受试者入选顺序给每个受试者分配一个药品编号,后根据药品编号从临床中心获取药品。研究人员、受试者和统计员对药物成分及干预措施不知情。
《2.4 治疗和结果》
2.4 治疗和结果
符合纳排标准的受试者按1∶1∶1分配如下治疗方案。SIN组:SIN缓释片120 mg,每日两次+MTX模拟片10 mg,每周一次;MTX组:SIN模拟片120 mg,每日两次+MTX 10 mg,每周一次;联合组,SIN缓释片120 mg,每日两次+MTX10 mg,每周一次,共24周。SIN由湖南正清药业集团有限公司(国家药品监督管理局Z20010174)提供,名称为正清风痛宁缓释片(ZQFTN)。正清风痛宁缓释片中SIN纯度均大于99.7%。模拟片和缓释片外观相同。
在24周内进行4次随访,时间分别为第0周、第4周、第12周和第24周。在这4个时间点对受试者进行查体、疗效评估、实验室安全性指标检查和不良事件记录。主要疗效指标为24周时达到ACR50标准和临床疾病活动指数(clinical disease activity index, CDAI)改善的受试者比例。次要疗效指标是24周达到ACR20标准或ACR70标准的受试者比例。
为了监测药物副作用,每次就诊都要进行生命体征检测、体格检查和实验室检查,包括血常规、尿常规和血液生化检查。在筛查期和第24周时进行心电图和胸部X射线检查。
《2.5 样本采集和制备》
2.5 样本采集和制备
每个研究随访时间点均采集受试者血清样本,保存在-80 ℃冰箱,3个治疗组135例受试者在4个访视点中采集221份血清样本。我们在前期研究基础上[15],增加了含羧基的其他羧酸标准品(即鸟氨酸和瓜氨酸),标准品均购自Sigma-Aldrich Laboratories公司(美国)和J&K Scientific公司(中国)。同时购买了来自Sigma-Aldrich Laboratories公司(美国)的5-(二异丙基氨基)戊胺(DIAAA)、1-羟基苯并三唑水合物(HOBt)、O-(7-氮杂苯并三唑-1基)-N,N,N´,N´-四甲基脲六氟磷酸盐(HATU)和三乙胺(TEA)。乙腈[CAN,液相色谱/质谱(LC/MS)级]和甲醇[MeOH,高效液相色谱(HPLC)级]均购自Anaqua Chemicals Supply Inc.,Ltd. (USA)。去离子水使用Millipore水净化系统(MilliporeCorp,美国)进行制备。MS级的甲酸和其他化学试剂由Sigma-AldrichLaboratories公司(美国)提供。
代谢物分析采用我们先前开发的超高效液相色谱-四极杆飞行时间质谱(UHPLC-Q-TOF/MS)方法[15]。简单来说,采用四倍体积的冷甲醇沉淀50 μL血清样品,然后在4 °C下以13 000 r∙min-1离心5 min。该过程重复两次,后合并上清液并在氮气流下干燥。将50 μL血清样品的残留物依次与5 μL含20 mmol∙L-1 HOBt的二甲基亚砜(DMSO),5 μL混合100 mmol∙L-1 DIAAA-TEA、200 mmol∙L-1 TEA的DMSO溶液,5 μL含20 mmol∙L-1 HATU的DMSO溶液进行混合,然后在室温下孵育1 min。最后加入35 μL ACN至终体积为50 μL,将1 μL直接注入UHPLC-Q-TOF/MS。
《2.6 UHPLC-Q-TOF/MS分析》
2.6 UHPLC-Q-TOF/MS分析
使用Agilent 1290 Infinity LC系统(UHPLC,美国)进行色谱分析,使用Waters ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm, 1.8 μm)分离代谢物。柱温保持在30 ℃,自动进样器设置在4 ℃。流速为0.3 mL∙min-1。注射体积为1 μL。流动相A和B分别为含0.1%甲酸的水和含0.1%甲酸的ACN,梯度设置如下:0~0.5 min,2%~5% B,98%~95% A;0.5~2.5 min,5%~6% B;2.5~4.5 min,6%~7% B;4.5~5.5 min,7%~7.3% B;5.5~7.5 min,7.3%~7.8% B;7.5~11 min,7.8%~9% B;11~13 min,9%~14% B;13~17 min,14%~23% B;17~19 min,23%~25% B;19~26.5 min,25%~35% B;26.5~28.5 min,35%~47% B;28.5~33 min,47%~60% B;33~35 min,60%~95% B;35~37.9 min,95% B;和38 min,2% B。
MS在配备正(POS)离子模式的电喷雾电离源(ESI)的Agilent6545精确质量Q-TOF/MS系统上进行。MS参数设置如下:干燥气体温度,300 ℃;干燥气体流量,11 L∙min-1;鞘气温度,325 ℃;鞘气流量,11 L∙min-1;雾化器压力,35 psig (1 psig = 6894.76 Pa);毛细管电压,3500 V;和喷嘴电压,500 V。衍生样品的质谱m/z范围为200~1000 Da。使用包含m/z 922.0098 (C18H18F24N3O6P3)的内部参考质量的低流量TOF参考混合物获得准确的质量测量。
《2.7 代谢物鉴定》
2.7 代谢物鉴定
采用MassHunter定性分析软件(中国安捷伦科技有限公司)进行原始数据挖掘。通过与相关标准的比较,确定具有相关标准的代谢物。其他的通过串联MS(MS/MS)光谱和Lipid Maps代谢物数据库、人类代谢组数据库1及METLIN代谢物和化学实体数据库2†进行了鉴定。使用GraphPad Prism 5.0版(GraphPad Software, USA)进行统计分析。
《2.8 统计分析》
2.8 统计分析
项目评价了SIN组、MTX组和SIN+MTX组的疗效和安全性。采用意向性(intention-to-treat, ITT)分析原则,以最小的和合理的方法剔除受试者,而在符合方案集(per-protocol, PP)中,根据24周观察期结束的受试者数据进行计算。对于主要疗效指标采用皮尔逊χ2检验进行二分变量分析。CDAI是疾病活动性的综合衡量指标,不包括ESR或CRP;因此,它适合于将新的生物标志物与现有的炎性指标如ESR或CRP进行比较。通过从基线到第4周、第12周和第24周的平均值的单向重复测量方差分析(ANOVA)来评估每组的次要疗效终点。
代谢物在群体辨别中的意义通过多因素的学生t检验进一步被测量。P值小于0.05被认为是显著的。使用Mann-Whitney U检验比较不同疾病活动组之间已识别的炎性生物标志物水平的变化。我们还通过Wilcoxon符号秩和检验比较了第4周、第12周和第24周的鸟氨酸、血沉和C反应蛋白水平。在4周、12周和24周后用标准化反应方法[SRM;平均变化除以变化分数的标准差(SD)]来评估对变化的敏感性。
《3、 结果》
3、 结果
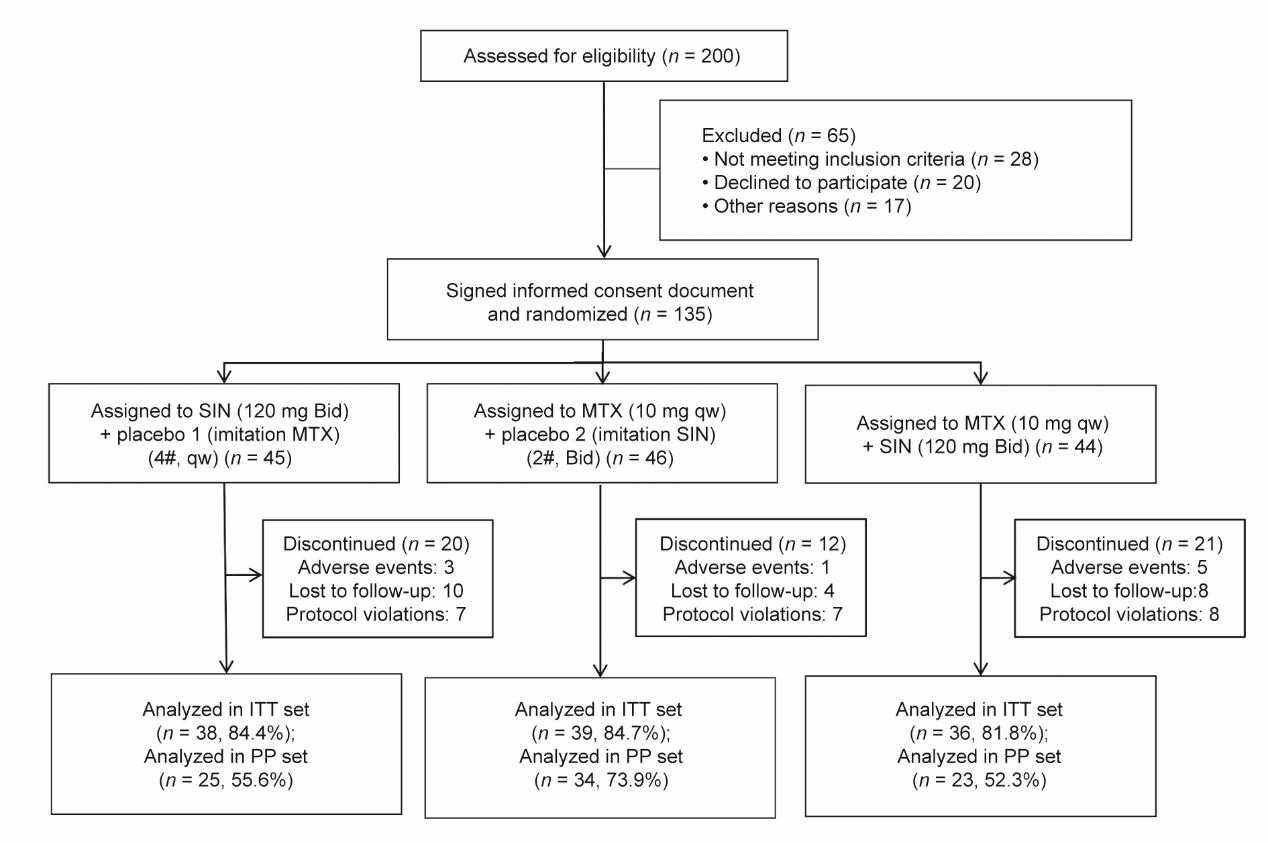
135例RA受试者按2010年ACR/EULAR标准随机分为SIN组、MTX组和SIN+MTX联合组[16]。最终,在ITT队列中分析了分别使用SIN、MTX和SIN+MTX治疗的38名、39名和36名受试者(图1)。三个治疗组的基线数据大体相似,具有可比性(附录A中的表S1)。
《图1》
图1 随机对照试验方案的流程图。Bid:一天两次;qw:一周一次。
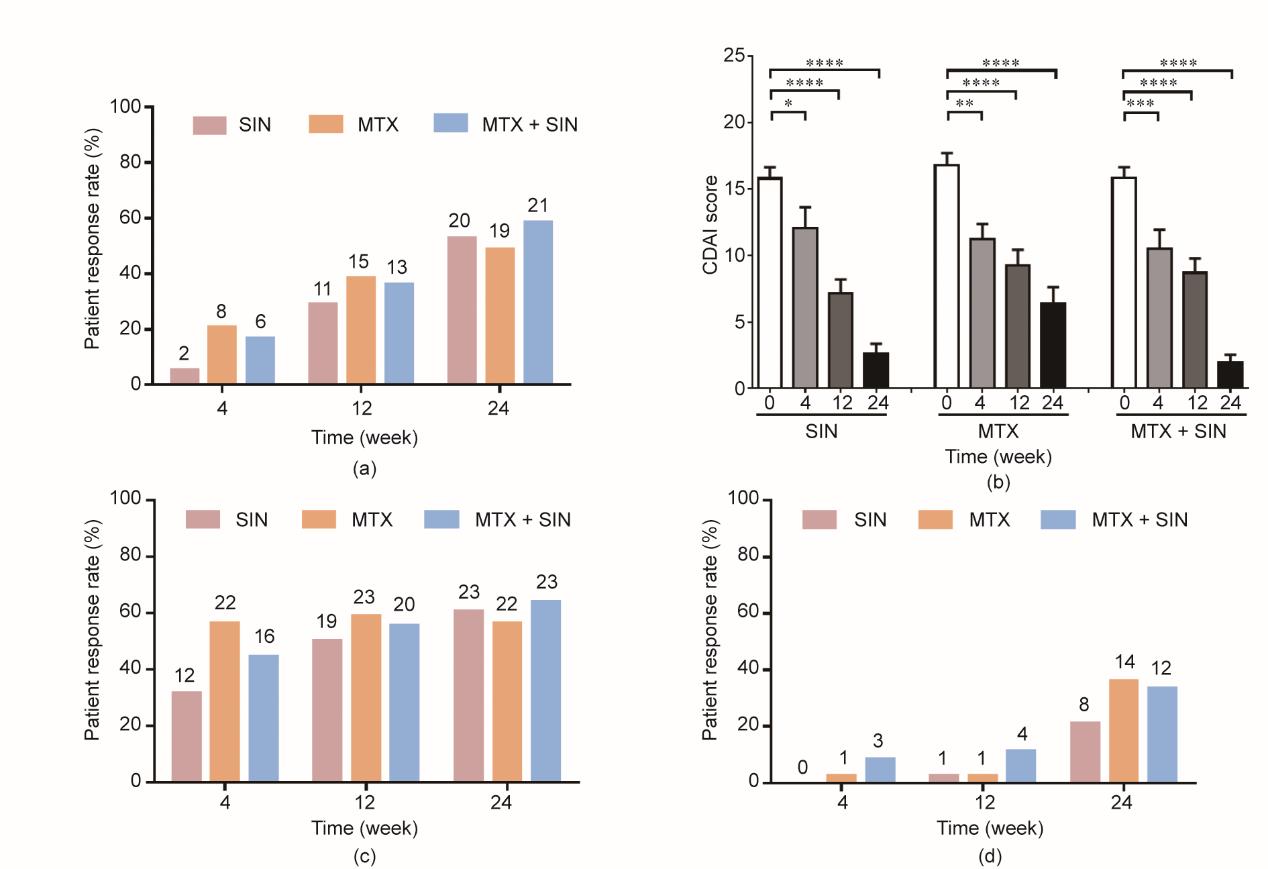
在24周时,ITT分析中SIN组、MTX组和SIN+MTX组分别有52.63%、48.72%和58.33%的受试者达到ACR50 [图2(a)]。随着治疗时间的延长,SIN、MTX和SIN+MTX的CDAI值均显著降低(P<0.0001)。24周时SIN组和SIN+MTX组CDAI评分均显著低于MTX组(SIN vs MTX: P<0.05; SIN+MTX vs MTX: P<0.01)[图2(b)]。ACR20和ACR70的次级疗效终点在24周达到,并在三个治疗组之间具有可比性,尽管SIN组的起效时间略慢于MTX组[图2(c)和(d)]。ACR评分的每个指标[压痛关节计数(tender joint count, TJC)28、肿胀关节计数(swollen joint count, SJC)28、健康评估问卷残疾指数(health assessment questionnaire disability index, HAQ-DI)、患者疾病活动总体评估(patient´s global assessment of disease activity, PaGADA)、医生疾病活动总体评估(physician´s global assessment of disease activity, PhGADA)、C反应蛋白和血沉]也有显著改善(表1)。类风湿因子(rheumatoid factor, RF)和抗环瓜氨酸肽抗体(cyclic citrullinated peptides, CCP)下降速度在SIN组和SIN+MTX组比MTX组更快(表1)。在PP分析中,SIN+MTX治疗组的ACR50有效率(86.96%)显著高于MTX组(55.88%),而与SIN组(72%)相当;这一发现表明,对于对MTX无效的患者,SIN和MTX的联合治疗可能是更好的选择(附录A中的图S1)。
《图2》
图2 各访视点的主要疗效指标和次要疗效指标受试者达标率。(a)三个治疗组类风湿关节炎患者ACR50治疗应答率;(b)三个治疗组四个随访时间点CDAI变化;(c)ACR20治疗应答率;(d)ACR70治疗应答率。*P<0.05; **P<0.01; ***P<0.001; ****P<0.0001。
《表1》
表1 三组RA受试者每次访视的临床表现和实验室指标
| Measures | SIN | MTX | SIN + MTX | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 week | 4 week | 12 week | 24 week | 0 week | 4 week | 12 week | 24 week | 0 week | 4 week | 12 week | 24 week | |
| TJC28 | 4.8 (2.6) | 4.7 (3.9) | 2.9 (2.7) | 1.4 (2.5) | 5.3 (2.7) | 3.4 (2.9) | 2.3 (2.6) | 2.4 (3.2) | 4.9 (2.3) | 3.9 (3.0) | 2.4 (2.5) | 1.0 (1.5) |
| SJC28 | 4.2 (2.9) | 3.6 (3.9) | 1.9 (2.7) | 0.9 (2.4) | 4.2 (2.4) | 2.7 (2.7) | 1.9 (2.7) | 2.4 (3.5) | 3.8 (2.1) | 2.6 (3.2) | 1.7 (2.3) | 0.9 (1.5) |
| HAQ-DI | 1.2 (0.8) | 0.8 (0.7) | 0.4 (0.5) | 0.3 (0.5) | 1.1 (0.7) | 0.6 (0.5) | 0.5 (0.4) | 0.3 (0.6) | 0.9 (0.7) | 0.7 (0.8) | 0.4 (0.5) | 0.2 (0.4) |
| Pain (mm) | 37.8 (13.1) | 28.2 (13.1) | 18.9 (12.0) | 9.7 (11.2) | 39.6 (13.5) | 29.3 (12.4) | 22.3 (10.8) | 15.2 (14.0) | 40.9 (14.6) | 27.5 (15.7) | 15.6 (8.2) | 5.4 (6.1) |
| PhGADA (mm) | 35.7 (11.7) | 26.6 (13.7) | 18.9 (12.0) | 11.3 (12.4) | 37.7 (11.9) | 28.1 (12.8) | 22.9 (11.0) | 14.7 (12.8) | 37.4 (15.9) | 25.8 (16.1) | 15.4 (7.6) | 5.4 (5.9) |
| PaGADA (mm) | 32.8 (9.0) | 26.1 (11.0) | 18.4 (11.7) | 10.7 (9.7) | 35.1 (10.8) | 25.7 (11.3) | 21.1 (10.5) | 14.1 (12.1) | 33.6 (9.9) | 24.7 (11.4) | 15.8 (7.6) | 5.4 (5.9) |
| CRP (mg·dL-1) | 21.7 (32.5) | 14.2 (19.0) | 3.9 (3.1) | 5.1 (5.0) | 21.3 (25.0) | 13.4 (14.7) | 11.2 (14.7) | 10.6 (14.4) | 20.8 (21.8) | 23.0 (40.4) | 11.8 (20.4) | 7.8 (13.9) |
| ESR (mm·h-1) | 30.8 (23.8) | 26.8 (20.5) | 18.4 (13.6) | 18.0 (12.8) | 27.4 (20.8) | 24.0 (20.9) | 23.3 (17.2) | 26.4 (19.9) | 26.5 (19.7) | 28.8 (23.4) | 20.5 (16.7) | 17.9 (13.7) |
| RF (IU·mL-1) | 323.1 (598.9) | — | — | 53.05 (58.34) | 278.5 (688.9) | — | — | 149.7 (424.1) | 199.3 (394.6) | — | — | 56.7 (67.9) |
| Anti-CCP (IU·mL-1) | 361.6 (826.3) | — | — | 139.0 (305.9) | 621.1 (1197.0) | — | — | 279.6 (255.6) | 412.0 (423.7) | — | — | 210.2 (255.6) |
| DAS28 (CRP) | 4.1 (0.7) | 3.6 (1.1) | 3.5 (0.8) | 2.3 (1.0) | 4.2 (0.7) | 3.5 (1.0) | 3.7 (1.0) | 2.8 (1.2) | 4.1 (0.7) | 3.5 (1.1) | 3.4 (1.2) | 2.2 (1.0) |
| DAS28 (ESR) | 4.4 (0.8) | 4.0 (1.2) | 3.2 (1.1) | 2.7 (1.2) | 4.4 (0.8) | 3.7 (1.0) | 3.2 (1.0) | 3.1 (1.2) | 4.4 (0.7) | 3.8 (1.2) | 2.9 (1.2) | 2.5 (1.1) |
本研究报告的主要不良反应是肝功能损害和胃肠功能紊乱。值得注意的是,SIN组肝病发生率(1/38)明显低于MTX组(10/39)和SIN+MTX组(8/36)(附录A中的表S2)。MTX组有14例受试者出现胃肠功能紊乱,明显高于SIN+MTX组和SIN组。SIN的主要副作用为皮疹和皮肤瘙痒。
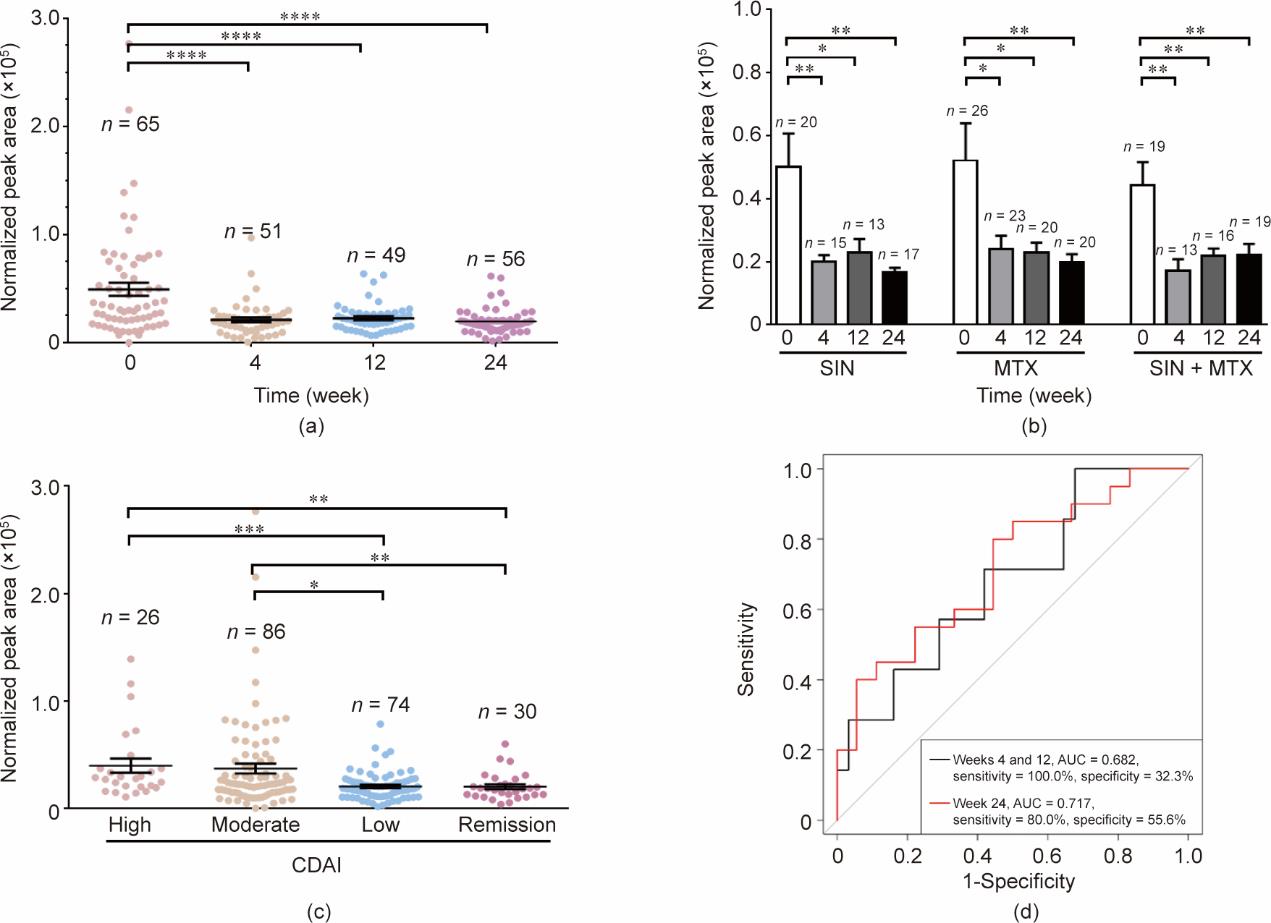
通过我们先前开发的UHPLC-Q-TOF/MS方法[15]获得的血清鸟氨酸、瓜氨酸和精氨酸水平与临床指标显著相关(附录A中的表S3),在治疗4周、12周和24周后鸟氨酸水平下降[图3(a)]。接受SIN、MTX和SIN+MTX治疗的受试者显示鸟氨酸水平显著降低,同时疾病得到缓解[图3(b)]。鸟氨酸的SRM反映了对疾病活动的反应程度,与CRP水平相当,高于ESR(附录A中的图S2)。
《图3》
图3 血清鸟氨酸水平作为炎症的生物标志物。(a)三个治疗组患者中治疗4周、12周、24周后鸟氨酸标准化峰面积水平;(b)SIN、MTX或SIN+MTX联用组三组组间鸟氨酸标准化峰面积水平;(c)不同CDAI水平下鸟氨酸标准化峰面积水平:高疾病活动(CDAI>22),中度疾病活动(10<CDAI<22),低疾病活动(2.8<CDAI<10),疾病缓解(CDAI<2.8);(d)鸟氨酸预测患者经24周治疗后达到ACR50治疗应答率的能力。*P < 0.05; **P < 0.01; ***P < 0.00;****P < 0.0001。
CDAI已被认为是比较鸟氨酸、血沉和C反应蛋白时最合适的疾病活动性的综合指标[17]。为了确定鸟氨酸是否反映CDAI水平,我们根据CDAI将样本分为4个亚组:高、中、低疾病活动或缓解。CDAI评分高和中等的受试者的鸟氨酸水平显著高于低活动度或缓解期受试者[图3(c)]。C反应蛋白水平和血沉也有类似的趋势(附录A中的图S3)。这些结果表明,鸟氨酸可以用来评估疾病的活动性。进一步分析发现,在24周达到ACR50的受试者中,39.1%的受试者在0周时鸟氨酸水平高于中位数,而只有20.0%的无应答者的鸟氨酸水平高于中位数。此外,我们使用怀卡托环境知识分析(WEKA)中基于相关性的特征子集选择方法(CfsSubsetEval)来检测鸟氨酸在治疗24周后达到ACR50的能力。根据受试者特征(ROC)分析,曲线下面积(AUC)为0.717,敏感度为80%,特异度为55.6% [图3(d)],支持血清鸟氨酸水平可反映治疗效应的结论。
《4、 讨论》
4、 讨论
在本研究中,我们首先通过一项前瞻性、多中心、双盲试验评估了SIN治疗RA受试者的疗效和安全性。然后,我们进一步确定了RA疾病缓解与鸟氨酸之间的相关性,这可能是SIN抗关节炎的潜在治疗机制。
SIN通常作为csDMARDs的补充治疗用于RA治疗[8];然而,几乎没有证据表明单用SIN对RA有积极作用。这是第一个关注SIN单药治疗效果的临床试验。根据主要疗效指标(ACR50和CDAI)和次要疗效指标(ACR20和ACR70),我们观察到从第4周到第24周治疗中SIN组与MTX组的疗效相当。这些结果表明在RA治疗中SIN是有效的植物抗风湿药。此外,PP分析结果显示SIN+MTX联合治疗组的疗效优于MTX组;联合治疗的不良事件发生率也较低,这表明对于患有轻度至中度活动性关节炎的RA受试者,SIN+MTX联合治疗可能优于单用MTX。
根据文献,与健康对照组相比,RA患者中与精氨酸代谢相关的氨基酸(包括瓜氨酸、鸟氨酸和精氨酸)升高[18‒19];且肌肉骨骼疼痛患者的鸟氨酸循环水平升高[20]。在本研究中,我们还发现了鸟氨酸与RA疾病活动之间的密切相关性,尽管这种相关性背后的可能机制尚未阐明。鸟氨酸来源于精氨酸,可在瓜氨酸、胶原蛋白或谷氨酸中代谢[21‒22]。瓜氨酸是肽精氨酸脱亚胺酶(PAD)翻译后修饰后的蛋白质,在遗传和细胞水平上都与RA密切相关;其抑制剂已在炎症性关节炎中显示出治疗效果[23]。瓜氨酸也可以进一步形成抗CCP抗体[24],因此推测鸟氨酸水平的升高可能会促进抗CCP的产生。此外,鸟氨酸在胶原蛋白合成和伤口修复中也很重要。RA可导致软骨和骨骼退化,呈慢性退行性状态,II型胶原蛋白是关节软骨中的主要和特异性分子[25]。因此,鸟氨酸水平升高可能与骨损伤的补偿或修复机制有关。谷氨酸亦与RA相关,据报道谷氨酸在RA患者滑液中的浓度增加了50倍以上[26],发现它可刺激肿瘤坏死因子-α(TNF-α)的表达[27]。鸟氨酸是谷氨酸的前体,因此鸟氨酸水平升高亦可能通过谷氨酸的作用影响TNF-α的表达。
SIN可以上调精氨酸酶1的基因水平[13],这可能促进精氨酸的减少,进一步下调鸟氨酸。我们的研究首次长期监测了SIN治疗24周中鸟氨酸水平的动态变化。血清鸟氨酸水平随受试者的CDAI评分而波动,疾病活动度高的受试者明显高于疾病活动度低或缓解的受试者。无论受试者是在SIN、MTX还是SIN+MTX组,第0周的鸟氨酸水平也可能预测受试者在第24周的治疗反应,提示SIN可能通过调节鸟氨酸影响RA的发展。
当然,本研究存在一定局限性。首先,研究样本量相对较小,没有采用中心实验室以避免不同医院之间的差异;此外,未评估X射线或磁共振成像(MRI)中评估骨破坏的放射学评分。
综上,本次研究首次提供了SIN单药治疗RA的有效性及安全性临床证据,结果表明,SIN的治疗效果与MTX相当,但副作用较后者少。同时,首次发现鸟氨酸水平与RA患者疾病缓解存在相关性,提示SIN可能通过调节鸟氨酸发挥潜在治疗作用。后续仍将通过进一步的深入分析来确认这种相关性。














 京公网安备 11010502051620号
京公网安备 11010502051620号




