《1. 引言》
1. 引言
人类的消化系统主要由口腔、食道、胃肠道,以及唾液腺、肝脏、胰腺等辅助器官组成。起源于消化道和辅助器官的消化系统肿瘤是目前最常见的癌症类型,包括食管癌、胃癌、结直肠癌(CRC)、肝癌和胰腺癌。其中,食管癌、胃癌、结直肠癌的发病率在全球恶性肿瘤中分别排在第八、第五、第三位[1]。胃癌和结直肠癌分别是全球第三大和第二大癌症相关死亡原因[2]。此外,肝癌和胰腺癌因确诊较晚且对治疗反应有限,是最致命的恶性肿瘤[3‒4]。总的来说,这些消化系统肿瘤占人类癌症发病率的25%以上,占癌症相关死亡原因的35%。因此,临床上亟需为这些癌症制定更加有效的治疗策略。
然而,开发新的治疗方法的主要障碍之一是缺乏能够很好地再现患者肿瘤特征的癌症模型。以往人们通过各种模型对消化系统肿瘤的发病机制和治疗策略进行了大量的研究。目前,患者来源的肿瘤细胞系(PDC)和肿瘤异种移植(PDX)是最常用的肿瘤模型。二维培养的PDC因缺乏肿瘤结构和微环境的特点,限制了其在临床前研究中的应用。虽然与PDC相比,PDX可以更好地模拟人类肿瘤生物学特性,但也存在成功率低、周期长等缺点。
近年来,三维(3D)培养技术已经被用于开发新的和更接近人类生理的癌症模型。值得一提的是,Sato等[5]利用单个LGR5+的干细胞成功建立了3D肠道隐管-绒毛结构,称为肠类器官。这项研究为其他消化系统类器官的建立奠定了基础。目前为止,研究者已经建立了大多数消化系统的类器官,包括结肠[6‒7]、肝脏[8]、胰腺[9]、胃[10]、唾液腺[11]、食道[12]。这些3D培养的类器官模拟了原始组织的组织学和遗传学特征,比PDC和PDX具有更多优势。因此,类器官已成为消化系统肿瘤研究的理想模型。本文中,我们讨论了类器官的建立方法及其在基础和转化研究中的应用。
《2. 消化系统类器官的建立》
2. 消化系统类器官的建立
《2.1. 类器官的细胞来源》
2.1. 类器官的细胞来源
理论上,类器官可以从含有干细胞的组织或结构中生成。目前,建立正常类器官的细胞来源包括多能干细胞(plurpotent stem cells, PSC)和成体干细胞(adult stem cells, ASC)(图1)[13‒15]。成体干细胞广泛存在于各种组织类型中,负责组织维护和损伤修复。例如,研究表明LGR5可作为各种消化道上皮细胞的干细胞标记物[16‒18]。在多种生长因子和其他刺激存在的情况下,组织来源的成体干细胞可以在3D基质中高效地生长为类器官。两种PSC——胚胎干细胞(ESC)和诱导多能干细胞(iPSC)——可以用来建立类器官。由于人类ESC既不方便获取也不符合伦理要求,在这里不作讨论。iPSC具有自我更新和分化的能力,已被广泛应用于正常的类器官构建。由于癌症类型和致癌突变的差异,不同患者来源的iPSC生成肿瘤类器官的效率不同。因此,iPSC来源的类器官通常需要选择性地培养为特定亚型,缺乏原始肿瘤的遗传异质性[19]。
《图1》
图1 消化系统类器官的构建。
《2.2. 一般步骤》
2.2. 一般步骤
从小鼠和人类成体组织中构建消化系统类器官的方法已经有大量研究报道[6,20‒22]。这里将大致步骤总结如下。首先,采集标本后,去除肌肉、结缔组织等多余组织。然后,将组织剪碎,并在温和的蛋白酶,如胶原酶或中性蛋白酶中进行消化。对于表达特异性干细胞标记物的单个干细胞,可以通过流式细胞术进行分选。接下来,将消化后的混合细胞或干细胞悬液包裹于3D细胞外基质(如Matrigel),该基质能够帮助细胞分化和进行空间组织,使其成为具有功能的类器官[23]。Matrigel凝固后,加入含多种生长因子、分化因子和细胞因子的类器官培养基。每3~5天更换一次培养基,单细胞一般可在1周内形成3D类器官结构。这些类器官可以进行连续传代和冻存,同时保持其形态特征和基因组稳定性。
PSC产生类器官的过程是紧密模仿胚胎发育的过程。该过程通常包括三个步骤:胚层诱导、组织特异性球体形成和类器官特化。由于消化系统均由内胚层来源的组织构成,因此内胚层形成对消化系统类器官的建成至关重要[24‒28]。在这一过程中,激活素A和骨形态发生蛋白4(BMP4)被用来诱导最终内胚层形成[29];然后添加一组生长因子来诱导前肠(WNT3A、FGF4、NOGGIN)或中/后肠(WNT3A、FGF4)分化。此外,在最后一天添加视黄酸,以诱导前肠内胚层的后续分化。经过以上处理,2~4天内可以观察到漂浮的3D球体的形成。最后,将球体重悬于Matrigel中,覆盖相应的类器官培养基[26]。
《2.3. 消化系统类器官的培养体系》
2.3. 消化系统类器官的培养体系
类器官培养体系由类器官培养基和细胞外基质(ECM)组成。该体系模拟了体内干细胞自我更新的微环境,支持干细胞的体外扩张和3D组织。
类器官培养基由各种生长因子、分化刺激因子和小分子化合物构成,是成功建立类器官的关键。所有的类器官培养基的基础成分一般包含:advanced DMEM/F12、青霉素/链霉素、HEPES、GlutaMAX、N2、B27、烟酰胺、N -乙酰半胱氨酸以及其他生长因子和抑制剂。尽管不同消化系统类器官的干细胞微环境的组成存在差异,但以下因子对大多数消化系统类器官的培养是必不可少的,包括受体酪氨酸激酶配体(EGF和FGF10)、Wnt激动剂(WNT3A和R-spondin)、BMP抑制剂(NOGGIN)和转化生长因子(TGF)-β抑制剂。此外,根据组织来源还需添加其他因子或抑制剂以促进类器官的扩增(表1)[6‒10,12]。
《表1》
表1 消化系统类器官培养基成分
| Tissue type | Source | Basal medium | EGF (ng·mL-1) | NOGGIN (ng·mL-1) | R-spondin 1 (ng·mL-1) | WNT3A (ng·mL-1) | Gastrin (μmol·L-1) | FGF10 (ng·mL-1) | Nicotinamide (mmol·L-1) | A83-01 (μmol·L-1) | Y-27632 (μmol·L-1) | SB202190 (μmol·L-1) | PGE2 (nmol·L-1) | Forskolin (μmol·L-1) | HGF (ng·mL-1) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Esophagus [ | Mouse | + | 50.0 | 1.0 × 102 | 1.0 × 102 | 1.0 × 102 | 1.0 × 105 | — | 10.0 | 5.0 × 105 | — | 10.0 | — | — | — |
| Stomach [ | Human | + a | 50.0 | 10% CM | 10% CM | 50% CM | 1.0 × 10-3 | 2.0 × 102 | — | 2.0 | — | — | — | — | — |
| Small intestinal [ | Human | + | 50.0 | 1.0 × 102 | 1.0 × 103 | 1.0 × 102 | 1.0 × 10-2 | — | 10.0 | 0.5 | — | 10.0 | — | — | — |
| Colon [ | Human | + | 20.0 | 1.0 × 102 | 1.0 × 103 | 50% CM | 1.0 × 103 | — | 10.0 | 0.5 b | — | 10.0 | 10.0 | — | — |
| Liver [ | Human | + | 50.0 | 25.0 | 10% CM | 30% CM | — | 1.0 × 102 | 10.0 | 5.0 | 10.0 | — | — | 10.0 | 25.0 |
| Pancreas [ | Human | + | 50.0 | 10% CM | 10% CM | 50% CM | 1.0 × 10-2 | 1.0 × 102 | 10.0 | 5.0 × 102 | — | — | 1.0 × 106 | — | — |
由于Wnt信号在维持消化道干细胞活性中发挥重要作用[30‒31],因此所有消化系统类器官培养基中均含有WNT3A和R-spondin。研究证明BMP信号通过抑制Wnt/β-catenin信号通路来抑制肠道干细胞的自我更新,因而BMP的拮抗蛋白是干细胞长期维持所必需的[32‒33]。表皮生长因子EGF与上皮细胞的增殖相关,是培养基的另一个重要组成部分。FGF10被证明在消化道发育过程中可促进细胞增殖、抑制分化,因此,其在胃、肝脏、胰腺类器官的培养中是必要的[34]。胃泌素能促进胃细胞增殖,在大多数消化系统类器官的培养基中也是必需的[35]。除以上生长因子外,类器官培养还需添加一组小分子化合物。Rho激酶抑制剂Y-27632可有效抑制单个干细胞的失巢凋亡,是有效建立肝脏类器官所必需的[6,36]。烟酰胺也称为维生素B3,被证明可以抑制乙酰化酶sirtuins的活性,促进人结肠类器官的形成[7]。研究证明TGF-β信号通路可抑制结肠上皮细胞增殖,促进细胞凋亡和分化[37‒38],因而在类器官培养基中加入TGF-β抑制剂A83-01以提高构建效率。P38抑制剂SB202190被发现可以提高接种效率,促进人结肠类器官的连续传代[39]。据报道,前列腺素E2(PGE2)可防止脱离诱导的细胞死亡和激活经典的Wnt信号通路,并被发现对人消化系统干细胞增殖是必要的[40]。
与二维培养系统不同,类器官培养需要ECM来辅助形成类似器官结构的空间排列和3D模式。ECM由大量具有不同物理和生化性质的成分组成,包括糖蛋白、蛋白多糖和多糖等[41‒42]。从小鼠肉瘤中提取的Matrigel是目前类器官培养体系中应用最广泛的ECM。Matrigel由多种细胞外基质蛋白组成,如胶原蛋白、层黏连蛋白、硫酸肝素蛋白聚糖等,能够为体外培养的细胞提供生理环境[43]。
《2.4. 类器官鉴定标准》
2.4. 类器官鉴定标准
目前,对于类器官的鉴定没有统一的标准。总结现有文献,鉴定类器官的通用标准是保留原始组织的形态和遗传特征。首先,类器官需具备起源组织的组织病理学特征,这些可以通过苏木精-伊红(H&E;)染色和免疫染色等组织学分析来识别。例如,肝脏类器官可以通过肝细胞标志物ALB和HepPar1来鉴别,胆管细胞类器官可以通过KRT19胆道标志物来鉴别。类器官还应保持起源组织的遗传特征,可以通过基因组和转录组测序等方法进行分析。我们相信,在以后的研究中,功能表征也应该成为鉴定类器官的一个必要标准。真实的器官功能再现能够实现类器官在再生医学中的应用。例如,在最近一项令人振奋的研究中,Sampaziotis等[44]建立的胆管细胞类器官可在移植后修复人胆管上皮。
《3. 消化系统肿瘤类器官的建立》
3. 消化系统肿瘤类器官的建立
正常消化系统类器官培养方法已成功应用于患者肿瘤组织来源的类器官培养。迄今为止,研究者已经成功建立了多种消化系统肿瘤患者来源的肿瘤类器官,包括食道[45‒46]、胃[10]、小肠[47]、结肠[48‒49]、肝脏[50]和胰腺[9,51]。一般来说,可以通过手术切除或活检获取肿瘤组织,建立肿瘤类器官。大部分肿瘤类器官的培养基成分与对应的正常类器官的培养基成分相同。然而,根据肿瘤样本特定的突变背景和异常激活通路,在缺失某些特定因子的情况下,消化系统肿瘤类器官通常能够更有效地生长。
食管癌可分为食管腺癌(EAC)和食管鳞状细胞癌(ESCC)两种亚型。已有研究成功从人EAC和ESCC组织中建立了食管肿瘤类器官[45‒46]。Li等[45]构建了EAC患者来源的类器官,再现了EAC的形态、转录组和基因组特征。Kijima等[12,46]利用小鼠食管类器官的培养基配方,从ESCC患者的活检组织中同时建立了肿瘤和非肿瘤类器官。
多项研究发现,在最优的培养条件下,正常类器官往往比肿瘤类器官生长更旺盛,这可能与肿瘤类器官基因组不稳定及其导致的细胞凋亡有关[48,50]。因此,可以通过对培养基进行调整,添加或去除某些因子,以促进肿瘤类器官的生长,抑制非肿瘤类器官的过度生长。例如,建立胃癌类器官时,若APC基因突变导致Wnt信号异常激活,则不需要加入WNT3A;若为RAS/MAPK信号通路突变,则不需要加入EGF;若有TGF-β信号通路突变则不需要加入A83-01 [6,10]。
结直肠癌是一种高度异质性肿瘤,不同患者的遗传改变、临床表现和预后各异。据报道,结直肠癌最常见的突变信号通路包括Wnt、RAS/MAPK、PI3K、TGF和TP53信号[52]。因此,研究人员利用不同亚型对培养因子需求的差异,有选择地扩增结直肠肿瘤类器官。Fujii等[49]从不同组织学亚型和临床分期的患者组织中建立了一系列结直肠肿瘤类器官。通过转录组分析对这些类器官进行鉴别,并根据对因子的不同需求进行选择培养。他们还证明,这些类器官能够很好地模拟原始肿瘤组织的组织病理分级和分化程度。
研究者通过使用特定的分离和扩增培养基,成功构建了原发性肝癌[包括肝细胞癌(HCC)、胆管癌(CC)和混合癌(CHC)]的类器官[50]。值得注意的是,为了避免非肿瘤类器官的生长,Broutier等[50]调整了正常肝脏类器官的构建方法:①延长组织消化时间;②调整培养基成分,去除R-spondin 1、NOGGIN和WNT3A,添加地塞米松和Rho激酶抑制剂。如上文提到,类器官也可从iPSC中获得,已有几项研究报道了利用iPSC建立肝脏肿瘤类器官。例如,Sun等[53]利用重编程的人肝脏细胞进行TP53、RB的失活,建立了肝脏类器官,然后通过基因过表达致癌基因c-Myc和RAS建立肝癌类器官模型。
多个研究团队已经成功建立了胰腺癌类器官[9,54‒55]。与肝脏肿瘤类器官相似,胰腺癌类器官可以从不同来源获得。手术切除的肿瘤组织是胰腺癌类器官的主要来源。Boj等[9]对小鼠与人的正常和胰腺肿瘤组织均建立了类器官模型。他们通过原位移植实验证明,这些胰腺肿瘤类器官完全模拟了肿瘤的发展进程:先是形成早期赘生物,进而发展为局部侵袭性和转移性肿瘤。另一团队报道,通过在iPSC来源的前体类器官中表达突变KRAS或TP53,成功建立了胰腺癌模型[51]。
《4. 类器官在消化系统肿瘤模型中的应用》
4. 类器官在消化系统肿瘤模型中的应用
《4.1. 宿主-病原体相互作用》
4.1. 宿主-病原体相互作用
与其他恶性肿瘤不同,消化系统肿瘤与病原性感染显著相关,如胃癌与幽门螺杆菌、胆囊癌与肠沙门氏菌、肝癌与肝炎病毒[56]。然而,病原体的感染和癌症进展之间的关系仍不甚清楚。将包含原始组织所有细胞类型的类器官与特定病原体共培养或进行感染实验,可以研究以上问题[57]。多项研究证明,胃类器官可以作为一种有效的幽门螺杆菌感染模型。如Bartfeld等[10]利用显微注射法将幽门螺杆菌注射至胃类器官,发现胃癌相关基因表达上调。在另一项研究中,McCracken等[26]证明,幽门螺杆菌感染胃类器官,导致c-Met显著激活,并促进上皮细胞增殖。Scanu等[58]利用小鼠胆囊类器官与肠道沙门氏菌共培养体系,研究病原体感染对胆囊癌发展的影响。他们发现,肠道沙门氏菌通过激活AKT和MAPK信号通路,诱导胆囊类器官出现不依赖生长因子的生长和恶性转化。也可建立类器官的病毒感染模型,用于研究病毒与肿瘤的关系。例如,Yin等[59]利用肠道类器官模拟轮状病毒感染并评估抗病毒药物效果。同样,也可以将肝脏类器官作为一个潜在的模型,研究病毒感染及其与肝炎病毒相关的肝细胞癌发展之间的联系。
《4.2. 类器官作为消化系统肿瘤进展模型的应用》
4.2. 类器官作为消化系统肿瘤进展模型的应用
肿瘤的起始和进展通常是肿瘤驱动基因突变逐渐积累的结果[60]。因此,破译肿瘤发展中的突变过程是非常重要的。目前,全基因组测序已经发现了消化系统肿瘤相关的大量基因突变[61]。然而,对于这些突变中的大部分,尚不能确定它们是否具有肿瘤驱动功能。以往的肿瘤发生研究主要基于肿瘤细胞系和动物模型。然而,从起源组织建立肿瘤细胞系的效率非常低,并且肿瘤细胞系不能完全保留原代肿瘤的遗传特征[62‒63]。虽然小鼠模型被广泛用于建立致癌突变模型,但建立转基因小鼠需要耗费较多的时间和资源,并且种间差异会影响实验结果的可靠性。
类器官能够在长时间的培养中保持遗传和表型稳定。CRISPR-Cas9是一种新型的基因组编辑工具,能够实现在特定基因组位点引入DNA双链断裂,使得基因修饰技术比以往的基因组编辑方法更加方便和高效[64]。CRISPR-Cas9和类器官技术的结合将极大地克服上述限制。近期已经有研究人员利用人类的正常结肠类器官建立了肿瘤的起始和进展模型。研究者利用CRISPR-Cas9技术,将结直肠癌中4个最常见的突变基因(APC、TP53、KRAS和SMAD4)依次引入正常结肠类器官。通过调节培养基中生长因子的组成来筛选获得突变体类器官。研究发现APC和P53的缺失是结直肠癌中染色体不稳定和异倍体产生的主要驱动因素[65‒66]。类似的,研究者利用CRISPR-Cas9介导的基因组编辑技术在人类胰腺导管类器官中建立了胰腺癌进展模型[54,67]。除了成体干细胞来源的类器官外,iPSC来源的类器官也已被用于消化系统肿瘤的起始和进展建模。上文提到,肝癌的起始可以通过对iPSC来源的肝脏类器官进行致癌基因或抑癌基因编辑来建模[53,68]。总之,类器官基因编辑技术将作为一种方便可行和高通量的工具,用以评估突变基因的功能。
《5. 药物开发和肿瘤个性化治疗》
5. 药物开发和肿瘤个性化治疗
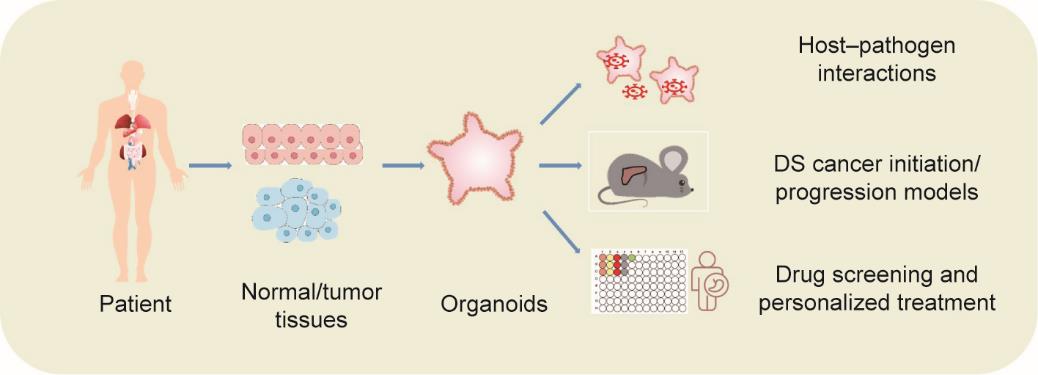
在过去几十年中,在传统肿瘤细胞系中筛选出大量抗肿瘤药物。然而,这些新发现的药物中的大部分在临床试验中未能达到预期效果[69‒70]。患者来源的肿瘤类器官保留了原始肿瘤的基因组、转录组和组织学特征,可以作为抗肿瘤药物筛选和测试的更好模型。研究证明,肿瘤类器官的药物敏感性与肿瘤组织的分子分型相匹配。例如,van de Wetering等[48]利用结直肠癌类器官检测一组化合物的作用,发现携带TP53突变的类器官对nutlin-3a(MDM2的抑制剂)具有抗性,而携带RAS突变的类器官对EGFR抑制剂不敏感;另外还发现携带RNF43 (Wnt通路的一种负性调控因子)突变的类器官对Wnt抑制剂超敏感。越来越多的研究表明类器官可以精准地预测患者对抗肿瘤药物的反应。最近,Vlachogiannis等[71]建立了患者来源的结直肠癌和胃食管癌类器官,并测试了这些类器官能否预测患者对抗癌药物的治疗反应。他们发现患者源性类器官(PDO)在预测患者对靶向药物或化疗的反应方面具有很高的预测价值(阳性准确率88%,阴性准确率100%)。最近的两项研究也报道了直肠癌类器官在预测患者对放化疗的反应中的成功应用[72‒73]。总之,以上研究有力地证明了PDO在临床试验中能够真实模拟患者的反应,为新模式的个性化医疗奠定了基础(图2)。
《图2》
图2 消化系统肿瘤类器官的构建和应用。
除了PDO能够有效预测患者反应外,将类器官用于药物开发的另一个主要优势是方便操作且节约成本,能够实现患者个性化的高通量药物筛选[74]。活体肿瘤类器官生物库可用于药物筛选,促进新药开发。目前为止,已经建立了结肠、胰腺、肝脏、胃等多种消化系统肿瘤的活体类器官生物库[48‒50,71‒72,75‒76]。例如,Leung等[76]建立了包含人胃癌多种肿瘤亚型的类器官生物库,通过测试类器官对顺铂和五氟类药物的反应,他们发现类器官与相应患者的药物反应一致。研究人员还利用胃癌类器官生物库进行了大规模的药物筛选,发现了新的潜在靶向药物。在一项胆道肿瘤(BTC)的研究中,Saito等[77]建立了BTC来源的类器官并进行了药物筛选,发现抗真菌药物阿莫罗芬和芬替康唑显著抑制BTC类器官的生长。
此外,严重的副作用是导致药物临床试验失败的主要原因之一。因此,类器官技术的另一个巨大的优势是,从患者身上可同时获得健康类器官和肿瘤类器官,有望实现专门针对肿瘤细胞而不损害健康细胞的药物筛选[78]。
《6. 免疫疗法》
6. 免疫疗法
虽然研究发现越来越多的抗肿瘤药物,但耐药性的产生往往导致治疗效果不佳。在这种情况下,通过激活患者自身的免疫系统来对抗肿瘤细胞的免疫疗法正在成为一种强有力的抗癌策略。然而,由于缺乏测试此类治疗效果的临床前模型,限制了免疫治疗的临床应用。研究者正努力探索如何将免疫系统整合到类器官的培养中。研究表明,可以利用共培养系统在类器官培养中加入免疫细胞。2017年的一项研究采用气-液界面的方法,将CD45+淋巴细胞与人结直肠癌类器官共培养,可维持存活长达8 d [79]。Neal等[80]采用类似的方法建立了保留肿瘤微环境的患者来源的肿瘤类器官。研究中,巨噬细胞、T细胞、B细胞、自然杀伤(NK)细胞、自然杀伤T(NKT)细胞等免疫细胞在共培养体系中成功存活了30 d。
类器官-免疫细胞共培养系统的成功建立为肿瘤免疫治疗研究提供了一个前所未有的模型。在共培养系统中,类器官中的肿瘤细胞能够为免疫细胞提供抗原特异性刺激。Dijkstra等[81]利用患者自身结直肠癌类器官和外周血淋巴细胞共培养来扩增肿瘤反应性T细胞。获得T细胞后,再检测其对相应的肺癌类器官的杀伤效率。Chakrabarti等[82]通过将小鼠来源的胃癌类器官与自体免疫细胞共培养,检测PD-L1检查点抑制的抗肿瘤效果。基于嵌合抗原受体(CAR)的治疗是另一种重要的免疫治疗策略。在2019年的一项研究中,Schnalzger等[83]使用患者来源的结直肠癌类器官测试了CAR改造的NK-92细胞的杀伤效率。在多种消化系统肿瘤类器官建立的基础上,类器官与免疫细胞的共培养系统可用于个性化免疫治疗策略的开发和评估,这将成为一种非常有价值的模型。
《7. 缺陷和展望》
7. 缺陷和展望
尽管类器官技术作为一种体外癌症模型展现出巨大潜力,但仍然存在局限性。首先,最明显的缺点之一是缺乏细胞类型的多样性,如缺乏间质、血管、免疫细胞和神经细胞,使其不能完全模拟复杂的肿瘤微环境。肿瘤微环境对肿瘤的发展和耐药性的产生有重要影响。未来的研究应该继续探索引入其他细胞类型的方法,如上述共培养系统。最近的一项研究中,Workman等[84]将iPSC来源的神经嵴细胞植入肠类器官,重现了正常的肠神经系统(ENS)。iPSC来源的神经细胞与类器官重组,成功地形成了类似于肠内ENS的神经胶质结构,并且具有神经元活性。此外,Ohlund等[85]成功建立了小鼠胰腺星状细胞与胰腺癌类器官的共培养体系。3D技术与类器官技术的结合为类器官在肿瘤微环境研究中的应用提供了新的机遇。最近,Kim等[86]将肿瘤细胞与基质组分进行3D重组,建立了多层的膀胱肿瘤“组装体”,再现了尿道上皮肿瘤的体内病理生理特征。类器官培养的另一个挑战是,肿瘤组织来源的类器官比正常类器官生长缓慢,导致污染的非肿瘤类器官过度生长。未来需要进一步探索以克服这一问题。如上文提到,Broutier等[50]通过调整正常肝脏类器官的构建步骤和培养基成分,建立了不同亚型的肝脏肿瘤类器官。最近有报道称,一些结直肠癌类器官在去除p38抑制剂的培养基中或在缺氧条件下[49]生长更旺盛,这表明正常类器官和肿瘤类器官之间,甚至肿瘤类器官之间存在很大差异。
目前,大多数类器官的培养需要小鼠衍生的细胞外基质替代物(如基质胶或胶原)作为支架来支持3D细胞生长。理想的组织支架不仅应该包含天然的细胞外基质蛋白,用于支持细胞的3D生长,还应具备生物相容性和可降解性。然而,小鼠来源的细胞外基质含有过于复杂的元素,如层黏连蛋白、IV型胶原和巢蛋白等。此类成分的不明确性可能会影响细胞活性以及对药物的反应[43]。因此,需要进一步的研究来开发更合适的细胞外基质替代物。
尽管存在缺陷,但类器官技术已经发展成为消化系统肿瘤研究中非常有前景的新的体外模型。目前为止,利用肿瘤患者的组织可有效地建立正常类器官和肿瘤类器官。这些类器官,特别是PDO在临床前模型的应用已被证明能够改善肿瘤治疗结果。未来,类器官技术的应用将极大地促进药物筛选和个性化医疗的发展,实现患者特异性药物反应的预测和个性化治疗。















 京公网安备 11010502051620号
京公网安备 11010502051620号




