《1、 引言》
1、 引言
大脑是全身最复杂的器官,由不同类型的细胞组成,是全身的“指挥中心”。除了神经元、星形胶质细胞、少突胶质细胞和神经胶质细胞外,大脑还具有自身的免疫细胞,如小胶质细胞。近年来的研究发现,大脑中的免疫细胞,包括大脑本身具有的免疫细胞和循环免疫细胞,在健康和疾病状态下都发挥着重要的功能[1]。例如,在胎儿向成人发育的过程中,脑部的小胶质细胞需要在CD69+ CD4+ T细胞的帮助下才能完成这一过程[2]。在疾病状态下,Hughes和Appel [3]的研究发现,小胶质细胞功能障碍可以通过髓鞘形成以减弱神经元和少突胶质细胞的活性,而髓鞘异常是神经系统疾病的标志。在神经炎症和神经退行性疾病中,包括帕金森病(PD)、多发性硬化症(MS)、阿尔茨海默病(AD)和亨廷顿病(HD),外周免疫细胞向脑部的迁移被认为是病理过程的开始。因此,应用免疫细胞的表型标记物是鉴定、识别和区分大脑中各种免疫细胞类型的关键。
脑部的小胶质细胞与外周单核细胞来源的巨噬细胞(MoDM)在病理条件下具有相似的形态和功能,Ter119是区分二者的独特标记物[4]。除表型外,功能分析也是研究脑部免疫细胞的重要方向。有研究表明,相同的免疫细胞可能在疾病的不同阶段发挥不同的作用。例如,在缺血性中风中,MoDM在急性期会增强促炎反应,但在慢性期却具有抗炎作用[5]。
为了满足对脑部免疫细胞表型和功能研究日益增长的需求,急需一种更全面、更精确、更高维的技术。然而,传统的免疫学技术,如荧光流式细胞分选术(FACS)在满足这种信息密集型需求方面存在较大的局限性。而新型的质谱流式技术(CyTOF)是一种高维度、高通量和单细胞水平的新型分析技术,可以同时检测多达100种参数。本文主要总结了CyTOF在脑部相关研究中的应用,探讨了CyTOF的技术基础、优缺点,并评价了其在脑部相关疾病临床诊断中的潜在应用。
《2、 CyTOF是一种系统分析细胞类型的强大技术》
2、 CyTOF是一种系统分析细胞类型的强大技术
《2.1 CyTOF的发展史》
2.1 CyTOF的发展史
CyTOF也被称为质谱流式技术,是一种通过金属结合来检测细胞表面和细胞内标记物的先进技术。该技术是由多伦多大学Bandura等[6]基于电感耦合等离子体质谱(ICP-MS)原理建立,用于检测流体中的元素物质。该技术使用金属元素组成材料(如镧系元素)作为探测材料,该元素在生物系统中含量极低,或几乎不存在。2011年,斯坦福大学的Bendall等[7]首次在免疫学领域采用了这种技术。Bendall等的研究使用了人骨髓单细胞悬液,分析了34个参数,揭示了人类造血系统疾病中存在的不同免疫细胞和药物反应。该技术自此被应用于免疫学研究,这项技术显著增加了检测参数的数量,并克服了使用传统FACS时出现的荧光基团重叠问题[6,8‒9]。CyTOF和FACS两种技术的的比较详见表1 [10] 。
《表1》
表1 CyTOF 与FACS之间的比较
| Feature | CyTOF | FACS |
|---|---|---|
| Detectable probe | Metal probe | Fluorescent probe |
| Compensation | No | Yes |
| Maximum detectable probes | Up to 50 (~100) | < 20 |
| Mixed sample | Yes (barcode) | Not common a |
| Protection from light | No | Yes |
| Fix before stain | Yes | No |
| Permeabilization | Yes | Only when staining intracellular marker |
| Data analysis | Relatively difficult | Relatively easy |
| Major data analysis software | Cytobank | Flowjo |
《2.2 CyTOF的原理》
2.2 CyTOF的原理
CyTOF主要基于飞行时间(TOF)质谱仪原理。TOF在测定离子的质量与电荷比方面非常准确。在采集过程中,所有的离子都通过一个已知强度的电场加速,并测量这些离子在已知距离内到达探测器所需的时间。离子越重,到达探测器的时间就越长。为了进行TOF测定,细胞被蒸发,只保留同位素。CyTOF是基于TOF原理开发的,使用抗体偶联到各种离子上,通过收集离子以确定偶联抗体的表达,进而识别由抗体定义的免疫细胞。
《2.3 CyTOF的三个主要优点》
2.3 CyTOF的三个主要优点
第一,CyTOF显著提高了检测参数的数量。在标记样本时,条形码(barcode)技术被应用于区分多达20个样品的混样。CyTOF操作要求每个样本在染色步骤之前都进行条形码标记,所有的样品都经过相同的染色、洗涤和破膜步骤。该步骤可以最小化样本之间由于上述处理产生的数据波动,以获得更一致、更准确的结果。同时,这种条形码技术的反卷积功能可以在很大程度上防止两个细胞之间的黏连,从而减少样品内出现双细胞情况[11]。此外,CyTOF在一个反应中使用的探针数量从18个(一般在FACS实验中用到的最多探针数量)显著增加到40~50个[6];在一些研究中,CyTOF可以包含多达100个通道[12]。由于各种免疫细胞类型是根据细胞表面标记物被识别和区分的,因此,CyTOF在检测同一样本时,通过使用更多的标记物使得其检测能力相较FACS技术扩大了4~5倍,并且在每个样本中可以应用更多的标记物以达到更加细分的效果[13]。例如,在人外周血单个核细胞(PBMC)中,自然杀伤(NK)细胞子集可定义为(CD45+CD3-CD19-CD20-CD14-HLA-DR-CD38+CD16+),髓系树突状细胞(DC)子集可定义为(CD45+CD3-CD19- CD20-CD14-HLA-DR+CD11c+CD123-)[13]。而当使用传统的FACS方法时,这些细胞标记物以及细胞活/死的染色就很可能占据了所有可用的检测通道,限制了使用相同样本对细胞功能标记物进行进一步研究。在功能上,NK细胞因其抗肿瘤活性已被用于治疗恶性肿瘤,在经分泌的各种细胞因子刺激后可能显著增加。由此,Vendrame等[14]使用CyTOF方法系统地研究了NK细胞受到细胞因子刺激后的改变。该研究除了记录典型的细胞表面表型标记和细胞功能因子之外,还加入了NK细胞受体(NKG2A、NKG2C和NKG2D)、自然细胞毒性受体(NKp30、NKp44和NKp46)和杀伤细胞免疫球蛋白样受体(KIR2DL1、KIR2DL2/L3/S2、KIR2DL3、KIR2DL5、KIR3DL1、KIR3DL1/S1和KIR3DL2)等标记。这些标记物可以用来研究在经不同细胞因子刺激后NK细胞产生的不同群体亚型[14]。类似地,Hansmann等[15]使用CyTOF发现了一种新的记忆B细胞亚群,即同时表达记忆型(CD27+)和幼稚型(CD24low, CD38+)标记物的表型;而这些新发现都依赖于CyTOF的极高检测能力。
第二,CyTOF显著降低了光谱重叠和背景噪声。正如Mazza等[16]所发现的,在使用多通道FACS方法时,必须考虑背景荧光和扩散误差,因为这些因素是增加可变性和降低准确性的主要原因。在CyTOF中,由于使用的抗体需偶联金属元素,如镧系元素,且这些元素组成在生物系统中很少或几乎没有表达,因此,CyTOF的背景通常接近于零。对于通道的重叠来说,重金属同位素之间的检测重叠一般被限制在2%以下[17],而传统FACS的光谱重叠为5%~100%。这是因为传统的FACS使用荧光素作为标签,这些分子的分子量范围较广,从小蛋白荧光素异硫氰酸酯(FITC)到大分子异藻蓝蛋白(APC)。不仅如此,每个荧光素都有自己的激发和发射波长[18]。而在CyTOF中,这些金属标签都具有相似的化学特征,因为它们同属于镧系元素家族,从而提高了整体敏感性[18]。尽管Takahashi等[19]的研究表明,在设计CyTOF检测通道时,仍需考虑在使用89Y、113In或115In时要进行高强度标记,因为这三种镧系元素的敏感性相对较低。但与传统的FACS方法相比,镧系元素的化学相似性仍然赋予CyTOF能够提供更准确数据的优势。
第三,CyTOF在细胞数量较少时,仍可以提供可靠的定量检测。Gadalla等[20]的研究发现CyTOF可以稳定地再现PBMC和肿瘤组织中的FACS数据,该研究为癌症临床试验的高维分析提供了超过35个参数指标。耶鲁大学的科学家的研究表明,这种高维技术可以从极其有限的样本量中,如1~2 mL的血液或小的活检片中揭示样本信息[13]。为了确定使用CyTOF可检测到的最小细胞数量,Yao等[13]通过连续稀释,使得细胞总数从1 × 106 mL-1降低到1 × 104 mL-1,分析了人外周血中不同免疫细胞类型,包括T细胞、B细胞、NK细胞、单核细胞、髓系树突状细胞(mDC)和浆细胞样树突状细胞(pDC)。研究结果显示,在不同细胞浓度的检测中,CyTOF可以检测到的免疫细胞比例与FACS的相同[13]。
《3、 CyTOF在健康和疾病状态下研究脑部细胞的具体应用》
3、 CyTOF在健康和疾病状态下研究脑部细胞的具体应用
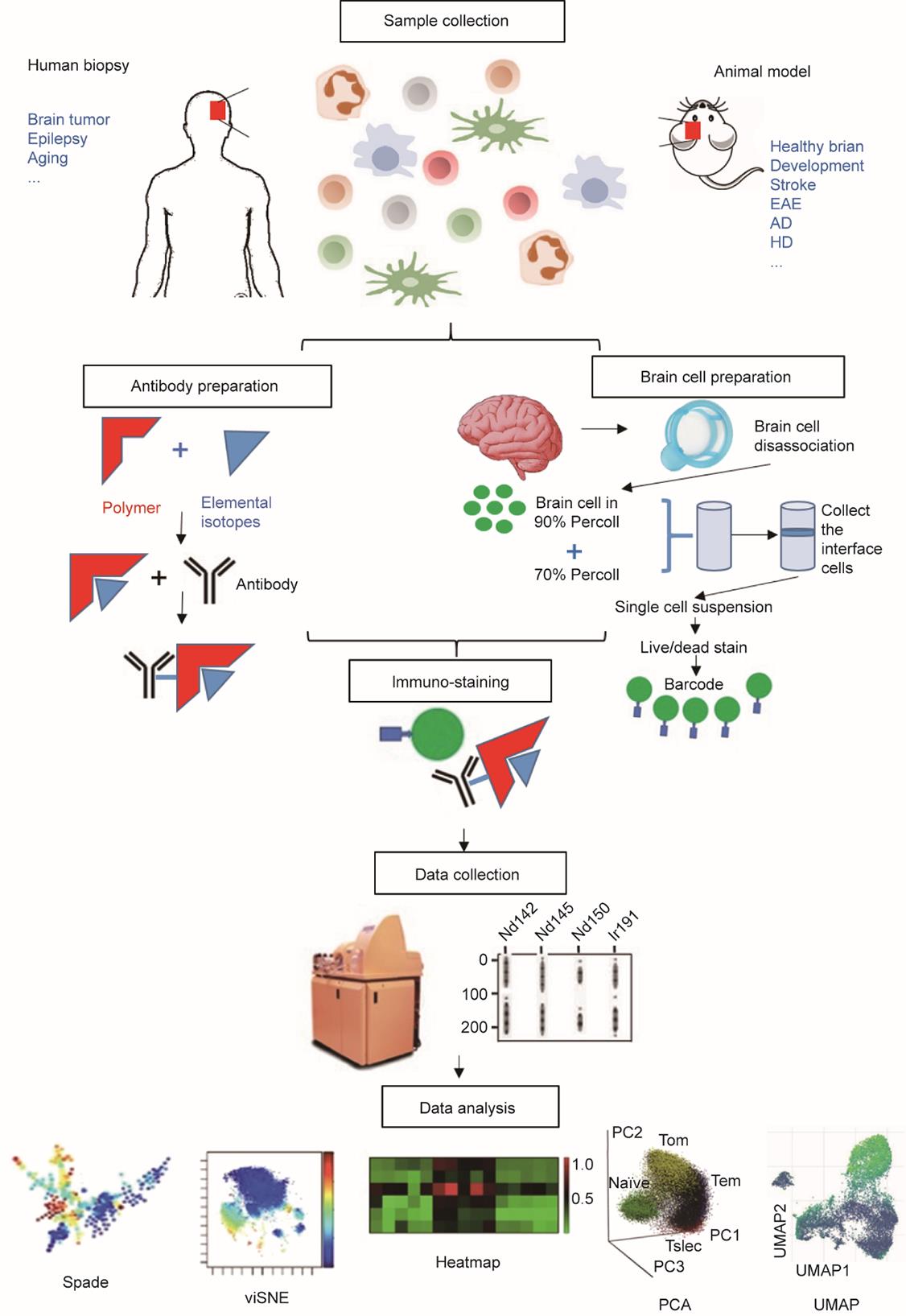
相较于传统FACS的荧光光谱重叠,以及有限的荧光参数检测能力,CyTOF的高维特征可以更好地检测脑部免疫微环境,以展示在健康状态及炎症状态、神经退行性疾病等不同病理条件下的脑内免疫细胞全景图(图1)。
《图1》
图1 质谱流式的实验流程。
《3.1 CyTOF在健康大脑免疫微环境中的应用》
3.1 CyTOF在健康大脑免疫微环境中的应用
在中枢神经系统(CNS)中,包括大脑、脊髓、视神经和视网膜,并不存在一个典型的淋巴引流系统。因此,大脑在传统上被认为是一个免疫豁免器官[21]。然而,越来越多的数据表明,脑部存在免疫细胞,且这些免疫细胞不仅能够预防感染[22‒23],而且在维持大脑的健康方面发挥着重要作用。
《3.1.1. 免疫细胞在健康大脑功能中发挥着关键作用》
3.1.1. 免疫细胞在健康大脑功能中发挥着关键作用
在健康的条件下,免疫细胞在维持大脑功能中起着关键作用。Brynskikh等[24]的研究表明,免疫细胞直接参与大脑的学习过程。具体来说,与野生型小鼠相比,免疫缺陷小鼠或适应性免疫缺失的小鼠学习能力显著降低[24]。此外,Ziv等[25]的研究表明,CD4+ T细胞有助于维持成人的神经信号传递和空间学习能力。还有研究表明,适应性免疫的正常状态对于维持心理活动并应对可能导致认知缺陷的不良因素起着重要的作用。例如,Kipnis等[26]发现T细胞清除的成熟小鼠出现了认知缺陷和行为异常,当T细胞得到补充后,认知得以恢复。值得注意的是,大脑的免疫细胞中不仅包括原驻的免疫细胞,即小胶质细胞,还包括浸润的免疫细胞。例如,Shechter等[27]报道,免疫细胞可以以一种稳定的方式通过脉管系统包膜进入大脑的免疫优势区域,并进一步发挥作用。此外,Louveau等[22]的研究发现,在脑膜中存在着持续的免疫监测。这些数据都表明,免疫细胞在正常状态下广泛存在于大脑中。
《3.1.2. CyTOF可检测健康大脑中的免疫细胞组成》
3.1.2. CyTOF可检测健康大脑中的免疫细胞组成
通常免疫细胞在健康大脑中的数量极低,导致了在健康的稳定状态下检测免疫细胞分群在技术上存在一定瓶颈。特别是使用传统的FACS方法时,这一缺陷尤为突出。随着新一代测序(NGS)技术的发展,科学家检测到了大脑中不同分区的免疫细胞基因表达谱[28];然而,测序的数据只显示了此类免疫细胞在转录水平上的基因变化,在蛋白质翻译水平上并不能提供有力证据。2017年,Korin等[29]使用CyTOF系统地检测了小鼠的脑部免疫细胞分群。他们通过使用44个细胞表面标记物,首次分析了大脑中的免疫细胞分群,其中包括T细胞、B细胞、NK细胞和DC细胞等[29‒30]。值得注意的是,通过比较大脑和外周血中免疫细胞的标记物表达,CD44被确定为脑浸润免疫细胞的标记物[29]。2018年,Mrdjen等[31]进一步证明,在正常中枢神经系统中存在大量的免疫细胞,主要包括脑内驻留的小胶质细胞和巨噬细胞、经典树突状细胞(cDC)、浆细胞样树突状细胞、B细胞、NK细胞和自然杀伤T(NKT)细胞等多种细胞类型。
《3.2 CyTOF可检测疾病状态下脑部免疫微环境》
3.2 CyTOF可检测疾病状态下脑部免疫微环境
来自内部或外部的刺激会引发大脑中炎症的发生,即为神经炎症。神经炎症的产生,使得脑部的免疫细胞组成及分布都发生了显著变化;然而,免疫组化技术或传统的流式细胞检测技术在少量样本中识别不同类型免疫细胞的能力有限。通过CyTOF检测技术,可以全面绘制神经退行性病变和神经炎症过程中的免疫细胞全景图谱。
《3.2.1. CyTOF在神经退行性疾病研究中的应用》
3.2.1. CyTOF在神经退行性疾病研究中的应用
基于免疫细胞蛋白质组图谱[6,32],Becher等[32]使用CyTOF在神经退行性病变小鼠模型中深入鉴定了不同种类的免疫细胞。该项研究确定了中枢神经系统在稳态时的免疫景观。结合功能分析,最终确定了一个位于中枢神经系统区域的免疫细胞亚群,即中枢神经系统边界相关巨噬细胞(BAM),该细胞亚群可以通过CD38和II类主要组织相容性复合体(MHCII)来区分[32]。此外,他们还通过多种细胞表面标记证实了小胶质细胞、树突状细胞和单核细胞在大脑中作为独立群体的存在。这些数据后来被Mrdjen等[31]和Korin等[29]证实,他们通过比较来自稳态和疾病状态下的数据揭示了更多的免疫细胞分群。研究表明,活化的小胶质细胞表达更高水平的CD11c和CD14,而CD86和CD44分子的表达水平没有变化,相反程序性死亡配体-1(PD-L1)表达下调[31]。同时,该研究还发现活化的小胶质细胞MHCII的表达也略有增加,而其稳态检查点标记物,即趋化因子受体1(CX3CR1)、Mer酪氨酸激酶(MerTK)和唾液酸结合免疫球蛋白样凝集素-H(Siglec-H)的表达降低[31]。在多发性硬化(MS)以及小鼠自身免疫性脑髓炎(EAE)模型中,Mrdjen等[31]报道,大脑内存在的大多数浸润细胞是外周单核细胞来源的免疫细胞,其次是T细胞。通过表型激活分析发现该动物模型中脑部的小胶质细胞是最活跃的一群细胞[31]。此外,与AD动物模型的免疫反应相似,在EAE模型中,小胶质细胞稳态检查点标记物CX3CR1、MerTK和Siglec-H的表达同样减少,而CD86、PD-L1和CD44的表达增加。同时,与EAE模型相比,AD小鼠模型中CD14的表达水平降低,而Sca-1的表达水平升高[31]。
在另一项研究中,Ajami等[33]通过应用CyTOF在小鼠EAE模型中发现了三种新的CD11b+脑髓系细胞群,并将这三个细胞群分别命名为A、B和C。值得注意的是这些髓系细胞群只在大脑中发现,而在外周血中不存在。这三个细胞群都表达经典的CD45、CD11b、CD317和CD39等相关分子。通过分析发现,B细胞群和C细胞群也表达MHCII和CD86。然而,A细胞群却为MHCII和CD86阴性。众所周知,MHCII和CD86是髓系细胞活化标志物[34],以上实验表明除A细胞群外,B和C细胞群是被激活的小胶质细胞群[33]。转录因子和信号分子是用来检测信号表型的标记物,如磷酸化的转录因子信号传导及转录激活蛋白 STAT(pSTAT1、pSTAT3、pSTAT5)、磷酸化环磷酸腺苷(cAMP)、磷酸化反应元件结合蛋白(pCREB)、磷酸化激酶(pMAPKAPK2)和核因子-κβ(NF-κβ)。Ajami等[33]的研究显示B和C细胞群高表达这些信号蛋白,而A细胞群并不表达。因此,该结果进一步证实了群体B和C确实是高表达免疫激活分子的活跃亚群。为了深入研究这三种细胞群的功能,他们使用了HD模型小鼠及ALS模型小鼠进行了深入研究[33,35]。在HD小鼠模型中,三种细胞群在疾病进展之前,以及疾病进展期间都可以被检测到。此外,在HD进展过程中,A和B细胞群的数量逐渐增加,而C细胞群的数量则一直保持在较低水平。在肌萎缩侧索硬化(ALS)小鼠模型中,小鼠脑部小胶质细胞的数量与HD模型中小胶质细胞数量增加趋势一致[35]。综上,通过CyTOF可以检测到多种免疫细胞的活化状态,特别是三组不同的小胶质细胞亚群(A、B、C)。在神经退行性疾病中,三类小胶质细胞亚群的表型与在稳态下表现出显著的不同,这些数据为脑部免疫细胞的相关研究提供了深入的参考信息。
CyTOF是鉴定新的细胞亚群的重要方法。例如,Willis等[36]使用CyTOF在小鼠MS模型中鉴定出一种独特的CD8+ T细胞亚群。 Guilliams等[37]开发了一种有效的标准流程,用来鉴别多种小鼠组织(如肺、脾、肠、肾脏、肝脏和大脑)中的DC细胞分群。该数据揭示了人和小鼠组织中DC细胞的异质性,而这些信息在传统FACS技术的使用中一直未能被明确定义[37]。
《3.2.2. CyTOF可用于系统研究缺血性脑卒中诱发的神经炎症》
3.2.2. CyTOF可用于系统研究缺血性脑卒中诱发的神经炎症
中风是导致人类死亡的主要原因之一,每年全球约有620万人死于中风[38]。缺血性中风是最常见的急性脑血管疾病,约占全球中风病例的80% [39]。缺血损伤可导致如微血管衰竭、血脑屏障损伤、氧化应激和脑水肿等多种神经功能缺损[40]。死亡神经元释放损伤相关分子(DAMP),DAMP进一步引起了缺血半脑的神经炎症[41]。这种局灶性脑炎加重了继发性脑损伤,进而诱发更严重的脑内炎症[42]。经过二十多年的研究,人们普遍认为神经免疫反应在缺血性脑卒中后的组织损伤和愈合过程中都起着关键作用[43]。
既往研究发现,多种免疫细胞与缺血诱导的脑炎相关,如脑部的小胶质细胞[44]、浸润T细胞[45‒49]、单核细胞[5,50]、NK细胞[51]及中性粒细胞[52]。为了探索不同T细胞亚群的功能,联合免疫缺陷(SCID)小鼠、CD8+ T细胞缺陷小鼠(B6.129S2-Mapk9/J)和CD4+ T细胞受损小鼠(B6.129S2-H2/J)模拟了缺血性脑损伤,即大脑中动脉闭塞手术(MCAO)。术后两天,野生型小鼠的脑梗死面积显著大于CD8+ T细胞或CD4+ T细胞缺陷型小鼠,这表明T细胞直接影响了卒中引起的脑梗死[49]。此外,Gu等[49]对辅助性T细胞(Th)1损伤小鼠(B6.129S2-Mapk9/J)、Th2损伤小鼠(C57BL/6-Il4/J)及调节性T细胞(Treg)受损小鼠(B6.129X1-Ebi3/J)进行了同样的大脑中动脉手术,结果表明Th1损伤小鼠脑梗死减少,而Th2损伤小鼠脑梗死加重。这些结果提示Th1+ CD4+ T细胞具有促炎功能,而Th2+ CD4+ T细胞具有抗炎功能。
除T细胞外,浸润性免疫细胞,如单核细胞、B细胞和中性粒细胞,也发挥着重要的作用。Fang等[5]研究表明,在MCAO后的急性期,趋化因子受体2(CCR2)敲除小鼠的脑梗死面积更小,死亡率更低,而CCR2主要负责单核细胞向大脑的迁移。Gan等[51]比较了Rag2敲除小鼠(缺乏T、NKT和B细胞)与Rag2和γc双敲除小鼠(缺乏T、NKT、B和NK细胞)在MCAO术后脑梗死面积,该研究发现双敲除的小鼠具有更小的梗死面积,进而证明了NK细胞也参与了脑梗死引起的神经炎症反应。此外,中性粒细胞也参与了中风诱导的神经炎症[52]。Myosin1f是一种免疫细胞迁移相关基因,在中性粒细胞中高表达[53]。前期研究[52]发现,与野生型小鼠相比,Myosin1f敲除小鼠具有更小的脑梗死面积,提示了中性粒细胞在卒中引起的神经免疫反应中的重要作用。
然而,由于通道数量的限制,传统的FACS技术不能在同一样本上整合这些免疫细胞变化相关的多种信息,而且传统的FACS技术也不能提供中风诱导的神经炎症的全景图[46]。因此,CyTOF无疑是系统地揭示免疫反应图谱的更好选择。基于FACS通道的设计,本文设计了一个金属偶联的CyTOF染色方案,检测了卒中小鼠模型在不同时间点、不同组织(大脑、外周血、脾脏、骨髓)中的免疫细胞分型。量化了MCAO术后第1天至第14天内这些器官中的免疫细胞数量。利用CyTOF,还对同一缺血半脑中的免疫细胞进行细胞数量的定量计数,为了更好地诠释免疫细胞在组织间的相互作用,首次应用R语言分析了来自大脑、外周血、脾脏和骨髓的免疫细胞之间的网络,进而分析这些免疫细胞在不同器官和不同时间框架之间的联系。本研究的数据显示,在缺血性中风后的一天内,全身的免疫细胞已经“连接” 在一起,这表明中风引起了一种全身性的免疫反应,而并不局限于脑部。这一研究成果有利于更好地从多器官、跨时间角度了解脑卒中诱发的神经免疫,并为脑卒中临床治疗提供了新的思路[54]。
《3.2.3. CyTOF在脑肿瘤研究中的应用》
3.2.3. CyTOF在脑肿瘤研究中的应用
在20~39岁的年轻肿瘤患者中原发性和转移性脑肿瘤是第三位常见肿瘤。目前标准的治疗方法,如手术、化疗和放疗仍有许多局限性,患者的中位生存期仅为5~7年[55‒56]。此外,高度免疫抑制性的肿瘤微环境(TME)导致只有极少数的患者可以从免疫治疗中获益。一项程序性死亡受体-1(PD-1)阻断剂治疗复发性胶质母细胞瘤(GBM)的临床试验(NCT02017717)结果表明PD-1并不能有效延长患者生存时间[57‒58]。作为具有高度异质性的组织,脑部肿瘤免疫微环境不仅包含大脑特有的小胶质细胞,还包括来自外周浸润的各种免疫细胞。因此,确定脑肿瘤的免疫特征有助于理解肿瘤细胞和免疫细胞之间的相互作用,以预测免疫治疗的效果[59]。
为了识别肿瘤特异性的浸润免疫细胞,Becher等[32]使用了两套CyTOF染色方案,一共74个参数,标记了38个临床胶质瘤、脑转移瘤(BrMs)和非肿瘤癫痫标本,对免疫细胞进行了综合评估。他们的研究结果显示,胶质瘤和脑转移瘤有不同的肿瘤免疫微环境。肿瘤相关巨噬细胞(TAM)是神经胶质瘤中的主要免疫细胞,而肿瘤浸润淋巴细胞(TIL)是存在于大脑中的主要免疫细胞。Kiss等[60]的研究发现,肿瘤免疫微环境可以影响肿瘤相关巨噬细胞的可塑性和极化状态。Friebal等[55]使用CyTOF研究发现肿瘤相关巨噬细胞由一种特定类型的肿瘤所驱动。例如,在脑胶质瘤中,CD206+单核细胞来源的巨噬细胞促进了肿瘤内免疫抑制微环境的形成,特别是在世界卫生组织认定的II级和III级肿瘤中。Fu等[61]通过CyTOF证实,在原发和复发的脑胶质瘤中,小胶质细胞与巨噬细胞(GAM)是主要的免疫细胞,并具有免疫抑制的特征。为了研究胶质瘤免疫图谱的变化,在2018年,Alban等[62]通过CyTOF分析了259例脑胶质瘤患者的血液样本。结果显示,在新诊断的胶质瘤患者中,骨髓源性抑制细胞(MDSC)随着时间的推移而减少。此外,低级别胶质瘤患者外周血中的MDSC越少,其生存时间越长[62]。Alban等[62]进一步检测了在脑胶质瘤发生发展过程中,其外周血中免疫细胞的变化,发现脑胶质瘤患者血液中非免疫抑制作用的Treg的细胞数量显著增加。此外,Khalsa等[63]通过CyTOF发现,在小鼠脑胶质瘤的模型中,肿瘤中有大量耗竭的CD8+ T细胞和驻留巨噬细胞,而具有较少的嗜酸性粒细胞和Siglec-F+巨噬细胞。该实验还发现脑胶质瘤患者的肿瘤浸润性免疫细胞(TIIC)表型与患者的血液淋巴细胞中免疫细胞分型具有显著差异[63]。
除脑胶质瘤之外,CyTOF还被应用于弥漫性星形细胞瘤(DA)和少突胶质细胞瘤(OG)。Fu等[64]用33个标签分析了10个弥漫性星形细胞瘤和4个少突胶质细胞瘤临床样本的免疫细胞分型。实验表明,在弥漫性星形细胞瘤中肿瘤相关的小胶质细胞和巨噬细胞比在少突胶质细胞瘤中具有更高的免疫抑制性。此外,PD-1+ CD8+ T细胞、T细胞免疫球蛋白-3(TIM-3)+CD4+ T细胞和Treg在弥漫性星形细胞瘤中均升高,这可能进一步促进了免疫抑制环境的形成。值得注意的是,之前CyTOF相关研究的数据表明,在各种脑肿瘤中小胶质细胞和外周浸润的巨噬细胞是免疫细胞的主要成分。因此,探究脑部相关巨噬细胞的功能将有力地推进对脑肿瘤免疫微环境的认识。
《3.2.4. CyTOF在癫痫研究中的应用》
3.2.4. CyTOF在癫痫研究中的应用
据估计,全世界有超过1050万儿童患有活动性癫痫[65]。既往研究表明,神经炎症在癫痫的产生和惊厥性疾病中起着关键作用[66]。Owens等[67]使用20种抗体标记物,检测了10名儿童癫痫患者的脑浸润淋巴细胞,通过CyTOF进行分析。他们的数据表明,在所有病例中均检测到活化T细胞的存在,其中涉及CD4、CD8和γδ T细胞,表明那些有严重癫痫发作的儿童患者已经发生了自身免疫反应。利用CyTOF高通量的优势,他们进一步表明,Treg存在位置很局限,而活化的效应记忆性CD4+ T细胞(CD45RO+、HLA-DR+和CD69+)在所有的脑浸润淋巴细胞中都存在。此外,这些细胞还表达C-X-C基序趋化因子受体3(CXCR3)和C-C趋化因子受体5(CCR5),表明切除的致痫性脑区释放了趋化因子来吸引免疫细胞浸润[67]。
《4、 CyTOF在小胶质细胞研究中的应用》
4、 CyTOF在小胶质细胞研究中的应用
小胶质细胞数量占成年中枢神经系统细胞数量的10%。在胚胎期,小胶质细胞的异质性达到最高点,而这种异质性在新生儿、幼年和成年期逐渐降低[68]。作为大脑中常驻的免疫细胞,小胶质细胞在大脑发育、内稳态、神经炎症、神经退行性疾病和精神疾病中都发挥着重要作用[68‒69]。在健康状态下,小胶质细胞主要发挥促进神经元发育、修剪突触、清除死亡细胞等功能[70]。当疾病发生时,小胶质细胞对环境改变做出相应反应并变得活跃,进一步提高了它的异质性[68]。与其他免疫细胞相比,小胶质细胞是患病脑组织中最主要免疫细胞类型[71]。具有高度多样化的功能,使得小胶质细胞成为大脑中最异质的细胞类型之一。
由于小胶质细胞高度异质性的特点,在单细胞水平上分析此类细胞是首选的方案。利用单细胞RNA测序,Sankowski等[71]和Masuda等[72]研究了小鼠和人类小胶质细胞的时空异质性。他们的数据显示,在小胶质细胞中,多种基因在发育和疾病阶段受到不同的调控。他们还发现,在MS [72]和GBM [71]中,小胶质细胞的RNA表达异常。随着CyTOF的发展,该技术在单细胞蛋白水平上提供免疫分子相关通路的信息[68]。具体来说,Mrdjen等[31]和Ajami等[33]采用了实验动物EAE和ALS小鼠模型,并报道小胶质细胞在疾病不同阶段的细胞表面标记物和功能标记物的表达都发生了显著变化。此外,CD44可以作为区分脑部固有的免疫细胞和外周血来源的免疫细胞标记物。为了进一步了解人类小胶质细胞的异质性,Bottcher等[73]应用CyTOF检测了来自人大脑5个不同脑区的小胶质细胞中57种标记物的表达。该项研究的数据显示,一些标志物的高表达与小胶质细胞的激活密切相关,如在疾病发生时表达上调的CD68、CD86、CD45和CX3CR1等分子。此外,这些标记物的表达具有高度的空间依赖性,与其他脑区相比,它们主要在丘脑中表达[73]。2019年,Sankowski等[71]通过结合单细胞测序和CyTOF的研究发现,与胶质瘤相关的小胶质细胞与疾病发生发展联系紧密。通过数据富集分析,最显著的变化是炎症反应(包括白细胞的细胞间黏附、干扰素IFN-γ的应答和免疫细胞的吞噬功能)以及氧化应激[71]。此外,他们的数据指出,人脑胶质瘤中的小胶质细胞的代谢发生了变化 [74]。例如,小胶质细胞中载脂蛋白E(APOE)的表达在神经退行性疾病中发挥重要作用,特别是在调节小胶质细胞表型方面[75]。然而Sankovski等[71]发现在胶质瘤中,肿瘤相关的小胶质细胞APOE的表达不受调控,这进一步表明脑疾病相关小胶质细胞的脂质代谢可能与其活化状态密切相关。
《5、 SynTOF——CyTOF在脑突触研究中的应用》
5、 SynTOF——CyTOF在脑突触研究中的应用
SynTOF是一种将CyTOF应用在脑突触研究中的技术,SynTOF尤其有助于理解脑部神经元突触的组成。众所周知,神经元突触在神经信号传递中起着不可或缺的作用;然而,由于神经元突触具有较高的复杂性和异质性,所以研究该种细胞的生物标记物具有一定的挑战性。Grjera等[76]率先采用CyTOF来研究人的突触体,并首次将这种方法命名为SynTOF。他们用突触小体的特异抗体进行单细胞染色。其染色组分主要包括脑细胞特异性抗体,如CD11b、CD56、CD298、胶质纤维酸性蛋白(GFAP)以及髓鞘碱性蛋白(MBP)和突触特异性抗体[如CD47、多巴胺转运体(DAT)、去甲肾上腺素转运体(NET)和谷氨酸转运体(GT)[76]。该标记的组成还包括一些功能标记物,如与自噬相关的微管相关蛋白1A/1B-轻链3(MAP1LC3,通常缩写为 LC3B),与氧化损伤相关的3-硝基酪氨酸,以及与蛋白酶体降解相关的K48 [76‒77]。在数据处理上,他们使用了空间自适应归一化(SPADE)[78]以及可视化的降维算法(viSNE)对SynTOF数据进行可视化分析[79]。
《6、 结论与展望》
6、 结论与展望
由于大脑组织具有高度异质性,在单细胞水平上研究细胞表面标记物及其表型具有很大的难度。在神经炎症发生时,外周免疫细胞通过血脑屏障迁移到大脑,形成更复杂的大脑免疫微环境。CyTOF可使用少量的样本,并显著增加染色通道,使得研究者可以在单细胞水平上“看到”由各种免疫细胞、肿瘤细胞或突触组成的更高维度全景图。这项技术也为人们提供了一种深入了解细胞表型和功能,及其内部信号传导的方式。更重要的是,CyTOF使得发现更加复杂细胞亚型并构建其细胞网络关系成为可能(图2)。
《图2》
图2 利用质谱流式技术研究在正常状态及疾病状态下的脑部免疫细胞及神经突触。
《6.1 CyTOF的局限性》
6.1 CyTOF的局限性
虽然与传统的FACS和其他方法相比,CyTOF具有显著的优势,但是CyTOF也存在缺点。第一,这些细胞在样本收集阶段会被破坏。因此,即便采用CyTOF,可能实验中仍然需要通过FACS进行细胞分选来收集感兴趣的细胞。第二,抗体的制备和标记的成本依然很高,该缺陷也阻碍了CyTOF的广泛应用。第三,虽然在原理上各通道之间没有信号干扰,但同位素杂质依然可能导致不同通道之间的污染。因此,在实际操作中,仍需要一个优化的染色方案,以最大化检测信号,最小化通道间干扰。Takahashi等[19]使用PBMC作为实验材料来优化CyTOF通道的设计。他们的结果表明,信号的强度、细胞表面标记物表达量、通道的灵敏度和信号干扰都是在设计实验时应该考虑的重要因素。例如,细胞高表达的CD45分子的检测抗体应该用89Y、113In或115In标记,因为这些同位素相对其他同位素不太敏感[19]。与传统的FACS技术一样,CyTOF也是通过细胞表面和细胞内标记物的表达来检测免疫细胞群及其亚型。2013年,Newell等[80]开发了一种将四聚体检测与CyTOF结合的技术,用于T细胞表位的检测。这种方法可以用人类血液样本筛选出多达109个肽-MHC四聚体。如果这项技术可以用于脑相关的研究,则将有助于研究者确定在脑衰老过程中或者与脑相关的疾病中可能存在的表位,该方法也可以用来有效预测在脑部感染时有哪些表位将被脑内的T细胞识别[81]。目前,CyTOF主要用于免疫细胞分型鉴定,该技术将如何推进其他领域的研究仍然值得思考[76]。令人鼓舞的是,CyTOF在临床上已初步被用于检测如脓毒性休克[82]、风湿性疾病和黑色素瘤[83]中细胞分群及细胞功能的研究。
《6.2 CyTOF与单细胞测序结合的新型实验手段》
6.2 CyTOF与单细胞测序结合的新型实验手段
单细胞测序与CyTOF的结合可以被用于在单细胞水平上快速、准确地研究基因信息、基因表达以及基因功能。值得一提的是,这两种技术是互补的,因为单细胞测序在转录水平上提供遗传信息,而CyTOF在翻译水平上显示基因表达水平。自2014年以来,已经陆续开展了一些将单细胞测序应用于深度脑研究的实验。Patel等[84]应用单细胞RNA测序技术揭示了原发性脑胶质瘤内的异质性。Pollen等[85]利用低覆盖率的单细胞信使RNA(mRNA)测序技术揭示了在异质发育的大脑皮层中活化的信号通路。随着测序技术的快速升级,该技术现在不仅可以揭示序列信息,还能显示DNA和RNA中甲基化的基因修饰[86]。
与单细胞测序类似,CyTOF是一种高通量、高维度的检测手段。相比测序技术,CyTOF可以揭示在蛋白表达水平上的相关信息。因此,结合这两种技术可以在单细胞水平得到更全面的生物信息。这类组合型方案已被应用于泪腺再生[87]和人外周血异质性的研究[88]。由于大脑是最具异质性的组织,这种技术组合将成为一种用于全面揭示大脑在不同生物条件或不同发育阶段中的遗传和蛋白质信息的有效方式。例如,Sankowski等[71]在小鼠模型中利用CyTOF和单细胞RNA测序分析了小鼠小胶质细胞和其他中枢神经系统相关巨噬细胞(CAM)的异质性。单细胞测序和CyTOF的特点列于表2 [32,78‒79,89‒96] 中。
《表2》
表2 单细胞测序和质谱流式的特点
| Feature | CyTOF | Single-cell sequencing |
|---|---|---|
| Detectable level | Translational | Transcriptional |
| Modification | Yes (post-translational modification) | Yes (methylation) |
| Require single-cell suspension preparation | Yes | Yes |
| Cell isolation | On the CyTOF machine | Sorting [ |
| Mixed sample | Yes (barcode) | Yes (barcode) |
| Fix | Yes | No |
| Applied cell types | Limited cell types (e.g., immune cells, synapse) | Generally applied to various cell types |
| Data analysis | Relatively difficult | Relatively difficult |
| Major data analysis software/programs | Cytobank (not limited to viSNE [ | Program R (other programming/algorithms [ |
最近,还有一些新的方法涌现出来,如同时检测表面蛋白标记和转录组的新型单细胞测序技术(CITE-seq)。利用寡核苷酸标记的抗体,CITE-seq可以通过测序的方法,同时测量单细胞转录组和细胞表面蛋白[97]。2017年,Peterson等[98]开发了一种组合方法,使用单细胞水平的液滴微流体来测量DNA标记抗体的基因和蛋白质表达水平,他们称之为“RNA表达和蛋白质测序分析”(REAP-seq)。他们的数据显示,该方法可以一次实验检测超过2万个基因,并且用82个预制抗体定量检测蛋白质。这两种方法都可以在转录和翻译水平上提供高通量的细胞信息。因此,这两种方法是在单细胞水平的脑免疫成分研究中最具潜力的技术。
《6.3 CyTOF与质谱成像技术相结合的新趋势》
6.3 CyTOF与质谱成像技术相结合的新趋势
最近,随着新技术的发展,CyTOF的检测维度从研究悬液中的单细胞扩展到分析包埋的组织切片。质谱成像技术(imaging mass cytometry, IMC)于2014年首次被报道[99]。该方法采用惰性气体激光烧蚀法对粒子流进行了分析。通过IMC可以从组织切片扫描仪上重建图像,该方法可与显微镜成像效果相媲美[100]。
类似于IMC,飞行时间多路离子束成像(MIBI-TOF)是一种新兴技术,可以通过在亚细胞分辨率下量化多个蛋白质在完整组织中的空间分布来研究单个细胞的表型与多细胞结构的功能间的联系[101]。该方法可以实现高分辨率和高灵敏度的多路成像。以上两种技术通常被用于人类癌症组织活检分析。这两种技术不仅可以用于揭示口腔鳞状细胞癌[102]和乳腺癌[103]患者的肿瘤微环境,而且还可以用于研究黑色素瘤[104]中的肿瘤浸润性淋巴细胞。由IMC所获得的空间信息不仅可以揭示这些信息是在哪里获得的,还可以解释各种细胞是如何构建组织的。因此,IMC或MIBI-TOF与CyTOF相结合的方法可以在未来的组织样本研究中产生更多用于展示空间信息的高维数据[105]。
《6.4 先进流式细胞术的出现——CytecAurora》
6.4 先进流式细胞术的出现——CytecAurora
Cytec® Aurora是一款先进的流式细胞仪,具有5个激光器和三个散射通道,可检测多达64种荧光通道。传统FACS技术的主要缺陷是各种荧光素之间的光谱重叠。Cytec® Aurora利用全发射光谱特征的差异解决了上述问题。Park等[106]应用40色染色检测了人外周血中主要细胞亚群的免疫表型。为了避免固定对细胞的影响,他们只对细胞表面标记物进行了染色。Sahir等[107]进一步开发了一个43色的染色方案,用以表征外周血中的T细胞、B细胞、NK细胞、单核细胞和树突状细胞亚群。他们还指出,即使样本数量较低,这种技术也可以有效分析免疫细胞成分。Riggs等[108]应用Cytec® Aurora技术研究在急性小鼠伽马疱疹病68(MHV68)感染时的巨噬细胞表型,这进一步显示了该技术在疾病相关研究中的应用潜力。Cytec® Aurora与传统FACS一样,均使用相对简单的染色方法,使其在神经炎症领域具有巨大的应用潜力。
《6.5 CyTOF数据的可视化分析》
6.5 CyTOF数据的可视化分析
由于CyTOF在单细胞水平上显著增加了表型和功能性状的可检测数量,产生了更多的数据,因此,急需开发高效的数据分析方法[109]。CyTOF数据的采集和归一化在分析前至少需要6个步骤,包括校准、细胞检测、归一化、去条形码、重新调节和随机化[110]。对于分析CyTOF数据的初学者,主要可以通过三种算法平台(viSNE、SPADE和Citrus)进行计算,这三个平台对于计算机背景要求不高,并提供可视化的结果展示[109,111]。具体来说,viSNE的优点在于可以显示细微的变化和罕见的细胞类群,而SPADE则提供了一种用于简化细胞数量和结构的树形模型。在使用SPADE时,有必要对树上显示的节点进行精确取舍,因为选择默认的节点数设置[78]可能会导致单元格中信息的错误显示。Kimball等[109]指出,X位移和表型图可以更好显示细胞子集的数量,并有潜力提取更多的数据。此外,还可以采用主成分分析(PCA)和t-随机邻域嵌入(t-SNE)进行降维分析。PCA通过数据的线性变换来减少高维空间,而t-SNE是线性的分析方式。与t-SNE相比,统一流形逼近与投影(UMAP)是一种新的更好的降维方法,该方法提高了分析速度,更好地保存了数据的全局结构。因此,UMAP已经被应用于最近的免疫成分研究[93,112]。
总体来说,尽管CyTOF的成本较贵、制样检测流程冗长、数据定量及可视化较复杂,但是,这种新的高维度检测技术已经彻底改变了单细胞水平的研究。目前,人们对大脑的认知还很有限,CyTOF作为一种高通量、高维的单细胞分析技术,极大地促进了研究人员对脑部免疫细胞在单细胞水平上的深入研究。有了这个强大的工具,使得科学家可以用更深入、更全面、更精确的方式分析脑部免疫细胞,并且能够更准确、更有效地剖析前所未见的脑部免疫细胞的基本特征。















 京公网安备 11010502051620号
京公网安备 11010502051620号




