《1、 引言》
1、 引言
骨肉瘤是一种好发于儿童和青少年的恶性间叶组织肿瘤[1‒3]。尽管近年来生存率显著提高,但许多患者的预后仍然不尽如人意[4]。此外,骨肉瘤存在多药耐药、肺转移和肿瘤复发等多种挑战[5]。因此,迫切需要开发骨肉瘤的新治疗靶点和治疗模式。
环状RNA(circRNAs)具有独特的环状结构,异常表达的circRNAs是调节各种肿瘤中多种生物学过程的关键基因[6‒9]。例如,circ0001320可以通过miR-558的海绵样作用调节肿瘤坏死因子(TNF)-α诱导的蛋白1和肌动蛋白1,抑制肺癌细胞的生长和转移[10]。据报道,circRNA 001306通过miR-584-5p的海绵样作用增加细胞周期依赖性激酶16(CDK16)的表达,促进肝细胞癌(HCC)的生长[11]。Peng等[12]最近报道了circCUL2通过miR-142-3p/Rho相关卷曲螺旋蛋白激酶2(ROCK2)激活自噬来调节胃癌的恶性转化和顺铂耐药。此外,越来越多的证据表明circRNAs在骨肉瘤的进展中起着关键作用[13‒14]。Shen等[15]揭示了环状内皮素转化酶1(circECE1)通过癌基因c-Myc调节骨肉瘤的能量代谢。Li等[16]报道了circ_0000282通过miR-192/X连锁凋亡抑制蛋白(XIAP)轴调节骨肉瘤细胞增殖。Pan等[17]证明了circ_0028171可以通过miR-218-5p/κB激酶β(IKBKB)轴促进骨肉瘤进展。然而,一些circRNAs在骨肉瘤中的表达和作用仍然不清楚。
circ_000203是一种685个核苷酸(nt)长的环状RNA,位于chr10:888871~931700,并从La核糖核蛋白4B(LARP4B)基因的外显子中剪切[18]。LARP4B已被报道在多种肿瘤类型中发挥重要作用[19]。此外,circ_000203的异常表达已与心肌纤维细胞中的心肌肥厚和纤维化相关联[18,20]。然而,circ_000203在骨肉瘤中的表达和作用仍需进一步阐明。我们前期观察到,与对照组的组织相比,circ_000203在骨肉瘤组织和细胞中高表达。因此,本研究的目的是探索circRNA (circ_000203)在骨肉瘤中的表达和作用,并阐明其潜在机制。
《2、 材料和方法》
2、 材料和方法
《2.1 研究参与者和样本采集》
2.1 研究参与者和样本采集
本研究共收集了来自北京大学人民医院的20例健康骨组织和40例普通型骨肉瘤组织。我们获得了所有研究参与者的书面知情同意,并获得了北京大学人民医院伦理委员会的批准。
《2.2 细胞培养和转染》
2.2 细胞培养和转染
骨肉瘤细胞系143 B、KHOS、HOS、U2OS、SAOS2和MG63细胞系以及健康人骨母细胞(hFOB)细胞系均从美国菌种保藏中心(ATCC)购买。143 B和hFOB细胞在含10%胎牛血清(FBS)的DMEM (Dulbecco´s modified eagle medium)中培养。其他细胞系在含10% FBS的RPMI (Roswell Park Memorial Institute) 1640培养基中培养,并在37 ℃和5% CO2条件下孵育。miR-26b-5p mimic/inhibitor、shRNA-circ_000203和过表达骨形成蛋白受体2(BMPR2)的质粒载体均购自吉玛基因公司,并使用脂质体3000进行转染。shRNA-circ_000203序列为:(F) 5′-GUCGUGUGUGAAUAUCCUACG-3′, (R) 5′-UAUAAUAAUCACACAGCACUG-3′;shRNA-阴性对照序列为:(F) 5′- TTCTCCGAACGTGTCACGTAA-3′, (R) 5′-TTACGTGACACGTTCGGAGAA-3′。miR-26b-5p mimic序列为:5′-UUCAAGUAAUUCAGGAUAGGU-3′;miR-26b-5p inhibitor序列为:5′-ACCUAUCCUGAAUUACUUGAA-3′。
《2.3 定量反转录聚合酶链反应》
2.3 定量反转录聚合酶链反应
使用RNeasy Plus通用试剂盒(Qiagen,德国)提取RNA,并使用无核酸酶(RNase)的去氧核糖核酸酶(DNase)(Qiagen)去除基因组DNA。然后,根据生产厂家的说明,使用iTaq通用单步RT-qPCR试剂盒(Bio-Rad,美国)进行定量反转录聚合酶链反应(qRT-PCR)分析。U6小核RNA和β-actin分别用作microRNA(miRNA)和其他mRNA的内源控制。使用Bio-Rad CFX96软件分析数据,并将其表示为三次独立实验的平均值,每次实验重复测量三次。引物序列列于表1中。
《表1》
表1 qRT-PCR引物序列
| Primers | Dirction | Sequences (5′‒3′) |
|---|---|---|
| circ_000203 | F | AAGAGAAGTACAGATTGCTTCA |
| R | CTCTTCTTTAACTTCTAATAATTC | |
| BMPR2 | F | CACCTCCTGACACAACACCACTC |
| R | TGCTGCTGCCTCCATCATGTTC | |
| β‐actin | F | GTCAGGTCATCACTATCGGCAAT |
| R | AGAGGTCTTTACGGATGTCAACGT | |
| miR-26b-5p | F | TTCAAGTAATTCAGGATAGGT |
| R | GTGCGTGTCGTGGAGTC | |
| U6 | F | CTCGCTTCGGCAGCACA |
| R | AACGCTTCACGAATTTGCGT |
《2.4 蛋白质印迹法》
2.4 蛋白质印迹法
蛋白质印迹法(Western blotting)是按此前描述过的方法[21]进行的。使用抗人BMPR2(1:1000; Abcam,英国)和抗甘油醛-3-磷酸脱氢酶(GAPDH; 1:1000; Santa Cruz,美国)抗体。使用美国国立卫生研究院(NIH)ImageJ软件(Bethesda,美国)定量条带的灰度。所有实验均进行了三次。数据以三次独立实验的平均值呈现。
《2.5 细胞活性检测和克隆形成实验》
2.5 细胞活性检测和克隆形成实验
转染后的骨肉瘤细胞被分散到96孔板中(每孔5×103个细胞)。根据使用说明,连续三天每日使用细胞计数试剂盒-8(CCK-8, Dojindo,日本)评估细胞的活力。对于克隆形成实验,转染的骨肉瘤细胞在完全培养基中培养5天。PBS冲洗和固定后,使用0.1%的结晶紫染料进行细胞染色。所有实验均重复三次。
《2.6 Transwell实验和划痕愈合实验》
2.6 Transwell实验和划痕愈合实验
对于Transwell实验,将5×104个转染的骨肉瘤细胞种植在涂/未涂基质胶的上层室(BD Biosciences,美国)中。24 h后,用PBS洗涤细胞三次,然后使用4%的多聚甲醛进行固定。然后,用0.1%的结晶紫染色并在倒置显微镜下观察。对于划痕愈合实验,将转染的骨肉瘤细胞接种到6孔板中,然后在板上进行划痕。随后对细胞进行培养,并在0和24 h拍照。所有实验均重复三次。
《2.7 双荧光素酶报告实验》
2.7 双荧光素酶报告实验
将BMPR2或circ_000203 3′-未翻译区域的序列克隆到PmirGLO荧光素酶报告载体中,含有突变或野生型(WT)miR-206结合位点,如先前所述[22]。然后,将载体和miRNA mimic或NC共转染到骨肉瘤细胞中,并评估荧光素酶活性。所有实验均重复三次。
《2.8 免疫组织化学》
2.8 免疫组织化学
实验方案如先前所述[2,21]。本研究使用抗人BMPR2(1:80)抗体,并由两名独立病理学家评估结果。所有实验均重复三次。
《2.9 RNA印迹法和 RNase R 实验》
2.9 RNA印迹法和 RNase R 实验
RNA印迹法(Northern blotting):使用TRIzol(Invitrogen,美国)从骨肉瘤组织中提取RNA。用Biotin RNA Labeling Mix(Roche Applied Science,德国)制备circ_000203和18S探针,用于 Northern blotting。RNase R处理:将10 μg RNA与40单位(U)RNase R混合,于37 °C下孵育2 h。使用qRT-PCR评估circ_000203和LARP4B mRNA的表达水平和稳定性。所有实验均重复三次。
《2.10 肿瘤异种移植实验》
2.10 肿瘤异种移植实验
随机选取10只雌性BALB/c裸鼠,分成两组(n=5)来评估circ_000203在体内骨肉瘤细胞中的作用。简单来说,将5 × 106个shRNA‒circ_000203或shRNA-NC转染的143 B细胞皮下注射到小鼠的左侧。然后,我们使用游标卡尺测量肿瘤大小,每隔5 d测量一次,持续15 d。最后,所有小鼠被处死并用于进一步实验。所有动物实验均获得北京大学人民医院动物护理和使用委员会的批准。
《2.11 统计分析》
2.11 统计分析
数据分析使用GraphPad Prism 8(GraphPad Software, Inc.,美国)进行,所有结果均表示为平均值±标准偏差。组间差异采用Student´s t检验分析,当p值小于0.05或0.01时,结果被视为具有统计学意义。
《3、 结果》
3、 结果
《3.1 circ_000203敲低通过调控miR-26b-5p/BMPR2阻止骨肉瘤进展》
3.1 circ_000203敲低通过调控miR-26b-5p/BMPR2阻止骨肉瘤进展
简而言之,将shRNA-circ_000203转染到骨肉瘤细胞中,显著下调了circ_000203的表达,从而释放大量与其竞争结合的miR-26b-5p。miR-26b-5p的过度表达抑制了BMPR2的表达,该基因已知能够诱导肿瘤增殖标志物Ki67的下调、肿瘤转移相关蛋白N端黏附蛋白的下调以及新血管生成生物标志物CD31群集的下调[23]。因此,circ_000203敲低显著抑制了骨肉瘤的进展(图1)。
《图1》
图1 shRNA-circ_000203基因沉默的示意图,通过miR-26b-5p/BMPR2通路抑制骨肉瘤的发展。将shRNA-circ_000203转染到骨肉瘤细胞中,沉默circ_000203或NC细胞后,将其消化并皮下植入裸鼠体内形成异种移植模型。两周后,shRNA-circ_000203的基因沉默显著抑制骨肉瘤的进展。在骨肉瘤细胞中,shRNA-circ_000203显著下调circ_000203,其海绵吸附的miR-26b-5p被大量释放。miR-26b-5p的过度释放显著降低靶基因BMPR2的表达,进一步导致肿瘤增殖标志物Ki67、肿瘤转移相关蛋白N-钙黏蛋白和新生血管生物标记CD31的表达下调,从而抑制骨肉瘤的进展。
《3.2 circ_000203基因沉默抑制体外骨肉瘤细胞的恶性进展》
3.2 circ_000203基因沉默抑制体外骨肉瘤细胞的恶性进展
如图2(a)所示,circ_000203起源于LARP4B基因的6个外显子,成熟长度为685 nt。qRT-PCR结果表明,与正常组织相比,骨肉瘤组织中circ_000203的表达水平较高[图2(b)]。随后,我们选择三对骨肉瘤组织样本进行Northern印迹,发现肿瘤组织中circ_000203显著过表达[图2(c)]。接着,我们使用6种不同的骨肉瘤细胞系通过qRT-PCR检测circ_000203的表达[图2(d)]。选择的骨肉瘤细胞表达的circ_000203比成骨细胞hFOB更多。由于这些骨肉瘤细胞系来源于表现出不同恶性程度的骨肉瘤患者,因此circ_000203的表达水平倾向于有所变化。具体来说,143 B和KHOS表现出最高的circ_000203表达水平,因此选择这些细胞系进行进一步实验。此外,我们使用RNase R验证circ_000203的闭环结构,发现circ_000203不会被RNase R消化,而线性的LARP4B则被消化[图2(e)和附录A的图S1]。然后,使用shRNA进行circ_000203基因沉默,并通过qRT-PCR进行评估[图2(f)]。CCK-8实验(附录A的图S2)和克隆形成实验(附录A的图S3)表明circ_000203的沉默抑制了骨肉瘤细胞的增殖。根据划痕实验的结果,circ_000203的沉默抑制了143 B和KHOS细胞的迁移[图2(g)和附录A的图S4]。此外,Transwell实验的结果显示,circ_000203的沉默抑制了骨肉瘤细胞的迁移和侵袭[图2(h)和附录A的图S5]。
《图2》
图2 circ_000203在骨肉瘤中高表达,circ_000203敲除抑制骨肉瘤细胞的恶性进展。(a)circ_000203的示意图;(b)circ_000203的表达情况;(c)Northern印迹;(d)骨肉瘤细胞比hFOB细胞表达更高水平的circ_000203;(e)RNase R验证了circ_000203的闭环结构;(f)通过qRT-PCR检测到的骨肉瘤细胞中circ_000203的敲除;(g)划痕愈合实验的结果;(h)Transwell实验结果。比例尺=100 μm。**p < 0.01。CDS:编码域序列。
《3.3 敲低 circ_000203在体内抑制骨肉瘤进展》
3.3 敲低 circ_000203在体内抑制骨肉瘤进展
为了评估circ_000203在体内对骨肉瘤发生的作用,利用转染shRNA-circ_000203或shRNA-NC的143 B细胞建立了小鼠异种移植模型。如图3(a)~(c)和附录A中的图S6所示,shRNA-circ_000203表现出明显的抗肿瘤行为并减缓了肿瘤生长速率。此外,还在收集的异种移植物中评估了circ_000203、Ki67、N-cadherin、E-cadherin和CD31的表达水平。与NC组相比,circ_000203在敲低组的肿瘤中显著下调[图3(d)]。此外,免疫组织化学实验表明,肿瘤转移相关蛋白N-cadherin、肿瘤增殖标志物Ki67和新生血管标志物CD31在circ_000203敲低组中明显受到抑制[图3(e)],而E-cadherin的表达显著上调[图3(e)]。这些结果表明,circ_000203敲低可以显著抑制骨肉瘤的生长和转移。
《图3》
图3 circ_000203敲低抑制了骨肉瘤的进展。(a)左后腿肿瘤异种移植小鼠的照片。红色圆圈表示肿瘤部位。(b)分离的皮下异种移植瘤的照片。(c)异种移植模型的生长曲线。(d)肿瘤中circ_000203的表达。(e)免疫组化检测肿瘤进展相关蛋白标记在异种移植样本中的表达。比例尺为100 μm。**p < 0.01。
《3.4 circ_000203靶向miR-26b-5p释放抑制BMPR2表达从而抑制骨肉瘤进展》
3.4 circ_000203靶向miR-26b-5p释放抑制BMPR2表达从而抑制骨肉瘤进展
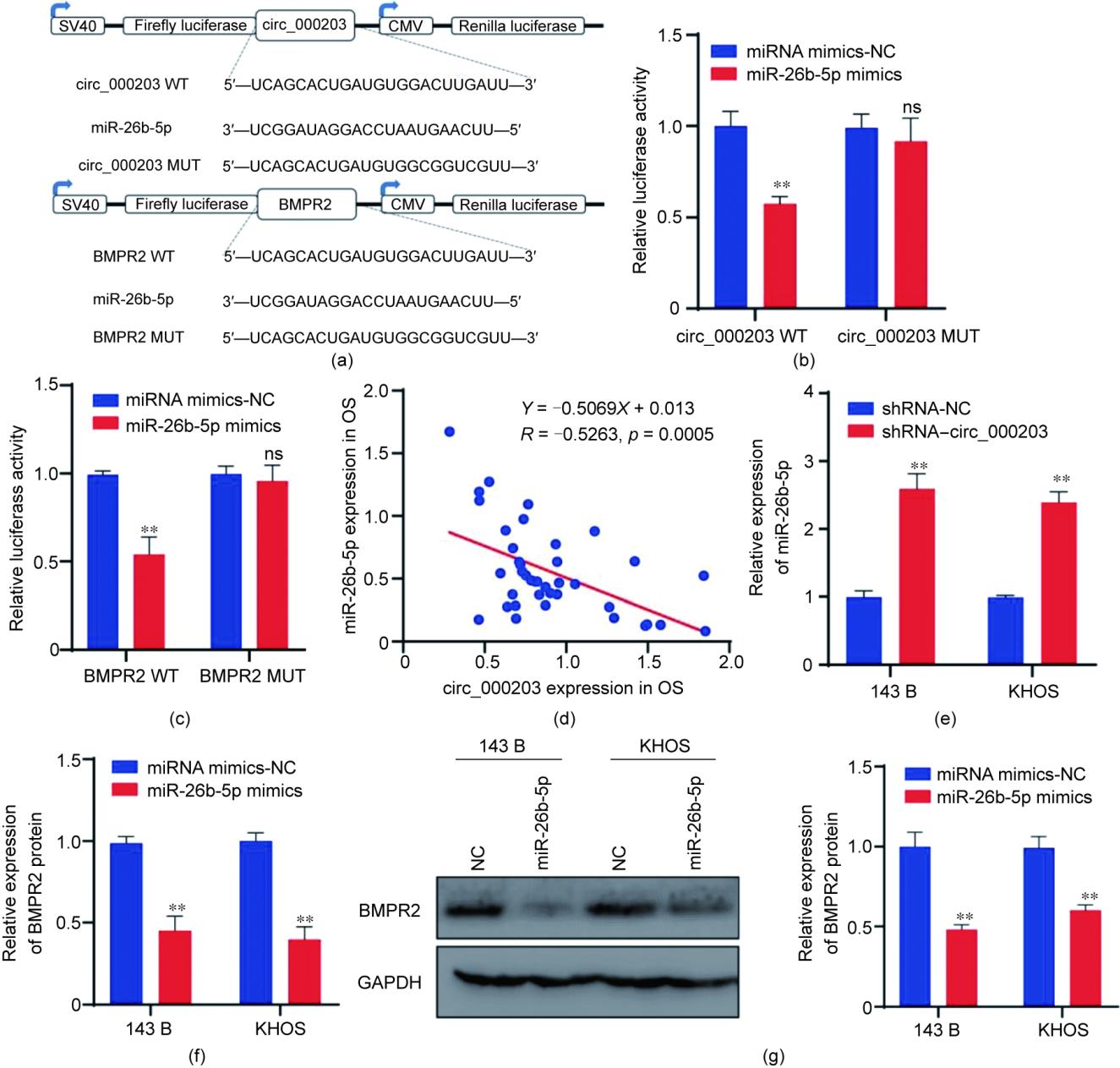
使用DIANA-LncBase v2工具†预测miR-26b-5p是circ_000203的一个潜在下游靶点。然后,使用生物信息学工具ENCORI‡预测BMPR2是miR-26b-5p的靶基因。双荧光素酶报告基因实验表明,与突变组(MUT)相比,miR-26b-5p抑制了circ_000203或BMPR2 WT的荧光素酶活性[图4(a)~(c)],证实它们之间的直接相互作用。使用qRT-PCR发现miR-26b-5p在骨肉瘤细胞和组织中表达较低(附录A中的图S7)。此外,我们观察到miR-26b-5p和circ_000203的表达呈负相关[图4(d)]。circ_000203敲减可增加骨肉瘤细胞中miR-26b-5p的表达[图4(e)],并且miR-26b-5p模拟物抑制BMPR2的表达[图4(f)和(g)]。此外,通过同时转染miR-26b-5p抑制剂(序列详见第2.2节)和shRNA-circ_000203进入骨肉瘤细胞,实现了miR-26b-5p和circ_000203的双重敲减(附录A中的图S8)。根据qRT-PCR分析,在shRNA-circ_000203转染的骨肉瘤细胞中,BMPR2的下调表达可在双重敲减细胞中得到逆转(图S8)。这些结果表明,circ_000203通过miR-26b-5p进行调控,进而调节BMPR2的表达。
《图4》
图4 敲低circ_000203通过释放miR-26b-5p介导下调BMPR2表达抑制骨肉瘤进展。(a)miR-26b-5p和circ_000203/BMPR2结合位点的示意图;(b)检测miR-26b-5p和circ_000203双荧光素酶报告基因;(c)检测miR-26b-5p和BMPR2双荧光素酶报告基因;(d)qRT-PCR结果表明,在骨肉瘤组织中,circ_000203和miR-26b-5p的表达呈负相关;(e)qRT-PCR结果显示,在circ_000203敲低的骨肉瘤细胞中miR-26b-5p增加;(f)miR-26b-5p降低BMPR2表达;(g)BMPR2蛋白表达的Western blot。**p < 0.01。
此外,我们转染了一个针对BMPR2的过表达载体至骨肉瘤细胞中(附录A中的图S9),并进行了功能实验以进一步验证circ_000203通过调节miR-26b-5p吸附BMPR2的表达来促进骨肉瘤细胞的发展。集落形成实验显示,增加BMPR2表达可以逆转circ_000203敲低导致的抑制细胞增殖的现象(附录A中的图S10)。划痕和Transwell实验显示circ_000203敲低导致的细胞迁移受到了一定程度的缓解,这部分缓解是通过BMPR2过表达而实现的(附录A中的图S11和S12)。结合miR-26b-5p过表达可以抑制骨肉瘤细胞恶性进展的结果(附录A中的图S13),我们证实,敲低circ_000203通过miR-26b-5p介导调控BMPR2表达降低,从而抑制了骨肉瘤的发展。
我们还检测了收集的移植瘤中的miR-26b-5p和BMPR2的表达情况,并发现circ_000203敲低肿瘤中miR-26b-5p显著上调,BMPR2下调(附录A中的图S14),这表明circ_000203敲低可以通过作用于miR-26b-5p/BMPR2通路来阻止骨肉瘤的进展。
《4、 讨论》
4、 讨论
多项研究表明,环状RNA在多种肿瘤的发展中发挥着至关重要的作用,包括骨肉瘤。circ_000203是一种新型的环状RNA,在肿瘤中尚未被发现[18]。本研究观察到,与对照组相比,circ_000203在骨肉瘤组织和细胞中高表达。因此,我们旨在探讨circ_000203的功能角色以及其在骨肉瘤中的作用机制。我们发现circ_000203的沉默显著抑制了骨肉瘤细胞的增殖、迁移和侵袭。
竞争性内源性RNA(ceRNA)是循环RNA的关键调控机制[24],循环RNA可以作为ceRNA吸附下游靶向miRNA,从而影响自由miRNA表达并实现靶基因的转录后调控。在这里,我们使用DIANA-LncBase v2预测miR-26b-5p作为circ_000203的潜在下游靶向。生物信息学工具ENCORI预测BMPR2是miR-26b-5p的靶基因。
miR-26b-5p已在多种肿瘤的研究中被报道[25]。Han等[26]发现,在肝细胞癌中,miR-26b-5p通过调节内在微孔聚合物(PIM)-2来增强T细胞反应。Wu等[27]揭示了miR-26a通过靶向程序性细胞死亡10(PDCD10)抑制膀胱癌细胞的进展。此外,Niu等[28]报道,miR-26b-5p可以通过靶向核蛋白α2(KPNA2)来抑制Burkitt淋巴瘤细胞的增殖。然而,miR-26b-5p在骨肉瘤中的作用仍不清楚。在本研究中,miR-26b-5p在骨肉瘤细胞和组织中表达较低,miR-26b-5p过表达显著抑制了骨肉瘤细胞的增殖、迁移和侵袭。
BMPR2是骨形态发生蛋白(BMP)信号转导的重要成员,据报道其可能是多种肿瘤进展的关键基因,比如胃癌、前列腺癌和乳腺癌[23,29‒31]。我们的既往研究发现BMPR2通过Ras同源基因家族成员A(RhoA)-Rho相关卷曲螺旋蛋白激酶(ROCK)-LIM结构域激酶2(LIMK2)途径促进人骨肉瘤细胞的侵袭和转移[23]。在本研究中,我们进一步证明了circ_000203的沉默抑制了细胞的增殖、迁移和侵袭,这可以部分地通过BMPR2过表达缓解。这些结果表明circ_000203通过靶向miR-26b-5p/BMPR2轴促进了骨肉瘤细胞的发展。总之,这些发现有助于建立对骨肉瘤进展调节机制的详细理解。
《5、 结论》
5、 结论
circRNA在骨肉瘤的发展中起着重要作用,但其潜在机制仍未被探索。本研究揭示了circ_000203通过调节miR-26b-5p/BMPR2轴促进骨肉瘤的发展。在骨肉瘤细胞中,circ_000203的沉默特异性诱导miR-26b-5p的释放,这是BMPR2表达的上游抑制因子,从而降低BMPR2水平并抑制骨肉瘤细胞的进展。此外,我们证明了通过操纵circRNA可以在体内抑制骨肉瘤异种移植物的可行性。我们的研究结果为骨肉瘤发病的分子机制提供了有价值的探索,表明circ_000203有潜在作为骨肉瘤的新生物标志物和治疗靶点的作用。

















 京公网安备 11010502051620号
京公网安备 11010502051620号




