《1、 引言》
1、 引言
随着社会进步和工业发展,产生了越来越多难以在污水中降解的有害有毒污染物。同时,近年来对人类健康和生态环境产生不利影响的药品及个人护理产品[1‒2]和内分泌干扰物[3]引起了越来越多的研究关注,亟需高效的废水处理方法来实现清洁生产的目标,推动人类社会的可持续发展。
许多有机污染物难以通过传统的水处理技术被有效去除[4‒6],包括草甘膦在内的许多有机污染物在污水处理厂的平均去除率不到50% [7]。为了解决这个问题,随着废水处理技术的快速发展,高级氧化技术正在兴起。高级氧化过程是一种强大、高效的水污染物降解方法。其中,基于过硫酸根离子的先进氧化过程由于其高氧化还原电位和选择性而受到广泛关注[8‒9]。过一硫酸盐的活化可以通过热活化、光活化[10]、超声辐射、电化学方法、均相金属离子催化和异相催化等技术实现[11‒12]。近年来,异相催化由于其高效率和较少的二次污染而受到广泛研究[8]。目前,半导体、过渡金属和无金属材料广泛用于激活过硫酸单酯[13‒14]。此外,磁性异相催化材料的开发解决了水溶液中材料分离问题,提高了实际应用的可能性[15‒17]。
目前开发异相催化氧化材料主要面临以下问题:贵金属的添加使得材料昂贵;催化剂难以从水环境中分离[18],回收效果受限[19]。一般来说,材料的开发是成本和效率之间的权衡。虽然吸附过程简单经济,但它并不能解决废水处理中的根本污染问题。相比之下,吸附过程与先进氧化技术相结合可能是更经济、更高效的技术,有助于进一步推动清洁和可持续发展。已有多项研究探讨了吸附-催化氧化过程的应用。例如,Wang等[20]观察到吸附-降解循环有利于去除双酚类物质。Peng等[21]证明了在Fe/Fe3C@NG上的吸附催化协同作用实现了对诺氟沙星(Nor)的高效去除。
金属有机框架(MOF)具有大的比表面积和可变反应位点[22‒23],因此被选为潜在的吸附剂和非均相催化材料。MOF是由金属离子和有机配体形成的三维有序多孔材料[24],也被称为多孔配位聚合物(PCP),广泛应用于气体储存[25]、催化[26]、吸附[27]、化学传感[28]、药物输运[29]、半导体[30]和生物医学成像[31]等领域。此外,许多研究人员还使用MOF作为模板或前体合成碳材料或金属复合材料[32‒35],来实现它们的应用。作为金属复合材料和碳的组合,基于MOF的碳复合材料具有优异的吸附和非均相催化潜力[36‒37]。
然而,稳定性是影响所有非均相催化剂性能的重要因素。MOF的实际应用也受其回收性能和稳定性的影响。在被报道的所有MOF中,MOF-5是最常用的材料之一,具有开放骨架结构、大孔面积和良好的热稳定性[38]。然而,包含二价金属中心和多羧酸配体的MOF,如MOF-5对水敏感,在水环境中会崩塌[39],使它们在废水处理方面竞争力不够。考虑配体与镍离子的结合比与锌离子结合更稳定,因此MOF-5中掺杂镍离子可以提高它在水环境中的稳定性,进而可以用于废水处理[40]。此外,向MOF-5中添加镍并随后煅烧可以得到一种磁性复合材料,有助于固-液分离和其随后的再生,解决非均相材料开发中遇到应用问题。
本研究通过以前报道的水热合成方法[41]制备了一种磁性异相催化剂,称为ZN-CS。选择罗丹明B(RhB)的去除作为模型过程,研究了提出的机理和耦合效应。探究了对不同目标污染物[酸性橙7(AO7)、亚甲基蓝(MB)、盐酸四环素(TC)和Nor ]的去除效果以及影响RhB降解的因素。最后,扫描电子显微镜(SEM)、Brunauer-Emmett-Teller(BET)分析、粉末X射线衍射(XRD)、傅里叶变换红外光谱(FT-IR)和电子顺磁共振(EPR)分析以及淬灭实验的分析结果表明,吸附污染物的降解使活性位点再生,有助于高回收性能的实现。与一些先前研究中使用的体系相比,此体系不使用任何贵金属,采用吸附-降解过程以实现经济和处理效果之间的平衡。此外,合成的催化剂具有磁性、可回收性和稳定的结构,对各种有机物去除效果良好。吸附-降解的耦合过程为开发同时具有吸附性能的催化材料提供了一种新方法。
《2、 实验方法》
2、 实验方法
《2.1 材料和药品》
2.1 材料和药品
乙二醇、六水合硝酸锌[Zn(NO3)2·6H2O]、N,N-二甲基甲酰胺(DMF)、甲醇、叔丁醇(TBA)、乙醇、六水合硝酸镍[Ni(NO3)2·6H2O]、RhB、无水硫酸钠和磷酸氢二钾(K2HPO4)均由成都科隆化学试剂有限公司提供。邻苯二甲酸(H2BDC)、AO7、过一硫酸氢钾(PMS)和TC均从阿拉丁化学试剂有限公司(中国)获得。Nor和三水合MB分别从TCI(上海)发展有限公司和中国医药集团化学试剂有限公司获得。所有水溶液均使用超纯水制备。实验中使用的所有化学品均为分析纯。
《2.2 材料制备》
2.2 材料制备
基于以前报道的方法[41]进行了一些修改,然后制备出核壳结构的ZN-CS纳米复合材料。首先,将0.75 g的Zn(NO3)2·6H2O和Ni(NO3)2·6H2O分别加入溶剂混合物(75 mL的乙二醇和120 mL的DMF)中。样品在磁力搅拌下搅拌,直到固体完全溶解。随后,将0.45 g的H2BDC溶解在制备的溶液中。将该溶液置于具有Teflon衬里的不锈钢高压釜中,在150 ℃下反应6 h。通过离心收集样品,用乙醇和DMF进行纯化,然后在100 ℃的烘干箱中烘干过夜。然后,将样品在450 ℃下,在氮气氛的管式炉中煅烧20 min,用去离子水洗涤,最终干燥得到ZnO@Ni3ZnC0.7。采用XRD和XPS分析证实了所合成催化剂的高结构稳定性,标记为ZN-CS。
《2.3 ZN-CS的表征》
2.3 ZN-CS的表征
采用分光光度计(MAPADA UV-1800PC,中国)分析RhB浓度,最大吸收波长为554 nm。使用QuadraSorb Station 2在-196 °C下获得N2吸附/解吸等温线。采用zeta电位分析仪(Nicomp Z3000,美国)测定ZN-CS表面的zeta电位。采用配备能量色散X射线光谱(EDS)探测器的JSM-5900LV扫描电子显微镜(JEOL. Ltd. Akishima,日本),分析新制备和使用过的催化剂的表面形貌和原子组成。用X´Pert Pro MPD DY129 X射线衍射仪获得XRD谱图。红外光谱采用FT-IR(Nicolet 6700, Thermo Scientific,美国)。
《2.4 实验操作》
2.4 实验操作
在20 ℃的玻璃烧杯中进行了一批次单独的吸附实验,研究ZN-CS对RhB的吸附性能。在固定时间间隔吸取反应溶液,并立即通过Whatman GF/F玻璃纤维膜分离,以测量剩余的RhB浓度。为了评价ZN-CS对PMS的活化能力,在室温下500 mL的玻璃烧杯中进行了ZN-CS的催化实验。由于ZnO已被用作半导体光催化剂进行广泛研究[42],因此在黑暗条件下进行了控制实验,以消除光的影响。由此得到的结果无显著差异(见附录A中的图S1),因此随后的实验在室内光照条件下进行。在添加PMS之前,将不同剂量的催化剂分散在200 mL RhB溶液中,搅拌约15 min以达到吸附平衡。通过添加所需量的PMS来启动降解反应。样品在一定的时间间隔内被取出,并过滤以确定剩余污染物浓度。在相同条件下进行了没有催化剂的空白实验。PMS是降解过程中必不可少的羟基和硫酸根自由基的主要来源。因此,为了研究PMS初始浓度的影响,使用100~400 mg·L-1范围内的PMS初始浓度进行实验。实验结果表明,使用200 mg·L-1 PMS可以明显提高RhB的去除率。因此,随后的实验中PMS浓度为200 mg·L-1。评估了25 mg·L-1、50 mg·L-1、100 mg·L-1和150 mg·L-1的催化剂用量的影响。此外,研究了初始RhB浓度的影响。
为了研究反应活性物质的贡献,甲醇和TBA被用作自由基清除剂。为了观察对反应位点的影响,使用二磷酸钾进行掩蔽。使用过的催化剂经超纯水洗涤并在100 ℃下干燥过夜。回收实验在[RhB]₀ = 3.40 mg·L-1条件下进行,这等于其他步骤不变的情况下,在
《3、 结果与讨论》
3、 结果与讨论
《3.1 吸附和催化氧化性能》
3.1 吸附和催化氧化性能
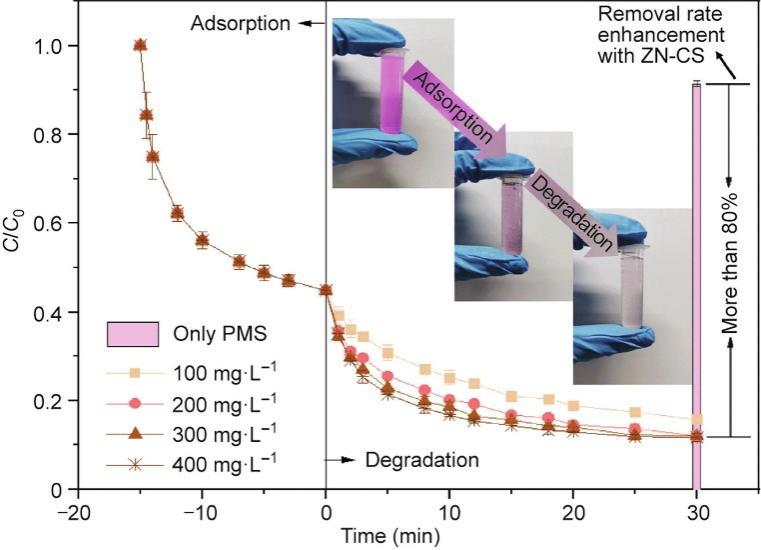
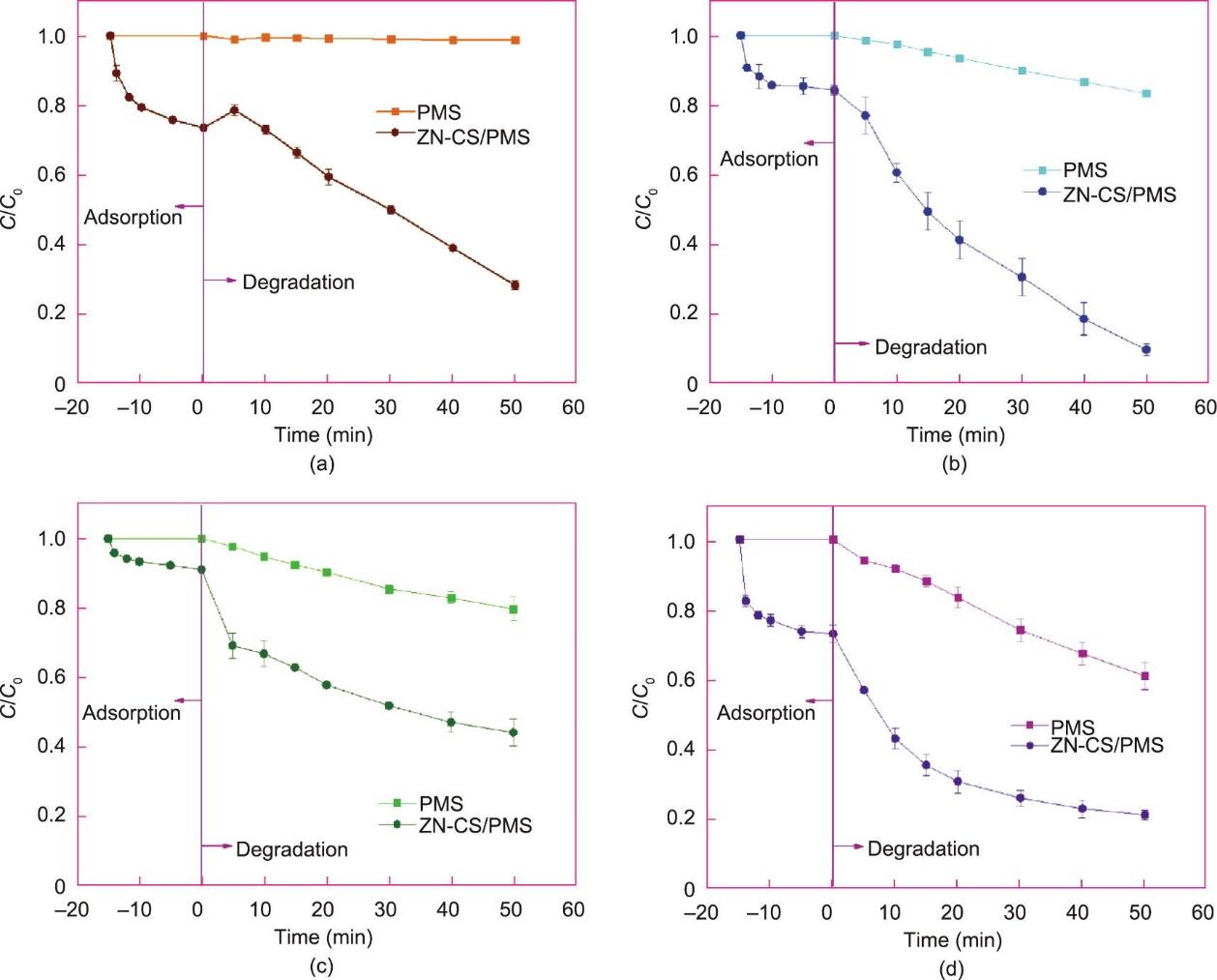
在添加PMS之前,ZN-CS对RhB表现出强烈的吸附亲和力,在15 min内可去除50%以上的RhB(图1)。去除过程中,溶液的pH变化和所有动力学结果分别在附录A中的图S2、文本S1和表S1中展示。此外,RhB的吸附速率缓慢增加,可能是由于水相中RhB浓度的降解、吸附位点逐渐耗尽。在达到吸附平衡后,向溶液中加入PMS以启动反应。30 min后,ZN-CS/PMS体系去除了大约90%的RhB,而在PMS体系中仅去除了8%的RhB。此外,在前驱体和单金属催化剂中,ZN-CS表现出最佳的去除效率(见附录A中的图S3)。此外,PMS浓度在开始时迅速降低,随着时间的推移缓慢降低(见附录A中的图S4)。开始时PMS的快速消耗可能是由于与催化剂的某些吸附或结合效应。随后,由于活性位点的饱和,PMS的活化变得逐渐缓慢。因此,该材料可以吸附RhB,并激活PMS进一步降解底物。吸附-降解的耦合效应呈现出一定的实际应用潜力(见附录A中的图S5)。在下面的分析中,RhB的消除过程可以分为两个阶段,吸附和降解。可能的两阶段机理将在后文提出。
《图1》
图1 初始PMS浓度对ZN-CS/PMS体系吸附和降解RhB的影响,以及单独的PMS体系对RhB的去除效率。反应条件:[ZN-CS] = 100.00 mg·L-1, [RhB]
《3.2 催化剂组成的初步分析》
3.2 催化剂组成的初步分析
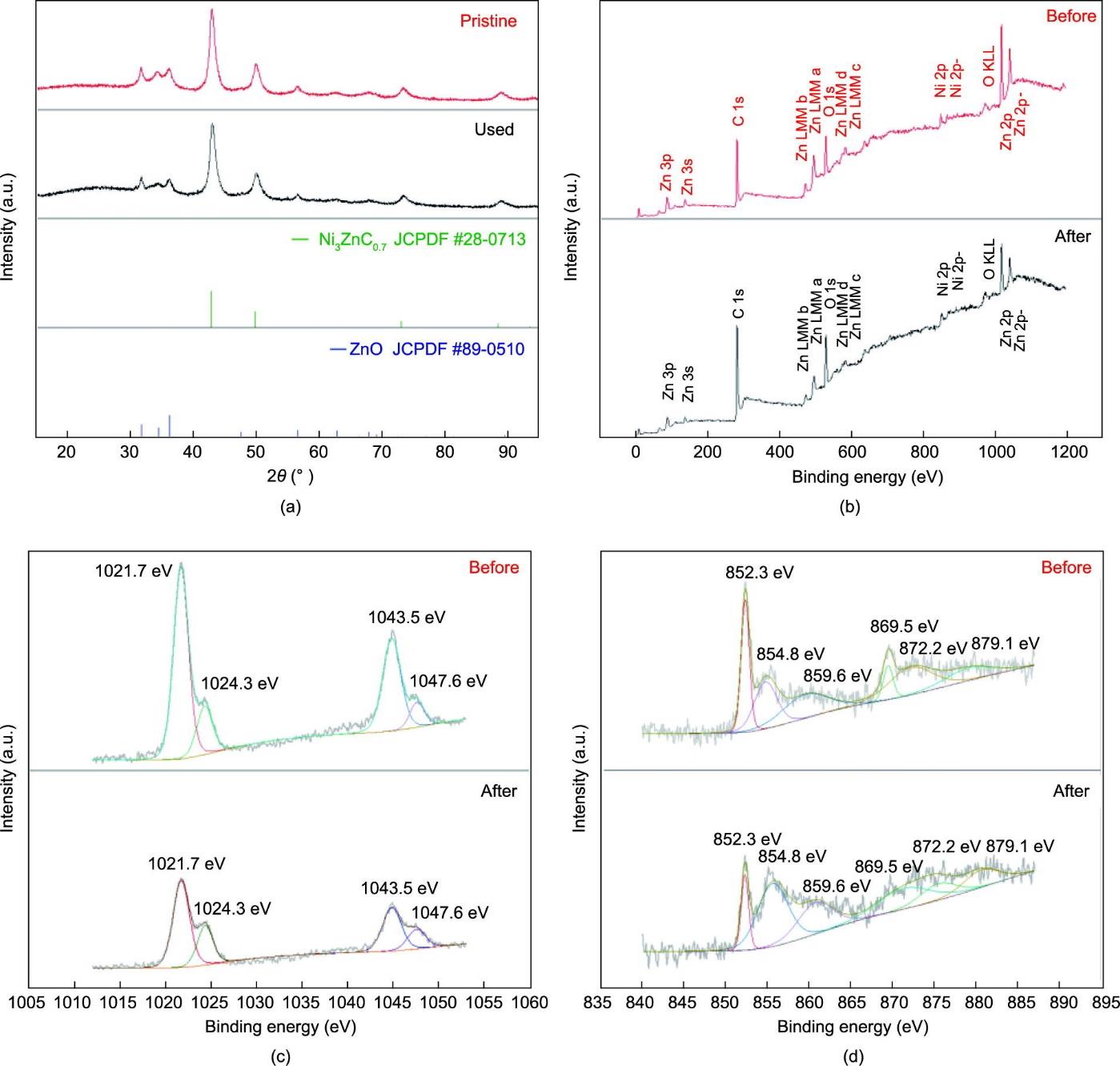
为了确认ZN-CS的晶体结构、相纯度和结构稳定性,检测了原始样品和使用后样品的XRD图谱[图2(a)]。结果表明,催化剂由ZnO(JCPDF #89-0510)和Ni3ZnC0.7(JCPDF #28-0713)组成。在壳层和核心中,ZnO和Ni3ZnC0.7的分布大致均匀(见附录A中的图S6和表S2)。样品的纯度高,未检测到其他晶体杂质。此外,使用后样品的相也经过XRD分析的确认,所得催化剂的相在反应过程中未发生改变。从广角XPS光谱[图2(b)]可以确定,ZN-CS由4种元素组成,即锌、镍、碳和氧。这个结果与XRD分析得到的结果一致。高分辨率的Zn 2p光谱[图2(c)]揭示了两个组分:结合能分别为1024.3 eV和1047.6 eV的ZnO,以及分别位于1021.7 eV和1043.5 eV的 Zn-Ni的两个峰。高分辨率的Ni 2p光谱[图2(d)]揭示了两个组分:在852.3 eV和869.5 eV处的Ni(0)和在854.8 eV和872.2 eV处的Ni2+。此外,还在859.6 eV和879.1 eV观测到两个振荡卫星峰。两种金属形式对应于XRD分析中的两个主要组分——ZnO和Ni3ZnC0.7。Ni2+的形成可能是由于Ni的表面氧化。此外,在降解过程中,ZnO的相对含量略微增加了,从20%增加到30%,表明Zn部分被氧化,起到电子供体的作用。Ni的价态没有明显的变化,表明在讲解中对失去和获得电子的贡献不显著。
《图2》
图2 (a)原始催化剂和使用过的催化剂的XRD图谱;(b)ZN-CS在降解前/后的广角XPS谱图(X射线光电子能谱图);(c)ZN-CS在降解前/后的高分辨率Zn 2p谱图;(d)ZN-CS在降解前/后的高分辨率Ni 2p谱图。
《3.3 吸附机理》
3.3 吸附机理
有一些包括物理吸附和化学吸附的经典的吸附机理解释。物理吸附主要涉及范德华力和静电吸引力。相比之下,化学吸附涉及吸附剂分子与吸附剂固体表面上的原子或分子之间的电子转移或共享而形成的化学键[43‒45]。为了进一步确定吸附机理,进行了几个实验和理论计算。
《3.3.1. 物理吸附》
3.3.1. 物理吸附
《(1). 物理吸附量》
(1). 物理吸附量
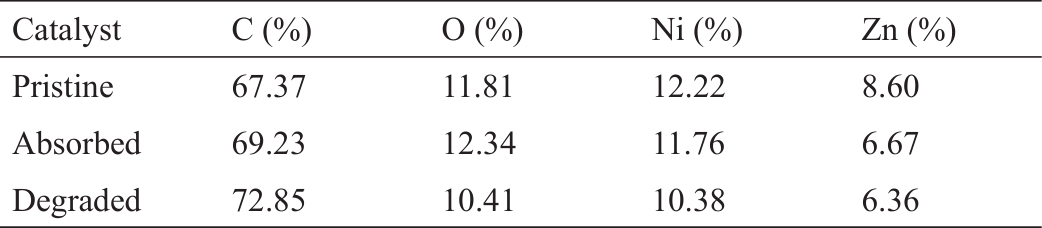
为了确定样品的物理吸附能力,使用SEM-EDS检查了它们的表面形貌和原子组成,并通过氮吸附/脱附实验计算它们的比表面积和平均孔径。合成的催化剂呈球形形态,具有核壳结构。图3(a)展示了原始催化剂的图像。催化剂表面松散多孔,外形类似绣球花。图3(b)为催化剂放大到2000倍的电子显微图。催化剂颗粒大小均匀,少数颗粒的壳结构受损。颗粒内部观察到大小为2~4 μm的团聚物。吸附后,孔道被填充,颗粒继续聚集[图3(c)和(d)]。在降解后,催化剂的形状没有显著变化,核壳结构仍然稳定[图3(e)和(f)]。这与XRD分析的结果一致。由于表面吸附物质的不断沉积,表面孔隙被填充,颗粒表面逐渐失活。这可能导致吸附能力的降低,并在降解过程中释放活性位点,使得吸附能力再生以便重复使用。图3(d)和(f)中的条形物被认为是回收过程中引入的杂质。此外,EDS分析的结果(表1)表明含氧官能团发生了变化,这将在后续的FT-IR表征分析中进行解释。
《图3》
图3 原始催化剂的SEM图像[(a)、(b)]、吸附RhB后的催化剂SEM图像[(c)、(d)],以及降解RhB后的催化剂SEM图像[(e)、(f)]。
《表1》
表1 EDS能谱分析中C、O、Ni、Zn表面元素含量的变化
如图4所示,氮气吸附-脱附等温线被识别为II型,具有H3型滞回线[46]。这是由于由片状颗粒积聚形成的大孔道的存在,并且与前体的形态一致。使用BET分析计算得到的样品比表面积为55.311 m2·g-1。从孔径分布图可以看出,ZN-CS的平均孔径小于20 nm。大的比表面积和狭窄的孔道也可能有助于RhB的富集,并为非均相反应过程提供足够的活性位点。
《图4》
图4 ZN-CS的N2吸附-脱附等温线和孔径分布曲线。STP:标准温度和压力;cc:立方厘米(cm3);P:氮分压;P0:吸附温度下氮的饱和蒸汽压。
《(2). 静电吸引》
(2). 静电吸引
如下所述,电荷作用因素也可能在吸附过程中发挥重要作用[47]。本文测量了催化剂的ζ电位,以确定其在不同pH值下的电荷性质。通过ζ电位分析仪测得反应体系中催化剂的零电荷点(pHPZC)约为7.5(见附录A中的图S7)。这个结果可以从以下两个方面进行讨论。首先,在pH值大于7.5时,催化剂表面带负电荷,负电荷随着pH值的增加而增加。当pH值小于7.5时,表面带正电荷,正电荷随pH值的减小而增加。RhB的pKa(酸度系数的对疏倒数)为3.0,KOW(辛醇-水分配系数)为190 [48]。当pH值大于7.5时,RhB上90%的羧酸分子解离,两性离子(含羧酸离子和季铵离子)数量随pH值的增加而增加。当pH值小于7.5时,随着pH值的降低,RhB上的羧酸解离减少。
因此,pH值的增加有利于增强催化剂与RhB季铵阳离子之间的静电吸引力。此外,催化剂与RhB上羧酸离子之间的静电斥力随pH值的增加而增加。从附录A中图S8可以看出,在pH值为3.02或8.96时,吸附能力有所提高。可能的原因是,在上述条件下,催化剂上所带的电荷更大,静电吸引力更强。
《3.3.2. RhB与ZN-CS的表面络合》
3.3.2. RhB与ZN-CS的表面络合
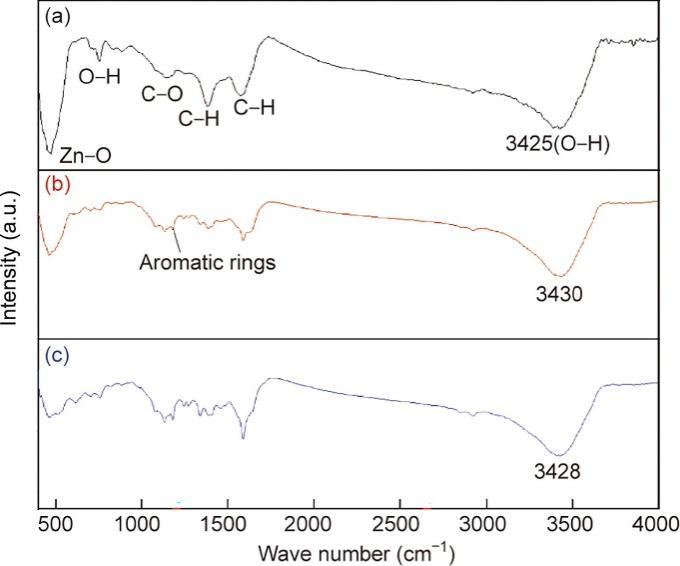
除了RhB与ZN-CS之间的物理吸附,本文还讨论了促进吸附过程的化学键表面络合作用。由于官能团在吸附剂和被吸附物之间的化学键合中起着至关重要的作用,因此对催化剂进行了FT-IR分析,以确定参与吸附过程的主要官能团。样品在100 °C下干燥过夜,以减少结合水对吸收峰的干扰。在750 cm-1处观察到的峰为O—H的弯曲振动(γ O—H)(图5)。在约3425 cm-1处观察到的宽峰归因于羟基的拉伸振动(ν O—H)[18],峰强度的下降可能归因于表面羟基的消耗和再生。此外,当催化剂用于吸附RhB时,上述峰经历了5 cm-1的蓝移(从3425 cm-1到3430 cm-1),表明RhB通过取代氧化物表面的O—H基团与催化剂结合[49‒50]。此外,由于芳香环的振动[51‒52],在吸附RhB的材料中观察到1178 cm-1处的新峰。这些结果表明,吸附机制涉及RhB和ZN-CS之间的表面络合。为了进一步证实化学吸附的作用,使用磷酸盐来屏蔽ZN-CS表面的羟基团,因为磷酸盐对该吸附位点具有更强的亲和力[53]。结果显示,在遮蔽剂存在的情况下,吸附容量减少了约10%(见附录A中的图S9)。这表明羟基团参与了化学吸附过程。
《图5》
图5 (a)原始催化剂的FT-IR光谱;(b)吸附后的催化剂的光谱;(c)降解后的催化剂的光谱。
《3.3.3. 动力学分析》
3.3.3. 动力学分析
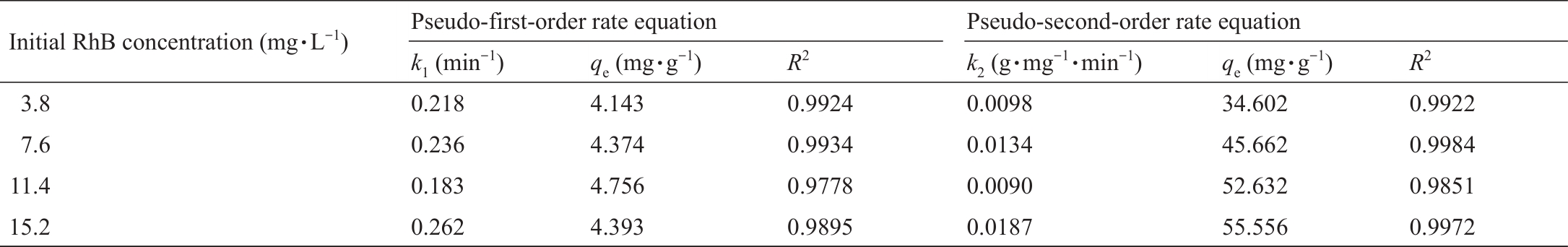
吸附动力学研究对阐明吸附机制至关重要。因此,使用拟一阶[54]和拟二阶[55‒56]模拟计算了吸附过程的动力学数据(见附录A中的文本S2)。计算得到的动力学数据(表2)表明,二级动力学能更好地描述吸附过程,表明化学吸附是速率决定步骤[56]。
《表2》
表2 拟一阶和拟二阶吸附速率方程中吸附速率常数、估计参数和相关系数的比较
不同吸附模型的拟合结果表明,Freundlich模型能最好地描述吸附过程,RhB在ZN-CS表面的吸附基本上是化学吸附(见附录A中的文本S3和表S3)。热力学参数(ΔG,ΔS和ΔH)的值表明,RhB在ZN-CS表面的吸附是自发、可行和放热的(见附录A中的图S10、文本S4和表S4)。综上所述,吸附过程主要由范德华力、静电吸引和羟基的表面络合作用决定,其中化学吸附是决定吸附速率的步骤。
《3.4 降解机理》
3.4 降解机理
《3.4.1. 活性物质和活性位点的鉴定》
3.4.1. 活性物质和活性位点的鉴定
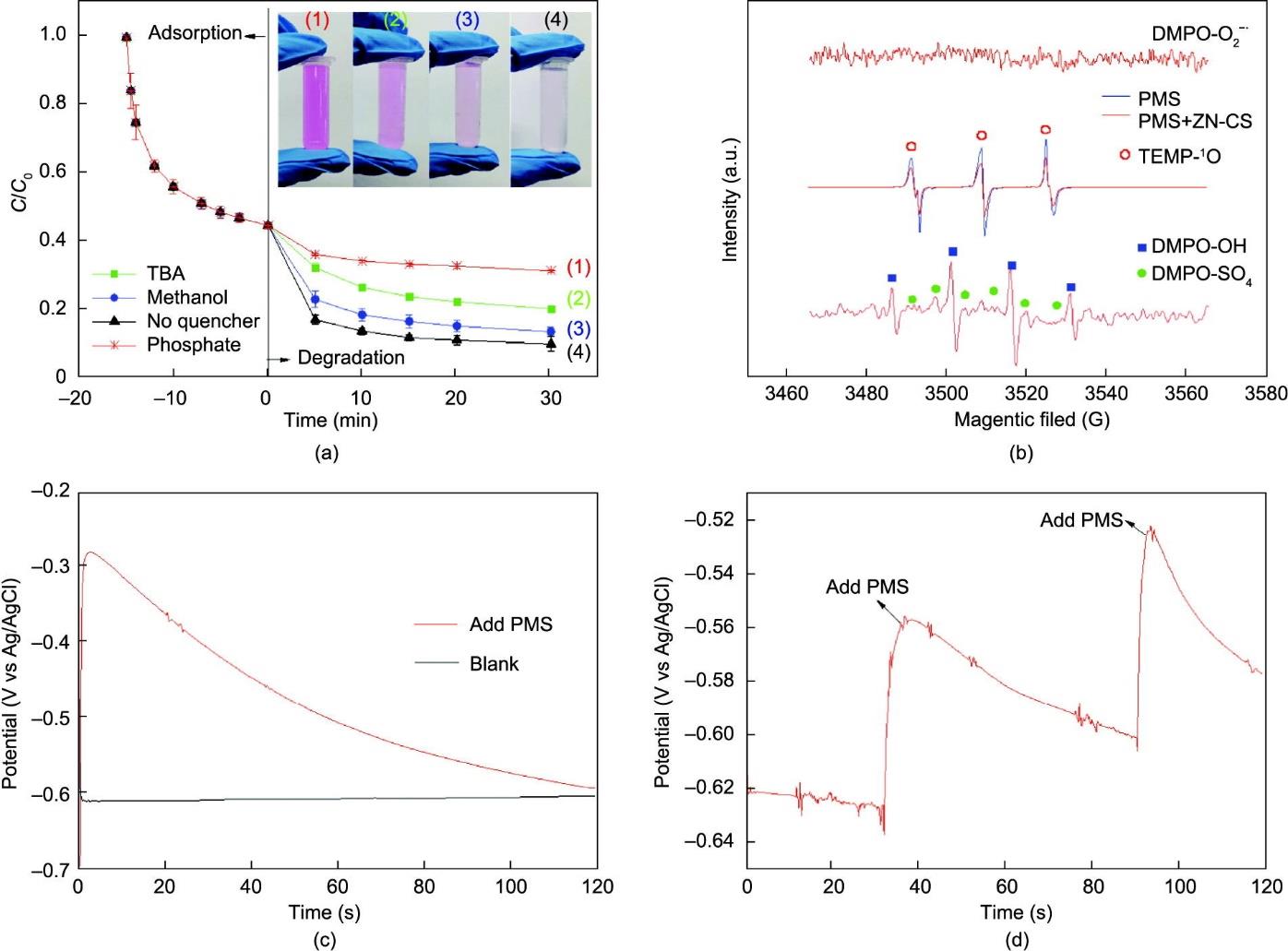
为了确定涉及的反应活性物种,使用了不同的淬灭剂,并研究了它们对RhB降解的影响[图6(a)]。甲醇和TBA被用来淬灭
《图6》
图6 (a)淬灭剂对反应的影响。TBA∶PMS = 1000∶1,甲醇∶PMS = 1000∶1,磷酸盐∶PMS = 5∶1(摩尔比)。反应条件:催化剂用量为100.00 mg·L-1,PMS用量为200.00 mg·L-1,初始RhB浓度为7.6 mg·L-1,室温,pH0 = 6.3;(b)不同体系中二甲基吡啶N-氧化物(DMPO)和2,2,6,6-四甲基哌啶(TEMP)自旋俘获的EPR光谱;(c)不同体系下ZN-CS电极上的时电位曲线([NS] = 0.5 mmol·L-1, [PMS] = 200.00 mg·L-1);(d)逐渐加入PMS后,降解体系中ZN-CS电极上的时间电位曲线([NS] = 0.5 mmol·L-1, [RhB] = 7.6 mg·L-1);NS:硫酸钠。
使用2,2,6,6-四甲基哌啶(TEMP)和二甲基吡啶N-氧化物(DMPO)作为自旋捕获剂进行EPR分析,以确定反应的自由基物种。在PMS/ZN-CS体系中观察到对应于DMPO-OH复合物的特征峰和对应于DMPO-SO4复合物的微弱信号[图6(b)]。由于实际检测中痕量硫酸盐自由基的捕获困难,DMPO-SO4复合物对应的信号较弱,与噪声信号具有相同的高度。此外,未检测到对应于
Ding等[72]总结了估算自由基过程和非自由基过程贡献率的方法[见附录A中的文本S7,公式S20~S22]。结果表明,自由基过程的贡献率约为34.1%,非自由基过程的贡献率约为65.9%,表明非自由基过程在该体系中起着重要作用。
近年来,人们提出了氧化剂间接氧化污染物的机理。污染物与由碳材料和氧化剂形成的高电位中间体之间的直接电子转移越来越受到重视。Ren等[73]提出过二硫酸盐(PDS)可以通过碳纳米管(CNT)催化形成高氧化还原电位的复合材料,用于直接降解有机化合物。基于Ren等的研究,本文使用催化剂作为电极确认了高电位中间体的形成(见附录A中的文本S8),并通过电位计分析监测了开路电位。在添加PMS后,开路电位显著增加[图6(c)],表明催化剂和PMS结合形成了高电位中间体(表示为ZN-CS*PMS)。电位的逐渐降低可以归因于高电位活性物质的消耗。随后补充PMS可以帮助恢复电位[图6(d)]。这表明ZN-CS*PMS具有直接氧化的潜力。
此外,确定催化剂上的活性位点对阐明机制是至关重要的。为了确定激活PMS的活性位点,分析了降解后催化剂的功能基团变化。图5展示了ZN-CS在400~4000 cm-1范围内的FT-IR光谱。在大约460 cm-1、750 cm-1、1137 cm-1、1383 cm-1、1570 cm-1和3425 cm-1处发现了5个不同的吸收带。如前所述,由于存在羟基[18],约在3425 cm-1处的峰强度增加表明在降解过程中O—H的再生。在添加PMS后,该吸收带的红移表明RhB与ZN-CS之间的结合被破坏,催化剂表面吸附的RhB被部分降解。反应后,约在460 cm-1处(对应于Zn—O键的伸缩)[74‒77]的吸收带减少表明ZnO被消耗或浸出。
最后,其余三个吸收带基本一致,证实了ZN-CS的稳定性。为了证实表面羟基的作用,用亲和力更强的磷酸进行了掩蔽实验[53],确认了表面羟基基团在PMS激活中的作用。
ZnO是一种包含大量移动电子的半导体,具有良好的电容特性[78]。它可以传递和存储电子,有利于ZN-CS*PMS中间体与污染物之间的电子转移和传导。此外,Ni3ZnC0.7具有良好的电导率[79]和电子转移能力。因此,可以假设Zn和Ni在ZN-CS*PMS与非自由基途径中的有机污染物之间的电子转移中起重要作用。在自由基过程中,Zn和Ni可能充当电子供体和受体,而在非自由基过程中,它们主要发挥电子传导的作用。因此,在ZN-CS的有机部分作用下,可能的降解机制可以用以下公式表示[公式(1)~(7)]。
(1)
(2)
(3)
(4)
(5)
(6)
(7)
《3.4.2. 再生性能》
3.4.2. 再生性能
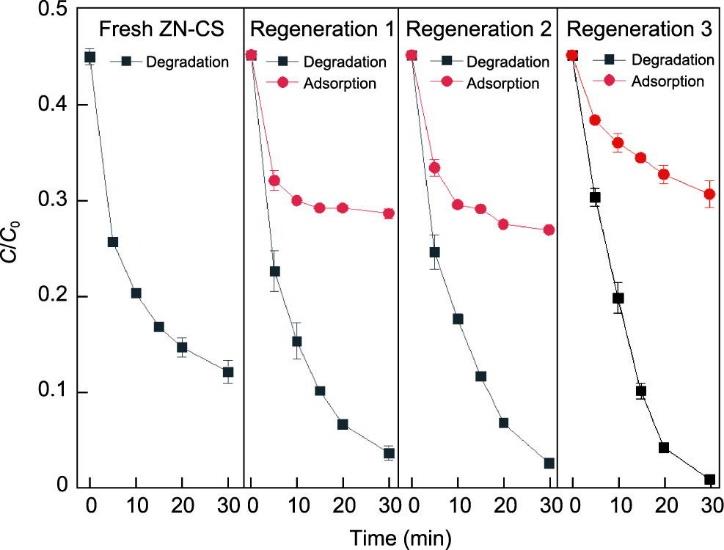
在回收实验中,RhB的去除被分为两个阶段。为了简化再生和重复使用,仅使用去离子水清洗和干燥催化剂,没有采取特殊措施进行催化剂脱附。如图7所示,在回收实验中催化剂的去除率保持在90%以上。再生后的催化剂对RhB的降解效果很好。催化剂循环使用中性能更好的原因如下。首先,即使没有脱附,再生样品在循环实验中对RhB具有一定的吸附容量。这是因为在批量实验中原来吸附的一些RhB已被降解,再生样品可以恢复一定的吸附容量。其次,产生的自由基或ZN-CS*PMS主要攻击表面吸附的染料。溶液中的自由RhB分子很少被攻击,导降解阶段溶液中的脱色率较低。相反,在循环实验中省略了预吸附步骤,ZN-CS/PMS体系产生的自由基攻击了溶液中许多自由的RhB分子,从而提高了去除效率。再次,吸附和降解阶段的主要活性位点都是表面羟基基团。在循环实验中,只有一部分表面羟基基团被染料分子占据,从而导致更多可用的活性位点和更高的去除效率。这表明吸附和降解过程具有耦合效应,而ZN-CS在这样的连续过程中保持了足够的性能,催化剂的可循环使用性有助于推广更清洁的生产技术。
《图7》
图7 ZN-CS的再生性能和可重复使用性。反应条件:
《3.5 耦合过程的机理》
3.5 耦合过程的机理
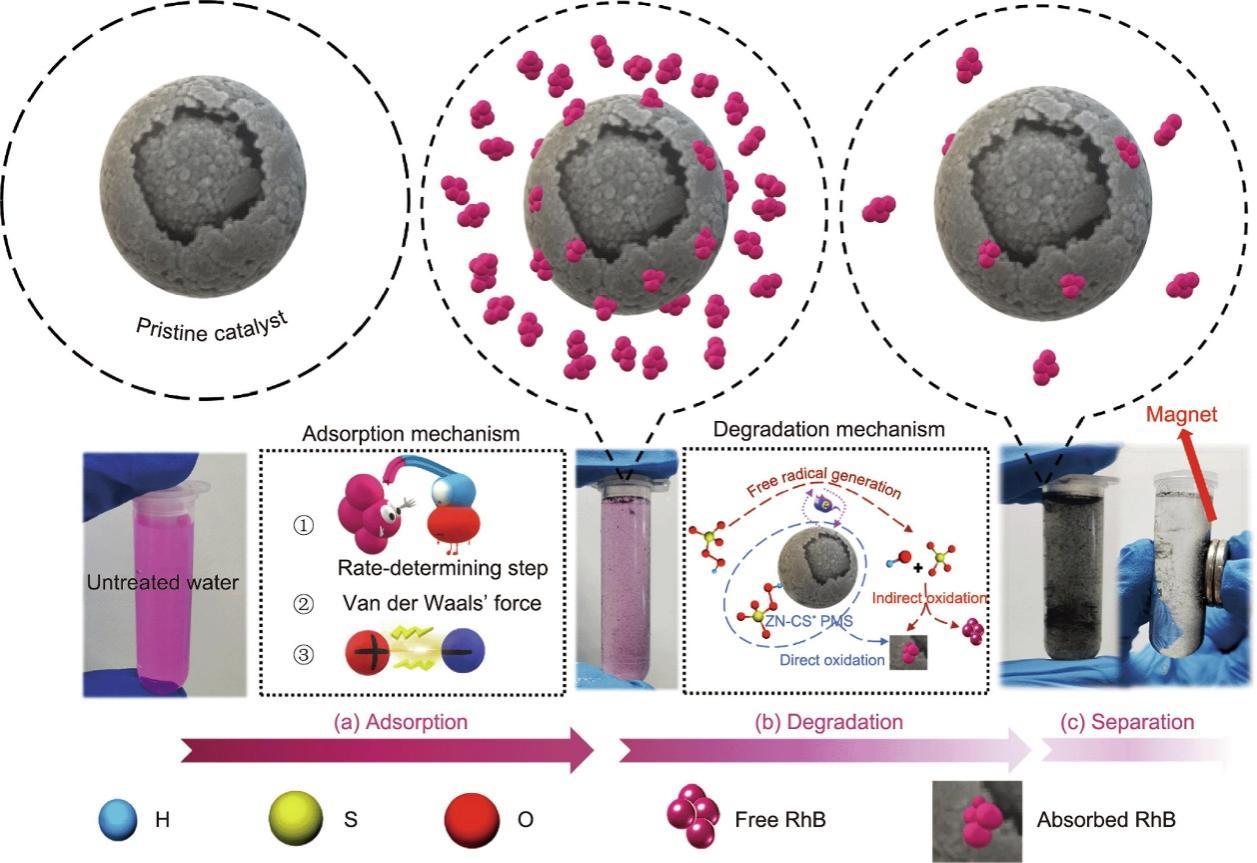
基于上述现象和分析,可以总结整个过程的机制(图8)。首先,由于范德华力、静电吸引和氢键络合作用,一部分RhB分子被吸附在催化剂表面,从而使得它们在溶液中的浓度下降。与此同时,RhB分子变为两种形式:吸附形式和游离形式(在水相中游离)。添加PMS后,观察到了降解的自由基和非自由基途径;这些途径同时攻击了两种形式的RhB分子。随后,溶液中的游离RhB几乎被完全去除,吸附的RhB也几乎被完全去除,这使得ZN-CS的部分吸附容量再生。此外,表面羟基是吸附和降解过程的主要活性位点。因此,对于吸附RhB的降解有利于促进降解过程的活性位点的再生,这也是再生性能提高的可能原因之一。最后,磁性ZN-CS可以很容易地从处理过的溶液中分离出来。
《图8》
图8 催化耦合过程的可能机理。(a)吸附机制;(b)降解机制;(c)分离机制。
《3.6 去除不同有机化合物的效果》
3.6 去除不同有机化合物的效果
为了检查ZN-CS的广泛适用性,使用ZN-CS/PMS体系对不同目标污染物(AO7、MB、Nor和TC)进行降解实验。实验结果如图9和附录A中的图S11所示。目标污染物和实验条件的基本信息在附录A的表S5中给出。MB是典型的阳离子染料,AO7是典型的阴离子染料,而TC和Nor分别代表水中的药物和个人护理产品(PPCP)。它们的大小和结构、在水中的电负性以及氢键受体和给体不同,可能导致它们的去除效果不同。如图9所示,ZN-CS/PMS体系对AO7的去除效率超过70%,而在PMS系统中,去除效果可以忽略不计。在第五分钟,溶液中AO7浓度的增加可能是由于添加PMS导致部分吸附的AO7脱附。对于MB,ZN-CS/PMS体系表现出超过90%的去除效率,而在PMS体系下去除效率不到20%。对于Nor,该体系展现出超过50%的去除效率,而在PMS体系中去除效率约为20%。对于TC,该体系的去除效率可以达到约80%,而PMS系统的去除效率约为40%。附录A中的图S9和文本S9说明了几个重要参数的影响。附录A中的图S12说明了RhB在真实水样中的去除情况。总之,ZN-CS对不同电性和大小的各种污染物均具有良好的吸附和降解效率,因此具有广泛的应用前景。
《图9》
图9 ZN-CS/PMS体系吸附和降解不同目标污染物的效果[ [ZN-CS] = 100.00 mg·L-1, [PMS] = 200.00 mg·L-1), pHin(初始pH值)= pH0 ]。(a)AO7(反应条件:[AO7] = 10.00 mg·L-1);(b)MB(反应条件:[MB] = 4.00 mg·L-1);(c)Nor(反应条件:[Nor] = 5.00 mg·L-1);(d)TC(反应条件:[TC] = 10.00 mg·L-1)。
《4、 结论》
4、 结论
综上所述,成功合成了磁性复合材料ZnO/Ni3ZnC0.7,并将该复合材料开发为有效的吸附剂和多相催化剂,用于PMS氧化去除多种有机化合物。这种纳米复合材料的磁性能够使其从溶液中快速、容易地分离出来。本研究提出了一个可能的吸附过程机制,该机制与静电因素和氢键有关。降解过程的机制表明,有机化合物主要被高电位中间体ZN-CS*PMS和PMS产生的羟基自由基氧化,这些自由基主要由表面羟基基团激活。由于吸附底物的降解,ZN-CS的吸附容量得以再生,实现了耦合效应。与一些先前研究相比,本处理体系没有使用贵金属。此外,该系统采用吸附-降解过程以实现经济效益和处理效果之间的平衡。此外,合成的催化剂具有磁性、可回收性、稳定结构,对多种有机物均有良好的去除效率。本研究为开发高效的磁性MOF基材料用于废水处理提供了新思路,并具有在印染废水或医疗废水处理中的潜在应用前景。
















 京公网安备 11010502051620号
京公网安备 11010502051620号




