《1、 引言》
1、 引言
器官移植是治疗各种晚期器官功能衰竭的最有效方法,然而移植排斥反应仍然是限制临床同种异基因器官移植(以下称为“器官移植”)长期疗效的最主要因素。一般而言,在同种异基因器官植入受体后,天然免疫细胞即开始介导天然免疫反应和炎症,其后启动适应性免疫介导的器官移植排斥反应(以下称为“排斥反应”)[1]。目前一线免疫抑制药物主要针对适应性免疫细胞,但其在改善移植器官长期存活方面的效果仍十分有限,这促使人们越来越关注天然免疫细胞在排斥反应中的作用。事实上除了参与炎症反应外,树突状细胞(dendritic cell, DC)、巨噬细胞以及自然杀伤(natural killer, NK)细胞等天然免疫细胞也密切参与排斥反应[2‒4]。传统观念认为天然免疫细胞主要通过炎症和抗原提呈作用参与排斥反应,然而越来越多的证据表明天然免疫细胞的作用机制远不止这些[5‒8]。同时,新近的研究也提示,除T细胞以外的免疫细胞在排斥反应中的作用愈发重要,尤其是天然免疫细胞[5‒6]。
巨噬细胞的表型和功能状态受其所处微环境的影响,因此具有很强的异质性和可塑性[1,9‒11]。传统上,幼稚巨噬细胞(naïve macrophages, M0)能被不同的条件诱导极化成M1型和M2型巨噬细胞[12‒16]。M1型巨噬细胞极化的条件包括干扰素(interferon, IFN)-γ或者脂多糖(lipopolysaccharide, LPS)+IFN-γ,这种极化依赖于信号转导与转录激活子(signal transducer and activator of transcription, STAT)1。M1型巨噬细胞能够产生白介素(interleukin, IL)-1、IL-6、肿瘤坏死因子(tumor necrosis factor, TNF)-α和一氧化氮(nitric oxide, NO),并且与Th1型免疫反应相关。M2型巨噬细胞极化条件包括IL-4和IL-13,M2极化依赖于STAT6;M2型巨噬细胞能够产生IL-10、转化生长因子(transforming growth factor, TGF)-β和精氨酸酶。在功能方面,M1型巨噬细胞发挥促进炎症反应和组织损伤的作用,M2型巨噬细胞发挥抑制炎症反应和促进纤维化的功能。新近的研究发现IL-23能够诱导一群独特的巨噬细胞,这群巨噬细胞主要产生IL-17A、IL-17E和IL-22 [17];M0巨噬细胞也能够被极化成血红蛋白/触珠蛋白诱导的巨噬细胞[haemoglobin/haptoglobin complexes-induced macrophages, HA-mac/M(Hb)]和亚铁血红素诱导的巨噬细胞(heme-induced macrophage, Mhem)[18]。此外,一些巨噬细胞亚群具有免疫调节功能,如调节性巨噬细胞(regulatory macrophage, Mreg)(图1)。
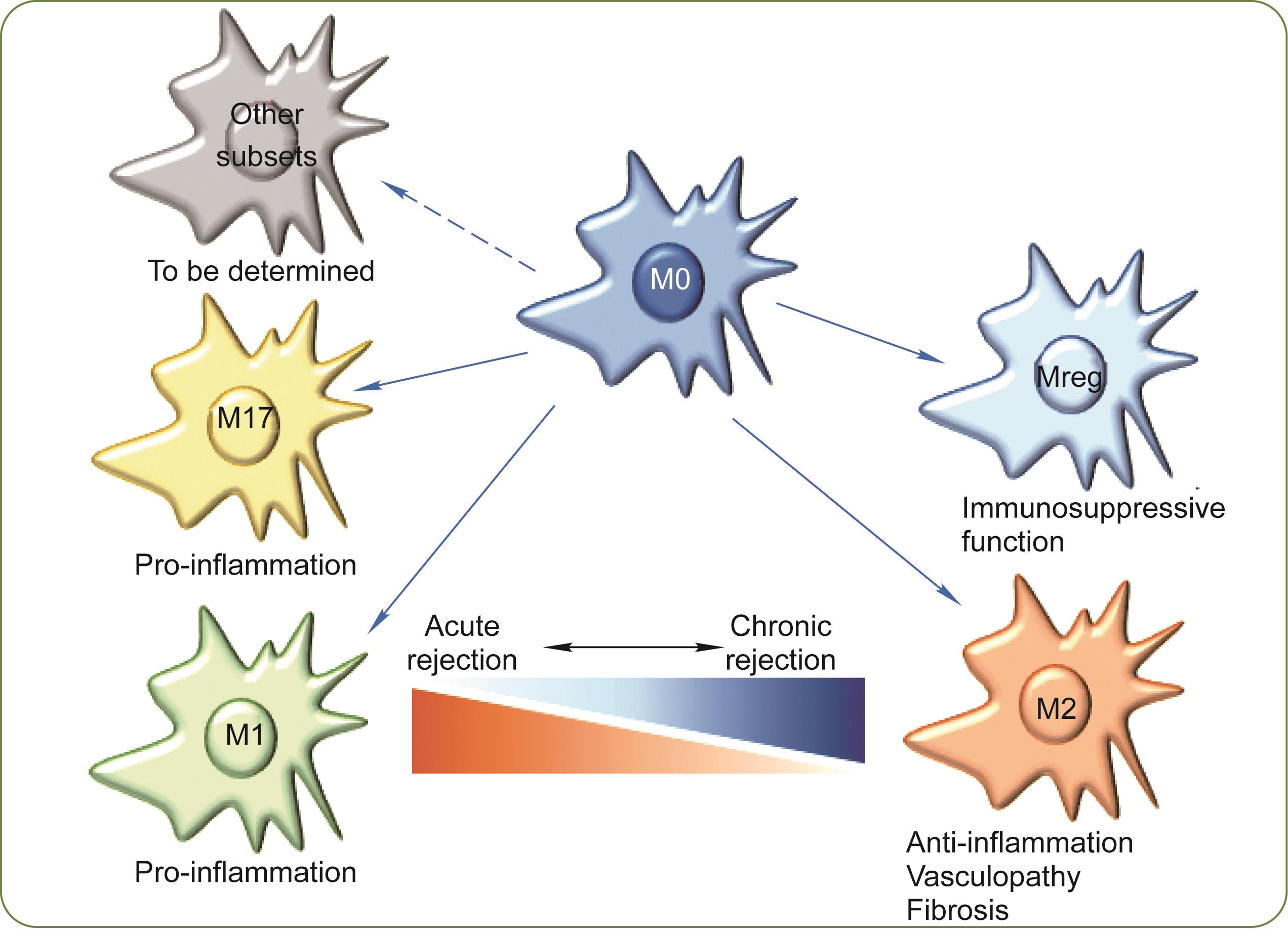
《图1》
图1 巨噬细胞亚群在移植免疫中的作用。M0(幼稚)巨噬细胞可以极化为M1和M2。M1巨噬细胞具有促炎症作用,M2巨噬细胞主要起抗炎作用,促进血管病变和纤维化。急性排斥反应时移植物浸润的巨噬细胞主要是M1,慢性排斥反应时主要是M2。M0也可以极化为M17、HA-mac、M(Hb)和Mhem巨噬细胞,但对它们在移植免疫中的作用的研究仍然有限。M0可分化为Mreg,后者在移植免疫中表现出免疫抑制功能。Mreg为调节性巨噬细胞。
排斥反应发生时,巨噬细胞是浸润移植器官中的主要免疫细胞之一,并且这与器官移植的短期和长期效果密切相关[19‒23]。因此,巨噬细胞在移植免疫中的作用十分重要,尤其是在受体的适应性免疫功能被抑制的情况下。利用小鼠同种异基因肾脏移植模型,Einecke等[24]描述了早期移植器官内巨噬细胞的动态变化过程。移植术后第1天,移植肾脏内产生了许多与巨噬细胞活化相关的因子,如同种异基因移植炎症因子1(allograft inflammatory factor 1, AIF1)、NO合酶2(nitric oxide synthase 2, Nos2)和TNF-α;从移植术后第2天开始,移植肾脏内浸润的巨噬细胞数量开始逐渐增加。巨噬细胞参与排斥反应的机制包括:提呈抗原,提供共刺激信号,产生细胞因子,与其他免疫细胞的交流以及发挥免疫调节作用。更重要的是,新近我们发现巨噬细胞能够直接介导移植器官排斥反应[8]。目前一些免疫耐受诱导方案包括通过Mreg实现器官移植免疫耐受的目标[25‒27]。此外,巨噬细胞也是抑制排斥反应的潜在靶标[7]。事实上,利用纳米生物技术制备的药物能够特异性抑制巨噬细胞,从而实现移植免疫耐受[28‒29]。本文旨在探讨巨噬细胞在器官移植中的不同作用,包括巨噬细胞在排斥反应发生方面的作用及其机制、免疫调节性巨噬细胞对移植器官的保护作用以及免疫抑制药物对巨噬细胞的影响。
《2、 巨噬细胞在同种异基因移植器官中的募集》
2、 巨噬细胞在同种异基因移植器官中的募集
因缺血再灌注损伤(ischemia and reperfusion injury, IRI)、炎症、组织损伤等原因,移植器官在移植后必然会发生天然免疫反应[30‒31]。以小鼠同种异基因肾移植为例,移植后移植肾内IFN-γ诱导的转录本(如泛素蛋白D)、趋化因子配体(包括CXCL9、CXCL10、CXCL11)的表达会渐进性升高,巨噬细胞活化相关转录本(如AIF1、Nos2、TNF-α)的表达水平在移植后第1天便会显著增加[24]。一些移植器官产生的趋化蛋白能够促进巨噬细胞向移植器官浸润,如单核细胞趋化蛋白1(monocyte chemotactic peptide-1, MCP-1)、细胞间黏附分子1(intercellular adhesion molecule 1, ICAM-1)、血管细胞黏附分子1(vascular cell adhesion molecule 1, VCAM-1)、巨噬细胞炎症蛋白1α(macrophage inflammatory protein 1α, MIP-1α)、受激活调节正常T细胞表达和分泌因子(regulated-on-activation,normal T cell-expressed and secreted chemokine, RANTES)、巨噬细胞游走抑制因子(macrophage migration inhibitory factor, MIF)[32‒37]。IRI也会提升移植器官内脂质运载蛋白2(lipocalin-2, Lcn2)的表达水平,进而促进巨噬细胞向小鼠同种异基因移植心脏浸润[38]。
细胞之间的相互作用对巨噬细胞浸润移植器官的功能十分重要。有研究证实来自CD4+ T的辅助能够促进巨噬细胞的浸润能力[39],并且也有观点认为T细胞的活化能够引起巨噬细胞的浸润[40]。此外,有研究发现B细胞缺失能够抑制巨噬细胞浸润大鼠同种异基因移植肾脏的能力[41]。与之相对应,大鼠同种异基因移植肾脏在发生急性排斥反应时,其内浸润的巨噬细胞数量急剧增加[42]。
除了浸润,巨噬细胞也会在移植器官内增殖[21,43‒44]。巨噬细胞集落刺激因子(macrophage colony-stimulating factor, M-CSF)促进巨噬细胞的增殖,而移植器官以及浸润其中的巨噬细胞均显著表达M-CSF。在发生急性排斥反应的小鼠同种异基因移植肾脏中,浸润的巨噬细胞表达M-CSF的受体集落刺激因子-1受体(colony-stimulating factor-1 receptor, c-FMS),而拮抗c-FMS能够显著抑制巨噬细胞的浸润及其在移植器官内的增殖[43‒44]。根据以上研究结果,我们认为浸润和在移植器官内的增殖是巨噬细胞在移植器官内募集的途径。结合巨噬细胞在排斥反应中的作用,针对巨噬细胞浸润和增殖可能是抑制排斥反应的潜在有效途径。
《3、 巨噬细胞与排斥反应》
3、 巨噬细胞与排斥反应
《3.1 提供适应性免疫活化所需的刺激信号》
3.1 提供适应性免疫活化所需的刺激信号
作为抗原提呈细胞(antigen-presenting cell, APC),巨噬细胞能够通过三种途径作用于受体的适应性免疫反应:提呈主要组织相容性复合物(major histocompatibility complex, MHC)——抗原肽复合物,提供共刺激信号以及产生细胞因子。Jose等[43]详细总结了巨噬细胞的潜在作用:①识别与提呈同种异基因抗原;②产生促炎分子促进炎症的发生;③释放NO和活性氧自由基(reactive oxygen species, ROS)参与抗体依赖的或细胞介导的细胞毒作用;④释放促纤维化因子和基质金属蛋白酶促进瘢痕形成。Benichou等[30]指出巨噬细胞能够分泌一系列与细胞毒性相关的细胞因子,包括IFN-α/γ、TNF-α、IL-1、IL-6、IL-12、IL-18、IL-15、ROS以及粒细胞集落刺激因子(granulocyte CSF, G-CSF)。
最近,关于CD47对巨噬细胞的调控作用备受瞩目。20多年前,发现信号调节蛋白α(signal regulatory protein α, SIRPα)-CD47通路能够调节巨噬细胞区分自我和非我抗原以及吞噬功能[45]。事实上,所有细胞都表达CD47分子,CD47分子也被冠以“不吃我”(don’t eat-me)信号分子,而SIRPα可在单核细胞、巨噬细胞、DC和粒细胞中表达[46]。对于SIRPα与CD47的相互作用,在肿瘤、自身免疫疾病、同种异基因和异种器官移植领域均有所研究。在同种异基因器官移植领域,CD47分子可能在移植的不同阶段发挥不同的作用。
供体细胞表达CD47有利于供体抗原诱导的免疫耐受。移植前,供体特异性细胞输注(donor-specific transfusion, DST)是常见的诱导移植耐受方法,而供体细胞表达CD47对这种诱导性免疫耐受的形成十分重要。在小鼠皮肤移植模型中,移植前DST的供体细胞若缺乏CD47,将导致DST不能抑制排斥反应和诱导同种异基因移植皮肤的长期存活[47‒48]。对于供体肝细胞输注和同种异基因小鼠皮肤移植的研究也发现了此类现象[49]。Zhang等[49]发现与移植前DST使用普通供体小鼠来源的肝细胞相比,输注缺乏CD47的供体小鼠来源的肝细胞能够诱发严重的同种异基因皮肤移植排斥反应。然而,在小鼠同种异基因心脏移植模型中,MHC-I/II或II类分子错配的移植心脏不表达CD47反而延长移植心脏的生存时间[50]。
同种异基因移植器官表达的CD47可能会促进IRI的发生。移植前利用CD47拮抗剂灌注同种异基因移植器官,能够显著降低IRI,提升移植器官的功能和生存率,这些器官包括大鼠移植肾脏、发生脂肪变性的大鼠肝脏以及猪的心脏[51‒53]。
同种异基因移植器官表达的CD47可能有利于同种异基因移植器官的功能稳定和长期生存。在大鼠同种异基因肾脏移植模型中,移植后注射拮抗SIRPα或CD47的单克隆抗体会打破已经形成的免疫耐受[54]。以上研究预示,因CD47调控的复杂性和其他作用的存在,巨噬细胞与CD47在移植免疫中的作用仍有待进一步探究。
《3.2 急性排斥反应》
3.2 急性排斥反应
在适应性免疫反应为主的急性排斥反应中,巨噬细胞主要发挥APC的作用(图2);然而,巨噬细胞具备直接介导排斥反应的作用。在急性排斥反应中,清除巨噬细胞可延长同种异基因移植心脏的生存时间并保护其功能[55]。研究发现在人的移植肾脏中,巨噬细胞占浸润的人类白细胞抗原(human leukocyte antigen, HLA)-DR+细胞的80% [21],这提示移植器官内的巨噬细胞具备很强的抗原提呈能力。此外,移植器官内的巨噬细胞的数量与T细胞介导的排斥反应程度之间存在相关性[21,56]。通过研究人的移植肾穿刺病理结果,发现轻度排斥反应标本中浸润细胞的52%为巨噬细胞,而重度排斥反应标本中这一比例增至60% [56]。同时,急性排斥反应过程中,浸润同种异基因移植器官的巨噬细胞主要表现为M1极化状态[54,57‒58]。此外,人移植心脏病理证据提示,巨噬细胞的血管内活化与急性血管性排斥反应相关,而这些活化的巨噬细胞能够通过降低小血管中的血流量从而导致心肌坏死[59]。
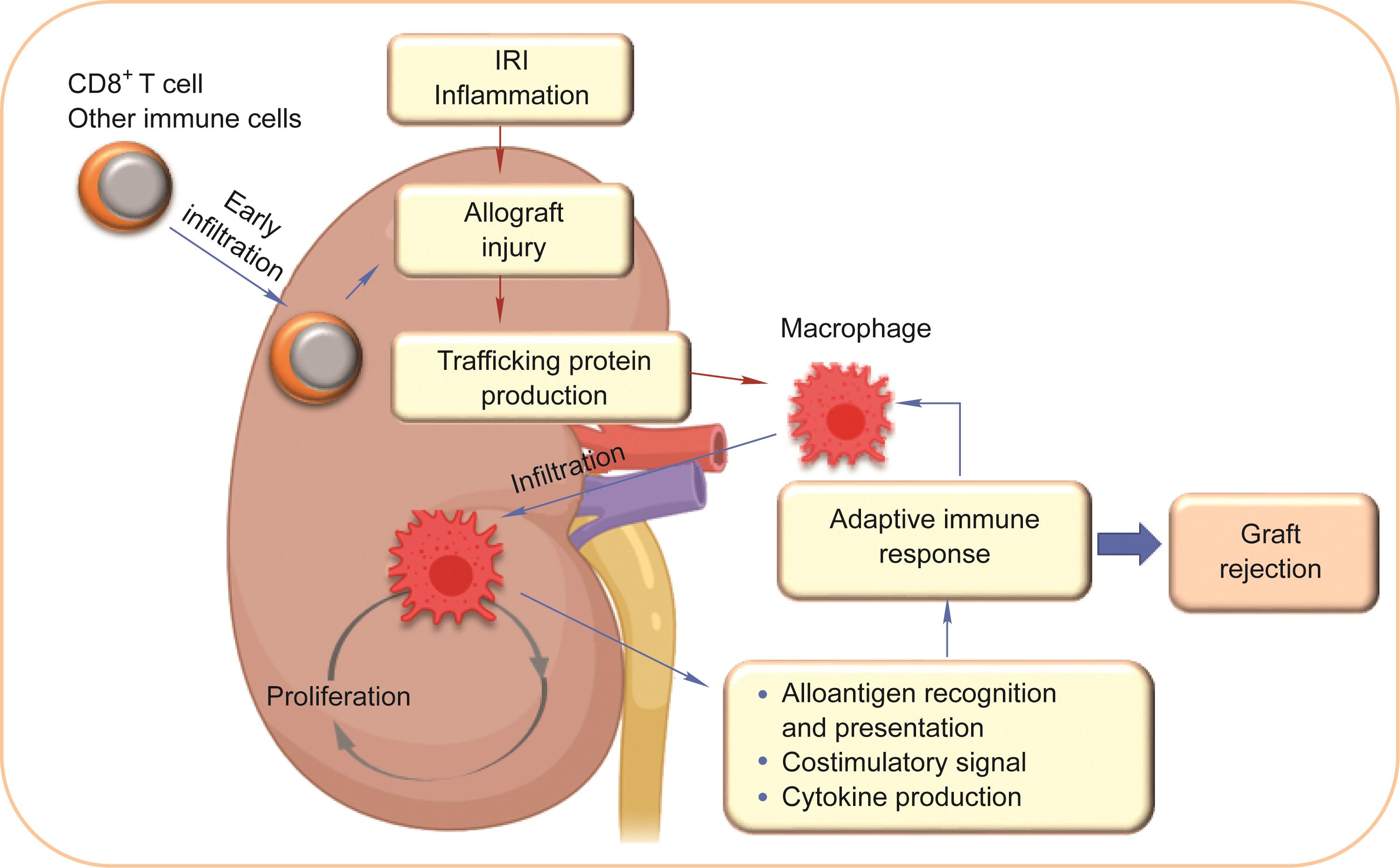
《图2》
图2 巨噬细胞触发并增强对器官异体移植物的适应性免疫反应。器官移植物损伤和其他免疫细胞导致巨噬细胞向同种异体移植物浸润。被招募的巨噬细胞可以在局部增殖以增加细胞数量。巨噬细胞可以通过抗原提呈、共刺激信号和细胞因子的产生触发和放大适应性免疫反应。
《3.3 慢性排斥反应》
3.3 慢性排斥反应
目前,慢性排斥反应是限制同种异基因移植器官长期生存的重要因素,然而目前仍然缺乏有效治疗慢性排斥反应的措施[60‒61]。血管病变和间质纤维化是慢性排斥反应的主要病理特征,而巨噬细胞在这些病理变化中发挥重要作用。在小鼠同种异基因心脏移植中,清除巨噬细胞能显著抑制移植心脏的血管病变[62]。临床研究也证实,巨噬细胞浸润与移植肾小管损伤和纤维化进程相关[20]。巨噬细胞可以通过以下两种途径促进纤维化的发生:①促进纤维母细胞在移植器官内的募集、增殖和活化;②巨噬细胞转化为肌成纤维细胞[63]。M2巨噬细胞能够大量分泌TGF-β,而后者是促进纤维化的重要细胞因子[64]。在发生损伤的同种异基因移植器官中,巨噬细胞可以发生巨噬细胞-肌成纤维细胞转化(macrophage-myofibroblast transition, MMT)。发生慢性损伤的人移植肾脏中,活动性间质纤维化病灶中的M2巨噬细胞表达α-平滑肌肌动蛋白(α-smooth muscle actin, SMA),后者是肌成纤维细胞的标志之一[65];此外,MMT细胞主要表现出M2极化状态并且大量为CD68+ α-SMA+ 细胞[66]。
慢性排斥反应中浸润移植器官的巨噬细胞主要表现M2型极化状态[20,39,60,65,67]。病理证据显示,移植一年的人移植肾脏中92%的巨噬细胞为M2型[20]。对于小鼠心脏移植慢性排斥反应的研究发现,移植后两周开始M1型标志物表达增加(IL-1β、IL-6、IL-15、IL-18、TNF-α、Nos2),并于术后6周显著减少;与此同时,M2型标志物(Ym1、Fizz1、VEGF、TGF-β和CD206)表达显著增加[39]。
一些研究对巨噬细胞在移植器官慢性血管病变和间质纤维化的作用机制进行了探究。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、肿瘤坏死因子受体相关因子(tumor necrosis factor receptor associated factor 6, TRAF6)是调节巨噬细胞M1和M2极化的关键因子[6]。在小鼠同种异基因移植心脏的慢性排斥反应条件下,敲除巨噬细胞的mTOR导致M2型极化受抑制,从而抑制慢性排斥反应;而敲除巨噬细胞的TRAF6抑制M1极化,但导致严重的移植器官血管病变。此外,mTOR信号通路能够调节程序性死亡蛋白配体-1(programmed death ligand-1, PD-L1)的表达。敲除mTOR促使巨噬细胞的PD-L1的表达水平增加,从而抑制小鼠同种异基因移植心脏的慢性排斥反应,而给予PD-L1拮抗剂能降低这种抑制作用[6]。利用小鼠同种异基因移植心脏慢性排斥反应模型,有研究发现缺乏Ras同源基因家族成员A(Ras homolog gene family member A, RhoA)能够通过下调趋化因子C-X3-C基元受体(C-X3-C chemokine receptor 1, CX3CR1)抑制巨噬细胞浸润移植心脏的能力,从而抑制慢性排斥反应[68];也有研究发现浸润移植心脏的M2型巨噬细胞表达嘌呤P2X7受体(purinergic P2X7 receptor, P2X7R),而应用P2X7R拮抗剂可以抑制M2极化以及移植心脏内巨噬细胞的浸润,从而抑制慢性排斥反应并延长移植心脏的生存时间[60]。此外,小鼠肾脏移植的研究发现Smad3能够调节MMT过程[66]。
总体而言,巨噬细胞主要通过M2极化促进同种异基因移植器官发生慢性病变。由此,抑制或清除巨噬细胞的这种作用可能显著抑制移植器官的血管病变和间质纤维化。然而,仍有待进一步探究慢性排斥反应过程中巨噬细胞的调节机制以及潜在治疗靶标。
《3.4 介导排斥反应和免疫记忆的能力》
3.4 介导排斥反应和免疫记忆的能力
传统上,在移植免疫反应过程中巨噬细胞主要发挥活化T细胞和B细胞介导的适应性免疫反应。然而,越来越多的证据表明,巨噬细胞能够直接介导排斥反应(图3)。我们的研究发现在特定条件下巨噬细胞能够作为效应细胞直接介导移植器官急性排斥反应的发生[8]。向缺乏T细胞和B细胞的免疫缺陷小鼠过继同种异基因抗原致敏后的巨噬细胞,能够引起这些小鼠排斥同种异基因移植皮肤。进一步证实穿孔素在这一反应过程中发挥重要作用。其他研究也发现致敏后的巨噬细胞能够通过吞噬作用介导排斥反应的发生[69]。有研究已证实移植器官内的巨噬细胞具有很强的吞噬能力和蛋白酶活性[70],并且这些巨噬细胞表现出杀伤同种异基因移植器官的能力[71]。此外,巨噬细胞能够通过Ca2+依赖途径杀伤同种异基因肿瘤[72]。
《图3》
图3 巨噬细胞直接介导同种异体器官移植排斥反应。在CD4+ T细胞存在下,激活的巨噬细胞将获得直接排斥同种异体移植物作为效应细胞的能力。巨噬细胞可能通过穿孔素、吞噬和钙依赖等途径排斥同种异体器官移植物。
除了介导排斥反应的能力,我们也发现致敏巨噬细胞存在抗原特异性[8]。在经同种异基因抗原刺激后,受体致敏单核/巨噬细胞获得了记忆性反应能力[73]。CD4+ T细胞辅助作用参与巨噬细胞免疫记忆性的产生过程。我们的研究[8]以及其他学者的研究[69]均证实,CD4+ T细胞能够通过CD40/CD40L途径辅助巨噬细胞形成抗原记忆性。
毋庸置疑,巨噬细胞能够直接介导排斥反应并且形成抗原特异性与记忆性免疫反应能力,这些功能超出了我们过去对巨噬细胞的传统认知。由此,详尽探究排斥反应过程中巨噬细胞的活化和功能途径将积极推动新型抑制移植器官排斥反应治疗方案的开发。
《4、 移植领域的调节作用和免疫耐受诱导》
4、 移植领域的调节作用和免疫耐受诱导
移植免疫耐受是器官移植领域的终极目标,而巨噬细胞可以通过其免疫抑制性表型促进免疫耐受的形成(图4)。由于缺乏特异性标志物和一致性结论,目前对于巨噬细胞的免疫抑制性亚群缺乏统一的定义。在没有刺激活化或成熟的诱导条件下,利用M-CSF能够从骨髓来源的单核细胞诱导免疫抑制性巨噬细胞。目前认为免疫抑制性巨噬细胞表达F4/80、CD169、CD64,并且低或中等程度表达MHC-II类分子,但不表达Ly6C或Ly6G。有观点认为这类巨噬细胞是Mreg的前体细胞[74]。在M-CSF培养和IFN-γ活化的条件下,能够将骨髓来源的单核细胞诱导分化成Mreg。Mreg是成熟的巨噬细胞,表达的分子包括F4/80、CD11a、CD11b、CD14、CD16/32、CD64、CD68、CD127、CD204、CD169、CD301、平足蛋白、树突状细胞相关性C型植物血凝素-1(dectin-1)、MHC-II类分子和CD80,但低表达或不表达CD86、CD40、Toll样受体(Toll-like receptor, TLR)2、TLR4、Ly6C和Ly6G [75]。Hutchinson等[76]利用CD14-/low-HLA-DR+CD80-/lowCD86+CD16-TLR2-CD163-/low来确定诱导所得的Mreg。有研究认为脱氢酶/还原酶9(dehydrogenase/reductase 9, DHRS9)是人类Mreg的可靠表型,利用它可以区分其他人单核细胞来源的致耐受性APC [77]。由于缺乏特异性标志以及明确的定义,无法明确区分单核样骨髓源性抑制细胞(monocytic myeloid-derived suppressor cell, M-MDSC;CD11b+Ly6C+Ly6G-表型)与Mreg [26‒27,78‒79]。因此,目前迫切需要用明确的标准和特定的生物标志物对具有免疫抑制功能的巨噬细胞进行分类和精确定义。
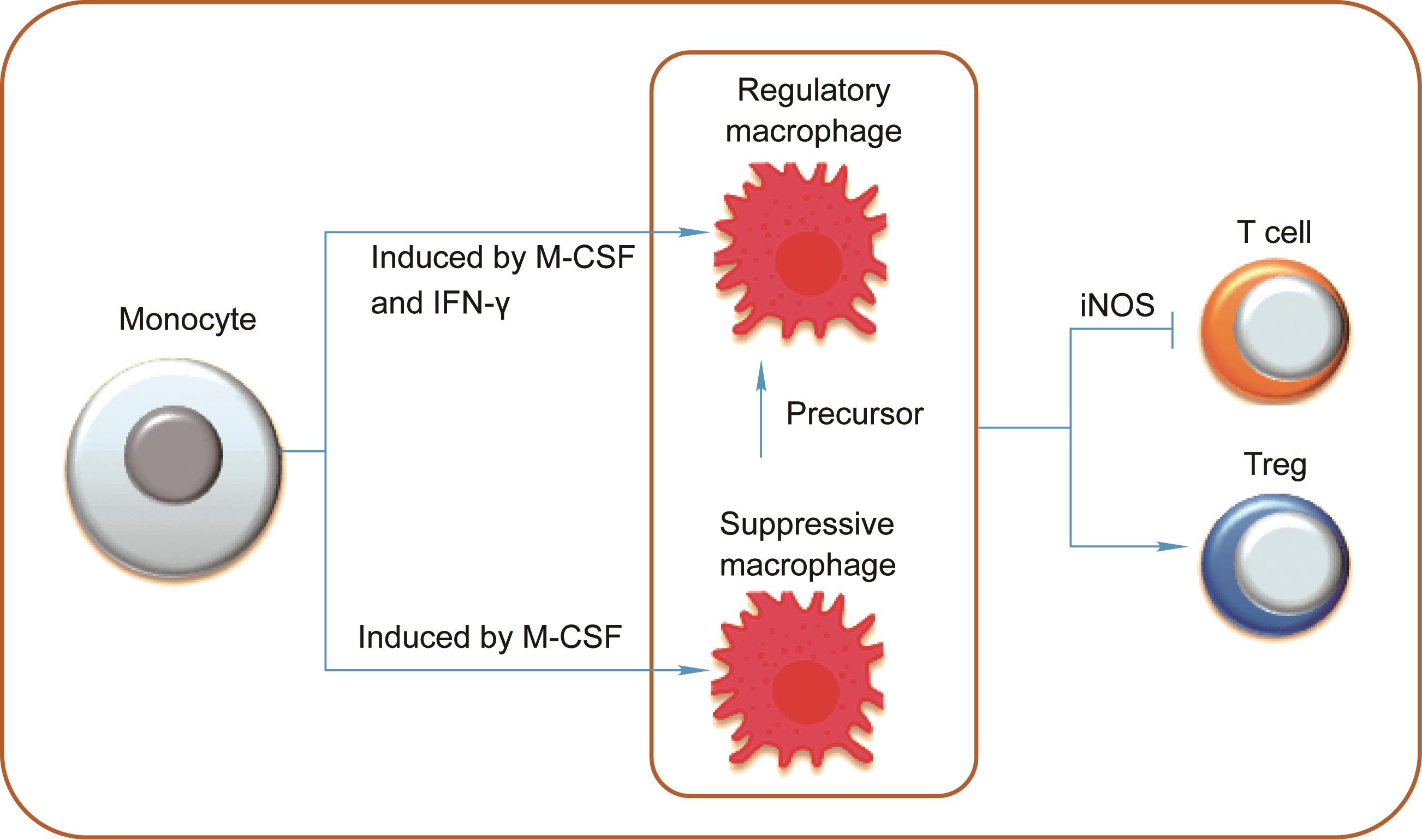
《图4》
图4 免疫抑制巨噬细胞在同种异体移植中的作用。M-CSF可诱导单核细胞产生抑制性巨噬细胞,M-CSF和IFN-γ可诱导单核细胞产生调节性巨噬细胞。这些免疫抑制巨噬细胞通过抑制效应免疫细胞和诱导Treg细胞来抑制同种异体移植器官排斥反应。
巨噬细胞抑制排斥反应的机制包括直接抑制同种异基因抗原反应性免疫细胞和诱导调节性T细胞(regulatory T cell, Treg)或其他具有免疫抑制功能的细胞(图4)。Mreg可以通过诱导型NOS抑制T细胞的增殖,并且这种作用存在抗原特异性以及需要细胞互相接触的特点[75]。人的Mreg能够通过吲哚胺2,3-双加氧酶、TGF-β、维甲酸、Notch和孕激素相关的子宫内膜蛋白途径诱导产生IL-10的TIGIT+ Foxp3+ Treg [80]。同时,同种异基因供体来源的Treg能够促进受体小鼠体内IL-10分泌型M2型巨噬细胞的分化[81]。由此,Mreg与T细胞可能形成相互作用的调节环路,协同抑制排斥反应。有研究发现在抗CD40L抗体诱导的小鼠同种异基因心脏移植耐受模型中,DC-SIGN+巨噬细胞具有免疫抑制功能,且这种细胞对于移植免疫耐受的形成至关重要[82]。DC-SIGN+巨噬细胞抑制CD8+ T细胞的增殖和浸润移植器官的能力,促进Treg的扩增和向移植器官的浸润[82]。DC-SIGN以及TLR4均参与调节IL-10的产生,这些调节作用与共刺激信号抑制分子诱导的免疫耐受息息相关[82]。此外,在混合型同种异基因嵌合体内发育成熟的供体巨噬细胞能够诱导效应性CD4+ T细胞分化成Treg。这些巨噬细胞具备抑制第三方T细胞增殖和免疫反应的能力[83]。总之,免疫抑制性巨噬细胞能够通过多种途径抑制排斥反应。
目前,器官移植临床以及科学研究领域正在探索通过向受体输注免疫调节性细胞从而建立移植免疫耐受的策略。Mreg具备用于建立这种移植免疫耐受的潜质,尤其是目前已经建立了稳定、有效的诱导Mreg的方案[75,84]。在小鼠同种异基因心脏移植的研究中,输注供体来源的Mreg能够显著延长移植心脏的生存时间,并且这种Mreg与雷帕霉素存在协同作用[75]。过继的Mreg能够在小鼠体内存活至少4周;研究人员也对移植前过继不同数量Mreg的效果进行了研究,发现过继100万个细胞并不能延长小鼠同种异基因移植皮肤的生存时间,而过继300万个细胞具备延长生存时间的效果[74]。利用高浓度人血清和M-CSF培养条件,从人CD14+外周血单核细胞诱导来的DHRS9+ Mreg已经被用于ONEmreg12 实验(clinicaltrials. Gov: NCT02085629)的I/II期临床实验,该研究旨在降低免疫抑制维持方案的用药剂量[75,82,84‒86]。现有两例活体供肾移植的研究结果提示,Mreg输注联合低剂量雷帕霉素维持免疫抑制能够在术后24周维持良好的移植肾功能[76]。此外,有研究通过7年的随访证实Mreg输注给一名肾移植受体带来了明显的益处,包括无排斥反应发生以及稳定的移植肾功能[80]。虽然Mreg输注初步展现了良好的临床效果,但对Mreg的研究仍需要进一步完善,包括Mreg的不同亚群以及理想的过继输注方案。
《5、 免疫移植药物对巨噬细胞的影响》
5、 免疫移植药物对巨噬细胞的影响
尽管已经证实在移植免疫中巨噬细胞具有多种多样的功能,然而在免疫抑制药物对巨噬细胞的影响方面,我们的认知仍然有限。在本节,我们简要讨论临床使用的免疫抑制药物对巨噬细胞的作用(表1)。
《表1》
表1 免疫抑制剂对移植器官中巨噬细胞的作用
| Immunosuppressive drug | Function to macrophages | Reference |
|---|---|---|
| Rapamycin | inhibit M2 polarization, promote suppressor macrophage generation | [ |
| Cyclosporine A | promote macrophage infiltration and graft fibrosis | [ |
| Tacrolimus | promote M2-like phenotype and preserve the anti-infection capacity of macrophages | [ |
| Mycophenolic acid | increase the expression of M2 surface markers on M1 macrophages, and preserve the anti-infection capacity of macrophages | [ |
| Steroids | promotes M2 polarization and profibrotic cytokine production | [ |
| Mizoribine | inhibit the glomerular macrophage accumulation and selectively reduce the M2 macrophages | [ |
《5.1 mTOR抑制剂》
5.1 mTOR抑制剂
在调节巨噬细胞方面,针对mTOR抑制剂的研究比其他免疫抑制药物多。我们以前的研究提示敲除mTOR只影响单核/巨噬细胞的早期发育阶段,这种作用是通过STAT5-IRF8依赖的CD115表达途径实现的[87]。雷帕霉素不影响巨噬细胞的M1极化,但能影响人巨噬细胞的表型及细胞因子分泌。对于M1型巨噬细胞,雷帕霉素可降低其CD25、TLR2、CD127、CD64、CD14、CD163、CD36、CD206和CD209的表达水平,增加C-C趋化因子受体7(C-C chemokine receptor 7, CCR7)、CD32的表达水平;对于M2型巨噬细胞,雷帕霉素降低其CD86、CD32、CD36、CD206、CXCR4和CD209的表达水平。与此相同,mTOR的缺失有损M2极化[6];雷帕霉素不利于M2型巨噬细胞的存活[88]。
巨噬细胞特异性敲除mTOR并不影响急性移植排斥反应[6]。但是Braza等[89]发明了含雷帕霉素的高密度脂蛋白纳米免疫药物,这种药物主要针对髓系细胞。应用后发现这种药物显著延长小鼠同种异基因移植心脏的生存时间,其机制主要是促进Mreg的扩增。在小鼠心脏移植抗体介导的排斥反应模型中,mTOR抑制剂能降低抗MHC-II类分子抗体活化的血管内皮细胞中埃兹蛋白-根蛋白-膜突蛋白(ezrin/radixin/moesin, ERM)磷酸化和ICAM-1簇集,从而抑制巨噬细胞浸润同种异基因移植心脏的能力[90]。前面已经提及移植前向受体输注供体Mreg能够抑制排斥反应,并且联合应用雷帕霉素能够提升这种抑制效果[75]。由于目前在不同条件和针对不同细胞亚群的研究中mTOR信号通路对巨噬细胞的调节作用存在差异,所以有必要进一步明晰mTOR信号通路(包括mTORC1和mTORC2)对巨噬细胞功能的调节作用。
《5.2 钙调磷酸酶抑制剂》
5.2 钙调磷酸酶抑制剂
临床回顾性研究已经证实在慢性排斥反应中,与环孢素A(cyclosporine A, CsA)相比,他克莫司对巨噬细胞具有更强的抑制功能。相对于他克莫司,接受CsA治疗的同种异基因肾移植患者的移植肾间质纤维化发生率更高[91],CsA可能强化巨噬细胞在慢性排斥反应中的作用[92]。首先,CsA促进巨噬细胞浸润移植器官。基于大鼠同种异基因肾移植模型,有研究证实CsA促进CCR5+和CXCR3+巨噬细胞向移植肾脏的浸润[93];CsA肾毒性与巨噬细胞的浸润存在关联[94]。其次,CsA能够促进巨噬细胞产生与慢性移植器官损伤相关的分子,如血小板源性生长因子(platelet-derived growth factor, PDGF)[95]。有研究提示CsA能够通过NF-κB途径抑制LPS诱导的巨噬细胞表达组织因子,从而抑制组织因子相关的冠脉病变和纤维蛋白沉积[96]。有趣的是,他克莫司对天然免疫细胞的影响甚微,但关于小鼠皮肤移植的研究发现,他克莫司能够保存巨噬细胞的抗感染能力[97]。此外,在体外研究中,他克莫司并不影响人单核细胞的噬菌能力;治疗量浓度的他克莫司不影响巨噬细胞的成熟和极化,只有高浓度情况下他克莫司会导致巨噬细胞的极化向M2偏移[98]。总体而言,在移植免疫中,钙调磷酸酶抑制剂对巨噬细胞具有多种作用。
《5.3 糖皮质激素类药物》
5.3 糖皮质激素类药物
糖皮质激素被广泛用于器官移植临床。在发生抗体或T细胞介导的排斥反应的人肾移植中,巨噬细胞的数量与糖皮质激素之间存在负相关性[21]。在体外,地塞米松能够诱导人单核来源的巨噬细胞表达M2极化的标志物和分泌促纤维化细胞因子,包括TGF-β1、成纤维细胞生长因子-2(fibroblast growth factor 2, FGF-2)、结缔组织生长因子(connective tissue growth factor, CTGF),同时抑制与M1型极化相关的TNF-α [65];地塞米松也能够促进大鼠巨噬细胞的M2型极化[99]。在系膜增生性肾小球肾炎大鼠模型中,泼尼松龙能够促进肾小球巨噬细胞的M2型极化,但不影响其M1型极化[99]。综合而言,在移植免疫中糖皮质激素类药物主要表现出强化M2型巨噬细胞极化的作用。
《5.4 其他类型的免疫抑制药物》
5.4 其他类型的免疫抑制药物
一些研究探究了其他类型的免疫抑制药物在调节巨噬细胞功能方面的作用。在体外,霉酚酸(mycophenolic acid, MPA)不影响人单核细胞的噬菌能力,但能够促进M1型巨噬细胞表达M2型极化相关的表面分子[99]。体内研究发现咪唑立宾能够抑制巨噬细胞在肾小球的募集,并且选择性减少M2型巨噬细胞;体外研究也证实咪唑立宾能够抑制巨噬细胞的M2型极化[90]。促红素衍生肽ARA290能够通过NF-κB通路抑制大鼠同种异基因移植肾的移植早期损伤,并减少巨噬细胞的浸润[34]。在接受CsA处理的同种异基因肾移植大鼠模型中,移植前及移植后每天给予受体大鼠辛伐他汀处理能够显著抑制巨噬细胞的浸润和保护移植肾功能[100]。此外,在小鼠同种异基因心脏移植模型中,抗CD40L抗体抑制促炎性巨噬细胞在移植物内的聚集及其产生IFN-γ的能力[82]。一项单中心超过15年的随访临床研究证实,巨噬细胞抑制剂伊班膦酸钠有利于保护人移植肾的功能并延长其生存时间[101]。我们相信,经过系统性研究后这些免疫抑制药物具有临床应用的潜在价值。
基于以上关于免疫抑制药物与巨噬细胞的研究,可以发现目前的免疫抑制药物主要针对于适应性免疫细胞,有待进一步研究这些药物对巨噬细胞功能的作用及研发其他相关药物。这些预期的研究成果将有利于开发理想的免疫抑制药物和构建优化的免疫抑制用药策略。
《6、 结论与展望》
6、 结论与展望
巨噬细胞是浸润移植器官免疫细胞中的主要成分,这一特点或许可以被用来预测器官移植的预后。排斥反应过程中,巨噬细胞不仅服务于适应性免疫反应,它们也能直接介导移植物损伤和排斥反应。基于功能的多样化以及可塑性,巨噬细胞具有多种亚群,包括M1、M2、IL-23诱导的亚群以及Mreg。不同的巨噬细胞亚群在移植免疫中扮演不同的角色。针对不同的亚群采取不同的治疗策略,将有利于通过开发新型治疗方案从而抑制排斥反应和诱导免疫耐受,如抑制促炎性巨噬细胞,促进免疫抑制性巨噬细胞。未来的研究应更多地着眼于探究不同巨噬细胞亚群在介导或抑制移植排斥反应过程中的功能和分子机制。














 京公网安备 11010502051620号
京公网安备 11010502051620号




