《1、 引言》
1、 引言
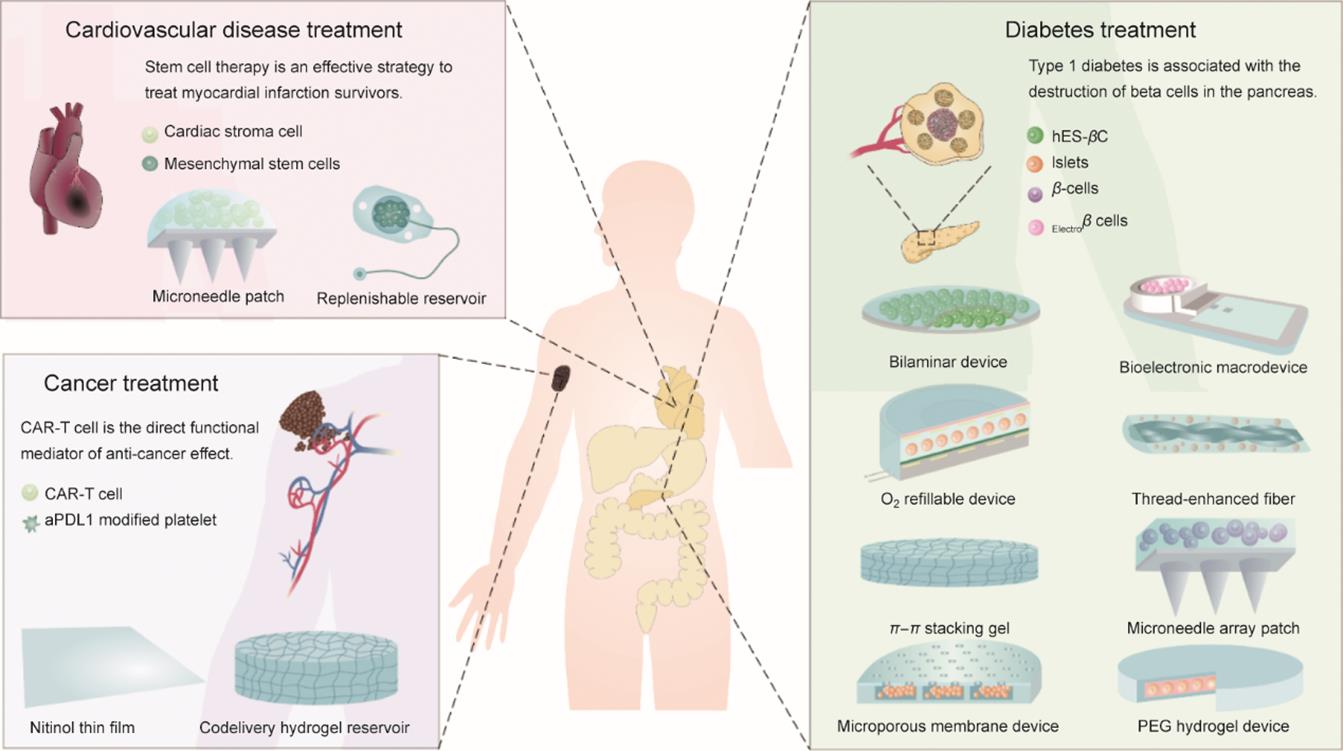
基于天然或工程化细胞的细胞疗法已被广泛应用于治疗各种疾病,包括内分泌失调[1‒4]、心血管疾病[5]、癌症[6‒9]和神经性疾病[10‒16]。此类疗法可直接以细胞为功能单元进行治疗,或者利用细胞分泌的生物活性分子发挥治疗作用[17‒21]。细胞疗法具备彻底改变各种慢性疾病治疗理念与策略的潜力[22]。然而,细胞经静脉注射或局部注射进入体内后,往往伴随着在体内或者病灶部位滞留时间短的问题[23],导致治疗效果不理想,并可能引发严重的安全性问题[22]。研究人员因此而设计了独特的植入式器械,用于细胞递送,以克服以上障碍,满足疾病治疗的多种需求[24‒27]。为达到以上目标,装载器械必须具备高效的物质交换能力,为细胞提供必需的营养物质,如氧气和氨基酸等;同时,在某些情况下,此类器械需要保护细胞免受免疫系统的攻击。此外,装载器械也需要具备一定的机械强度和高的生物相容性,以保持功能结构的完整以及避免引起不必要的免疫反应[28]。根据尺寸大小[34],该类器械一般可分为微尺寸装载器械[29‒31]和大尺寸装载器械[32‒33]。因为大尺寸装载器械(某一维尺寸大于1000 μm)很容易被改造以满足治疗各种疾病的不同需求,因此本文将重点介绍此类装载器械(图1)。例如,被研究得较为广泛的膜控腔室型器械,其孔隙率、孔径大小和膜厚度可以被精准地调控。而另一类叫做微针阵列贴片(microneedle array patch, MN)的器械,其微针长度、几何形状、密度和硬度亦能被轻易调控。
《图1》
图1 大尺寸器械的设计及其在治疗1型糖尿病、心肌梗死和癌症免疫中的应用。CAR:嵌合型抗原受体;hES-βC:胚胎干细胞来源的β细胞;
大尺寸器械可以将需要移植的细胞封装在器械内部,便于追踪其在体内的分布。另外,在器械失效或引起炎症反应时,从身体中取出大尺寸器械亦较为方便[32,35]。目前,大尺寸器械已被用来递送胰岛或者胰岛素分泌细胞治疗糖尿病[35‒38]。该类器械也被用来递送抗体分泌细胞治疗神经退行性疾病[39‒40],递送心脏基质细胞(cardiac stromal cell, CSC)治疗心脏病[41],递送嵌合抗原受体T(CAR-T)细胞用于癌症免疫治疗[42],递送外泌体分泌细胞治疗帕金森症[43]。
本文中,我们将从制备方法、材料选择、器械特性及其对体外和体内治疗结果的影响等各方面对大尺寸器械进行论述。由于各种疾病的治疗对大尺寸器械具有不同的要求,因此对器械的介绍将围绕疾病的种类展开。进一步地,本文对大尺寸器械的设计策略和功能进行讨论,对该领域存在的挑战和机遇进行总结和展望。
《2、 大尺寸器械用于糖尿病治疗》
2、 大尺寸器械用于糖尿病治疗
目前,由于异体胰岛供应量少且长期服用免疫抑制类药物伴随着炎症和癌症风险增加[46],因此胰岛移植仅限于治疗病情严重的胰岛素缺乏性糖尿病患者[44‒46]。利用大尺寸装载器械将移植胰岛限制在内部的免疫豁免部位,可以保护植入的胰岛免受宿主免疫系统的攻击,或可有效减少甚至免除免疫抑制药物的使用[18,32,47‒49]。此外,此方法也可用于递送异种胰岛[50]和人胚胎干细胞(human embryonic stem cell, hES-βC)制备的β细胞[22,51‒55],或能解决胰岛供应量不足的问题。这类大尺寸器械主要包括膜控释放系统、凝胶支架器械和微针阵列贴片类器械。这些器械都具备易制备、易回收的优点[56‒61]。然而,植入器械表面的成纤维细胞过度生长、血管化不良[62]和宿主免疫反应[63],都可能影响大尺寸器械的临床转化,我们将在下面进行一一讨论。
《2.1 膜控释器械用于细胞封装》
2.1 膜控释器械用于细胞封装
膜控释储库系统是一类表面覆盖薄膜的密闭腔室型器械。薄膜上分布着合适密度和尺寸的孔洞,允许机体与储库内进行营养物质和生物活性分子的交换[64]。膜控释储库系统尺寸较大,因此可以比较方便地对其外在大小、膜厚度以及孔洞尺寸进行调控[35,65]。迄今为止,膜控释储库系统在细胞疗法上已经取得了重大进展。例如,一种装载了胰岛素分泌细胞的器械已被开发出来,用以治疗不同类型的糖尿病[66]。此外,研究人员正在研究应用降低免疫反应[67]、提供氨基酸[68]和氧气[69‒71]的策略等以提高植入细胞的存活率和增强其治疗功能。
《2.1.1. 具有合适膜孔大小的生物相容性器械》
2.1.1. 具有合适膜孔大小的生物相容性器械
近来,利用两层膜及其中间的腔室而制备的腔室型器件被研制出来。此类器械植入体内后,若其表面不加以修饰,则易诱发机体的异物排斥反应,造成器械被纤维化组织包裹。尤其是膜表面增生的纤维化组织易堵塞膜孔,从而影响膜两侧物质的交换。因此,选择具有较少异物反应的膜材料,是保证移植物成活和器械在失效后被顺利取出的关键。另外膜上孔径的大小则决定膜两侧物质的交换速率,从而影响到器械内细胞的生存、活性及功能。然而,器械与外界所交换的物质的尺寸通常介于细胞因子(约2 nm)与细胞直径(约10 μm)的大小之间,何种孔径大小的膜,既能保证良好的物质交换,又能最大限度地减少宿主免疫系统对移植细胞的攻击,仍然存在较大争议。
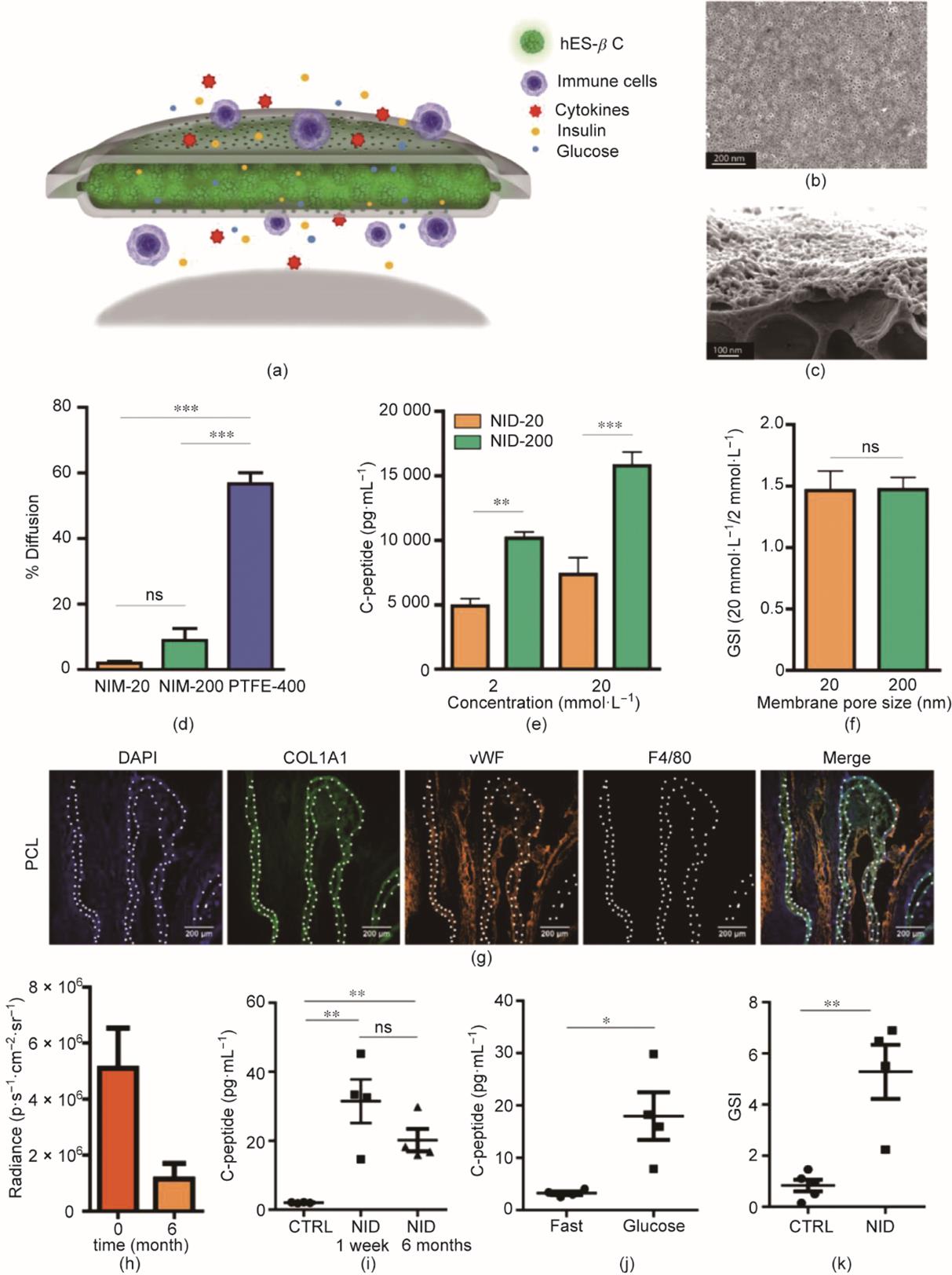
在最近的一项工作中,Chang等[72]将两层聚己内酯(polycaprolactone, PCL)纳米孔膜贴合,制备了柔性双层U型器械[图2(a)~(c)]。与聚四氟乙烯(polytetrafluoroethylene, PTFE)膜(孔径为400 nm)相比,研究人员所研发的膜孔径为20 nm和200 nm的器械可以更有效地抑制免疫球蛋白通过,因此能更好地保护细胞免受宿主免疫系统的攻击[图2(d)]。由于其较好的物质交换能力,封装在器械中的hES-βC可以在培养基中存活5周以上。尽管孔径为20 nm的膜比孔径为200 nm膜表现出对胰岛素和C肽更明显的跨膜运输阻碍作用[图2(e)],但膜孔径为20 nm和200 nm的器械均达到约为1.5的葡萄糖刺激指数(glucose stimulation index, GSI)[图2(f)]。将此膜控释器械植入C57BL/6J小鼠皮下一个月后,该器械周围没有明显的纤维化组织沉积。4个月后,器械周围血管密度增加而巨噬细胞募集减少[图2(g)]。值得注意的是,当该器械的膜孔径为200 nm时,该器械可以将细胞封装在内长达6个月而不泄露。但是,该过程伴随着大约75%的细胞损失[图2(h)]。在免疫缺陷非肥胖糖尿病-重度联合免疫缺陷(NOD-SCID)小鼠中植入此器械6个月后,经腹腔给小鼠注射葡萄糖,可以观察到葡萄糖刺激的C肽分泌[图2(i)、(j)],且GSI在2~7之间[图2(k)]。
《图2》
图2 一种用于hES-βC包封的PCL双层膜器械。(a)双层膜器械的示意图。(b)PCL(聚己内酯)膜的代表性扫描电子显微镜图像。(c)具有纳米多孔层和微孔层的PCL膜横截面的代表性扫描电子显微镜图像。(d)7天内免疫球蛋白跨膜扩散率。(e)暴露于葡萄糖溶液(2 mmol·L-1和20 mmol·L-1)后,封装在hES-βC中C肽的分泌量(n = 4)。(f)在膜孔径为20 nm (NID-20)和200 nm (NID-200)的材料中负载的hES-βC的葡萄糖刺激指数(GSI)。该装置依次暴露在2 mmol·L-1和20 mmol·L-1的葡萄糖溶液中30 min。GSI:在20 mmol·L-1和2 mmol·L-1中C肽释放量的比值,并定义为葡萄糖刺激指数。(g)PCL膜皮下植入C57BL/6J小鼠4个月后,细胞核(DAPI)、胶原蛋白(COL1A1)、新生血管(vWF)和巨噬细胞(F4/80)标志物的免疫荧光染色图像。白色虚线表示PCL膜的位置。(h)器械植入6个月后细胞的损耗量,Radiance:生物发光强度。(i)腹腔糖耐量实验中血清C肽的释放量。实验组小鼠分别植入NID封装的hES-βC 1周和6个月,未移植的小鼠作为对照(CTRL),并在实验前禁食(n = 4)。(j)植入NID封装的hES-βC 6个月并禁食过夜的小鼠(n = 4)在糖耐量实验前和60 min后的血清C肽水平。(k)植入NID封装的(NID组)或裸露的hES-βC(CTRL组)6个月后的小鼠的GSI(n = 4)。*P < 0.05, **P < 0.01, ***P < 0.001。ns:无统计学意义[
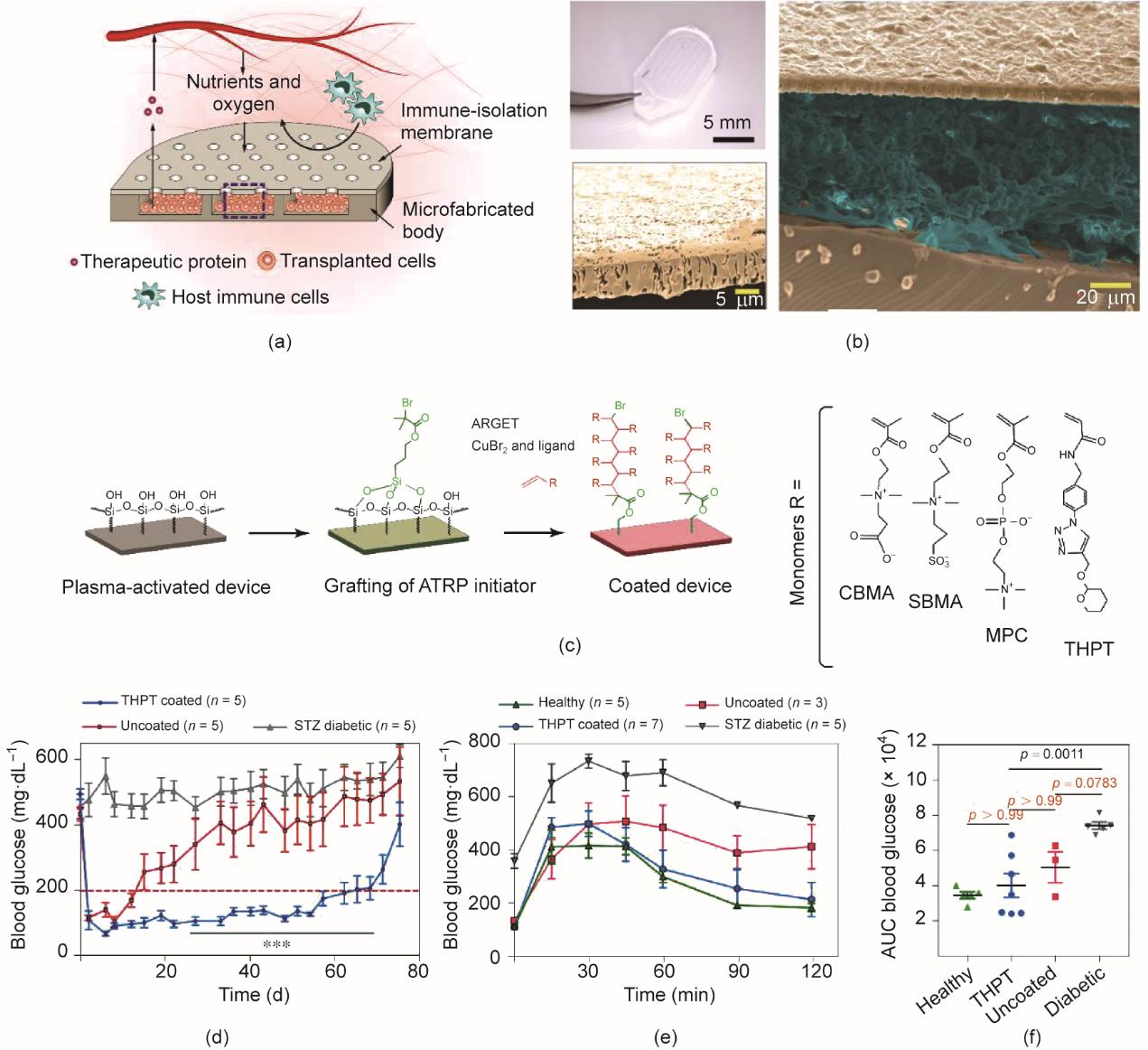
在另一项研究工作中,研究人员制备了一种异物反应较弱、对抗体和细胞因子具有高渗透性但同时又能够限制细胞渗漏的器械[50]。该器械由两部分组成:①深度为150 µm的聚二甲硅氧烷(polydimethylsiloxane, PDMS)储库;②具有不同孔径的多孔聚碳酸酯(PCTE)膜[图3(a)、(b)]。随后,研究人员将能够分泌小鼠促红细胞生成素的工程化HEK293T细胞(HEKepo细胞)封装到该器械中。研究发现,巨噬细胞能够穿透孔径为1 µm的膜而浸润到器械内腔。将孔隙减小到0.8 µm,该PCTE膜则可以较好地阻止免疫细胞进入器械内。值得注意的是,在经各组器械治疗的小鼠体内,均检测到抗HEKepo细胞的抗体,但均未引起明显的移植物损伤。进一步研究发现,将膜孔径缩小到0.4 μm,能够更加有效地阻止免疫细胞浸润到器械内部,同时又实现了氧气、营养物质和生物活性分子的交换。
《图3》
图3 用于细胞和胰岛递送的膜控腔室型器械。(a)微孔装置的示意图。(b)装置的代表性图像:用于小鼠实验的代表性装置图片(左上);典型的横截面扫描电子显微镜图像(右),伪彩显示膜、细胞和硅胶体的位置;膜的伪彩图像(左下)。(c)膜表面的改性方法。(d)用负载有胰岛细胞(200~300当量)的装置治疗的1型糖尿病小鼠的血糖水平,n = 5。(e)健康小鼠和装置治疗15天的糖尿病小鼠在糖耐量实验后的血糖水平。(f)对(e)数据的分析结果。ATRP:原子转移自由基聚合;ARGET:通过电子转移再生的激活剂;CBMA:甲基丙烯酸羧基乙酯;SBMA:甲基丙烯酸磺基乙酯;MPC:2-甲基丙烯酰氧乙基磷酸胆碱;AUC:曲线下面积[
随后,研究人员进一步用三种两性离子聚合物和四氢吡喃苯三唑(tetrahydropyran phenyl triazole, THPT)衍生聚合物对器械膜进行修饰,以减少异物反应[图3(c)]。将器械植入C57BL/6J小鼠体内后,THPT衍生聚合物修饰的膜在预防纤维化和维持细胞存活方面优于两性离子聚合物修饰膜。研究人员将胰岛与海藻酸钠凝胶混合并封装在器械中,然后将其植入链脲佐菌素(streptozotocin, STZ)诱导的糖尿病C57BL/6J小鼠的腹腔内。经THPT修饰的器械可以维持小鼠正常血糖的平均时间为75天,远高于未修饰器械的21天[图3(d)]。此外,在葡萄糖筛查试验中,经THPT修饰的器械治疗的小鼠与健康小鼠一样,能够在120 min内将小鼠血糖恢复到正常范围[图3(e)和(f)]。
《2.1.2. 可重复充填氧气的器械》
2.1.2. 可重复充填氧气的器械
充足的氧气供应对植入细胞的生存至关重要,因此在设计器械时需要将其纳入考量范围内。其中,研究人员证明,向器械中吹入氧气是一种可行的方法。Ludwig等[73]开发了一款名为“β-Air”的器械。该器械内包含一个可反复充填富氧空气的储罐。氧气可以缓慢地穿过PTFE隔膜,到达胰岛细胞所在的隔室。将德国长白母猪胰岛封装在“β-Air”器械中[73],随后植入到Göttingen小型猪皮下,并取出检验。当将该器械先后暴露于3.3 mmol·L‒1和16.7 mmol·L‒1的葡萄糖溶液中时,植入前和13天后取出的器械的GSI分别为3.5和6.7。随后,研究人员将该装置与生长激素释放激素(growth hormone-releasing hormone, GHRH)激动剂结合,以增强植入后β细胞的生存和细胞增殖[74]。研究发现,包裹胰岛的凝胶的表面积、输送气体方法、气体成分均会影响细胞活力[75]。例如,当胰岛密度为每平方厘米1000个且厚度为500 µm时,频繁的空气输注或者开放型腔室均可有效地维持细胞活性。然而,当胰岛密度超过每平方厘米2000个时,在无空气输送或者仅输送含氧量为20%或30%的空气时,正常血糖的维持时间不会超过两天。研究人员进一步将器械推进到临床试验,且给药剂量设定为每千克体重2100个胰岛[76]。如果每天更新空气,移植的器械可以将功能维持10个月以上。然而,由于植入胰岛数量不足,C肽的基线水平仅为(0.04 ± 0.03) mmol·L-1,远低于健康个体的平均水平。移除器械后,植入部位有一个薄的纤维囊,血管化情况良好且无炎症迹象。值得注意的是,在取出的移植物中,胰岛仍保持着正常的形态,分布着正常形态与功能的α和β细胞。
《2.1.3. 预血管化器械》
2.1.3. 预血管化器械
预血管化是另一种增强氧气和营养供应的有效策略。Pepper等[77]发现,将植入部位预血管化,可以显著提高植入胰岛的存活率。他们设计了一种生物相容性的细胞袋(cell pouch, CP)器械作为胰岛移植的免疫隔离区和预血管化部位[78]。将CP预植入小鼠皮下4~5周,促使拟植入部位预先血管化。随后,利用负载胰岛的CP器械治疗糖尿病小鼠,可将小鼠的血糖逐渐恢复到水平正常。移植100天后,95%的小鼠血糖恢复到正常水平。若此时将CP器械移除,则小鼠在1周内又会回到高血糖水平。胰岛移植到CP中后其功能依然正常。相反,直接进行细胞移植不能逆转糖尿病。然而,本研究中没有对未预血管化的CP的治疗效果进行评估。
间充质干细胞(mesenchymal stem cell, MSC)和富血小板血浆(platelet-rich plasma, PRP)也可以促进血管生成[79‒80]。受此启发,研究人员以生物相容性较高的聚乳酸(polylactic acid, PLA)为原料,利用3D打印技术制备出腔室型器械[81‒82]。微通道均匀分布在器械表面,保证新形成的血管能够渗透到细胞库中。在该器械中先装入PRP和MSC,然后再将器械移植到大鼠和非人灵长类动物的皮下组织中。预装载了PRP和MSC的器械表面形成了密集的血管网络,从而能够提供一个快速进行氧气交换的微环境,为提高随后装载的胰岛或能够分泌睾酮的Laydig细胞的存活率提供了条件。此外,免疫抑制分子诱导的局部免疫抑制微环境可以与血管网络协同作用,进一步提高所移植的同种异体细胞的存活率[83‒85]。Paez-Mayorga等[86]设计了一种皮下可植入的双储库器械。该器械包含一个中央的细胞储库。中央储库两侧的空间则装载了MSC和免疫抑制剂CTLA4Ig。这种设计不仅可以增强血管生成,还能够建立免疫抑制微环境来保护包裹在装置内的同种异体Leydig细胞。
Song等[87]则开发了一种微血管网筛。将该网筛覆盖于器械表面,可促进细胞附着,加速新生血管生成,促进氧气和营养物质的供给。在该研究中,纤维蛋白基质中培养的人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVEC)可以在微柱基质上自组装形成血管网。两周后,该血管网状物可在器械表面诱导形成致密的具有正常功能的血管网。将装载了胰岛和覆盖了微血管网的器械移植到SCID-Beige小鼠的皮下后,小鼠的血糖可以保持在正常水平达3个月。
《2.1.4. 无线生物电子器械》
2.1.4. 无线生物电子器械
上述器械的糖响应胰岛素释放功能均建立在β细胞内在的糖响应控制机制之上。若想利用外部刺激来操纵这个信号环路,从而控制胰岛素释放,仍面临较大挑战。在机体内,朗格汉斯(Langerhans)胰岛内的β细胞能够响应血糖波动,并相应地调整其胰岛素的分泌速率。其机制如下:当血糖升高时,经葡萄糖转运体运输,葡萄糖加速流入β细胞,随后在细胞内产生大量三磷酸腺苷(adenosine triphosphate, ATP),导致三磷酸腺苷/二磷酸腺苷(adenosine diphosphate, ADP)比值升高。然后,ATP敏感的K+通道关闭,导致细胞膜去极化,诱导电压门控钙离子通道(Cav)打开,促使钙离子加速流入,刺激胰岛素分泌[88]。
基于这一原理,Krawczyk等[89]设计了一种电子器械,并装载了电压敏感的人β细胞(electrosensitive human β-cells, Electroβ cells)和定制的生物电子接口,旨在远程控制胰岛素释放以治疗1型糖尿病(type 1 diabete, T1D)[图4(a)]。研究人员选择HEK293T细胞转染质粒,在细胞膜上表达一个L-型电压门控钙离子通道,并使其能够分泌人胎盘碱性磷酸酶(human placental-secreted alkaline phosphatase, SEAP)作为报告蛋白。与只表达电压门控钙离子通道的细胞相比,表达电压门控钙离子通道Cav1.2和内向整流钾离子通道Kir2.1的HEK293T细胞表现出较低的SEAP本底水平,并能够实现膜去极化触发的SEAP释放[图4(b)和(c)]。随后,选择具有正常胰岛素分泌机制但没有葡萄糖感应能力的β细胞系变体INSVesc进行基因改造,获得同时表达Cav1.2和Kir2.1通道以及proinsulin-NanoLuc的Electroβ细胞系,实现胰岛素的可控分泌并方便对其进行监测[图4(d)~(f)]。
《图4》
图4 一种装有β细胞的无线控制的生物电子大尺寸器械。(a)该器械的三维模型。(b)不同钙离子通道的报告蛋白分泌量的比较。(c)表达Cav1.2的细胞或共同表达Cav1.2和Kir2.1的细胞的性能比较。Cav1.2、Cav1.3 [42a]和Cav1.3 [∆42]是三种L型电压门控钙通道。数据为平均值±标准误差,n = 3;**P < 0.01,***P < 0.001。(d)暴露在不同的葡萄糖溶液中,Electroβ细胞中胰岛素释放量。数据为平均值±标准误差,n = 3;**P < 0.01,***P < 0.001。(e)在电刺激下,Electroβ细胞的胰岛素分泌途径。PhEF1α-α2/β1-P2A-β3-pA和PhEF1α-α1C-P2A-Kir2.1-pA是表达Cav1.2和Kir2.1的转基因结构域。(f)Electroβ细胞的代表性透射电子显微镜图像。白色箭头指向含有胰岛素的囊泡。(g)葡萄糖耐量实验。植入48 h后,装置中的Electroβ细胞被电刺激60 min(红色区域);然后,腹腔注射葡萄糖后监测小鼠的血糖水平。野生型(wild type),n = 8;1型糖尿病小鼠,植入物电刺激(T1D, implant electrostimulated),n = 6;1型糖尿病小鼠,空植入物(T1D, empty),n = 10;胰岛(islets),n = 3。(h)血糖的实时监测记录数据。植入装置的空腹1型糖尿病小鼠被电刺激30 min,并监测血糖水平。绿色区域表示正常血糖范围。野生型(wild type),n = 6;无刺激(no stimulation),n = 6;电刺激(electrostimulated),n = 7 [
随之,一种用于体内植入的无线电刺激器械也被设计和制备出来[图4(a)]。在该大尺寸器械中,铂电极被安装在包裹Electroβ细胞的半透膜两侧,可以对细胞施加电脉冲刺激。此外,一个配电盘(switchboard)被连接到该设备,以产生用于电刺激的方形单极脉冲。在糖耐量测试中,体内植入器械的糖尿病小鼠在电刺激60 min后,其血糖迅速恢复到正常水平,并呈现出类似于经人胰岛治疗的血糖反应曲线[图4(g)]。通过实时血糖监测发现,只要电刺激30 min,器械在1 h内就能将糖尿病小鼠的血糖恢复至正常水平[图4(h)]。将含有Electroβ细胞的器械移植后3周内,器械表现出良好的生物相容性,其免疫细胞浸润或器械相关的细胞毒性基本可以忽略不计。该系统的优势在于,它能对血液中葡萄糖水平进行实时监测并依外部控制而做出响应。然而,扩大这些设备的生产规模可能具有一定挑战性。
《2.2 微针阵列贴片用于细胞递送》
2.2 微针阵列贴片用于细胞递送
微针阵列贴片是另一种大尺寸器械,已经被广泛研究用于无痛地递送胰岛素[90‒92]、疫苗[93‒94]、抗癌药物[95‒97]、活细胞[98]和其他种类的药物[99‒102],治疗多种疾病[103‒106]。贴片表面均匀地分布着微针,这些微针能够刺入皮肤,因此赋予微针阵列贴片经皮给药的能力。此外,微针阵列贴片可以承担通信功能,让微针阵列贴片上负载的细胞能够感知微针所在组织的生理环境的变化[41,107]。
Ye等[107]利用微针阵列贴片负载能够产生胰岛素的β细胞,用于治疗Ⅰ型糖尿病[图5(a)]。在该方法中,微针阵列贴片以甲基丙烯酸酯化的透明质酸(hyaluronic acid, HA)为原料制备而成[图5(b)],并在脱模后进行紫外线交联。为了维持β细胞的活性,细胞被包裹在海藻酸钠微凝胶中,然后再贴合于微针阵列贴片的背面[图5(c)]。另外,微针中还额外整合了葡萄糖信号放大器(glucose-signal amplifier, GSA)。将该贴片贴于皮肤后,微针能够插入真皮组织中,使整个器械获得实时感知血糖波动并响应释放药物的能力。在Ⅰ型糖尿病小鼠模型中,负载细胞的微针阵列贴片能够感知高血糖并随之释放胰岛素,使血糖维持在正常范围的时间达到10 h以上[图5(d)]。重要的是,连续使用两个微针阵列贴片并不会导致小鼠低血糖[图5(e)]。在该器械中,微针阵列贴片和海藻酸钠微凝胶能够将β细胞与宿主的免疫系统隔离,减少免疫排斥反应。此外,微针阵列贴片的多孔网络结构能够帮助β细胞感受组织液的葡萄糖浓度变化。然而,要想将该器械推到临床应用,还需要做很多工作,包括如何扩大化生产。
《图5》
图5 用于细胞和胰岛递送的微针阵列贴片。(a)葡萄糖响应机制示意图。[Glucose]和[O2]分别代表葡萄糖和O2的浓度。GOx:葡萄糖氧化酶;AM:淀粉酶;GA:葡糖淀粉酶。(b)代表性扫描电子显微镜图像。(c)负载细胞的微针贴片的荧光图像。GSAs用罗丹明标记,细胞用钙-α-淀粉酶标记。(d)使用微针贴片的1型糖尿病小鼠的在体血糖调节能力。MN w/o GRS:空MN;MN L-GRS:微针贴片与细胞凝胶;MN S-GRS:无细胞微针贴片;MN L-S GRS:装有凝胶的微针贴片;MN L-S GRS (w/o GOx):MN L-S GRS不使用葡萄糖氧化酶(GOx);MN L-S GRS(不使用AM)。MN L-S GRS:不使用直链淀粉。(e)1型糖尿病小鼠在接受两次连续的微针贴片治疗后的血糖水平[
《2.3 中空多孔纤维》
2.3 中空多孔纤维
理想的大尺寸器械表面应具备致密的血管网络,使器械内与周围生理环境之间可以顺畅地进行物质交换[70]。与此相似,增加装置的比表面积也可以促进物质交换。为此,Tan等[108]利用膜表面孔径为(0.27 ± 0.02) μm的中空微孔聚醚砜纤维制备了一种大尺寸器械。纤维的外表面修饰了抗炎细胞因子白细胞介素-4(IL-4),可以诱导巨噬细胞向M2型极化。此外,利用纤维连接蛋白(fibronectin, FN)修饰纤维的内表面构建仿生微环境,促进β细胞在纤维膜内表面黏附并形成单细胞层。修饰前后,纤维的孔隙大小没有发生明显变化,却使纤维内的β细胞数量增加了10倍,证明这一策略具有较高的可行性。
类似地,Wang等[109]设计了一种纳米纤维器械,可用于自体、同种异体或异种胰岛移植,治疗Ⅰ型糖尿病。该装置由表面的纳米纤维膜和核心的海藻酸钠水凝胶组成。纳米纤维膜由热塑性硅树脂-聚碳酸酯-聚氨酯制成。纳米纤维膜的孔径小于500 nm,可防止免疫细胞浸润。在Ⅰ型糖尿病小鼠模型中,腹腔植入该器械能够逆转免疫缺陷和免疫正常小鼠的糖尿病症状。另外,通过微创手术将该器械移植到实验狗的腹腔中。两周后,在取出的器械中仍能观察到存活的人β细胞,但同时也观察到免疫排斥反应。
《2.4 水凝胶》
2.4 水凝胶
水凝胶是一种能够在水或生物流体中膨胀的交联高分子网络。水凝胶的亲水链可以容纳大量的水分子,因此有足够的空间成为药物、蛋白质和细胞的“储库”。水凝胶可以由天然大分子如海藻酸钠和明胶,或者合成聚合物如聚乙二醇[poly(ethylene glycol), PEG]和聚(2-羟乙基甲基丙烯酸酯)[poly(2-hydroxyethyl methacrylate), PHEMA]制备[110‒116]。目前针对水凝胶的研究主要集中在改善其机械强度,减少异物反应及促进水凝胶与机体间的营养物质和氧气的交换速率,目标是提高细胞的存活率和维持器械性能。
《2.4.1. 聚合物线增强海藻酸钠水凝胶强度》
2.4.1. 聚合物线增强海藻酸钠水凝胶强度
海藻酸钠是目前应用最广泛的水凝胶原料,具有良好的生物相容性[117‒119]。但是,海藻酸钠水凝胶存在一些局限性。例如,海藻酸钠不可避免地含有脂多糖、肽聚糖和脂磷壁酸,而这些物质可能被免疫系统识别为外来分子,导致异物反应和器件表面纤维化。此外,海藻酸钠水凝胶的机械强度较低,导致水凝胶器械不易植入或移除。目前,研究人员已经开发了一些策略,来提高海藻酸钠水凝胶的机械强度[120‒121]。此外,新的生物相容性材料也在开发中,以替代海藻酸钠并解决其体内应用面临的局限性[122‒124]。
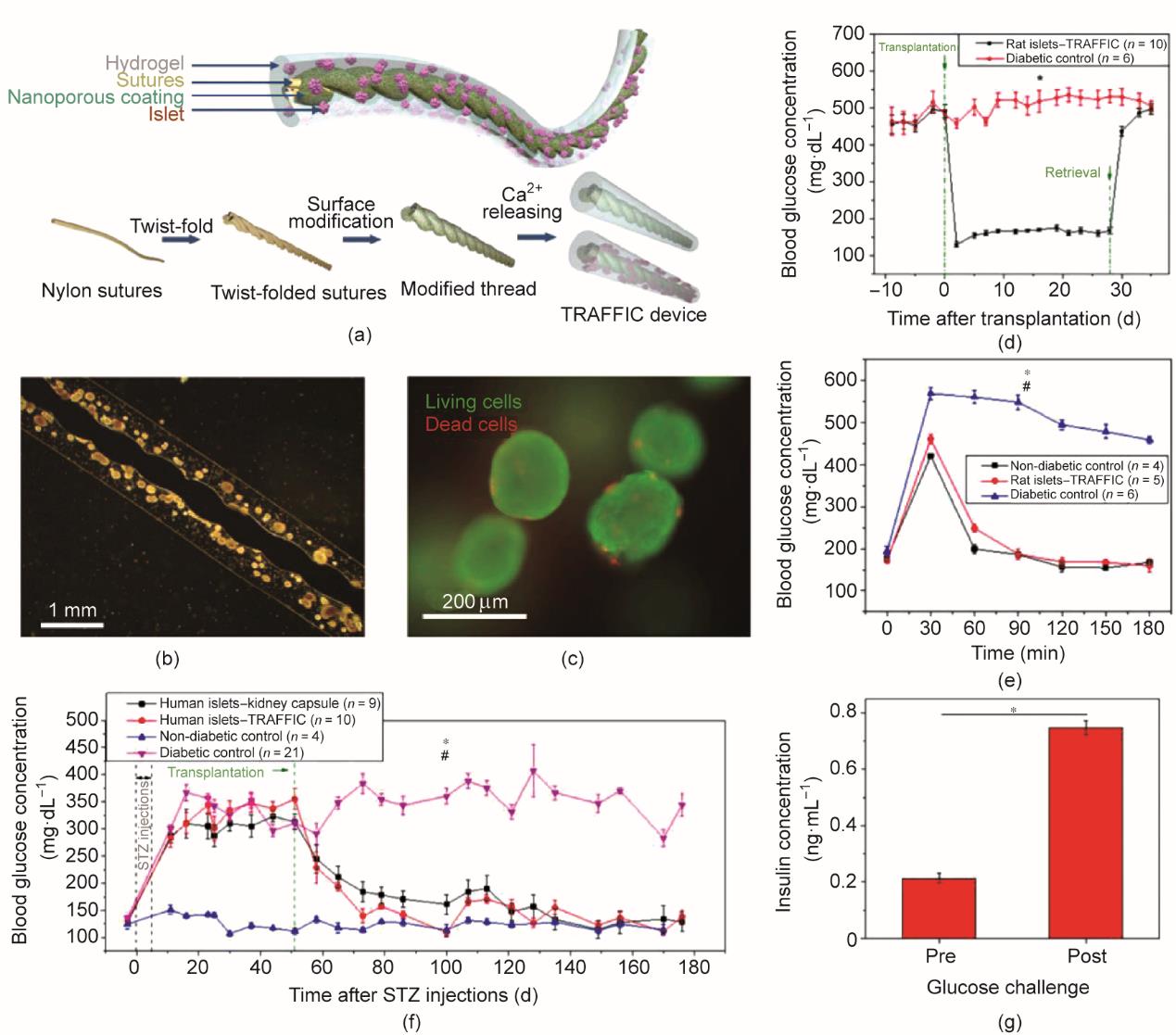
An等[120]开发了一种能够释放钙离子的纳米多孔聚合物线。将聚合物线做成螺纹线结构,并在其表面覆盖封装有胰岛的海藻酸钠水凝胶,从而获得螺纹线增强的海藻酸钠凝胶纤维[图6(a)]。海藻酸钠水凝胶能够牢固地黏附在纳米多孔线上[图6(b)],且胰岛能够在该器械中存活[图6(c)]。在葡萄糖溶液中,该器械能够模拟胰岛功能,实现胰岛素的动态糖响应分泌。在I型糖尿病小鼠实验中,将负载大鼠胰岛的海藻酸钠凝胶纤维植入小鼠腹腔中,两天后血糖即恢复至正常范围内,且在4周内将血糖维持在正常水平[图6(d)]。移植后第28天,进行腹腔葡萄糖耐量试验(intraperitoneal glucose tolerance test, IPGTT)(2 g·kg-1),糖尿病小鼠和健康小鼠的血糖在2 h内均回到正常水平[图6(e)]。负载人胰岛的海藻酸水凝胶纤维能够逆转免疫缺陷型的糖尿病SCID-Beige小鼠的高血糖[图6(f)],并维持正常血糖超过4个月。在实验狗中,将10 in(注:1 in=2.54 cm)长的海藻酸钠水凝胶纤维放置在肝脏和隔膜之间,移植的胰岛能够存活,并实现糖响应型的胰岛素分泌[图6(g)]。
《图6》
图6 一种用于细胞和胰岛递送的螺纹线增强型海藻酸钠水凝胶。(a)该器械的示意图。TRAFFIC:用于封装胰岛的线增强海藻酸纤维。(b)代表性的胰岛装载器械图像。(c)封装在纤维中的胰岛的活/死染色。(d)糖尿病的C57BL/6J小鼠移植封装大鼠胰岛器械后的血糖水平,n = 6~10,*P < 0.05。(e)在取回装置前,接受葡萄糖注射后的糖尿病小鼠的血糖水平,n = 4~5,*P < 0.05(糖尿病对照vs大鼠胰岛器件),#P > 0.05(非糖尿病对照vs器件治疗的大鼠)。(f)糖尿病SCID-Beige小鼠移植各种类型的人胰岛后的血糖水平,n = 4~21,*P < 0.05(人胰岛器械vs糖尿病对照),#P > 0.05(人胰岛-肾胶囊vs人胰岛器械)。(g)封装在纤维凝胶中的胰岛植入前和植入后,小鼠体外葡萄糖刺激的胰岛素分泌情况,n = 3,*P < 0.05。所有数据都是以平均值±平均值的标准误差表示[
《2.4.2. 盘状三唑两性离子水凝胶》
2.4.2. 盘状三唑两性离子水凝胶
另一种提高水凝胶机械强度的方法是研制大块状水凝胶。在众多水凝胶中,三唑两性离子水凝胶具有较高的拉伸性能和机械稳定性,因此受到研究者的青睐。Liu等[123]开发了多种基于三唑两性离子水凝胶的盘状水凝胶用于胰岛移植,其原料包括聚季铵化三唑羧基甜菜碱丙烯酰胺[poly(quaternized triazole carboxybetaine acrylamide), P(qTR-CB)]、聚三唑羧基甜菜碱丙烯酰胺[poly(triazole carboxybetaine acrylamide), P(TR-CB)]和聚三唑磺基甜菜碱丙烯酰胺[poly(triazole sulfobetaine acrylamide)或P(TR-SB)]。通过提高合成过程中的单体浓度,可以促进强离子键的形成,因此能够增强凝胶的机械强度[125]。三唑磺基甜菜碱丙烯酰胺(triazole sulfobetaine acrylamide, TR-SB)制备的P(TR-SB)水凝胶,具有比聚羧基甜菜碱(polycarboxybetaine, PCB)水凝胶高20倍的断裂应变,且其在健康小鼠皮下植入后几乎没有异物反应。在糖尿病小鼠植入负载大鼠胰岛的P(TR-SB)凝胶后,小鼠的血糖可以维持在正常水平长达一个月。与之对比,包裹于海藻酸钠凝胶中的胰岛则无法持续维持血糖正常。取出该凝胶后,将其先后置于2.8 mmol·L-1和16.7 mmol·L-1的葡萄糖溶液中并培养60 min,发现胰岛素分泌量增加约1.5倍。此外,P(TR-SB)凝胶在植入小鼠后,其周围的血管化程度也增长明显。
《2.4.3. 不可降解的聚乙二醇水凝胶》
2.4.3. 不可降解的聚乙二醇水凝胶
为了促进器件周围的血管化,Weaver等[126]制备了一种蛋白酶促降解型聚乙二醇水凝胶,并在水凝胶中加入精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)和血管内皮生长因子(vascular endothelial growth factor, VEGF)。RGD为胰岛细胞提供黏附位点,而VEGF则可刺激器件周围血管网络的形成。此外,研究人员利用这些材料制造了一个多层胰岛封装器械。该器械主要包括两部分:①器械核心为封装了胰岛的不可降解聚乙二醇水凝胶;②核心外部则包裹了一层促血管网络生成的可降解聚乙二醇凝胶[127]。相比于传统的海藻酸钠水凝胶,该聚乙二醇水凝胶能够更好地维持胰岛活性。将包裹了雄性Lewis大鼠胰岛的器械植入雌性Lewis大鼠腹腔脂肪垫中,可以发现,外层修饰有VEGF聚乙二醇水凝胶的器械能够更好地促进血管密度的增加。
《2.4.4. 多孔管状水凝胶》
2.4.4. 多孔管状水凝胶
如前所述,增加器械的比表面积可以促进器械内的胰岛与周围环境的物质交换。Naficy等[128]制备了一种由聚丙烯乙二醇(polypropylene glycol, PPG)和亲水聚氨酯(hydrophilic polyurethane, HPU)构成的可移除式多孔管状器械,用于β细胞或胰岛移植。HPU-PPG水凝胶刚度范围为100 ~ 400 kPa,可提供机械支撑。为了获得该器械,首先需要制备氯化钠颗粒预填充的水凝胶,再用水冲洗除去氯化钠晶体,从而获得多孔结构。这些孔洞中可以填充海藻酸钠水凝胶,用于进一步负载β细胞系或胰岛细胞簇。实验发现,海藻酸钠水凝胶与内部细胞具有良好的生物相容性。体外实验结果表明,相比于普通RPMI 1640培养基,含33 mmol·L‒1葡萄糖溶液的HEPES缓冲液[Krebs-Ringer Bicarbonate N-(2-hydroxyethyl)piperazine-N´-2-ethane sulfonic acid buffer]可以更好地刺激负载在器械中的胰岛释放出胰岛素,使24 h内胰岛素释放量翻倍。结果表明,胰岛可能比β细胞系具有更好的糖响应胰岛素释放性能。此外,水凝胶不易降解,在植入后可以完整取出。
《3、 大尺寸器械用于心血管疾病治疗》
3、 大尺寸器械用于心血管疾病治疗
心肌梗死(myocardial infarction, MI)会造成心肌细胞损伤,致使约36%的MI幸存者面临较高的心衰风险[129]。干细胞疗法能够通过旁分泌机制,分泌再生因子治疗MI,改善心脏功能,预防心力衰竭[130‒131]。因此,延长MI部位干细胞的滞留时间,具有改善干细胞治疗MI疗效的潜力。其中,可注射支架和心脏贴片已被开发用于提高细胞递送效率。可注射支架可为植入的细胞提供生理支持,诱导血管形成,缓解纤维化[132]。心脏补片可以提供直接的机械支持来增强心脏功能,并构建一个适合细胞生长的微环境。
《3.1 心脏补片用于MI治疗》
3.1 心脏补片用于MI治疗
Kim等[133]将脱去细胞的细胞外基质(decellularized cell-derived extracellular matrice, CDM)冲压在聚乙烯醇(polyvinyl alcohol, PVA)水凝胶上,获得可拉伸的细胞外基质薄膜,用于干细胞的递送。CDM能够促进细胞黏附,提高NIH-3T3成纤维细胞在器械内的增殖速度。在大鼠MI模型中,负载间充质干细胞器械的治疗效果优于直接注射或与FN/PVA水凝胶共用的间充质干细胞,显示了该器械的优越性。基于心肌细胞外基质和甲基丙烯酸明胶(gelatin methacrylate, GelMA),Bejleri等[134]也设计了一种生物打印的心脏补片,用于递送心脏祖细胞。这种心脏补片具有足够的机械强度,能够有效促进新血管再生,并能在体内保留14天以上。
Song等[135]开发了一种引入导电高分子聚丙烯酸的氧化海藻酸钠-明胶水凝胶,具有良好的自愈性、生物相容性、导电能力以及机械稳定性。在凝胶内培养的新生儿心肌细胞表现出改善的分化肌节和细胞间接触,以及组织良好的肌节α-肌动蛋白和定向分布的肌节。该贴片能够显著抑制心肌纤维化,增加左室壁厚度,促进血管生成。Song等[136]也利用重编程的成纤维细胞制备了预血管化的心脏补片。
此外,为了避免因器械内细胞活力降低导致的治疗功能减弱或丧失、增加贴片的保存时间与扩展应用场景,Huang等[137]研制了一种可以冷冻保存的、负载并能够分泌细胞因子的心脏补片用于MI后的心脏修复。
《3.2 微针阵列贴片用于MI治疗》
3.2 微针阵列贴片用于MI治疗
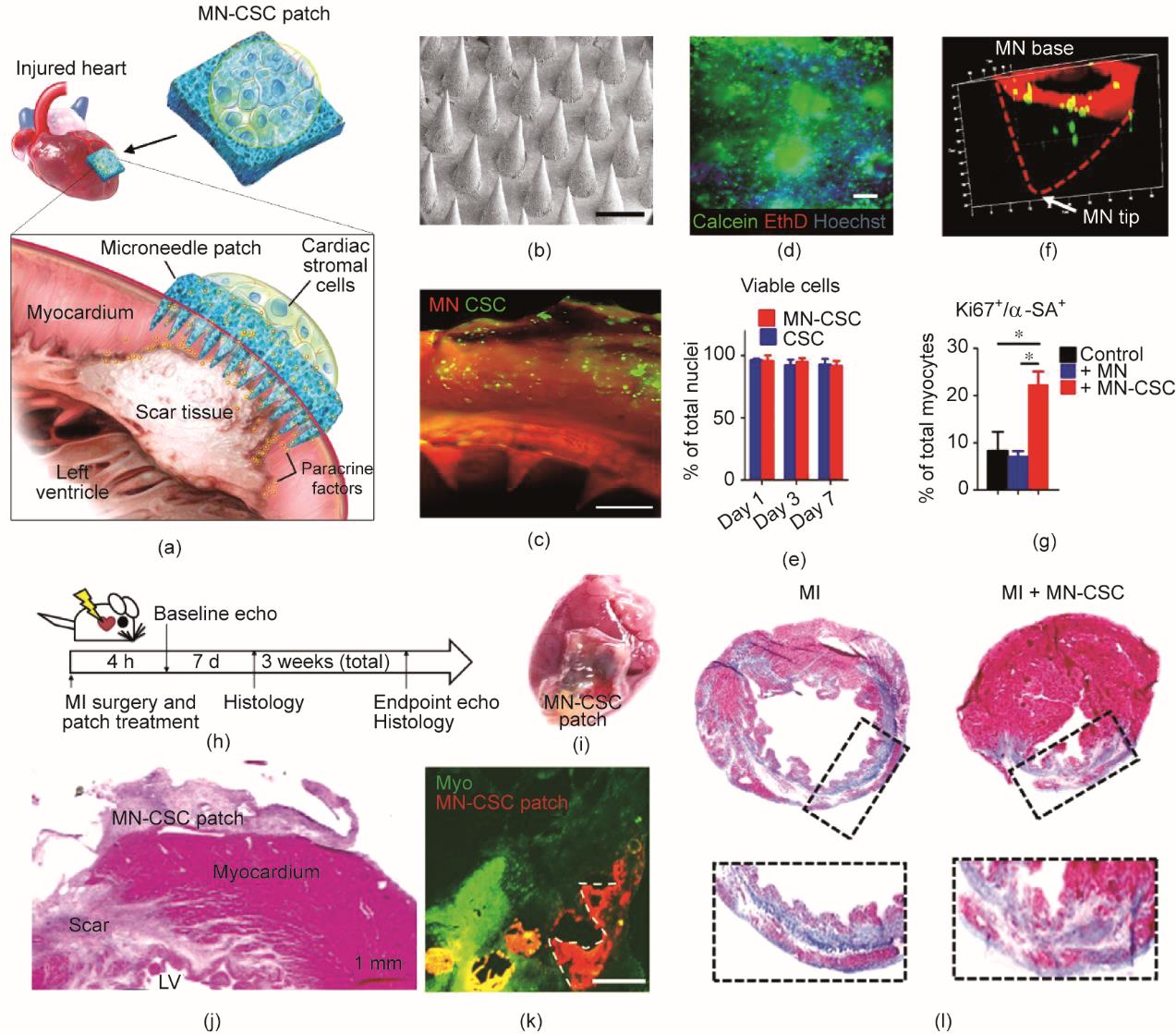
如何实现贴片与MI部位的物质交换效率以提高治疗效果仍具有较大挑战。为了促进微针贴片与MI给药部位的物质交换,Tang等[41]制备了一种负载CSC的微针阵列贴片,方便CSC与MI部位细胞的物质交换,促进细胞再生因子向受损心肌的运输[图7(a)]。微针阵列贴片由易结晶的PVA制备而成[138] [图7(b)]。贴片上的微针可以刺入心肌组织,吸收组织间隙液发生微肿胀,在凝胶内部形成微米级通道,允许贴片与宿主心肌细胞直接进行物质交换和信息传递。CSC被包裹在位于MN贴片背面的生物相容性纤维蛋白凝胶中[图7(c)],并保持良好的存活率[图7(d)]。与直接进行心肌组织内注射相比,这种方法延长了CSC在损伤部位的滞留时间。在培养基中培养时,整合在贴片顶部的细胞在7天内存活状况良好[图7(e)]。另外,CSC能够从纤维蛋白凝胶迁移到微针贴片的腔中[图7(f)],并分泌再生因子到培养基中,从而证明其具备提高心肌细胞活力的能力[图7(g)]。在大鼠MI模型中[图7(h)],将含有1 × 106个基质细胞的MN贴片贴在新形成的MI区[图7(i)和(j)],并在MI区放置7天以上[图7(k)]。与对照组相比,治疗后心肌细胞凋亡数量减少,血管生成密度显著增加[图7(j)],心脏的梗死壁和存活组织较厚[图7(j)]。治疗三周后,接受MN-CSC移植的心脏纤维化程度降低[图7(l)]。
《图7》
图7 微针阵列贴片递送心脏基质细胞用于MI治疗。(a)细胞整合的微针贴片的设计示意图。(b)微针贴片的代表性图像,比例尺:500 μm。(c)细胞整合的微针贴片的荧光图像,比例尺:500 μm。(d)细胞活/死染色的代表性图像,比例尺:200 μm。(e)细胞存活率的定量分析,n = 3,数据以平均值±标准差表示。(f)细胞(绿色)与微针贴片整合3天后的代表性共聚焦图像。(g)用增殖标志物Ki67和α-肉瘤肌动蛋白(α-SA)对新生大鼠心肌细胞(NRCM)进行的定量分析。NRCM单独培养或在有MN或MN-CSC补丁的情况下培养,n = 3,数据以平均值±标准差表示。(h)动物研究的整体设计示意图。(i)用细胞贴片处理的心脏的代表性图像。(j)用细胞贴片处理的心脏的苏木精和伊红(H&E)染色,LV:左心室。(k)用微针贴片处理后7天的心脏的荧光图像,比例尺:400 μm。(l)使用Masson´s三色染色的心肌切片的代表性图像,心脏是在心肌梗塞三周后获得的,蓝色表示疤痕组织;红色表示存活的心肌[
《3.3 可填充式细胞储库用于MI治疗》
3.3 可填充式细胞储库用于MI治疗
在另一项研究中,Whyte等[139]制备了一种治疗型细胞储库,主要通过干细胞分泌的旁分泌因子治疗心肌梗死。该器械主要由三个部分组成:附着于心脏的细胞储库、植入皮下的通路端口和连接它们的管道。储库的可透膜面向心脏表面,而不透膜向外。体外实验表明,储存在器械内的小鼠间充质干细胞能够在培养基中存活28天,并持续向培养基中释放荧光素酶。此外,该研究证实,通过填充管道,可向细胞储库补充干细胞。由于间充质干细胞的生存时间较短,这种多次反复给药的策略可以在多个时间尺度上向MI部位递送细胞相关因子,包括细胞因子、趋化因子和旁分泌因子。
《4、 大尺寸器械用于CAR-T细胞疗法》
4、 大尺寸器械用于CAR-T细胞疗法
CAR-T细胞疗法在治疗pre-B型急性淋巴细胞白血病或B细胞淋巴瘤方面取得较好的效果[140‒141],但是应用于实体瘤治疗时仍面临多重挑战[142‒143]。CAR-T细胞是发挥抗癌活性的直接功能介质,因此在设计用于实体肿瘤治疗的CAR-T细胞递送器械时,必须考虑提升CAR-T细胞停留在肿瘤部位的能力和数量,并为细胞提供物理支持,提高CAR-T细胞的生存能力和抗癌活性。
为了实现上述目标,Coon等[42]开发了用于CAR-T细胞递送的镍钛合金薄膜(thin-film nitinol, TFN)。薄膜上设计有微型图像,允许金属膜在外力作用下发生形变,单轴拉伸形变可超过100%。通过将纤维蛋白凝胶层覆盖在器械表面,可以促进CAR-T细胞的黏附和迁移。此外,抗CD3、CD28和CD137的抗体亦被结合到纤维蛋白凝胶上,用以刺激CAR-T细胞的扩增。在体外培养实验中,TFN上的CAR-T细胞能够保持功能达6天。在不可切除的卵巢癌模型中,通过TFN递送的CAR-T细胞能够根除70%的小鼠肿瘤,延长平均生存时间至80天,远远高于静脉注射或瘤内注射CAR-T细胞的小鼠的生存时间。这种方法为增强CAR-T细胞对实体瘤的抗肿瘤活性提供了一种选择。
GFOGER修饰的海藻钠水凝胶也被用于增强T细胞在肿瘤部位的增殖和滞留能力,并对切除的4T1肿瘤和多灶性卵巢癌具有显著的抗癌活性[144]。Weiden等[145]开发了一种可注射、生物相容、功能化的聚异氰酸多肽水凝胶。当T细胞与其一同注射到肿瘤部位后,该凝胶可改善T细胞在肿瘤部位的停留时间并持续释放出细胞。此外,将能够分泌IL-15的CAR-T细胞与PEG-壳聚糖水凝胶联合注射至视网膜母细胞瘤中,可以显著提高CAR-T细胞的抗癌活性,从而保住了小鼠的视力[146]。这些治疗策略均取得了令人鼓舞的治疗结果。然而,免疫抑制和低氧的肿瘤微环境仍可能会阻碍CAR-T细胞对实体肿瘤的抗癌活性。因此,研究人员又发展了一些新的策略来解决这些问题。
为了逆转肿瘤免疫抑制微环境,Hu等[147]设计了一种可生物降解的HA水凝胶储库,用于同时递送硫酸软骨素蛋白聚糖4(chondroitin sulfate proteoglycan 4, CSPG4)靶向的CAR-T细胞、抗程序性细胞死亡配体1抗体(anti-programmed cell death ligand 1 antibody, aPDL1)修饰的血小板(P-aPDL1)和细胞因子IL-15包裹的聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]纳米颗粒[图8(a)和(b)]。将水凝胶植入术后肿瘤部位,局部肿瘤的复发和远端肿瘤生长均得到了抑制。水凝胶储库能够持续缓慢地向周围肿瘤组织释放CAR-T细胞,避免了因细胞突释而导致的CAR-T细胞大量失活。同时,水凝胶中加载的IL-15能够维持CAR-T细胞的活性[图8(a)]。此外,术后炎症环境能够触发血小板活化,加速抗aPDL1的释放,抑制免疫检查点通路,增强CAR-T细胞的杀伤作用。在体外实验中,血小板能够在96 h内完全地从水凝胶中释放出来;与之对比,在相同条件下,只有50%的CAR-T细胞从水凝胶中释放[图8(c)]。在共体外培养实验中,含有P-aPDL1和CAR-T细胞的水凝胶显示出较好的抗癌活性[图8(d)]。在体内实验中,装载CAR-T细胞和P-aPDL1的水凝胶储库显示出明显高于其他组的肿瘤抑制活性[图8(e)]。值得注意的是,这种水凝胶的全身抗癌活性证实了水凝胶的单侧给药可以抑制对侧肿瘤的生长[图8(f)]。
《图8》
图8 一种用于同时递送和缓慢释放CAR-T细胞和偶联了a-PDL1的血小板的水凝胶储库。(a)水凝胶用于手术后细胞免疫疗法的机制示意图。PMP:血小板衍生的微粒子;NP:纳米粒子。(b)装有细胞和血小板的水凝胶的典型冷冻扫描电子显微镜图像,比例尺:10 μm。(c)CAR-T细胞和血小板在体外的释放,1×107个CAR-T细胞和1×107个血小板被装入水凝胶,n = 3。(d)肿瘤细胞和T细胞共培养72 h后的细胞流式图,n = 3,数据以平均值±标准差表示。(e)治疗三周后小鼠肿瘤的代表性图像,小鼠接受了以下治疗,1:生理盐水;2:P-aPDL1@gel;3:CAR-T细胞;4:CAR-T + P-aPDL1;5:CAR-T@gel;6:CAR-T@gel + P-aPDL1;7:CAR-T-P-aPDL1,比例尺:1 cm。(f)右侧原发肿瘤治疗后左侧肿瘤的大小,n = 6,**P = 0.0023,数据以平均值±标准差表示[
为了改善肿瘤缺氧微环境,Luo等[148]制备了一种多孔水凝胶包被的免疫芯片系统,用于同时递送CAR-T细胞、IL-15和O2到实体肿瘤中。在实体瘤内,凝胶层逐渐降解并向肿瘤微环境释放氧气,从而为CAR-T细胞提供氧气,促进CAR-T细胞从免疫芯片迁移到肿瘤。该疗法能够增强T细胞对肿瘤基质的浸润并提高细胞的存活率,降低肿瘤细胞HIF-1α和Ki67的表达,展示出抑制肿瘤生长的能力。
《5. 3 D打印水凝胶以建立血管网络结构》
5. 3 D打印水凝胶以建立血管网络结构
实体器官包含相互穿插的血管网络,具有物质输送功能。基于生物相容性水凝胶的3D打印血管网络对于人工器官(包括复合血管骨骼、骨骼肌、心脏组织和肝脏)的细胞生存至关重要[149]。Cui等[150]采用质地较硬的PLA和载细胞的柔性GelMA分别构建骨支架和血管,将局部生物活性因子固定,并结合3D打印技术建立具有血管网络的骨骼。此外,Zhang等[151]以内皮细胞自促作用为基础,利用3D打印技术制备基于水凝胶的含血管心肌组织,将血管形成和血管新生结合起来。
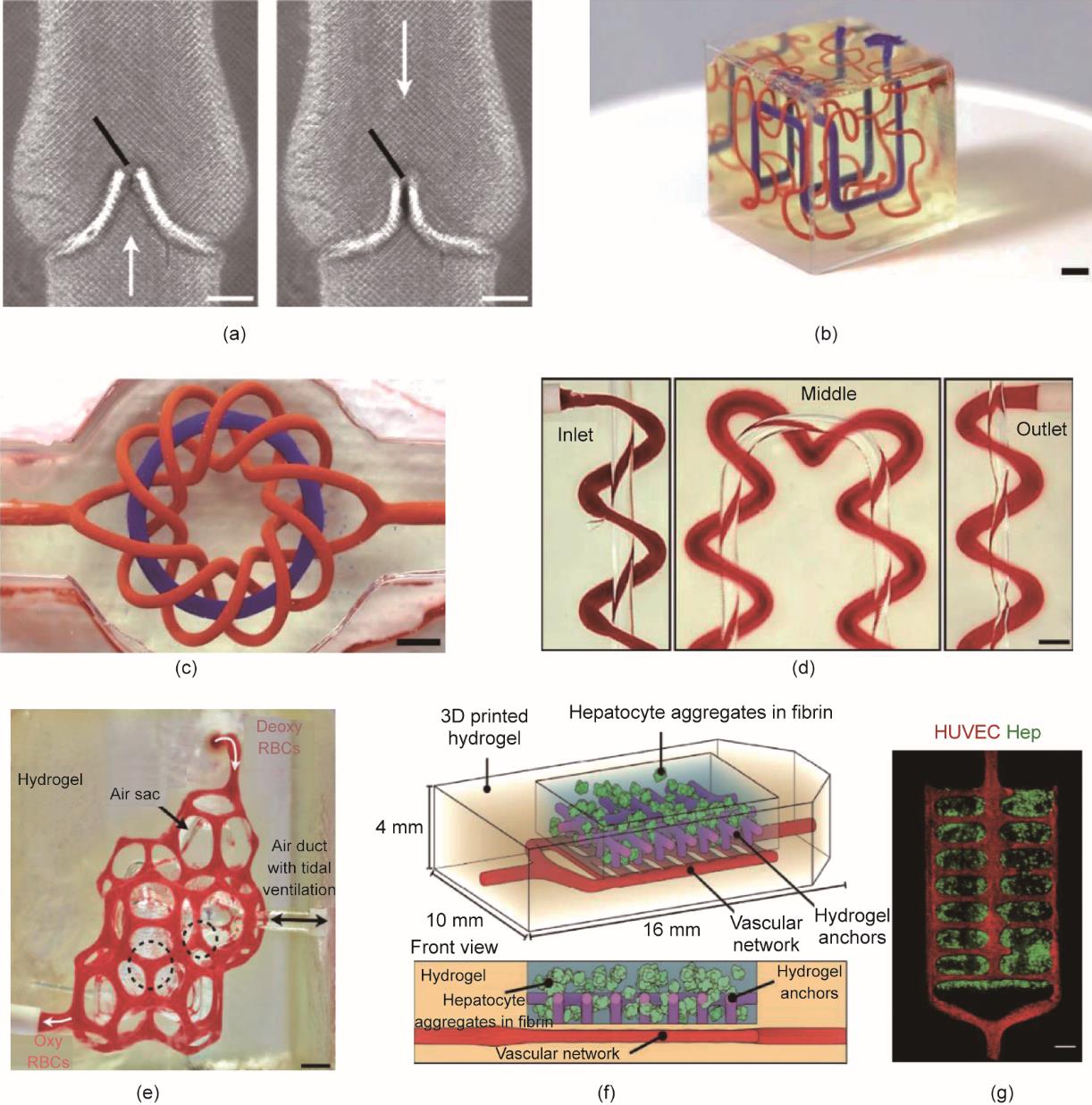
最近,Grigoryan等[152]开发了一种3D打印策略,创建具有内部缠绕血管网络的生物相容性水凝胶,并通过血管内3D流体混合器和二尖瓣进一步将其功能化。该研究发现,无毒的食品添加剂柠檬黄可吸收多余光子,从而增强立体投影在z轴的分辨率,使制备具有缠绕血管网络的柔性水凝胶成为可能[152]。此外,通过3D打印技术,在血管网络中还进一步引入了功能性血管内流体混合器和二尖瓣[图9(a)],证实这种3D打印技术能够产生具有拓扑结构的功能性血管。在该研究中,研究人员利用3D打印技术制备了非连续的立方晶格和缠绕环面[图9(b)和(c)],并证实血管间存在O2运输[图9(d)]。此外,该研究还进一步制备了具有类似肺泡拓扑结构的水凝胶,用于研究呼吸过程中的氧气交换过程[图9(e)],证实分支的血管网络、水凝胶膨胀和血液重定向都能够实现更快的氧气交换。研究人员还制备了包裹哺乳动物细胞的可植入水凝胶,验证了这种打印策略与活细胞的相容性。该纤维蛋白水凝胶器械中含有肝脏组织聚集物、内皮细胞嵌入的血管腔以及用于固定纤维蛋白凝胶的水凝胶锚栓,被用作肝脏模型进行研究[图9(f)和(g)]。在慢性肝损伤小鼠模型中,该器械能够在体内存活超过14天,并在肝聚集物附近的微血管中发现了宿主血细胞。这种用于打印血管网络的3D打印技术,可应用于大型3D器械中,促进其与机体的氧气和营养物质的交换。
《图9》
图9 具备精密血管结构功能的3D打印柔性水凝胶。(a)在由20 wt%的聚乙二醇二丙烯酸酯(PEGDA;6 kg•mol-1)制成的水凝胶中3D打印出缠绕的轴向血管和螺旋线,比例尺:3 mm。(b)水凝胶内的希尔伯特曲线,比例尺:3 mm。(c)环状物和环形结,比例尺:3 mm。(d)轴向血管和包围的螺旋,红细胞从入口流向出口,比例尺:1 mm。(e)有红细胞流动的肺泡状结构的照片,Deoxy RBCs:脱氧红细胞,oxy RBCs:含氧红细胞,比例尺:1 mm。(f)装有肝细胞聚集物的多室水凝胶构造,血管网络中播种了内皮细胞。(g)部分水凝胶的共聚焦显微镜图像,Hep:肝细胞聚集物[
《6、 讨论与结论》
6、 讨论与结论
在过去的几年里,人们用生物相容的惰性材料或可降解材料制备了具有各种结构的大尺寸器械,用于递送细胞以治疗多种疾病(表1)[41‒42,50,72‒74,77‒78,81,87,89,107‒108,120,123,134‒136,139,144,146‒148,150‒152]。大尺寸器械通常被精心设计,满足细胞对营养、氧气、细胞因子和免疫豁免环境的需求,维持细胞(无论是异体还是异种细胞)的生存活性和治疗功能。为了达到这些目标,近年来发展起来的预血管化策略和构建局部免疫抑制环境的策略,能最大限度地为移植物供给氧气和营养物质,防止其被宿主免疫系统攻击,从而提高细胞的负载率,减少器械体积,发挥出器械应有的治疗功能。同时,这些策略也有助于器械的植入和移除。必须指出的是,用于细胞治疗的大尺寸器械必须根据每种疾病的具体要求而定制。
《表1》
表1 具有代表性的细胞治疗器械
| Disease | Device type | Device construction | Dimensions | Membrane or hydrogel components | Cell type | Ref. |
|---|---|---|---|---|---|---|
| Diabetes | Membrane-controlled release system | Bilaminar membrane container | Kidney shaped, 500 mm wide, 3.5 cm long# | PCL | Stem-cell-derived | [ |
| O2 refillable chamber | 7 mm tall, 31.3 mm diameter | PTFE with an alginate layer | Islets from pigs and rats | [ | ||
| CP | 7 mm wide, 15 mm long, | Not mentioned | Islets from mice | [ | ||
| Microporous membrane chamber | 10 mm wide, 17 mm long, 1 mm deep | Polycarbonate track-etched membranes, tetrahydropyran phenyl triazole-derived polymer coating | HEK293T cells, 3T3 fibroblasts, C2C12 myoblasts, islets from rats | [ | ||
| Wireless bioelectronic chamber | 34 mm long, 15 mm wide# | Polyamide | Pancreatic | [ | ||
| Microvascular mesh | 7 mm outer diameter, 1 mm tall | Polydimethylsiloxane with nylon grids | Islets from rats | [ | ||
| Enhanced angiogenesis | 2.5 mm thickness, 9 mm diameter, and a reservoir volume of 120 µL | Polylactic acid | Not mentioned | [ | ||
| MN array patch | Cell-integrated MN array patch | 100 mm2, pyramid-shaped needles, 400 μm along base side, 800 μm tall | HA | Mouse insulinoma cell line 6 cells | [ | |
| Fiber | Hollow porous fibers | 0.5 mm internal diameter, 13 mm long#, 5 fibers as a device | Poly(ether sulfone) | Islets from mice | [ | |
| Reinforced hydrogel | Polymer-thread-reinforced alginate hydrogel | 1.5 mm diameter, 1 in long for mice, 10 in long for dogs | Poly(methyl methacrylate), alginate | Islets from rats and humans | [ | |
| Disk-like hydrogel | 6 mm diameter, 2‒3 mm thick | Triazole sulfobetaine acrylamide-derived polymer | Islets from rats | [ | ||
| Porous tubular device | 2 mm inner diameter | PPG, polyurethane | Neonatal islets from pigs, human pancreatic 1.1B4 cell line | [ | ||
| PEG hydrogel disk | 500 μL volume, 12 mm diameter, 4.4 mm tall | Crosslinked PEG | Islets from rats | [ | ||
Device-less encapsulation | Hollow catheter | 5 mm perimeter, 2 cm long | Nylon | Islets from mice and clinical-grade human islets | [ | |
| MI | MN array patch | Cell-integrated MN array patch | 12 mm × 12 mm, conical-shaped needles, 300 mm base, 600 mm tall | PVA | CSCs from rat hearts | [ |
| Membrane-controlled release system | Replenishable implanted epicardial reservoir | 6 mm wide, 9 mm long# | Thermoplastic polyurethane | MSCs from mice | [ | |
| Ionic hydrogel | Hydrogel-based patch | Not mentioned | Polyacrylic acid-doped alginate/gelatin hydrogel | Cardiomyocytes | [ | |
| Patch | 3D-printed patch | 10 mm diameter, 0.6 mm height | Cardiac extracellular matrix hydrogel and GelMA | Human cardiac progenitor cells | [ | |
| Cell sheet | Prevascularized, multiple-layered cell sheets | 43.6 ± 6.5 μm thick cell sheets | Nano-thin and nanoporous PLGA membranes | Direct cardiac reprogrammed cells from fibroblasts | [ | |
| Cancer | Film | Patterned film | 7 mm × 4 mm | Nitinol coated with fibrin gel | CAR-T cells targeting receptor tyrosine kinase-like orphan receptor | [ |
| Hydrogel | Reservoir hydrogel disk | 400 μL volume, 8 mm diameter | HA | CAR-T cells with CSPG4-specific CAR | [ | |
| 15 mm diameter, 2 mm thick | GFOGER-modified alginate | Mouse CD8+ effector T cells specific for 4T1 breast tumor antigens or with NKG2D-CAR | [ | |||
| Injectable | Chitosan‒PEG hydrogel | GD2-specific CAR-T cells and GD2-specific CAR-T cells secreting IL-15 | [ | |||
| Injectable porous microchips system | Hydrogel-encapsulated porous immune microchip | 200 μm thick microchip | HEMOXCell (Hemo; an oxygen carrier)-loaded alginate | Anti-Meso CAR-T cells | [ | |
Chronic liver injury | Hydrogel | 3D-printed hydrogel | 16 mm × 10 mm × 4 mm | PEG diacrylate, GelMA | Primary hepatocytes from rats | [ |
| Bone construct | Hydrogel | Cylinder 3D-printed hydrogel | 9 mm diameter, 4 mm thickness | Polylactic acid | HUVECs, human MSCs | [ |
| Cardiovascular disease | Heart on-a-chip | Mesh-like hydrogel scaffold | 150 μm fiber diameter, 7 mm ×7 mm base | Alginate and GelMA; PDMS base | HUVECs, cardiomyocytes from rat | [ |
治疗T1D的大尺寸器械在植入期间必须将功能性细胞限制在装置内部,并保证胰岛素能够足量释放至器械外,以调节血糖水平。然而,将胰岛素分泌细胞的存活和功能维持足够长的时间甚至终生仍具有极高的挑战性。使用生物相容性和免疫相容性材料在减少异物反应和纤维化方面已经取得了一些成功。这些策略对于器械和机体微环境间物质的顺利交换以维持器械内部封装的细胞的功能和活性来说至关重要。此外,降低纤维化也避免了装置与周围组织的黏附,方便器械失效后能够被移出体外。目前,胰岛或β细胞植入器械的研究重点仍集中在优化腔体器械膜的理化特性,以减少纤维化并促进新生血管再生。
近年来,随着多能干细胞来源的胰岛素分泌细胞的相关研究逐渐成熟,异体胰岛供应短缺的问题得到了一定程度的解决。提高分化细胞在移植期间的存活率可能有利于疾病的治疗。相比于胰岛,多能干细胞来源的治疗性细胞可能潜在的易诱发全身性疾病或癌症[22]。因此,基于这些细胞的大尺寸器械必须被设计得足够坚固和耐用。另外,植入的位置需要仔细选择,以减少碰撞和器械破裂导致其失效的可能性。另外,减少免疫反应对细胞生存至关重要,需要更多的研究来证实免疫系统对植入细胞在周期超过一年时的影响。此外,与凝胶相比,腔室型器械具有更高的强度,可能更适合于干细胞移植。
虽然通过干细胞诱导生成胰岛细胞能够缓解胰岛供应短缺的问题,但是如何将大量细胞植入尺寸可接受的器械是另一个难点[153]。据估计,要使受试者恢复正常血糖水平,需要30万个当量的胰岛[154]。然而,膜控释系统与生理环境之间缓慢的养分和氧气交换要求容器的厚度小于300 µm [155]。此外,体内可供负载了细胞的器械植入的空间有限。如何提高临床相关的密闭扩散室中的功能细胞的密度,同时保持其生存活性和治疗功能,仍然是一个挑战。将2D结构转化为3D结构或通过外部装置提供营养物质和氧气(如“β-Air”装置)[75]是解决这一问题的一种可行选择。此外,利用3D打印技术,在植入物内部构建血管网络或空气网络可能有助于解决这一问题。
在未来,装载胰岛素分泌细胞的大尺寸器械可能会成为一种“现成”的产品,用于治疗内源性胰岛素分泌不足的患者。大尺寸器械可通过微创手术植入。干细胞来源的治疗细胞作为另一种“现成”产品,通过器械上的外接端口,可反复填充至已植入的器械中,增强其治疗作用。此外,联合使用胰岛素分泌细胞和胰高血糖素分泌细胞的大尺寸器械,或能改善血糖控制。
在众多基于干细胞的MI疗法中,为了延长细胞治疗时间,其中一种疗法是将装载了细胞的器械植入到心脏表面,并经一个管道多次充填细胞到器械中[139]。充足的营养物质和氧气供应是延长细胞生存时间的另一种选择,且可以避免复杂的细胞填充过程。如果装置是可生物降解的,则不需要移除植入的细胞和器械,可以避免因器械移除而造成的二次创伤,增强患者的依从性。另外,心脏在不停地跳动,因此如何将器械安装到心脏表面并固定是一项很有挑战性的工作。因此,为了满足MI的治疗要求,用于治疗MI的器械需要具有灵活性、黏性、耐用性和生物相容性。在未来,MI治疗器械将能够同时提供监测和细胞递送功能。对治疗MI的细胞可根据病情的发展进行类型和数量的调整。
CAR-T细胞免疫治疗中,器械设计的重点已经从提供物理支持转变为将释放到肿瘤中的CAR-T细胞或基因工程T细胞的治疗功能最大化。此类器械一般植入到肿瘤部位,直接对病灶部位进行细胞递送。再通过生物活性分子修饰器械,刺激CAR-T细胞增殖,增强对肿瘤细胞的杀伤能力。例如,PLGA纳米颗粒中包裹的IL-15可以显著促进CAR-T细胞的增殖和存活,从而增强器械的抗实体瘤活性。未来,开发出将细胞释放装置植入内部器官肿瘤(而不是皮肤和眼睛等浅表器官)的策略,将进一步扩大这种装置的临床应用。

















 京公网安备 11010502051620号
京公网安备 11010502051620号




