《1、 引言》
1、 引言
自从进行第一例器官移植以来,异种移植作为避免器官供体短缺问题的一种手段引起了人们的关注。因此,猪基因工程技术取得了新的进展。已经生产出可用于异种移植的转基因猪,并且正在以非人灵长类动物为受体的临床前模型中验证它们[1‒2]。近年来已有数例使用极强的免疫抑制药物进行控制的长期植入的报道[3‒5]。然而,在猪和非人灵长类动物的临床前模型中,仅使用临床上批准用于人类的免疫抑制剂进行免疫抑制的有效性受到限制[6]。
因此,我们旨在开发一种新的供体肾构建治疗方法,该方法将使用组织工程生产的嵌合胚肾,通过体外将人源肾祖细胞注射到胎猪肾中作为异种再生药物[7]。作为实现这一目标的第一步,本研究在非人灵长类动物模型中检验了胎猪肾作为移植物相较于血管化新生猪肾的优势。理论上,移植胎肾的流入血管为宿主血管,这种方法可以避免异源排斥反应的第一靶点血管内皮功能障碍[8‒9]。
尽管已有一些涉及小动物的报道,但据我们所知,目前还没有关于猪-猴临床前模型的明确实验发展过程的报道[10]。因此,我们认为,本研究是在使用临床认可的免疫抑制药物的免疫抑制方案下,首次比较和检验了分别以遗传上未修饰的正常猪和食蟹猴作为供体和受体的模型的植入程度。
最初,将新发育的血管化新生猪肾[2]和胎猪泄殖腔(包括胎肾、输尿管和膀胱)移植到同一受体猴中,并在本研究中验证了发育程度和免疫反应的差异。然后,将胎猪泄殖腔移植到受体猴的主动脉和网膜周围,并进行长期观察。病理上观察了一段时间后的发育程度。
《2、 材料和方法》
2、 材料和方法
《2.1 实验动物与伦理》
2.1 实验动物与伦理
以野猪为供体,玻璃化冷冻保存的E28~30的泄殖腔被解冻并用于胎猪肾脏。此外,体重为5.00~6.12 kg的20~28日龄猪的新生猪肾被用作供体肾。这些实验是根据相应的动物实验指南进行的。
经IVTeC Co., Ltd.(日本)动物实验伦理委员会批准,在IVTeC Co., Ltd.实验室进行了新生猪肾实验(批准号:IVT20-26、20-84;实验编号:K-20-019和K-20-051)。对受试者的实验是在日本住友制药株式会社实验室进行,使用的是5~10岁、体重6.5~7.9 kg的猴,并得到了Sumitomo Dainippon Pharma Co., Ltd.动物伦理委员会的批准(批准号:AN12843;实验编号:RD-AN12843-02, RD-AN12843-03, RD-AN12843-04)。所有异体再生肾实验都得到了东京慈惠会医科大学动物伦理委员会的批准(批准号:2020-055)。
《2.2 实验1》
2.2 实验1
《2.2.1. 新生猪肾和胎猪泄殖腔移植》
2.2.1. 新生猪肾和胎猪泄殖腔移植
根据Takamura等[2]描述的方法进行血管吻合的新生猪肾移植。实验方案示意图如图1所示。在腹部中线切口后,新生猪肾供体的血流被切断。随后,在用由465 mL 欧洲柯林液、35 mL 50%葡萄糖溶液和1000单位肝素组成的保存液回流后,将肾连同血管和输尿管一起移除。它被带到受体设施以准备移植(总储存时间为3 h)。
《图1》
图1 实验方案示意图。
所有受体猴子从前一天晚上开始禁食直到手术。在手术当天使用阿托品(0.1 mg∙kg-1,肌肉注射)和氯胺酮(10 mg∙kg-1,肌肉注射)诱导后,使用异氟醚(0.5%~2%)吸入维持麻醉。手术前后,布托啡诺(0.1 mg·kg-1,肌肉注射)用作镇痛剂,每体47 500单位的青霉素钾用作抗菌药物。
在全身麻醉下通过腹部中线切口对预处理的受体猴进行剖腹手术。结扎左肾动脉/静脉和左输尿管后切除左肾;将新生猪肾原位放置,血管和输尿管吻合[2]。
然后将主动脉和左肾附近的后腹膜钝性剥离形成一个囊袋,并用刮刀将两个泄殖腔移植到每只动物的囊袋中[2]。移植后用结扎夹(美国强生公司)封闭囊袋。同样,将两个泄殖腔移植到大网膜内,用结扎夹封闭囊袋。这防止了泄殖腔脱落,因为它们被网膜组织覆盖。将泄殖腔移植到主动脉旁和网膜后,闭合腹部和伤口,手术完成。
《2.2.2. 移植组织恢复》
2.2.2. 移植组织恢复
移植后13天,经腹部中线切口再次切开腹部。剖腹手术后暴露出大网膜,并以结扎夹夹住的部分为引导,识别移植的胎肾。将移植的胎肾的一部分与周围的网膜组织一起剥离以避免损伤,并回收组织。
随后,手动移动肠,暴露移植的猪肾。剥离左肾动脉/静脉及左输尿管周围区域,暴露腹主动脉和下腔静脉。结扎左肾动脉后,结扎左肾静脉和左输尿管,在猪肾动静脉侧解剖移植肾并整体取出。最后闭合腹部及伤口,手术完成。术后继续给予免疫抑制剂药物,同时观察饮食摄入情况。
此外,移植到网膜的剩余胎肾在移植后27天再次使用相同的方法鉴定。胸内放血处死动物,回收移植组织,完成实验。
《2.3 实验2》
2.3 实验2
《2.3.1. 胎猪肾移植》
2.3.1. 胎猪肾移植
受体猴的术前和术后准备与实验1中进行的准备相似。整个腹部用聚维酮碘消毒,中间切开,麻醉后打开。剖腹手术后,手动移动网膜和肠管以暴露后腹膜。将主动脉附近的腹膜后腔和左肾钝性剥离,形成一个囊袋,并使用称量勺将两个泄殖腔移植到每只动物的囊袋中。随后,移植后用结扎夹封闭囊袋。然后,将三个泄殖腔类似地移植到网膜中,然后用结扎夹封闭囊袋。为确保泄殖腔不脱落,用网膜组织覆盖。将泄殖腔移植至主动脉旁和网膜后,闭合腹部及伤口,手术完成。
《2.3.2. 网膜胎肾恢复/主动脉旁胎猪膀胱和尿路吻合术》
2.3.2. 网膜胎肾恢复/主动脉旁胎猪膀胱和尿路吻合术
移植后33天,使用腹部中线切口重新打开腹部。剖腹手术后,暴露大网膜,并以LIGACLIP®夹住的部分为引导,识别整个移植的胎肾。然后与周围的网膜组织一起解剖胎肾,以避免损伤,并回收组织。
同样,在确定移植的胎肾到主动脉旁区域后,剥离左肾动脉/静脉和左输尿管周围区域,暴露附近的腹主动脉和下腔静脉。结扎左肾动脉后,结扎左肾静脉和左输尿管,取出左肾。取出后,通过降落伞式缝合技术,将一个胎猪膀胱与受体猴的左侧输尿管端对端吻合,进行泌尿重建。最后,泌尿系重建术后,闭合腹部及伤口,完成手术。
《2.4 输尿管形成后主动脉旁胎肾的恢复》
2.4 输尿管形成后主动脉旁胎肾的恢复
移植后50天或79天,使用腹部中线切口重新打开腹部。剖腹术后手动移动网膜和肠,并确认主动脉旁区域的移植组织。识别后结扎右肾动脉,从静脉管线注入约100 mL细胞外液[生理盐水、葡萄糖和维多美静(Alfresa Pharma,日本],同时给予呋塞米(20 mg)和靛洋红(20 mg)。观察大于15 min后,评估移植组织的尿液生成量。随后,从周围组织中解剖并回收移植组织,完成实验。
《2.5 免疫抑制、抗炎和支持治疗》
2.5 免疫抑制、抗炎和支持治疗
免疫抑制治疗是根据先前的报道进行的,并做了一些修改[2,6],详细内容见表1。免疫抑制剂药物均经美国食品药品监督管理局(FDA)批准,但临床上未采用该方案。
《表1》
表1 本研究中使用的免疫增强、抗炎和辅助药物
| Agent (company) | Dose (duration) |
|---|---|
| Thymoglobulin (Sanofi) | 10 mg·kg-1, i.v. (day -3) |
| Rituximab (Zenyaku Kogyo) | 10 mg·kg-1, i.v. (day -2) |
| Abatacept (BMS) | 50 mg·kg-1, div (every one week) |
| Tacrolimus (Astellas) | 0.06-0.01 mg·kg-1, twice a day, i.m. (target trough 9-12 ng·mL-1 (days -9 to 2 target trough 15-20 ng·mL-1)) |
| Mycophenolate mofetil (Pfizer) | 10-50 mg·kg-1, twice a day, p.o. (target trough 4-6 µg·mL-1) |
| Methylprednisolone (Pfizer) | 10 mg·kg-1, div (day 0); 5 mg·kg-1·d-1, p.o. (after day 1), tapering to 0.5 mg·kg-1·d-1 |
| Tocilizumab (Chugai) | 10 mg·kg-1, s.c. (days -1, 7, and 14, and every two weeks) |
| Etanercept (Pfizer) | 0.5 mg·kg-1, s.c. (days 0, 3, 6, and 10) |
| Aspirin (Bayer) | 40 mg·kg-1·d-1, p.o. |
| Low molecular weight heparin (Kaken) | 700 IU·d-1, s.c. |
| Erythropoietin (Kyowa Kirin) | 2000-4000 IU, s.c. (twice a week) |
| Famotidine (LTL) | 0.25 mg·kg-1, p.o., twice a day |
| Valganciclovir (Mitsubishi) | 15 mg·kg-1, p.o. |
| Benzylpenicillin (Meiji Seika) | 95 000 IU·d-1, i.m. |
具体而言,这需要他克莫司(TAC)(0.02 mg·kg-1,即从第-9天开始每天两次)、阿巴他齐特[50 mg·kg-1,静脉滴注(div),从第7天开始每周一次]和霉酚酸酯(MMF)[40 mg·kg-1,口服(p.o.),从第5天开始每天两次]。甲基强的松龙(10 mg·kg-1,div)也从第0天开始给药,并从第二天开始转为p.o.,然后逐渐停用。还给予了胸腺球蛋白[10 mg·kg-1,静脉注射(i.v.),第-3天]、利妥昔单抗(10 mg·kg-1,i.v.,第-2天)、托昔单抗(10 mg·kg-1,s.c.,第-1、7和14天)和依那西普(0.5 mg·kg-1,s.c.,第0、3、6和10天)。
每周两次测定他克莫司和霉酚酸酯在血液中的浓度,并以目标谷浓度为标准酌情调整剂量(TAC谷值为第–9~2天,15~20 ng·mL-1,第3天后,9~12 ng·mL-1;MMF谷值为4~6 g·mL-1)。
《2.6 对受体猴的监测》
2.6 对受体猴的监测
确认了受体猴的每日饮食状态和活动,并通过补充予以支持(如有必要)。此外,每周两次通过体重测量、体温、SpO2测量和血液取样评估它们的一般状况。除TAC和MMF外,红细胞(RBC)、血红蛋白(Hb)、血细胞比容(Ht)[(平均红细胞体积(MCV)、平均红细胞血红蛋白(MCH)和平均红细胞血红蛋白浓度(MCHC)]、网织红细胞(RET)、白细胞(WBC)(中性粒细胞、淋巴细胞、单核细胞、嗜酸性细胞和嗜碱性细胞)、血小板(Plt)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、空腹血糖(Fbg)、总蛋白(TP)、白蛋白(Alb)、总胆红素(T-Bil)、乳酸脱氢酶(LDH)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、γ-谷氨酰转移酶(γ-GTP)、肌酸激酶(CK)、血尿素氮(BUN)、肌酐(Cr)、钠(Na)、钾(K)、氯(Cl)、钙(Ca)、磷(P)、葡萄糖(Glu)、总胆固醇(T-Cho)、甘油三酯(TG)和C反应蛋白(CRP)也通过血液测试进行测量。
《2.7 组织学和免疫组织化学评估》
2.7 组织学和免疫组织化学评估
回收标本用4%多聚甲醛固定,石蜡包埋。然后将其分成4 μm厚的切片,用苏木精和伊红(HE)、过碘酸希夫和Masson三色染色法染色。
对于免疫组织化学,使用分级浓度的乙醇和去离子水对来自福尔马林固定标本的4 μm厚系列切片进行脱蜡和水合。使用0.01 mol·L-1柠檬酸钠缓冲液在高压锅中对用于CD3和CD31染色的组织切片进行抗原提取10 s(预热缓冲液30 s)。抗原回收后,切片用磷酸盐缓冲液(PBS)轻轻洗涤。3%过氧化氢封闭内源性过氧化物酶20 min。用PBS洗涤后,用5%脱脂乳封闭所有切片30 min。然后将所有载玻片与抗CD3抗体(MA5-12577;Invitrogen,美国)或抗CD31抗体(ab28364和JC70/A;Abcam,英国)置于4 ℃温度下培养一整夜。用PBS洗涤后,将切片与Histofine® Simple Stain(424151;日本)培养30 min。以二氨基联苯胺为色原,苏木精为复染剂。
《2.8 评估促红细胞生成素基因表达》
2.8 评估促红细胞生成素基因表达
将实验2第50天采集的一些泄殖腔储存在RNAlater(R0901;Sigma-Aldrich,美国)。使用RNeasy微量试剂盒(74134; QIAGEN, Nederland)从收集的样品中分离RNA。聚合酶链反应(PCR)条件如下:94 ℃ 2 min;然后在98 °C下循环40次,持续10 s,在60 °C下循环15 s,在68 °C下循环1 min。所用引物列于表2。
《表2》
表2 猪和猴EPO的引物
| Gene | Forward primer | Reverse primer |
|---|---|---|
| Cynomolgus monkey | GCA CCT ACC ATC AGG GAC AG | TGT CTT CAC GGT TCT CAC TCG |
| Pig | CAA CTC CTC CCA GCC ATC TG | CCT GCT TGG TAG GTG CAG AA |
《3、 结果》
3、 结果
《3.1 实验1——胎肾抗异种排斥反应的免疫学益处》
3.1 实验1——胎肾抗异种排斥反应的免疫学益处
根据一般情况及血液生化检查结果增加或减少免疫抑制剂的剂量。图2显示了所得到的药代动力学(实验2也在此显示)。此外,在所有病例开始给予免疫抑制剂药物后,观察到肝酶的暂时性升高。术后还观察到了贫血情况。
《图2》
图2 每只动物的血液检测数据。(a)第200号(实验1);(b)第335号(实验1);(c)第323号(实验2);(d)第219号(实验2)。
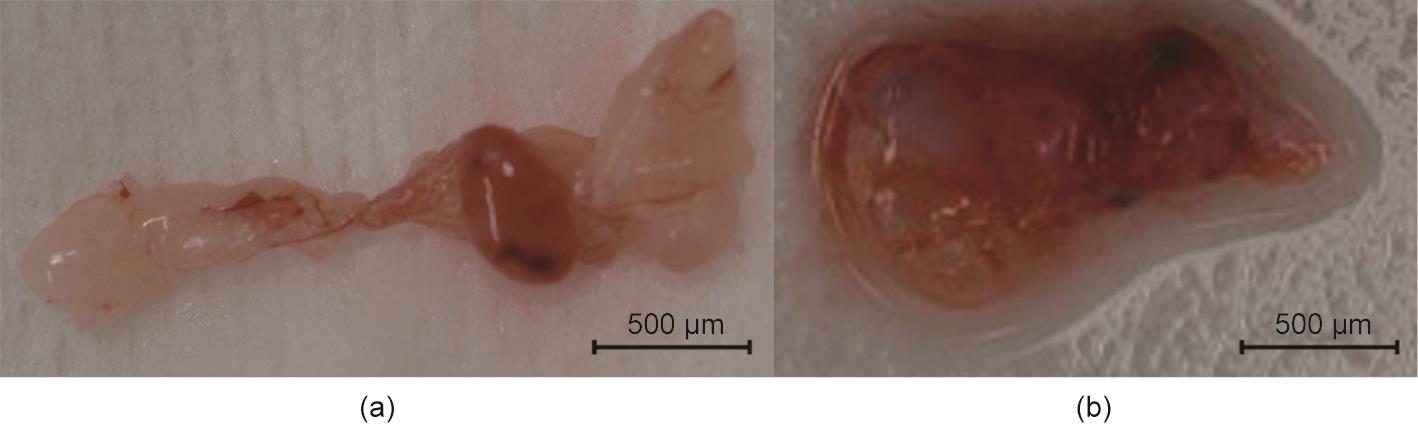
一只受试者因病情突然恶化于术后第7天死亡。另一只受试者相对更稳定。然而,由于病情恶化和血小板转换,移植后13天再次打开其腹部,以取出血管化猪肾并进行泄殖腔活检。与移植时相比,取出的肾脏明显肿胀(重21~124 g,最大直径为5.2~10 cm),颜色也变为暗红色,而泄殖腔在视觉上得以保留(图3和图4)。病理检查显示大部分组织被破坏。由于严重间质出血和皮质坏死效应,未检测到明显的肾小球、肾小管或肾小管周围炎症表现,但观察到伴有纤维蛋白血栓和管腔阻塞的严重动脉炎。观察到大量被HE和CD3阳性细胞深度染色的多核细胞[图5(a)~(e)]。
《图3》
图3 实验1中移植的新生儿肾脏。(a)移植前;(b)移植后13天。
《图4》
图4 实验1中移植的胎猪泄殖腔。(a)移植后13天;(b)移植后27天。
同时回收的胎肾保留了几乎所有的组织结构,如肾小球和肾小管。此外,未观察到核型异常细胞和CD3阳性细胞的浸润[图5(f)~(h)]。
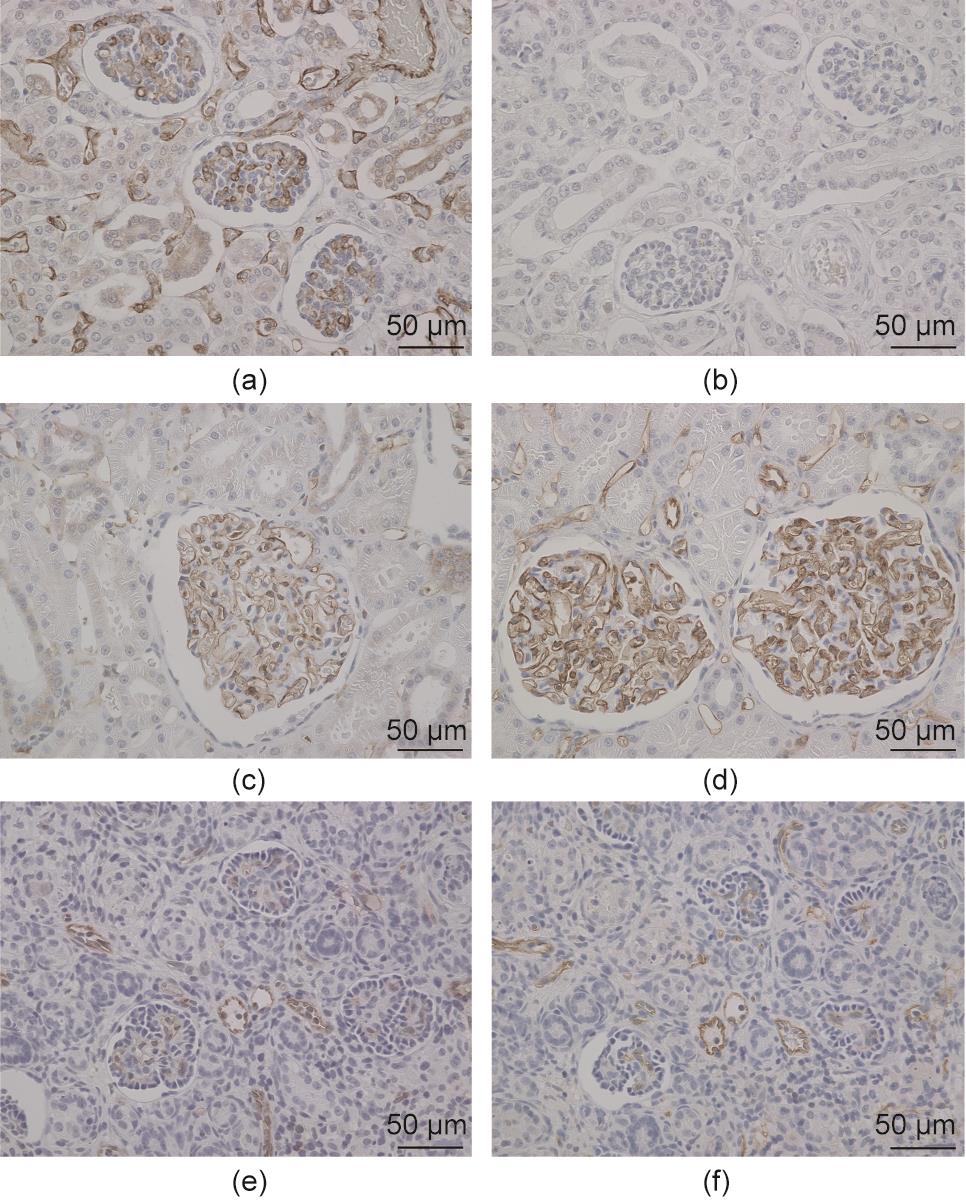
再次闭合腹部后,我们继续对同一只猴给予免疫抑制药物。移植的猪肾被切除后其恢复健康,且相对稳定,直至移植后27天死亡。图4显示了两个回收的胎肾。移植后13天被保留组织结构;在某些部位观察到CD3阳性细胞的浸润[图5(i)~(k)]。表3所示为每个样本的Banff评分。我们将动脉内膜炎从泄殖腔评估中排除,因为在移植的泄殖腔中无法确认血管炎的可评估血管。然而,在猪和猴中使用具有不同染色特性的两种CD31抗体评估了血管的存在(图6)。
《表3》
表3 各样本的Banff病变评分
| Sample | Score of experiment 1 | Score of experiment 2 | ||||
|---|---|---|---|---|---|---|
| Kidney day 13 | Cloacae day 13 | Cloacae day 27 | Cloacae day 33 | Cloacae day 50 | Cloacae day 79 | |
| Inflammation | 3 | 0 | 3 | 0 | 0 | 0 |
| Tubulitis | 0 | 0 | 0 | 0 | 0 | 0 |
| Endarteritis | 3 | ‒ | ‒ | ‒ | ‒ | ‒ |
| Glomerulitis | 0 | 0 | 0 | 0 | 0 | 0 |
| Peritubular capillaritis | 0 | 0 | 0 | 0 | 0 | 0 |
《图5》
图5 比较实验1的新生猪肾脏和胎猪泄殖腔的组织病理学特征的代表性图。(a)~(e)新生猪肾脏;(f)~(h)胎猪泄殖腔(移植后13天);(i)~(k)胎猪泄殖腔(移植后27天);(a)~(d)、(f)、(g)、(i)、(j)Masson三色染色;(e, h, k)CD3(MA5-12577)。
《图6》
图6 实验1的泄殖腔第27天的血管评估。(a)、(b)成年猪肾;(c)、(d)成年猴肾;(e)、(f)胎猪泄殖腔(移植后27天)。(a)、(c)、(e)CD31(ab28364);(b)、(d)、(f)CD31(JC70/A)。
《3.2 实验2——在FDA批准的免疫抑制药物下产生胎猪泄殖腔》
3.2 实验2——在FDA批准的免疫抑制药物下产生胎猪泄殖腔
在组织移植约4周后的第33天进行尿路吻合术。作为标准,最初计划在尿道吻合术后6周评估移植组织。然而,一只受试者的病情在吻合后逐渐恶化。因此,在移植后50天取出移植组织后对其实施了安乐死。另一只受试者相对更稳定。因此,组织在吻合后46天(移植后79天)按计划恢复。
移植后33天,从网膜中回收的最大胎肾的最长直径约为800 µm [图7(a)]。肾小球、肾小管等组织结构大部分保留,与实验1相同,并且未观察到细胞浸润。在目测检查的基础上,肾小囊腔似乎略有扩大。
《图7》
图7 实验2移植胎猪泄殖腔。(a)移植后33天;(b)移植后50天;(c)移植后79天。
移植后50天从主动脉旁区域回收的最大胎肾的最长直径约为1.5 mm。此外,移植后79天从主动脉旁区域回收的最大胎肾的最长直径约为2 mm [图7(b)和(c)]。在组织切除前穿刺胎猪膀胱。因此,在受体静脉注射靛洋红后,无法从任何部位抽吸液体,也无法确认染料迁移到尿路。组织病理学评估未显示移植后33天、50天和79天胎猪肾脏中细胞浸润程度有任何显著变化(图8);然而,肾小球似乎萎缩,肾小囊腔扩大,表明存在肾积水。此外,吻合部分是开放的,在受体猴的胎膀胱和输尿管吻合处的胎膀胱中观察到似乎为液体潴留的空泡。还对从第50天采集的泄殖腔中提取的RNA进行PCR。在与食蟹猴EPO mRNA对应的引物中观察到RNA扩增,表明可能产生EPO(图9)。
《图8》
图8 比较实验2中胎猪泄殖腔的组织病理学特征的代表性图。(a)~(c)移植后33天;(d)~(f)移植后50天;(g)~(i)移植后79天;(a)、(b)、(d)、(e)、(g)、(h)Masson三色染色;(c)、(f)、(i)CD3(MA5-12577)。
《图9》
图9 实验2第50天泄殖腔的EPO PCR。
《4、 讨论》
4、 讨论
据我们所知,本研究首次直接比较了遗传未修饰的猪和猴之间异种移植中新生猪和胎猪肾脏的免疫原性,并观察了胎猪肾脏尿道吻合术后的长期病程。这些实验证实,在异种移植中,胎猪肾脏可能比新生猪肾脏工作更有利,并且胎猪肾脏的长期植入是可能的。
在将成熟的猪肾移植到猴中时,在仅给予FDA批准的免疫抑制药物的情况下,即使是转基因猪也难以长期移植[6]。本研究中的新生猪肾移植导致一只受体猴的病情恶化,移植肾的排斥反应与之前报道的结果一致。但同期胎猪肾中几乎未观察到排斥反应的炎症细胞浸润和组织破坏特征。有趣的是,在移植的胎猪泄殖腔中检测到来自猴的血管和EPO。这一发现表明,受体动物的血管和细胞都可以流入胎肾并被嵌合。已有关于将胎鼠、猪和人肾脏移植到异种受体啮齿动物的报道[7,9,11]。已经确定,如果选择适当的时期,如四周时间,则胎肾成熟为产生尿液的肾组织,而不会分化为其他组织。此外,移植过程中异种受体的血管流入胎肾[7,9],并且在发育阶段肾内供体抗原表达减少[9,12]。这表明异种移植中发生泄殖腔排斥的可能性低于新生儿肾脏排斥。然而,在同时移植新生肾和胎肾的实验1中,尽管实验1的疗程比实验2短,但在胎肾中观察到炎症细胞浸润。因此,强烈诱导炎性反应的因子(如新生猪肾)的存在也可将炎症传播至胎猪肾,胎猪肾被认为具有低免疫原性。此外,抗猪免疫球蛋白E(IgE)/A抗体等天然抗体也可能参与受体猴的免疫反应[13]。但是,它们也可能对胎猪肾脏的发育没有显著影响。
只有在使用免疫抑制剂的情况下才有可能长期植入。然而,通过仅在胎肾移植中减少免疫抑制药物的类型和剂量,甚至可以预期长期植入(实验2)。
排异反应和尿排泄系统的建立都是受体将胎儿肾脏发育成更成熟的肾脏所必需的[14]。与之前的报道一样,本研究建立了泌尿排泄系统。然而,未能确认尿液的生成和排出,这提示存在尿潴留的可能性。因此,体型较小且不是四足的猴类可能容易发生移植血管的血管功能不全[2],并且泌尿道也可能受损。使用支架预防尿路梗阻并确定不易堵塞的最佳吻合部位是未来建立可靠的泌尿排泄系统的必要条件。
《5、 结论》
5、 结论
本研究证明了在不使用转基因动物的情况下,使用猪-猴临床前模型成功移植和长期植入胎肾。此外,本研究对于开发输注人源性肾祖细胞以实现人源化肾脏的嵌合胎肾也具有重要意义。




















 京公网安备 11010502051620号
京公网安备 11010502051620号




