《1、 引言》
1、 引言
轻质油(LCO)是炼油厂催化裂化(FCC)工艺的重要副产品之一,具有较高的芳烃含量(质量分数高达90%)和硫含量(质量分数高达4.0%),因而在用作燃油之前需要对轻质油进行进一步处理[1]。工业上广泛采用加氢处理和加氢裂化技术处理LCO,通过对LCO组分中的多环芳烃进行加氢、裂化和异构化,将LCO升级为高质量产品[2‒3]。然而,对于LCO中芳香族硫化合物,如二苯并噻吩(DBT)和4,6-二甲基二苯并噻吩(4,6-DMDBT)等,加氢反应条件尤为苛刻,导致LCO脱硫成本较高[4]。因此,开发其他的脱硫技术以降低清洁燃油的生产成本尤为重要。目前,多种非加氢脱硫方法,如氧化脱硫[5‒10]、萃取脱硫[11‒12]和吸附脱硫[13‒18]被相继开发,作为现有加氢脱硫方法的补充,旨在去除难处理的芳香硫化合物。其中,吸附脱硫因可在温和条件下吸附芳香族硫化合物而受到广泛关注,有望与现有加氢脱硫技术联用以降低LCO的处理成本(图1)。高效吸附剂被认为是影响吸附脱硫性能的关键因素之一[18]。
《图1》
图1 石油精炼过程示意图[
六方氮化硼(h-BN)是一种二维层状材料,广泛应用于各种领域,如催化、吸附、磁性、导热、生态学和生物学领域等[19‒22]。此外,通过对h-BN材料的原子结构和电子结构进行改性,还能进一步扩展该材料在氧化[23‒24]、超级电容器[25]、电化学合成[26]和吸附分离[27‒28]等领域的应用。根据文献报道,氮化硼材料的电子结构和表面结构在储氢和吸附脱硫等应用中也起着重要作用[29‒32]。特别是杂原子掺杂的氮化硼材料,与原始氮化硼相比,具有独特的电子结构,因而表现出独特的物理化学性质,如优异的催化活性[33]、较强的电子离域效应[34]和较高的吸附性能[35‒36]等。非金属氧原子的电负性高于氮原子,因此氧原子掺杂的BN材料显示出独特的性质。迄今为止,已有多种氧掺杂BN材料的合成方法被相继报道(见附录A中的表S1)。当在BN材料中掺杂氧原子时,低晶格缺陷可能导致BN材料在室温具有铁磁性[37]。硼氮氧材料具有良好的稳定性且更强的吸附能,可以作为一种优异的储氢材料[38]。综合考虑,调控BN材料的电子和表面结构是一种能够有效而直接地提升吸附脱硫性能的策略。
近来,Weng等[39]提出将氧原子嵌入BN中,用氧原子取代氮原子以调节BN的电子结构,提高BN的吸电子能力。由于掺氧BN吸附剂具有不均匀电子云密度特性,使其表现出高吸附活性[40]。然而,先前的研究主要集中于通过氧原子掺杂改性BN来提高吸附脱硫性能[41],但是关于制备的氧掺杂BN材料中氧原子的存在形式是边缘羟基取代(BN‒OH)还是氧原子嵌入BN面内晶格的问题鲜少提及。因此,本文构建具有边缘羟基氧以及内部取代氧原子的BN材料,用以研究不同取代位置对吸附脱硫性能的影响。
本文提出了一种基于聚合物的合成方法来可控地构建原子尺度双氧原子位点修饰的BN(BN‒2O)材料,系统地研究了氧原子的引入对BN‒2O电子和表面结构的影响,并将之与吸附脱硫性能相关联。研究发现,BN‒2O材料边缘处的羟基结构可促进吸附剂与吸附质之间的π-π相互作用,有利于增强BN‒2O的吸附脱硫能力。而在BN‒2O内部晶格的氧原子则可通过极化吸附质的方式,进一步强化BN‒2O与吸附质之间的偶极作用,使得BN‒2O对硫化合物表现出良好的吸附选择性。此外,BN‒2O中的多级孔结构也有利于提高吸附性能。本文为氧掺杂BN材料的可控合成制备及其吸附脱硫应用提供了深入的见解,并有望为其他杂原子掺杂吸附材料的设计提供思路。
《2、 材料和方法》
2、 材料和方法
《2.1 BN‒2O和BN‒OH的合成》
2.1 BN‒2O和BN‒OH的合成
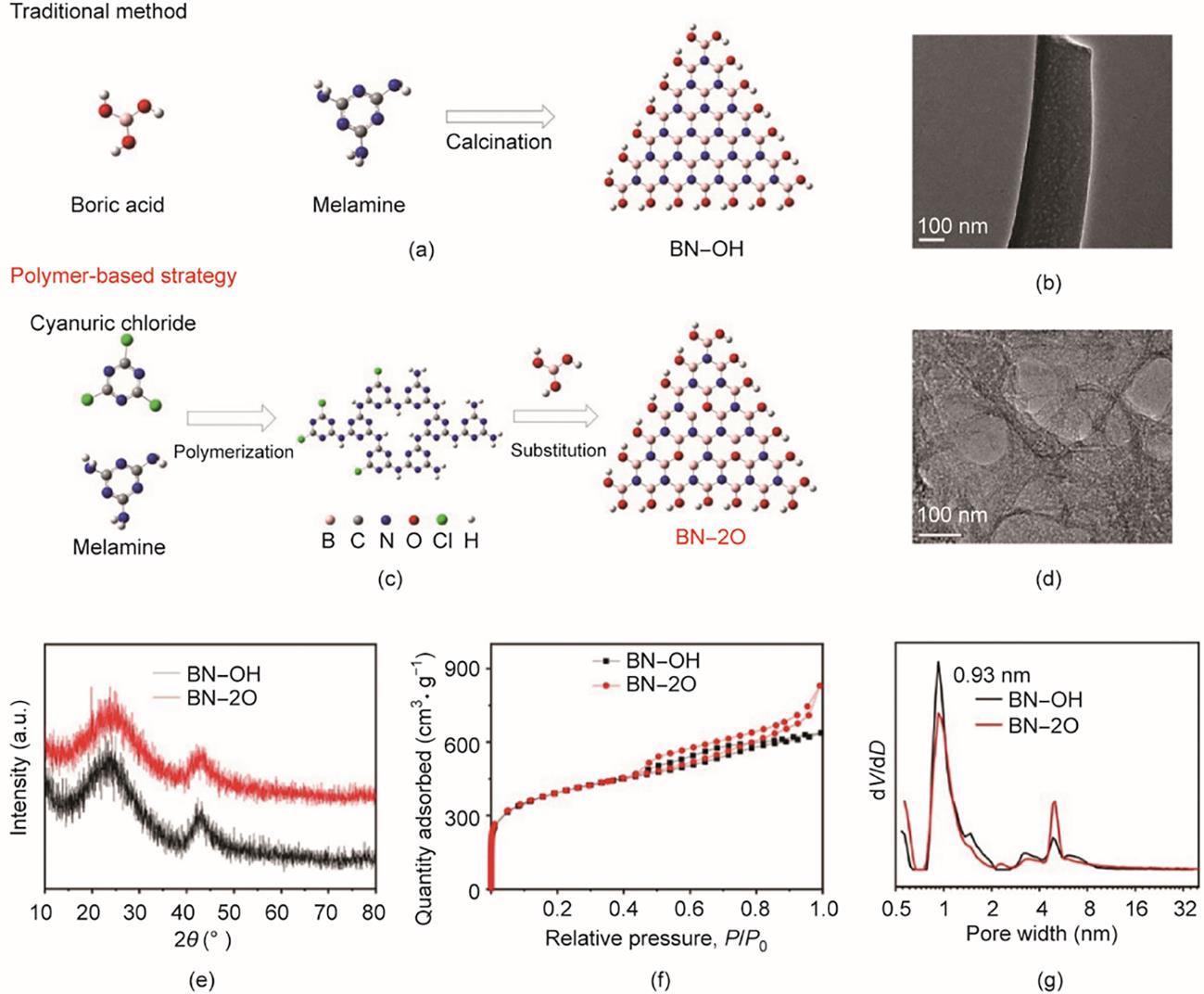
称取0.02 mol三聚氰氯(C3N3Cl3)和0.06 mol三聚氰胺(C3H6N6)于烧杯中,加入50 mL乙腈,搅拌30 min。然后加入0.01 mol硼酸过夜,搅拌后,在70 °C下蒸干。将干燥后的样品放在通N2(200 mL‧min-1)的管式炉里,在900 °C下保持2 h,即得BN‒2O(具有边缘羟基氧以及内部取代氧原子,图2)。
《图2》
图2 BN‒OH [(a)、(b)]和BN‒2O [(c)、(d)]的合成示意图及TEM图;(e)BN‒OH和BN‒2O的XRD图;BN‒OH和BN‒2O的N2吸附-脱附曲线(f)及孔径分布图(g)。
边缘羟基化BN(BN‒OH)的制备方法与BN‒2O的制备方法相似,但在制备过程中未加入三聚氰氯。
试剂来源以及纯度详见附录A中的补充材料。
《2.2 表征》
2.2 表征
材料的形貌表征所用的仪器为场发射扫描电镜(SEM, JSM-7001F, JEOL, Japan)和透射电镜(TEM, JEM-2100, JEOL)。X射线衍射(XRD)表征所用的仪器为Shimadzu XRD-6100 X射线衍射仪(Japan)。N2吸脱附曲线表征所用的仪器为Micromeritics ASAP 2020 HD88比表面积和孔隙度分析仪(Micromeritics Instrument Corporation, USA),孔径分布所用的分析方法为非定域密度函数理论(NLDFT)。傅里叶变换红外(FTIR)表征所用的仪器为Nicolet Nexus 470傅里叶变换红外分光光度计(Thermo Electron Corporation, USA)。紫外可见漫反射(UV-Vis DRS)表征所用的仪器为UV-2450分光光度计(Shimadzu Corporation)。X射线光电子能谱表征所用的仪器为VG MultiLab 2000 分光仪(VG Instruments, UK)。电子顺磁共振(EPR)表征所用的仪器为A300-10/12(Bruker, Germany)。热重(TG)分析表征所用的仪器为STA 449 C(NETZSCH Corporation, Germany)。
《2.3 吸附性能测试》
2.3 吸附性能测试
首先,将DBT溶解于正辛烷中,再加入十四烷作为内标物,制得初始硫含量分别为100 mg‧L-1、200 mg‧L-1、300 mg‧L-1、500 mg‧L-1和800 mg‧L-1的模拟燃油。含4,6-DMDBT的模拟燃油的制备过程与上述过程类似,其初始硫含量为425 mg‧L-1。将对二甲苯或萘(50 mg‧L-1)作为竞争吸附质,分别加入上述含DBT(500 mg‧L-1硫)的模拟燃油。
之后,为了探究BN‒2O的吸附容量,将20 mL模拟燃油和0.05 g吸附剂振荡t min,收集上清液,并通过安捷伦气相色谱(Agilent-7890A, USA)测量油品中剩余硫含量。
最后,动态吸附实验过程、吸附容量计算公式、Langmuir等温线模型,Freundlich等温线模型、准一级动力学模型和准二级动力学模型详见附录A中的补充材料[42‒43]。
《3、 结果和讨论》
3、 结果和讨论
在本文中,以三聚氰氯和三聚氰胺作为前驱体,通过缩聚法制备聚合物前驱体。在硼酸和聚合物前驱体进行热解的过程中,硼原子将取代中间产物中的碳原子,从而得到BN‒2O。图2(c)为BN‒2O的合成示意图。通过电镜进一步观察制备材料的形貌,BN‒2O呈现出棉花状的形态[见附录A中的图S1(a)],BN‒2O主要通过三聚氰氯和三聚氰胺分子聚合而成,与此形成鲜明对比的是,所制备的BN‒OH [见附录A中的图S1(b)]呈现出纳米线结构。根据TEM图结果可知,BN‒2O样品[见图2(d)及附录A中的图S1(c)和图S1(d)]呈现片状形貌,具有由层褶皱组成的多孔结构,而BN‒OH的孔[图2(b)]仅分布在纳米线中。此外,可以注意到BN‒2O和BN‒OH的晶体结构略有不同。XRD分析[图2(e)]显示在23°处有一个宽峰,对应于BN的(002)晶面[44‒45]。而BN‒2O在42°左右的特征峰强度略弱于BN‒OH,这表明BN‒2O样品的无序原子排列可能会对其电子和表面结构有影响[46]。
根据N2吸附-脱附曲线的结果进一步探究缩聚作用对BN‒2O表面结构的影响[图2(f)]。BN‒2O和BN‒OH的比表面积分别为1306 m2·g-1和1309 m2·g-1。BN‒2O的孔径主要集中在0.93 nm处[图2(g)],这可能源于聚合物的分解[47]。如图2(f)所示,BN‒2O呈现典型的IV型吸附-脱附等温线,具有H4型回滞环,且在相对压力(P/P0)高时吸附不饱和,表明BN‒2O存在微孔、介孔和大孔[48]。这与TEM图结果一致。BN‒2O中小于1 nm的微孔有利于吸附过程的进行,且介孔和大孔可以促进传质[49‒51]。因此,多级孔结构有利于吸附脱硫过程的进行。
FTIR图表明三聚氰氯与三聚氰胺的缩聚作用会影响BN‒2O的化学结构[图3(a)、(b)]。BN‒OH在3408 cm-1、1387 cm-1和799 cm-1处的特征峰分别对应B‒OH振动、面内B‒N伸缩振动和面外B‒N‒B弯曲振动[39,52]。与BN‒OH相比,BN‒2O在1040 cm-1处出现了一个新的峰,归属于sp2杂化的B‒O键[53]。进一步利用UV-Vis DRS表征探究BN‒2O的电子结构[图3(c)];与BN‒OH相比,BN‒2O的吸收光谱发生了显著的变化。如图3(c)所示,BN‒OH和BN‒2O在247 nm处存在的特征吸收峰归属于BN的电子激发[54]。BN‒2O在320 nm处的另一个吸收峰由空位和杂质产生[55]。氧原子嵌入BN‒2O的晶格内部,形成了不同于BN‒OH的独特电子结构。氧原子的高电负性可以作为极性中心来增强BN与富电子二苯并噻吩类硫化合物之间的π-π相互作用[56]。利用XPS进一步分析BN‒2O和BN‒OH的电子结构[图3(d)~(f)]以及元素组成(见附录A中的表S2),结果表明氧含量有明显的增加,这可能源于初始的缩聚作用。将BN‒2O的B 1 s峰分解成三个峰(位于190.8 eV、191.7 eV和192.6 eV处),分别归属于B‒N、B‒OH [57]和B‒O [40];表明BN‒2O比BN‒OH有更高的B‒OH含量,而且BN‒2O还含有B‒O结构。此外,BN‒2O的O 1s XPS比BN‒OH具有更低的结合能,表明BN‒2O结构中存在更多的晶格内部取代氧原子。以上结果表明通过氧掺杂策略可对BN‒2O的结构进行可控调节。
《图3》
图3 (a)、(b)BN‒OH和BN‒2O的FTIR图;(c)BN‒OH和BN‒2O的UV-Vis DRS图;(d)~(f)BN‒OH和BN‒2O的XPS图:(d)BN‒OH‒B 1 s;(e)BN‒2O‒B 1 s;(f)O 1 s。B‒OH表示硼原子与边缘羟基相连,B‒O表示硼原子与晶格内部氧原子相连。
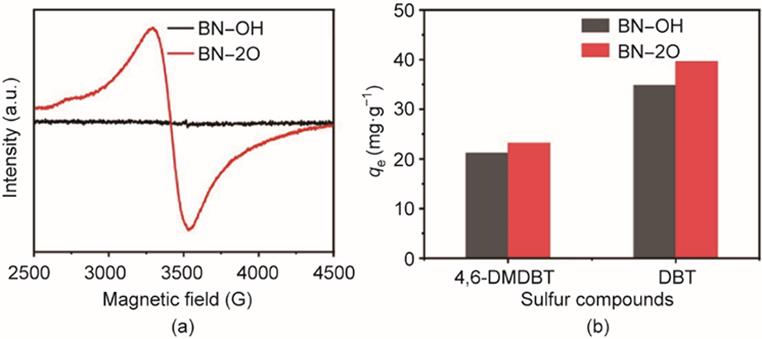
采用电子顺磁共振(EPR)实验直接表征材料的缺陷结构[图4(a)]。与BN‒OH相比,在g = 2.0616时,BN‒2O显示出较强的信号,主要是由于BN结构中晶格内部取代的氧原子存在大量顺磁缺陷结构和未成对电子[58]。综上所述,基于聚合物的合成路线,具有大量氧掺量的BN‒2O被成功制备。
《图4》
图4 (a)BN‒OH和BN‒2O的EPR图;(b)对不同硫化合物的吸附性能图。qe:吸附平衡时的吸附容量(mg‧g-1)。吸附条件:500 mg‧L-1初始硫含量(DBT)和425 mg‧L-1初始硫含量(4,6-DMDBT)、V(fuel) = 20 mL、m(adsorbent) = 0.05 g、T = 298 K、标准大气压。
据文献报道,三聚氰氯和三聚氰胺在缩聚过程中形成中间体,经过一系列反应形成富氮石墨烯[59]。其中碳原子可以被B(OH)官能团或单个硼原子所取代[60]。因此在BN结构中存在面内晶格取代氧原子和边缘羟基氧原子。硼酸和聚合物中间体形成B‒N键需要克服能垒,以去除硼酸中的羟基和聚合物中的其他有机基团[39]。当使用伯胺或仲胺时,煅烧过程中能垒明显降低。然而,当使用叔胺时,B‒N键的形成需要克服更高的能垒,以消除叔胺中的有机基团。在这种情况下,部分B‒O键以内部含氧官能团的形式存在于制备的BN材料中。为了进一步探索该假设,对不同前驱体进行了TG分析(见附录A中的图S2),结果表明BN‒2O的前驱体分解温度高于BN‒OH的前驱体分解温度。该结果证实了制备的BN‒2O前驱体在缩聚过程中,硼酸和中间体形成B‒N键需要克服更高的能垒以去除硼酸中的羟基和聚合物中的其他有机基团。因此,可推测BN结构中氧原子的晶格内部取代和边缘羟基化是通过这种基于聚合物的合成策略实现的。
基于上述分析,具有大量氧掺量和微孔结构的BN‒2O被成功制备。对BN‒OH和BN‒2O吸附DBT和4,6-DMDBT的吸附脱硫性能进行探究,结果如图4(b)所示。BN‒2O的吸附容量明显高于BN‒OH。与文献报道的吸附剂相比(见附录A中的表S3),BN‒2O对DBT具有优异的吸附脱硫性能。BN‒2O吸附剂之所以具有优异的吸附脱硫性能主要存在两个因素,即材料的形貌和电子结构[56]。一方面,根据N2吸附-脱附等温线和孔径分布结果,BN‒2O具有很多小于1 nm的微孔(有利于吸附),且存在的介孔和大孔结构也有利于提升吸附容量[49‒50,61]。另一方面,BN‒2O的边缘和晶格内部结构中含有大量的氧原子可以增强吸附质与BN‒2O的相互作用。
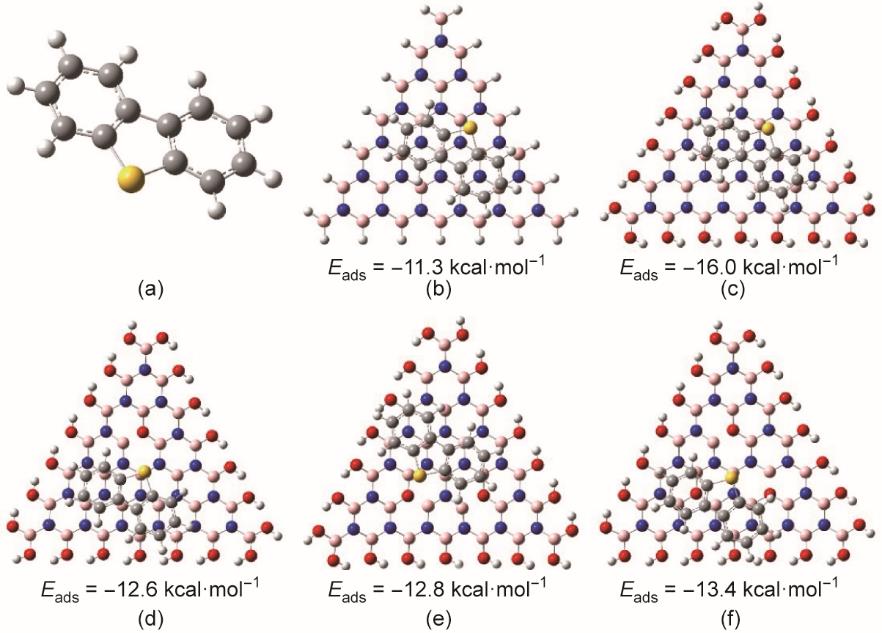
采用理论计算深入探究掺杂氧原子对BN吸附脱硫性能的影响。基于密度泛函理论(DFT)研究芳香族硫化合物和BN吸附剂(BN、BN‒OH和BN‒2O)之间的吸附作用(见附录A中的图S3及图5)。晶格内部取代氧原子的掺杂数被定义为BN‒2O(x为内部取代氧原子数)。利用M062X-D3方法,在6-31G(d) 基组中进行色散矫正,计算吸附自由能。发现DBT通过π-π相互作用吸附在BN模型上,吸附自由能为-11.3 kcal‧mol-1(1 kcal = 4.19002 × 103 J)[图5(b)]。边缘羟基化后,BN‒OH对DBT的吸附增强,吸附自由能为-16.0 kcal‧mol-1 [图5(c)]。此外,还研究了DBT在BN‒2O模型上的吸附[图5(d)~(f)];由于BN存在晶格内部取代氧原子,因此BN‒2O模型中存在未成对电子,这与EPR的结果一致。但是,DBT的吸附受到了晶格内部取代氧原子的阻碍,导致BN‒2O1、BN‒2O2和BN‒2O3模型的吸附自由能分别为-12.6 kcal‧mol-1、-12.8 kcal‧mol-1和-13.4 kcal‧mol-1。
《图5》
图5 (a)DBT的分子模型;DBT被吸附于BN(b)、BN‒OH(c)、BN‒2O1(d)、BN‒2O2(e)和BN‒2O3(f)上的吸附模型。
采用自然布局分析(NPA)进一步探究吸附性能提升的原因(见附录A中的图S4)。研究发现,DBT被吸附后,其分子上的NPA电荷分布变化较小,但硫原子上的NPA电荷数量明显增加。由于较高的电负性,掺杂氧可以吸引BN上的电子,降低BN主体的电子云密度,从而促进吸附剂与吸附质之间的π-π相互作用。因此,边缘羟基化可增加吸附剂的吸附容量(见附录A中的图S1)。由于这种效应,含有更多B‒OH键的BN‒2O表现出更高吸附芳香族硫化合物的能力。
基于NPA结果还研究了DBT在BN‒2O模型上的吸附情况[见附录A中的图 S4(c)~(e)]。可以发现,BN‒2O模型上吸附的DBT电荷分布变化明显。一方面,晶格内部取代氧原子可以作为路易斯碱向DBT的共轭环提供电子。另一方面,不饱和硼原子可以作为路易斯酸位点从DBT共轭环中吸引电子。这两种效应降低了DBT的共轭,阻碍了吸附剂与吸附质之间的π-π相互作用。此外,在DBT被吸附于BN‒2O1的模型中,DBT倾向于远离晶格内部取代氧原子,这进一步表明晶格内部取代氧原子阻碍了π-π相互作用(见附录A中的图S5)。然而,BN‒2O模型中的晶格内部取代氧原子也会增加被吸附DBT的分子极性,导致硫原子和氧原子之间存在偶极相互作用。NPA研究表明,BN‒2O模型上被吸附的DBT中硫原子的电荷顺序如下:BN‒2O1 (0.441) ≈ BN‒2O2 (0.439) < BN‒2O3 (0.456) [与吸附自由能的顺序相同:BN‒2O1 (-12.6 kcal‧mol-1) ≈ BN‒2O2 (-12.8 kcal‧mol-1) < BN‒2O3 (-13.4 kcal‧mol-1)。这种特殊的偶极相互作用(见附录A中的图S2)有利于BN‒2O从富含芳烃的燃油中选择性吸附DBT。
附录A中的图S6显示了模拟燃油在含有一定量芳烃情况下,吸附剂选择性吸附DBT的能力。与模拟燃油相比,在萘或对二甲苯存在的情况下,BN‒2O仍然表现出较高的吸附性能,吸附容量分别达到32.4 mg·g-1和33.6 mg·g-1。这一结果表明晶格内取代氧原子对BN选择性吸附DBT的重要性,这与理论计算结果相符。在室温下研究了BN‒2O对不同初始硫浓度模拟燃油中DBT的吸附[图6(a)]。在较高初始DBT浓度时,BN‒2O的吸附容量较高,说明初始浓度在吸附过程中起着至关重要的作用。根据上述结果,分别用Langmuir和Freundlich等温线模型来描述DBT的吸附实验数据[见图6(b)和附录A中的表S4]。结果表明,吸附结果更符合Freundlich等温线模型,说明DBT在BN‒2O不均匀表面上形成多分子层吸附[62]。
《图6》
图6 (a)BN‒2O对不同初始硫含量DBT的吸附性能图。(b)DBT被吸附于BN‒2O上的Langmuir和Freundlich等温线拟合曲线。(c)DBT被吸附于BN‒2O上的准二级吸附动力学模型。Ce:吸附平衡时的浓度(mg‧L-1);qt:吸附时间为t min时的吸附容量(mg‧g-1);吸附条件:V(fuel) = 20 mL、m (adsorbent) = 0.05 g、T = 298 K、标准大气压。(d)DBT被吸附于BN‒2O的穿透曲线。
进一步研究DBT在BN‒2O上的吸附动力学,以研究达到平衡前的吸附速率 [见图6(c)和附录A中的图S7及表S5]。采用准一级和准二级动力学模型确定吸附行为,BN‒2O吸附实验数据拟合的准二级动力学系数(R2)更接近1。高初始浓度下的h值高于低初始浓度下的h值,表明初始DBT浓度对吸附速率有显著影响[63]。
对BN‒2O进行动态吸附脱硫性能探究[图6(d)]。从图6中可以看出,BN‒2O具有较高的吸附脱硫性能,这是由于其独特的电子结构和多级孔结构。BN‒2O经甲苯洗脱吸附的DBT后干燥再生,对其循环性能进行探究,4次循环的吸附容量分别为39.6 mg·g-1、31.2 mg·g-1、27.6 mg·g-1和24.4 mg·g-1。因此,该材料在吸附脱硫技术中具有潜在的应用前景。
《4、 结论》
4、 结论
本文报道了以三聚氰氯和三聚氰胺分子缩聚而成的聚合物与硼酸混合热解制备得到的双氧原子位点掺杂BN材料。与BN‒OH相比,BN‒2O具有更高的吸附容量的原因在于丰富的氧含量以及微孔结构。DBT可能在BN‒2O非均匀表面上形成多分子层吸附。理论计算表明,双氧原子位点改性可以提高BN‒2O吸附剂的吸附脱硫性能。经过4次循环后,BN‒2O仍具有较高的吸附容量,因此BN‒2O材料可作为高效吸附剂应用于吸附脱硫。本研究为双氧原子位点改性BN的可控合成提供了新的思路,为杂原子掺杂吸附材料的设计和应用提供了广阔的前景。
















 京公网安备 11010502051620号
京公网安备 11010502051620号




