《1、 引言》
1、 引言
抗生素耐药性是21世纪全球最大的公共卫生挑战之一,碳青霉烯类药物是我们治疗危及生命的多重耐药菌感染的最有效抗生素之一[1]。不幸的是,碳青霉烯耐药肠杆菌(carbapenem-resistant Enterobacterales, CRE)的快速传播是目前困扰住院患者和医生的主要问题,因为CRE对碳青霉烯类药物、头孢菌素类药物和青霉素类药物均表现出高水平耐药性,严重限制了治疗方案[2]。因此,CRE被称为“梦魇细菌”,同时伴随着大量的经济负担[3],并被列为首要的公共健康威胁之一[4]以及迫切需要优先研发新抗生素的病原体[5]。
目前,世界范围内医疗机构相关的CRE菌株主要产三种碳青霉烯酶:新德里金属-β-内酰胺酶(NDM)、肺炎克雷伯菌碳青霉烯酶(KPC)和可水解碳青霉烯的氧青霉烯酶-48型β-内酰胺酶(OXA-48)[6]。产NDM菌株在50多个国家广泛流行,特别是在南亚(印度、巴基斯坦和孟加拉国)和中国,而产KPC菌株更普遍在北美洲和南美洲(美国、阿根廷和巴西)以及在中国和欧洲(希腊、意大利和以色列)流行[7]。一项涉及36个欧洲国家的跨国研究显示,医院获得性碳青霉烯耐药大肠杆菌(CREC)中NDM和KPC阳性率分别为10.3%和7.2% [8]。在中国,2014—2015年在25个省份收集的产NDM和KPC临床分离株分别占所有CREC的49.4%和39.6% [9]。相反,在另一项中国19个省份健康人群的研究中,46.7%的CREC中blaNDM是唯一检测到的碳青霉烯酶基因[10]。综上所述,这些数据表明,NDM是中国大多数人源CREC菌株的碳青霉烯酶。
在世界范围内来自食品、野生和伴侣动物的CREC菌株中,NDM仍然是流行最广的碳青霉烯酶[11]。在中国,产NDM菌株正成为食品动物中最主要的产碳青霉烯酶菌株,并污染下游的肉制品[12],其中,blaOXA-48和blaKPC极少出现[13]。然而,尽管有一些证据表明CREC可在人与动物之间直接传播[15],但迄今为止,动物来源的CREC还没有被普遍认为是影响人类健康的问题之一[14]。
《2、 材料和方法》
2、 材料和方法
《2.1 研究设计》
2.1 研究设计
图1和附录A中的图S1展示了本项研究的框架。本文由回顾性横断面研究开始。首先,从中国细菌耐药监测网(CHINET)中,获得在2016年1月1日至12月31日期间,中国30家医院的门诊患者和住院患者中收集的共计29 799株大肠杆菌分离株。这些医院多数为大型诊疗机构,共覆盖22个省(直辖市),所在省(直辖市)总人口约9亿。为了避免重复,根据患者识别代码,临床标本中每个患者仅包含一个分离株。物种鉴定采用自动化系统,如Vitek 2 Compact(bioMérieux,法国)和Phoenix-100(Becton, Dickinson and Company,美国)系统或基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF MS; Bruker Daltonics,德国)。使用Vitek 2 Compact自动系统(bioMérieux)测定分离株对19种临床抗菌药物(头孢他啶、头孢噻肟、头孢吡肟、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、氨曲南、厄他培南、亚胺培南、美罗培南、阿米卡星、庆大霉素、环丙沙星、左氧氟沙星、甲氧苄啶/磺胺甲𫫇唑、磷霉素、黏菌素、呋喃妥因和替加环素)的敏感性。药敏结果根据CLSI(Clinical and Laboratory Standards Institute,美国临床和实验室标准协会)标准进行判读1†,至少对一种碳青霉烯类药物具有抗性的菌株被定义为CREC(图1和图S1)。
《图1》
图1 数据来源及研究流程图。MIC:最小抑菌浓度;CSEC:碳青霉烯敏感大肠杆菌;pos:阳性;neg:阴性。
其次,我们于2017年4月1日至5月31日间在辽宁、湖南和陕西三个省各收集22个猪养殖场和16个鸡养殖场的粪便样本,以评估blaNDM和blaKPC的总体丰度;关于样本采集和处理过程的细节已在之前的研究[16]中描述,如果提取的DNA质量不足以进行下一步分析,则排除该养殖场数据(图1和图S1)。如前所述,使用qPCR方法以16S rRNA基因为对照,评估blaNDM和blaKPC的相对丰度[17]。
再次,我们对全球的动物源和人源CREC菌株进行了全面的基因组研究,以确定它们在基因、质粒和菌株水平上的基因组特征和关联(图1和图S1)。详细的过程将在下文中描述。本研究于2015年11月24日获得复旦大学附属华山医院伦理委员会的道德许可(项目号:KY2015-285)。个人同意书采用普通话版本,并从所有住院患者那里通过面对面或电话交流获得同意。我们排除了不愿意参与本研究的个体,并且所有参与者都被告知他们有权在任何阶段退出本研究。
《2.2 数据来源》
2.2 数据来源
中国22个省(直辖市)的人口统计数据来自中国国家统计局和《中国农业年鉴》2。人为因素共分为6类,包括:国内生产总值(GDP)、人口(数量和密度)、抗菌药物使用、动物生产(食品动物和淡水养殖,主要是鱼和虾)、动物源性食品消费和每日动物源性食品摄入量。大部分数据收集于2015年,抗菌药物使用数据来自2013年[18]。
在基因组分析中,我们从NCBI数据库中下载了所有可用的中国NDM阳性大肠杆菌全基因组序列(n = 463)用于综合分析(附录A中的图1和表S1)。我们还从NCBI数据库中获得了来自4个宿主(人、猪、鸡、蝇)的1852株NDM阴性大肠杆菌的基因组序列,相当于NDM阳性序列总数的4倍(图1和表S1)。所有菌株均给予有序自然数,并使用Excel中的RAND函数随机选择进行相应分析。
《2.3 基因组分析》
2.3 基因组分析
基因组序列分析包括基因组组装、多位点序列分型、质粒检测和系统发育种群预测,具体描述见我们已发表的文章[19]。使用Bandage(0.8.1版)对不含质粒复制子基因的序列片段进行分析,以确定可能的质粒类型3。桑基图由R 3.6.1中的networkD3软件包(0.4版本)生成4†。所有组装后的NDM阳性基因组序列用于核心基因组比对,通过RedDog pipeline生成系统发育树5。该树使用Tree of Life v5进行可视化处理6‡。
《2.4 溯源分析》
2.4 溯源分析
我们使用DAPC(discriminant analysis of principal components)模型[20]来预测所有NDM阳性大肠杆菌的潜在来源。所有菌株(n = 2315)的核心基因组单核苷酸多态性(SNP)图谱,包括NDM阴性的大肠杆菌,均使用snippy pipeline生成7††。用于DAPC模型的1389株NDM阴性大肠杆菌的SNP矩阵通过R3.6.1中的Adegenet软件包实现[18]。其余463株阴性菌株用于评估上述模型的拟合度。最后,利用构建的DAPC模型预测了所有中国NDM阳性菌株(n = 463)的遗传来源。预测组∶训练组∶测试组=1∶3∶1。
《2.5 统计分析》
2.5 统计分析
将人口统计学和非临床数据输入Excel 2016(微软,美国),将变量“年龄”分为7个亚组(婴儿、学龄前儿童、学龄儿童、青少年、青年、成人和老年人),同时将变量“感染部位”分为5个亚组(血液、尿液、痰液、脑脊液和其他)。此外,基于之前对鸡生产[21]和国家猪生产计划[22]的研究,我们根据年出栏量[23]将中国大陆分别划分为2个鸡生产区和4个猪生产区。分类数据采用χ2分析检验,连续数据采用Mann-Whitney U检验。在SPSS 23.0版本(IBM,美国)中进行单变量分析,随后使用Cramer系数(Φ)对P值≤0.05的变量进行共线性评估。如果一对变量高度相关(Φ > 4.0),我们选择更具生物逻辑合理性的变量进行多变量逻辑回归分析。单变量分析中具有显著性意义的变量将被用于多变量分析。采用向前逐步(似然比)方法对多变量逻辑回归分析中的混杂因素进行控制。最终模型中保留P值小于0.05的变量。逻辑回归模型的拟合优度采用Hosmer-Lemeshow检验。森林图使用R语言中的forest plot包生成8。
使用R 3.6.1对 blaNDM的丰度进行分析和可视化。当丰度值低于检测限时,添加一个伪数值1×10-7(低于最低丰度一个数量级)后再进行log10变换[24]。不同组间的比较采用Mann-Whitney U检验或Kruskal-Wallis H检验,取0.05为显著性水平。
《3、 结果》
3、 结果
《3.1 CREC与临床和非临床因素的相关性》
3.1 CREC与临床和非临床因素的相关性
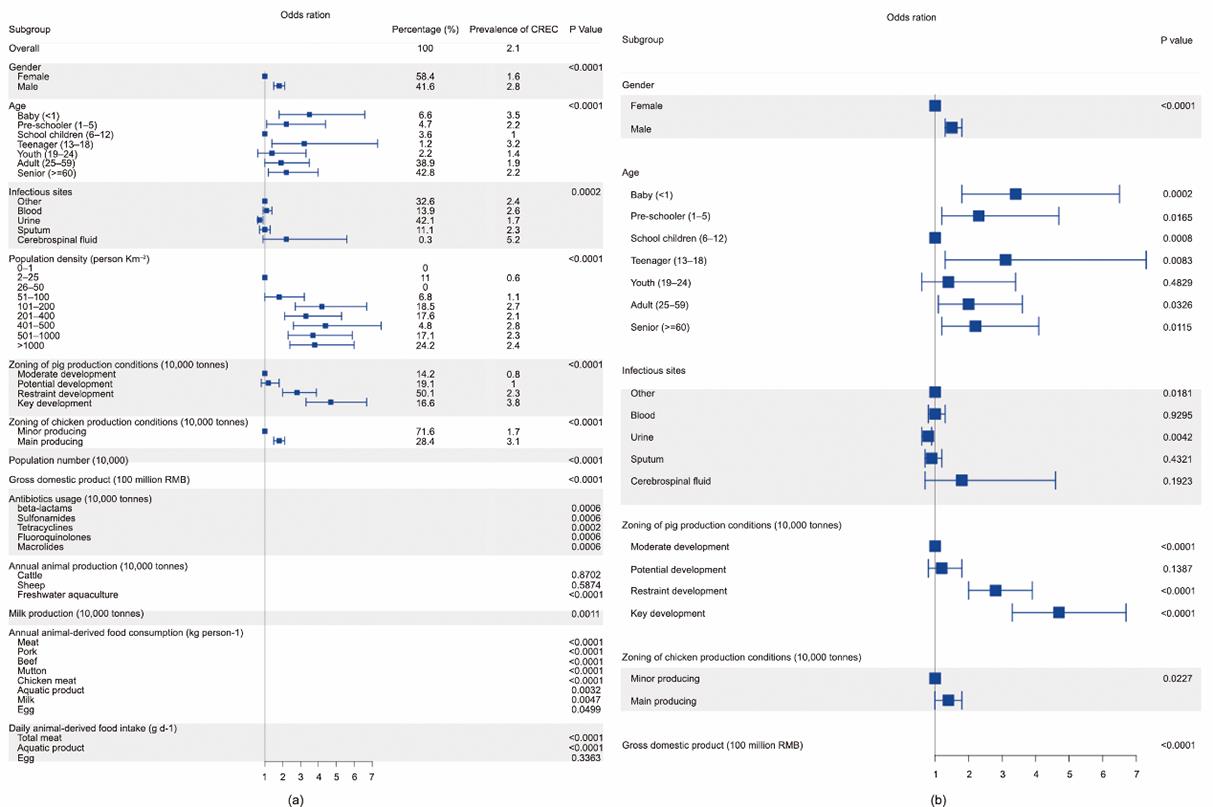
本研究设计示意图如图1和图S1所示。在来自中国22个省(直辖市)的不同感染样本中共分离到29 799株大肠杆菌,其中,631株(2.1%)被鉴定为CREC。四川省的CREC流行率最高(4.7%),福建省无CREC分离株(附录A中的图S2)。对CREC感染患者的分析显示,男女比例为1.4∶1,但根据单变量分析,男性CREC的感染率明显高于女性(P < 0.0001)(图2和附录A中的表S2)。婴儿(小于1岁)和青少年(13~18岁)的CREC感染率最高分别为3.5%和3.2%。尿液在阳性样本中所占比例最大(42.1%),但比值比最低(OR=0.7),95%的可信区间(CI)在0.6~0.9之间(表S2)。相比之下,脑脊液占阳性样本的比例最低(0.3%),但流行率最高(5.2%)。总的来说,26/29个变量与CREC感染(P≤0.05)显著相关(表S2)。排除高度共线性变量后,6个非临床变量和3个人口统计学变量被纳入多变量逻辑回归分析[图2(b)和表S2]。在三个临床分类变量中,男性感染CREC的ORs(OR=1.6, 95% CI: 1.3~1.8)高于女性,婴儿和青少年也表现出更高的ORs(OR=3.4, 95% CI: 1.8~6.5和OR=3.1, 95% CI: 1.3~7.5)。尿路感染的ORs最低(OR=0.8, 95% CI: 0.6~0.9)。对三种非临床分类变量而言,在GDP较高地区(表S2)或更高的鸡出栏量(OR=1.4, 95% CI: 1.1~1.8;表S2)和猪出栏量地区(OR=5.5, 95% CI: 3.5~8.7;表S2)的人群有更高的CREC感染率。Hosmer-Lemeshow检验[χ2 = 11.35,自由度(d.f.)=8,P = 0.182 > 0.05]表明所选的模型适合当前的数据。
《图2》
图2 单变量(a)和多变量(b)分析的森林图。
《3.2 敏感性试验》
3.2 敏感性试验
药敏试验表明,CREC(n = 631)对头孢菌素、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦和氟喹诺酮类(58.8%~95.7%)的耐药性明显高于碳青霉烯敏感大肠杆菌(carbapenem-susceptible E. coli, CSEC; n = 29 168, 2.9%~59%)(P < 0.0001)(表1)。CREC对阿米卡星和磷霉素的耐药率分别为16.8%和28.5%,而CSEC对阿米卡星和磷霉素的耐药率分别为2.7%和5.6%。CREC和CSEC对黏菌素和替加环素的敏感性均较高(大于96.7%)。值得注意的是,59%的CSEC对头孢噻肟表现出耐药性(表1)。虽然无法获得CHINET分离株的耐药基因型,但可利用NCBI数据库中中国临床大肠杆菌分离株(NDM阳性菌株和阴性菌株分别为195株和494株)的序列检测两组间的耐药基因阳性率。总的来说,除mcr和oqxAB基因外,NDM阳性菌中大多数抗菌药物的耐药基因,特别是β-内酰胺耐药基因(blaCTX-M、blaOXA和blaCMY)的阳性率显著高于阴性菌株(附录A中的图S3)。最近上传至NCBI的不携带NDM的mcr阳性菌株数量的增加可能是导致NDM阴性菌株中mcr基因阳性率更高的原因;该结果与我们的药敏试验结果相一致——NDM阴性菌株对黏菌素的耐药性高于阳性菌株。
《表1》
表1 临床CREC和CSEC分离株的药敏数据
| Antimicrobial agents | CREC ( | CSEC ( | |
|---|---|---|---|
| Cefoperazone/sulbactam | 413 (65.5%) | 1313 (4.5%) | <0.0001 |
| Piperacillin/tazobactam | 371 (58.8%) | 846 (2.9%) | <0.0001 |
| Ceftazidime | 536 (84.9%) | 7380 (25.3%) | <0.0001 |
| Cefotaxime | 604 (95.7%) | 17209 (59.0%) | <0.0001 |
| Cefepime | 483 (76.5%) | 7671 (26.3%) | <0.0001 |
| Cefoxitin | 413 (65.5%) | 3413 (11.7%) | <0.0001 |
| Aztreonam | 481 (76.2%) | 10150 (34.8%) | <0.0001 |
| Ertapenem | 569 (90.2%) | 0 | <0.0001 |
| Imipenem | 395 (62.6%) | 0 | <0.0001 |
| Meropenem | 487 (77.2%) | 0 | <0.0001 |
| Amikacin | 106 (16.8%) | 788 (2.7%) | <0.0001 |
| Gentamicin | 339 (53.7%) | 12367 (42.4%) | <0.0001 |
| Ciprofloxacin | 482 (76.4%) | 16247 (55.7%) | <0.0001 |
| Levofloxacin | 454 (71.9%) | 15459 (53.0%) | <0.0001 |
| Trimethoprim/sulfamethoxazole | 414 (65.6%) | 16392 (56.2%) | <0.0001 |
| Fosfomycin | 180 (28.5%) | 1633 (5.6%) | <0.0001 |
| Colistin | 11 (1.7%) | 700 (2.4%) | 0.2849 |
| Nitrofurantoin | 107 (17.0%) | 1108 (3.8%) | <0.0001 |
| Tigecycline | 21 (3.3%) | 117 (0.4%) | <0.0001 |
《3.3 畜禽养殖场样本中的丰度》
3.3 畜禽养殖场样本中的丰度
由于临床CREC感染与省份间畜禽生产规模有很强的相关性,我们通过收集湖南、辽宁、陕西的猪、鸡养殖场粪便样本(每省份各22家猪养殖场和16家鸡养殖场),以确定blaNDM和blaKPC的丰度。剔除无效DNA提取物后,对61个猪养殖场和45个鸡养殖场的样本进行分析[附录A中的图S4(a)和表S3]。所有养殖场均为blaKPC阴性;然而,分别有73.8%(n = 45)和62.2%(n = 28)的猪养殖场和鸡养殖场检测到blaNDM,基因相对丰度范围分别为1×10-5~1×10-3和1×10-3~1×10-2(blaDNM/16S rRNA)[附录A中的图S4(b)和表S3]。总体而言,鸡养殖场和猪养殖场中blaNDM丰度的中位数相似(P=0.0758);然而,湖南省一个猪养殖场和辽宁省一个鸡养殖场的blaNDM丰度值异常高,分别为0.2467和0.2465 [图S4(c)和表S3]。
《3.4 动物源和人源NDM阳性大肠杆菌间的保守序列分型》
3.4 动物源和人源NDM阳性大肠杆菌间的保守序列分型
由于NDM是CREC菌株中主要的碳青霉烯酶,因此我们利用生物信息学手段进一步研究了动物源和人源NDM阳性大肠杆菌间的关系。用463株NDM阳性大肠杆菌和463株随机选择匹配的NDM阴性大肠杆菌(1∶1)构建了基于序列分型(sequencing types, STs)的最小生成树,其菌株来源组成为人(195 vs 217)、猪(99 vs 110)、鸡(123 vs 136)和苍蝇(46 vs 0)。由于数据库中没有苍蝇来源的阴性菌株,因此该部分菌株按其他来源比例分配。总体而言,NDM阳性大肠杆菌共有96种ST类型,其中,ST167(n = 62, 13.4%)、ST156(n = 34, 7.3%)和ST48(n = 31, 6.7%)最多。相比之下,NDM阴性的大肠杆菌属于158种ST类型,包括ST10(n = 47, 10.2%)、ST101(n = 16, 3.5%)和ST48(n = 15, 3.2%)(附录A中的图S5和表S1)。分别有16(n = 111)、11(n = 90)和10(n = 96)种STs在人源NDM阳性大肠杆菌与鸡、猪和苍蝇源NDM阳性大肠杆菌中同时存在,而在人源NDM阴性菌中,分别有25(n = 93)和19(n = 77)种STs与鸡和猪的相关STs重叠(附录A中的图S6)。在所有4个来源中均检出了属于ST167、ST206、ST10和ST48的NDM阳性菌株。其中,85.9%的(55/64)ST167和62.1%(18/29)的ST10分别来自人和猪(图S6和表S1)。
《3.5 动物源和人源NDM阳性菌株/质粒之间的基因组关联》
3.5 动物源和人源NDM阳性菌株/质粒之间的基因组关联
本研究利用463株NDM阳性大肠杆菌间的362 650个SNPs构建了核心基因组系统发育树,研究了菌株与质粒水平上的关联性(图3和图4)。通过种群结构贝叶斯分析(BAPS),将4个来源的菌株划分为11个谱系。人源菌株分布在所有谱系中,其中,L4谱系(n = 19)只有人源菌株(图3)。L8谱系中含有的NDM阳性大肠杆菌数量最多,共111株(24.0%),其中33(29.7%)、35(31.5%)、23(20.7%)和20株(18.0%)分别来自人、猪、鸡和苍蝇(图3)。L11谱系中的87株菌来自上述4个来源,其中,63株(72.4%)来自人(图3)。同一来源的菌株通常形成相似性极高的分支(大于99.95%,图4中以粉红色三角形表示),而在C1~C5分支中存在来自两个或两个以上不同来源的亲缘关系紧密的菌株(图4)。
《图3》
图3 463株NDM阳性大肠杆菌的系统发育树。谱系由不同颜色的树枝和树右边的竖条表示。右侧桑基图展示了各谱系、分离来源、携带blaNDM的质粒类型和NDM蛋白亚型之间的分布和联系。所有的竖条都标记有相应的标签。
《图4》
图4 系统发育树显示了5个主要分支C1~C5中不同宿主间最接近的遗传关系。基于463株NDM阳性菌株的SNP差异利用最大似然法构建了中值有根系统发育树。平均分支长度小于0.0005(99.95%)的簇被折叠并用粉色三角形表示。三角形的大小与演化支中菌株的数量成正比。不同宿主之间亲缘关系近的菌株用红色三角形表示,同时5个遗传关系最近的分支标记为C1~C5。属于这5个分支的菌株以粉红色圆圈背景显示,并标记了确切的分支长度。这些菌株的名称和宿主分别用字符和不同颜色的圆点表示。
除105个不确定质粒类型的blaNDM短序列和一个位于染色体上的blaNDM-5序列外,其余357个菌株中blaNDM的质粒属于19种不同的Inc类型(图3和表S1);其中,blaNDM-5(332, 71.7%)为最常见NDM亚型,主要位于IncX3型质粒上(255, 76.8%)。值得注意的是,IncB/O/K/Z型质粒(n = 40, 8.6%)只携带blaNDM-9。总体而言,IncX3(275, 59.4%)是所有来源和谱系的主要质粒类型,在117(42.5%)、74(26.9%)、50(18.2%)和34株(12.4%)分别来自人、猪、鸡和苍蝇的菌株中发现。NDM阳性的IncB/O/K/Z质粒主要在鸡源菌株中发现(35,87.5%),而人源菌株中不存在该类型质粒(图3和表S1)。
《3.6 NDM阳性大肠杆菌的来源预测》
3.6 NDM阳性大肠杆菌的来源预测
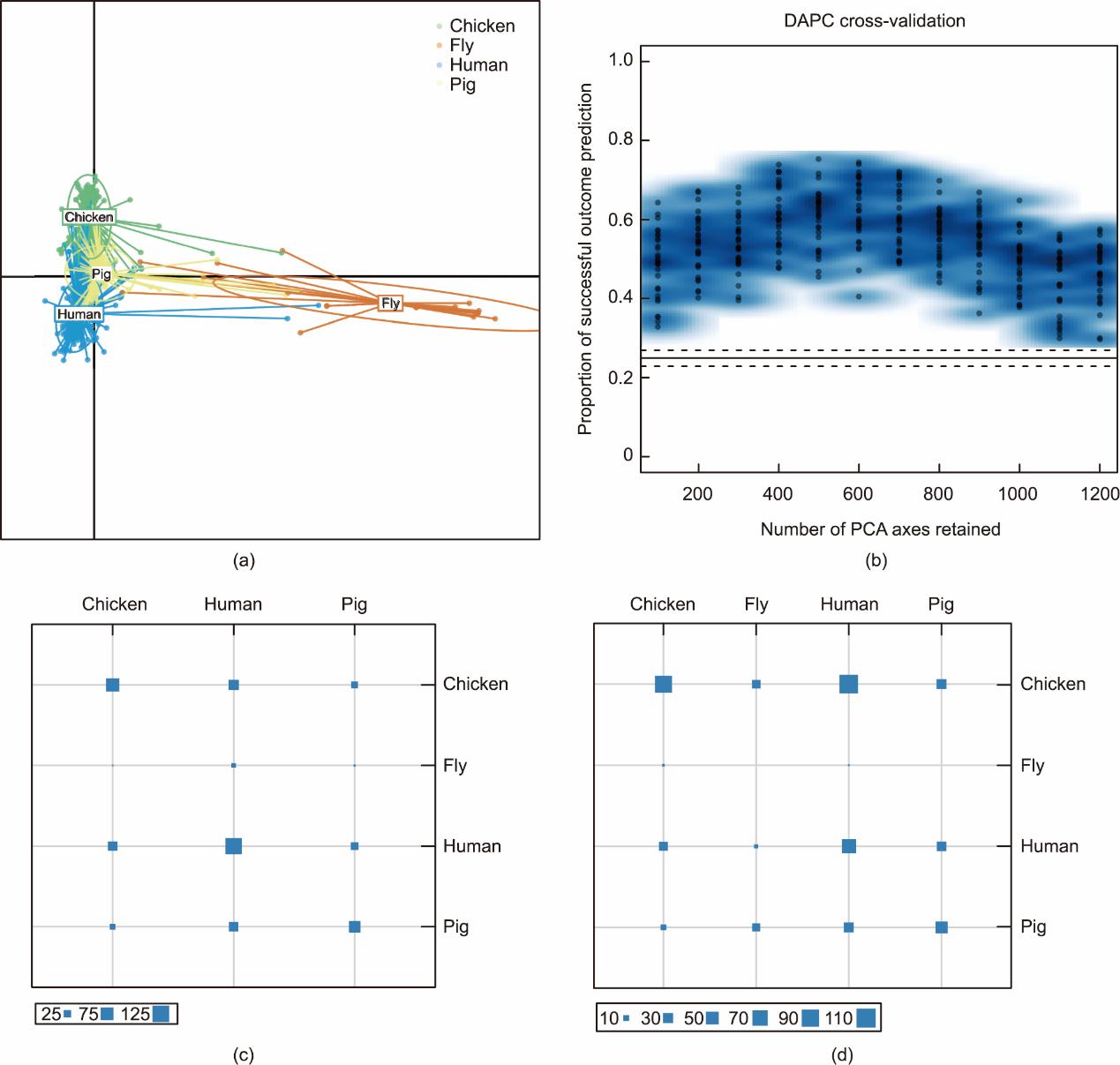
我们采用DAPC方法预测463株NDM阳性分离株的来源,其中,测试组共463株NDM阴性株,训练组共1389株NDM阴性株(比例为1∶1∶3,图S1)。虽然DAPC模型预测了来自人、鸡和猪的菌株之间存在密切的遗传关系,但仍可观察到一个可区分的边界[图5(a)],随后选择了代表结果预测效果最好的前600个主成分(共1200个)进行分析[图5(b)]。在测试组中该模型预测的菌株来自鸡、苍蝇、人和猪的准确率分别为87.4%、83.9%、88.3%和83.5% [图5(c)和附录A中的表S4]。通过该模型,19.5% (n = 24)、8.1% (n = 10)和1.6% (n = 2)的鸡源NDM阳性大肠杆菌(n = 123)可能来自人、猪和苍蝇,而27.3%(27/99)的猪源NDM阳性大肠杆菌可能来自人[图5(d)和表S5附录]。虽然30.8%(60/195)的人源分离株似乎没有改变宿主,但预计分别有53.8%(n = 105)和14.9%(n = 29)的菌株分别来自鸡和猪[图5(d)和表S5]。所有苍蝇源菌株(n = 46)分别来自人(n = 5, 10.9%)、鸡(n = 22, 47.8%)和猪(n = 19, 41.3%)[图5(d)和表S5]。
《图5》
图5 使用DAPC模型对NDM阳性大肠杆菌溯源。(a)训练集的散点图。每个点代表一个菌株,不同的颜色表示不同的来源。椭圆表示每个原点的95% CI。(b)DAPC模型的交叉验证。(c)测试集的表格图。(d)预测集的表格图。行和列分别表示报告的来源和预测的来源,每个正方形的大小表示相应的菌株数量。PCA:主成分分析。
《4、 讨论》
4、 讨论
我们的数据涵盖来自22个省(直辖市)的样本,代表了中国最大的临床CREC监测研究。来自中国30家医院的感染相关大肠杆菌分离株中CREC的总流行率(2.1%, 631/29799, CHINET, 2016)高于欧洲(0.1%,未提供/121582,EARS-Net,2016)[25]和美国(0.3%,5/1916,30家医院,2015—2017年)[26]。本研究中CREC感染与男性存在正相关,这与之前的报道一致[27]。在我们目前的研究中发现,婴儿(<1岁)被CREC感染的概率最高,近期一篇关于美国儿童中有较高CRE感染率的报道也印证了这一点[28]。婴儿的微生物群落变化较大,容易受到抗生素的干扰,这可能为CRE定植提供了机会,这已被证明是老年重症监护室(ICU)患者内源性感染的风险因素[29]。有趣的是,人类和动物[18]中使用的β-内酰胺类药物的排放与CREC感染没有显著相关性,这意味着β-内酰胺类药物向环境中的排放可能不是CREC传播的主要驱动因素。研究表明,β-内酰胺类药物在室温[30]下会迅速降解,这可能导致它们在环境中几乎不产生选择压力。
本研究首次确定了畜禽养殖量与人类CREC感染之间的正相关关系。我们的微观基因组分析提供了几个支持这种联系的证据。首先,我们观察到在中国三个省的畜禽养殖场粪便样本中,blaNDM的丰度很高,而不含有blaKPC。其次,从人、鸡、猪和苍蝇分离株中鉴定出具有相似的携带blaNDM的IncX3质粒,然而在目前和以前的研究中blaKPC很少在动物中被发现[11]。第三,我们鉴定了来自人和动物源NDM阳性大肠杆菌核心基因组序列之间的密切关系。第四,溯源分析显示,人和动物源的NDM阳性大肠杆菌之间的分界模糊。综上所述,这些观察表明NDM阳性CREC菌株在动物和人类之间存在显著的传播风险。值得注意的是,动物源性食品的消费与CREC感染间的关系仅在单变量分析时呈现显著相关,在多变量逻辑回归分析中则无显著相关,表明其他可能的传播途径(如污染物传播)也是blaNDM质粒或CREC扩散的一个因素。例如,在包括医院污水、废水、饮用水、自然水道和其他来源的多个环境样本中均检测到blaNDM [31],以及伴侣动物、苍蝇和野生动物中也分离到携带NDM的菌株[11]。此外,先前研究报道了CREC通过环境在动物和人类之间传播[12,32]。以上证据均表明环境污染物是潜在的传播驱动因素。
blaNDM在动物和人类之间的成功传递可能包括以下证据。首先,blaNDM-IncX3质粒的流行率为76.8%,出现在各主要谱系的CREC内(图3),提示该质粒可能是非宿主特异性质粒;此外,本研究中可能低估了blaNDM-IncX3质粒的流行率,因为大量携带NDM(n = 105)的序列太短,无法确认其质粒类型,许多可能是IncX3型质粒。其次,携带blaNDM的质粒——特别是blaNDM-IncX3——对宿主细菌几乎没有适应性代价,增加了其在不同生态系统中的稳定性和持续性[33‒34]。第三,除了兽医禁用的碳青霉烯类药物外,包括青霉素和头孢菌素在内的β-内酰胺类药物,是中国(2018年3192 t)和其他116个世界动物健康组织成员国(2015—2017年间占总抗菌使用量的16.1%)[36]用于食品动物养殖的第二大类抗菌药物[35]。这些常用的β-内酰胺药物主要被用于饮用水中,可能对畜禽中NDM阳性细菌的选择和持续存在发挥重要作用。第四,blaNDM和包括mcr-1 [10]、floR和tet(A)等其他耐药基因在可转移质粒上共存[37],可分别通过使用黏菌素、氟苯尼考和四环素将blaNDM共同筛选出来。
尽管我们的研究证据表明了CREC在动物和人类之间的传播,但仍存在一些局限性。第一,我们的采样方案可能在时间跨度方面不完全一致;然而,该研究的数据集足够大,并通过流行病学和基因组学分析,提供了CREC在动物和人类之间传播的有力证据。第二,尽管以前的大规模监测表明NDM可能是大肠杆菌中最普遍的碳青霉烯酶类型[8,10],但本研究中仍缺少临床CREC菌株中碳青霉烯酶类型的数据。第三,我们直接分析了动物和人类感染之间的关联,但没有分析患者的肠道定植情况和相应的动物源性食品。然而,先前的研究表明,血液和尿路感染的病原体经常来自肠道共生菌或食源性致病菌[38‒39]。第四,包括大肠杆菌、肺炎克雷伯菌和梭状芽孢杆菌在内的肠杆菌类细菌是临床感染菌中blaNDM的主要宿主。本研究只关注了NDM阳性的大肠杆菌,没有关注其他宿主菌,因为它是动物中主要的碳青霉烯耐药细菌[11]。第五,部分基因组数据来自其他研究,存在信息缺失的情况(例如,分离时间和地点、真实来源和报告来源之间不一致等),可能给我们的DAPC模型引入了系统误差。然而,在系统发育树的几个簇中发现了菌株间的强关联,并且在不同的宿主中发现了相同的质粒,表明了CREC在动物和人类之间的传播。
从“全健康”的理念出发,为对抗CREC在动物和人类之间的传播,应该考虑以下的行动:①由于撤销抗菌药物已被证明可以减少细菌耐药性的流行率[16,40],因此可以通过更合理地使用β-内酰胺类药物和其他可能产生共筛选效应的抗菌药物,进而减少畜禽养殖场携带blaNDM细菌的流行。②中国畜禽养殖业正向大规模集约化养殖转变,并逐渐减少农村后院养殖系统9,这将有助于加强对卫生、抗菌药物消费和感染控制措施的监管。此外,还应减少仅为促生长或预防疾病使用的药物量。③食物供应链、环境和医院在耐药病原体的传播中发挥着重要作用;因此,建立完善的动物(农场和周围环境)和人类(定植、感染和生活环境)耐药菌/耐药基因的监测体系是限制CREC传播的必要前提。④在动物和人源菌株中,有很大比例的blaNDM基因(>70%)与IncX3质粒相关(图3);因此,需进一步研究宿主的偏好性、持久性以及消除blaNDM-IncX3质粒的干预措施。⑤农场、屠宰场、食品加工厂和零售店应通过有效的清洁和消毒程序切断CREC传播途径,以减少CREC对非生物表面的污染。此外,由于苍蝇和鸟类在CREC的传播中发挥着重要作用,需要充分了解它们对CREC传播的贡献[12]。最后,中国农业农村部于2020年7月停止使用所有抗生素作为促生长剂之后,其他替抗方法如CRISPR-Cas9 [41]、噬菌体[42]和传统中药[43]是有希望对抗这种无处不在的病原体的新武器。
《5、 结论》
5、 结论
本研究揭示了全国范围内临床CREC感染和地区畜禽养殖产量间的显著相关性,同时揭示了鸡、猪养殖场粪便样本中blaNDM丰度的普遍性。此外,我们在猪养殖场发现了长期存在的blaNDM阳性大肠杆菌,并阐明了不同宿主来源菌株基因组间的界限模糊。综上所述,这些证据表明了CREC在动物和人类之间的关联和传播。综合所有证据,我们假设CREC首先出现在医学临床中,然后被引入至畜禽养殖业中,而猪和鸡正是CREC持续存在的有利宿主,这导致了CREC通过食物链或通过环境载体[生物和(或)非生物]在人类和动物之间的循环传播。

















 京公网安备 11010502051620号
京公网安备 11010502051620号




