《1、 引言》
1、 引言
泌尿系统疾病的诊断和预后主要依靠影像学检查,如排泄性尿路造影、逆行膀胱造影(urination cystography, UCG)、泌尿系CT等。但这些方法存在射线暴露、造影剂过敏、成像效果不佳等缺陷[1‒5]。此外,随着微创手术日益普及,对灵敏、实时和安全成像方法的需求也在迅猛增长。
无创肾功能分析对于泌尿系统疾病的诊断必不可少,尤其是单侧肾脏疾病[6]。肾功能的准确评估需要对肾脏进行高对比度和高时间分辨率的实时成像,目前单光子发射计算机断层扫描(SPECT)、磁共振成像(MRI)和正电子发射断层扫描(PET)是用于临床诊断和临床前肾功能研究的主要工具[7‒9]。这些方法同样也存在成本高、获取受限和潜在辐射暴露风险等问题。因此,临床和临床前肾功能评估亟需一种安全、低成本且灵敏的肾功能成像技术。
近红外(near-infrared, NIR)荧光成像由于具有高灵敏度、高时间分辨率和快速反馈等优势,是一种极具应用前景的生物医学成像方法,该技术在临床中显示出优越的性能,但有限的成像穿透深度限制了其进一步的临床应用[10‒13]。随着成像模式的迅速改进,越来越多的研究表明近红外二区光谱区域(NIR-II, 1000~1700 nm)窗口荧光生物成像比常规近红外一区光谱区域(NIR-I, 700~900 nm)窗口荧光生物成像具有更好的空间分辨率、更高的信噪比(SBR)及更深的成像穿透深度[14‒18]。目前,已有包括量子点(quantum dot, QD)[17,19‒20]、碳纳米管[21‒23]、聚集诱导发光(aggregation-induced emission, AIE)材料[24‒27]、稀土纳米材料[28‒30]等在内的几种NIR-II荧光探针被用于NIR-II荧光全身和显微成像。然而,由于不确定的药代动力学/毒代动力学和药物代谢情况,上述材料中的大多数在临床转化过程中面临挑战[4,31‒32]。因此,如何找到能兼顾NIR-II成像优势和临床应用性的NIR染料显得尤为重要。迄今为止,只有一种临床获批的NIR染料吲哚菁绿(indocyanine green, ICG),由于其NIR-II荧光拖尾效应而具有临床NIR-II荧光成像潜力,但仅限于肝胆系统和淋巴系统的成像应用[15‒16,33]。
亚甲基蓝(methylene blue, MB)是一种经美国食品药品监督管理局(FDA)批准的肾脏可排泄NIR-I染料,已被广泛用于NIR-I荧光成像引导手术,如输尿管的识别、胰腺及胰岛素瘤的定位及乳腺癌术中导航[34‒37]。MB具有出色的摩尔消光系数[峰值吸光度(665 nm)处为71 200 L∙mol-1‧cm-1]和相对较高的量子产率(QY, 3.8%)[34],因此MB具有成为临床可用NIR-II荧光成像材料的潜力,而目前MB在NIR-II荧光生物成像中的应用尚未见报道。
本研究首先成功地检测了MB的NIR-II荧光拖尾,并通过Intralipid® 1%溶液进行体外模拟成像,比较了MB在NIR-I窗口和NIR-II窗口中的组织穿透能力。随后,在小鼠模型中对MB在NIR-I和NIR-II窗口中的UCG和排泄性尿路造影成像效果进行了对比成像,并成功实现了基于MB NIR-II成像对肾功能的非侵入性评估。本研究旨在评估将MB NIR-II荧光成像应用于泌尿系统结构和功能评估的有效性和可行性,为NIR-II成像应用于临床和临床前提供了全新的潜在选择。
《2、 实验材料与方法》
2、 实验材料与方法
《2.1 材料》
2.1 材料
临床医药级MB购自济川药业(中国),磷酸盐缓冲液(PBS)购自国药集团化学试剂有限公司(中国),Intralipid® 20%购自Baxter Healthcare Corporation(美国),所有实验均使用电阻率为18.2 MΩ‧cm-1的去离子水。
《2.2 光学表征》
2.2 光学表征
使用Shimadzu UV-2550紫外可见NIR扫描分光光度计(Shimadzu,日本)测量MB在水溶液中的吸收光谱,测量范围为550~900 nm。MB在去离子水及尿液中在NIR-II窗口的荧光发射光谱是通过基于PG2000光谱仪(Ideaoptics Instruments,中国)和2000C光谱仪(Everuping Optics Corporation,中国)进行测定的。
《2.3 量子产量测定》
2.3 量子产量测定
使用二氯乙烷(DCE)中的NIR-II染料IR-26(量子产量,Quantum Yield;QY ≈ 0.5%)作为参照,测量MB水溶液的QY [38]。在623 nm激光激发下测量了一系列具有不同光密度(OD)值的IR-26 DCE溶液和MB水溶液,并且在1000 nm以上波段对NIR-II荧光强度进行了积分,获得了用于描述积分NIR-II荧光强度对OD依赖性的直线的两个斜率(一个来自IR-26的DCE溶液,另一个来自MB水溶液)。MB的QY(Q2)由下式计算:
式中,Q1是IR-26在DCE中的QY(0.5%);Fslope1是IR-26在DCE中的斜率值;Fslope2是MB水溶液的斜率值;n1是DCE的折射率;n2是水的折射率。
《2.4 光稳定性》
2.4 光稳定性
MB水溶液(0.005 mg‧mL-1)的光稳定性测定是在功率密度为80 mW‧cm-2的623 nm发光二极管(LED)连续照射下进行(持续60 min),并基于比色皿区域计算平均荧光强度。
《2.5 Intralipid模拟成像》
2.5 Intralipid模拟成像
如前所述,在体模中进行体外测试。Intralipid® 1%溶液是通过将 Intralipid® 20%稀释到去离子水中制备的。将装有MB溶液(0.005 mg‧mL-1)的毛细管玻璃管(内径为0.3 mm)浸入制备的Intralipid® 1%溶液中,其深度范围为液面以下1~6 mm。进行了不同深度的NIR-I和NIR-II成像(激发波长:623 nm;功率密度:30 mW·cm-2;曝光时间:NIR-I窗口10 ms vs NIR-II窗口50 ms)。
《2.6 动物实验》
2.6 动物实验
本研究经浙江大学动物实验机构伦理委员会(IACUC: JU20160141)批准。本研究中的所有动物实验均严格按照浙江大学动物实验机构伦理委员会的要求和指南进行。美国癌症研究所(ICR)小鼠(6~8周龄,雌性)和BLAB/c裸鼠(6~8周龄,雌性)由上海SLAC实验动物公司提供并饲养在浙江大学实验动物中心。动物饲养区保持在24 °C,光照/黑暗循环为12 h,提供充足的水及食物。每次手术和影像学实验前,小鼠腹腔注射2%戊巴比妥(40~50 mg‧kg-1体重)诱导麻醉并保持麻醉状态。小鼠在排泄性尿路造影前静脉注射MB水溶液(0.01 mg‧g-1体重,静脉注射),UCG前给予MB水溶液(0.005 mg‧mL-1, 100 μL)灌注膀胱。
《2.7 NIR-I荧光成像》
2.7 NIR-I荧光成像
使用GA1280相机(1280 × 1024像素;Tekwin System,中国)进行NIR-I成像,该相机配备了定焦镜头(焦距50 mm,800~2000 nm的增透膜;Edmund Optics,美国),配备800 nm长通滤波器和900 nm短通滤波器以提取NIR-I荧光信号,使用623 nm LED(SOLIS-623C;Thorlabs,美国)为研究区域提供均匀照明(见附录A中的图S1)。
《2.8 NIR-II荧光成像》
2.8 NIR-II荧光成像
配备定焦镜头(焦距50 mm,800~2000 nm抗反射涂层;Edmund Optics)的二维电子冷却砷化铟镓(InGaA)相机(640 × 512像素;Tekwin System),冷却至-40 °C用于获取NIR-II窗口中的图像[见附录A中的图S1(b)]。使用623 nm LED(SOLIS-623C;Thorlabs,美国)为成像区域提供均匀照明。在每次成像实验之前测量光斑功率密度。 在成像过程中,使用800 nm短通滤波器过滤623 nm激发光。将1000 nm长通滤波器(Thorlabs)放置在相机镜头前,限制低于1000 nm的波长并允许高于1000 nm的波长通过相机镜头以获取NIR-II荧光信号。
《2.9 体内肾脏和膀胱结构成像》
2.9 体内肾脏和膀胱结构成像
以200 μL MB水溶液(0.005 mg‧mL-1)对小鼠膀胱进行灌注后进行MB辅助的UCG。小鼠静脉注射MB(0.01 mg‧g-1体重)后进行基于MB的排泄性尿路造影,获取肾脏(背侧)和膀胱(腹侧)在NIR-I和NIR-II窗口的荧光信号(激发光源:623 nm LED;功率密度:80 mW‧cm-2)。
《2.10 活体输尿管成像》
2.10 活体输尿管成像
小鼠麻醉后被仰卧位固定在平台上,随后进行剖腹手术并完全暴露输尿管。每只小鼠静脉注射MB(0.01 mg‧g-1体重),然后将一块腹部组织覆盖于一侧输尿管上。进一步比较NIR-I和NIR-II成像下覆盖组织后的输尿管成像效果。建立急性输尿管结扎模型需在右侧输尿管通过手术缝线结扎,在结扎后立即通过尾静脉注射浓度为1 mg‧mL-1的MB,并将光斑功率密度调整至30 mW‧cm-2。使用NIR-I或NIR-II相机观察小鼠以定位输尿管及组织覆盖下的输尿管结扎点。
《2.11 活体肾功能成像》
2.11 活体肾功能成像
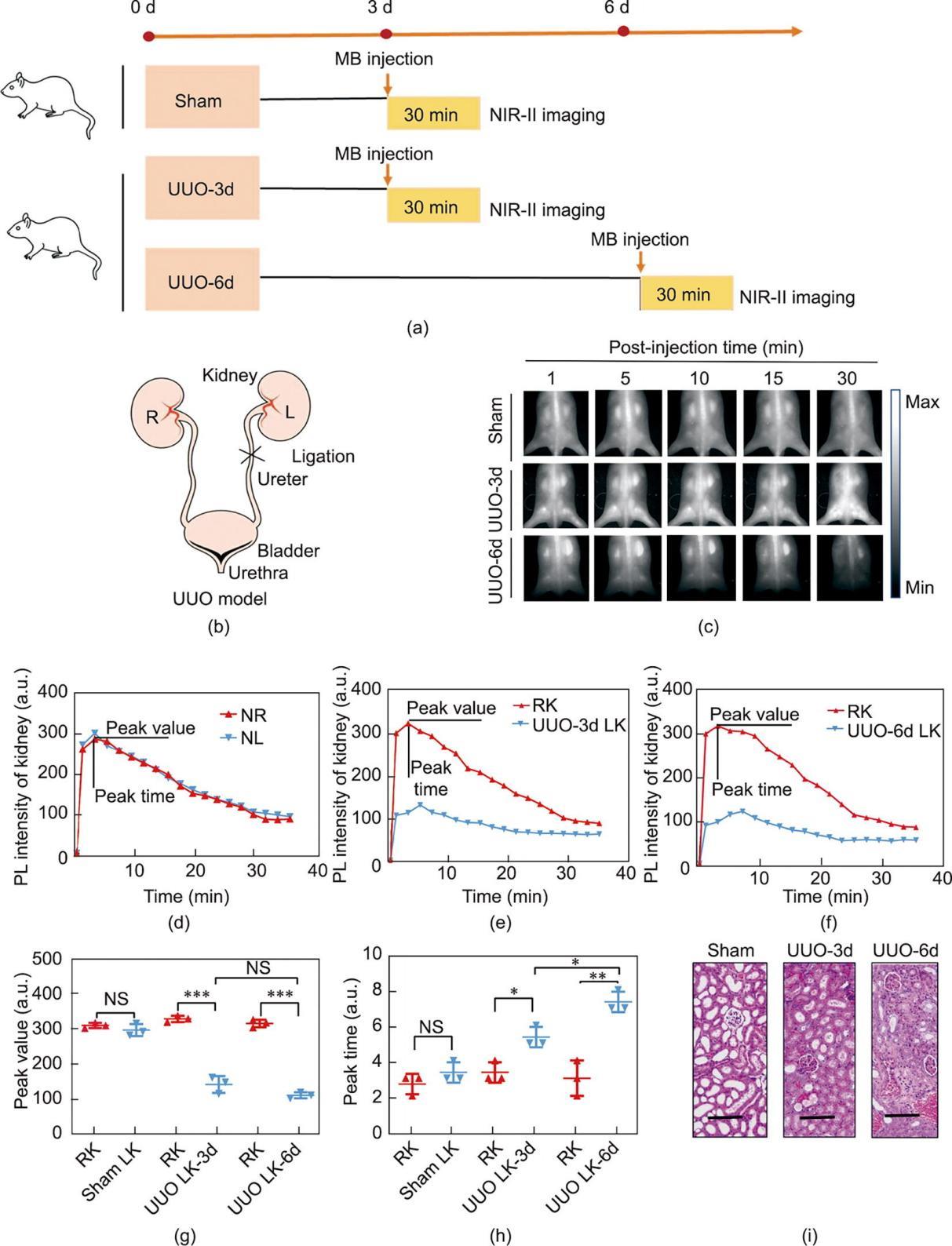
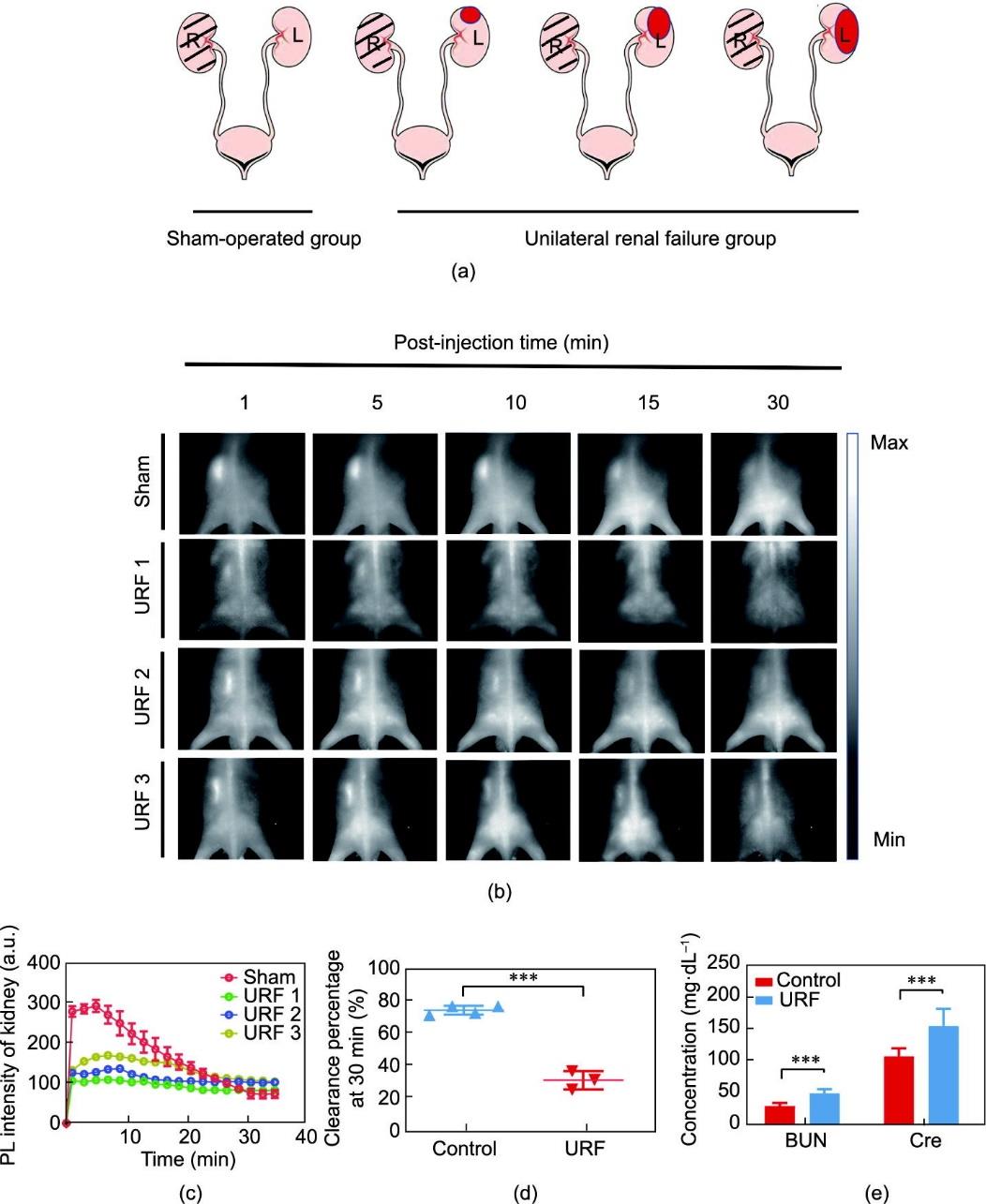
建立单侧输尿管梗阻(unilateral ureteral obstruction, UUO)模型以用于MB辅助NIR-II荧光成像,研究肾脏灌注。首先通过完全结扎小鼠左侧输尿管而保持右侧输尿管完整来建立UUO模型,小鼠模型随着时间的推移逐渐出现单侧肾积水及肾灌注障碍,而对照组(假手术组,仅做开腹后缝合)不结扎输尿管。随后对UUO-3d组(UUO建模后3天)、UUO-6d组(UUO建模后6天)和对照组进行MB静脉注射(0.01 mg‧g-1体重)。记录不同时间点肾脏信号的分布以制作时间依赖的荧光信号曲线。另一方面,通过建立单侧肾功能衰竭(unilateral renal failure, URF)模型以评估基于MB辅助NIR-II荧光成像的肾脏滤过功能。简而言之,URF模型和对照组均切除右肾(right kidney, RK),而左肾(left kidney, LK)在URF模型组则被电凝刀不同程度损伤,对照组LK则保持完好。建模后如上所述进行NIR-II荧光成像。
《2.12 血清肌酐及尿素氮测定》
2.12 血清肌酐及尿素氮测定
从小鼠的角静脉采集血液。采集的血样以4500 r‧min-1离心15 min。根据制造商的方案,使用商业试剂盒测定血清肌酐(serum creatinine, Cre)和血尿素氮(blood urea nitrogen, BUN)。
《2.13 组织病理分析》
2.13 组织病理分析
小鼠解剖后,对取自UUO组和对照组的肾脏组织用4%多聚甲醛固定、乙醇溶液脱水、石蜡包埋,切成15 μm厚的切片进行苏木精-伊红(H&E)染色。切片用二甲苯和乙醇洗涤,然后在苏木精工作液中浸泡4 min,在伊红工作液中浸泡2 min,然后用蒸馏水洗涤。使用显微镜(Primovert;Zeiss,德国)分析染色切片。
《2.14 数据分析》
2.14 数据分析
基于手动选择的研究区域,使用ImageJ软件(1.6.0版;美国国立卫生研究院)对每个荧光图像进行定量分析。使用OriginPro软件(9.0 版;OriginLab,美国)生成图表。数据以平均值±标准偏差(SD)的形式呈现。使用t检验进行统计分析。*表示两组实验数据之间具有统计学意义(*p < 0.05, **p < 0.01, ***p < 0.001)。
《3、 结果与讨论》
3、 结果与讨论
《3.1 MB光学特性表征》
3.1 MB光学特性表征
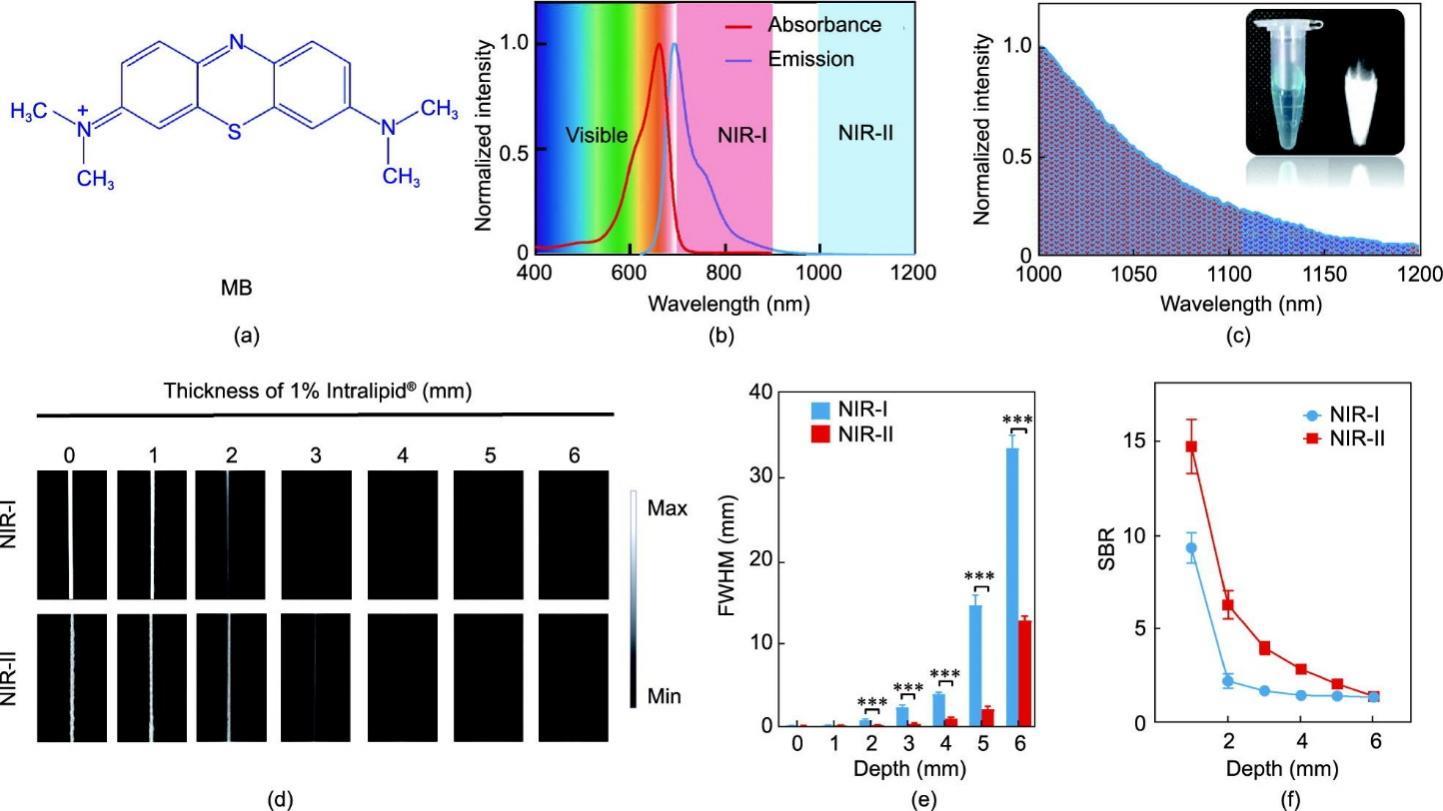
MB是一种小分子NIR-I染料[化学结构如图1(a)所示],其吸收峰约在665 nm。MB水溶液的发射光谱可被基于硅(Si)和InGaAs检测器的光谱仪所捕获,表明其荧光发射扩展到NIR-II窗口[图1(b)、(c)]。在NIR-II光谱区,以DCE中IR-26的NIR-II荧光QY(约0.5%)作为参照,计算得MB的QY为0.2%(见附录A中的图S2)。重要的是,MB在623 nm LED激发下(浓度:0.1 mg‧mL-1,功率密度:30 mW‧cm-2)显示出比另一种肾脏可清除NIR-II染料 CH-1055-PEG在793 nm激光激发下(0.1 mg‧mL-1,功率密度:30 mW‧cm-2)[39]具有更高的NIR-II荧光强度,如附录A中图S3所示。此外,MB水溶液在连续623 nm LED(80 mW‧cm-2)照射60 min后也未见明显的荧光衰减,显示出其极佳的光稳定性(见附录A中的图S4)。为了比较MB在NIR-I和NIR-II窗口中的荧光穿透能力,使用Intralipid®模拟生物组织的光学特性,进行组织模拟实验:随着Intralipid® 1%溶液厚度的增加,NIR-I和NIR-II窗口中的荧光信号均呈现降低趋势。实验结果显示在3 mm厚的Intralipid® 1%溶液中,MB的NIR-I荧光信号接近背景噪声,而MB的NIR-II荧光信号即使在5 mm厚的Intralipid® 1%溶液覆盖下仍然可见。本文绘制了Intralipid®模拟实验中不同深度下的NIR-I和NIR-II装有MB溶液的毛细管图像半峰全宽(full-width-half-maximum, FWHM)[图1(d)]。在未加入Intralipid® 1%溶液时毛细管在NIR-I和NIR-II窗口中FWHM分别为(386.5 ± 5.4) μm和(389.4 ± 1.7) μm。而当深度增加到6 mm时,NIR-I和NIR-II窗口中的FWHM分别为(3294.9 ± 453.2) μm和(1243.1 ± 14.4) μm [图1(e)]。此外,MB在NIR-II窗口的SBR在Intralipid® 1%溶液厚度为1 mm 、2 mm、3 mm、4 mm和5 mm时分别为其在NIR-I窗口成像时的1.7、4.3、2.7、2.1和1.8倍[图1(f)]。这些结果表明,由于NIR-II窗口中的光散射更少,NIR-II 窗口中MB的荧光比NIR-I窗口中的荧光具有更深的组织穿透性和更高的成像灵敏度。
《图1》
图1 MB光学表征。(a)MB的化学结构式;(b)水中MB的归一化吸收和发射光谱;(c)MB在1000~1200 nm波长区域的归一化荧光发射谱图;(d)在0 mm、1 mm、2 mm、3 mm、4 mm、5 mm和6 mm Intralipid®1%溶液中MB(0.005 mg·mL-1)填充的玻璃毛细管的NIR-I和NIR-II荧光图像(激发波长:623 nm;功率密度:30 mW·cm-2;NIR-I窗口曝光时间:10 ms;NIR-II窗口曝光时间:50 ms)。基于MB溶液玻璃毛细管的FWHM(e)和SBR(f)计算。数据为平均值± SD,n = 3个独立测量。
《3.2 基于MB NIR-I和NIR-II荧光成像的UCG》
3.2 基于MB NIR-I和NIR-II荧光成像的UCG
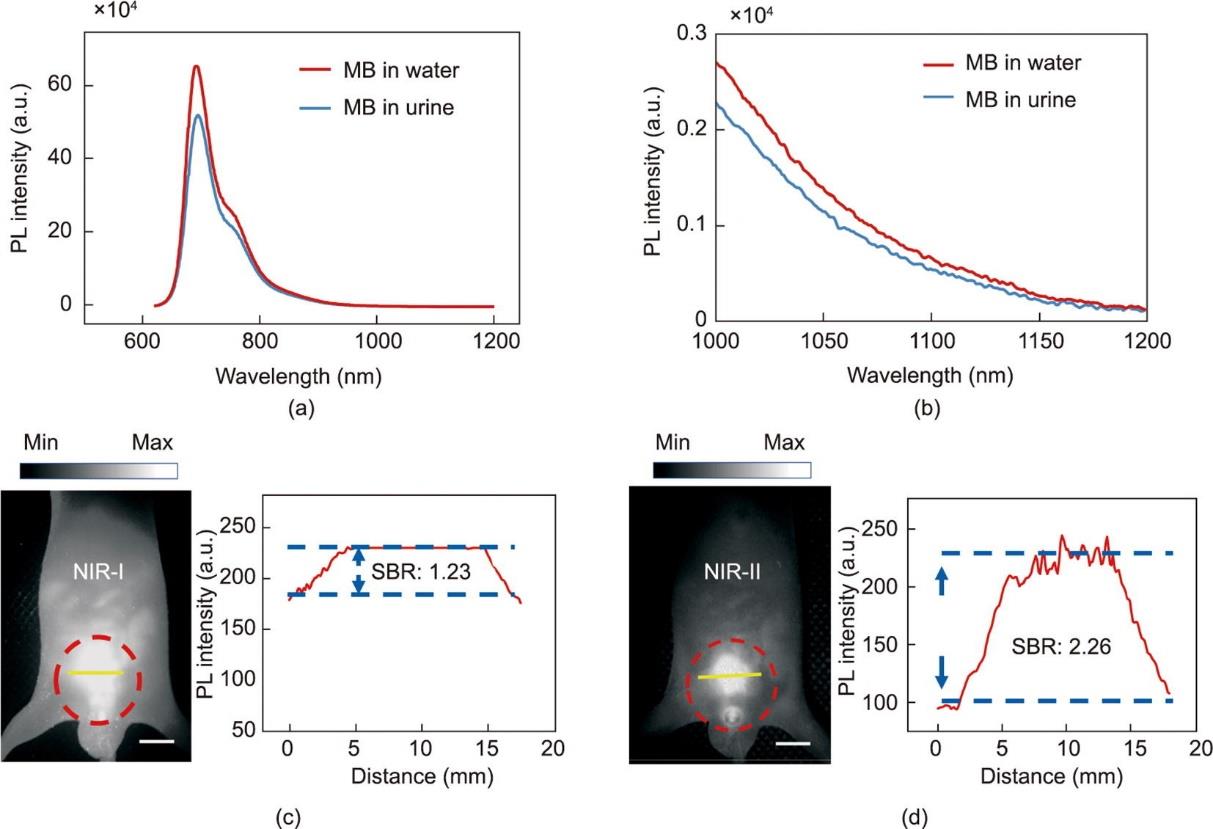
膀胱输尿管反流是儿童泌尿外科常见病,由于患者排尿时尿液从膀胱反流至输尿管和肾盂,病程可进展为反复尿路感染,最终导致肾脏瘢痕形成、萎缩、肾功能损伤等一系列并发症[40]。UCG是诊断膀胱输尿管反流的金标准,然而由于膀胱输尿管反流是一种间歇性发作疾病,因此通常需要进行多次反流评估测试以明确该疾病。目前可用的UCG技术基于射线暴露,无形之中增加了患者尤其是患儿的患癌风险[41]。因此,本研究尝试使用MB辅助荧光成像技术来实现UCG。首先研究了MB在尿液中的稳定性:与相同浓度的MB水溶液相比,用小鼠尿液稀释后,MB的荧光强度变化很小[图2(a)和(b)],表明其在尿液中同样具有较好的光稳定性。随后,在用MB水溶液灌注膀胱后,在NIR-I和NIR-II窗口中进行了基于MB的UCG。虽然在相同成像条件下MB在NIR-I窗口中的荧光信号比在NIR-II窗口中的荧光信号更强,但NIR-I窗口中的SBR(1.23)明显低于NIR-II窗口中的SBR(2.26)。这与之前的体外实验结果一致,基于MB的UCG在NIR-II窗口可以清晰、准确地反映膀胱的大小和边界[图2(c)和(d)]。根据以上结果可知,MB辅助荧光成像是一种很有前途的临床可用UCG技术。此外,与NIR-I窗口相比,基于MB的UCG在NIR-II窗口中更具成像优势。
《图2》
图2 基于MB的NIR-I及NIR-II UCG。(a)、(b)相同浓度(0.005 mg·mL-1)下MB水溶液和尿液中MB的发射光谱(PL:光致发光);(c)、(d)具有代表性的NIR-I和NIR-II膀胱荧光成像(激发波长:623 nm;功率密度:80 mW·cm-2;NIR-I窗口曝光时间:5 ms;NIR-II窗口曝光时间:25 ms)。MB 浓度为0.005 mg·mL-1(体积为50 μL,膀胱灌注)及SBR分析。
《3.3 MB的体内代谢及稳定性》
3.3 MB的体内代谢及稳定性
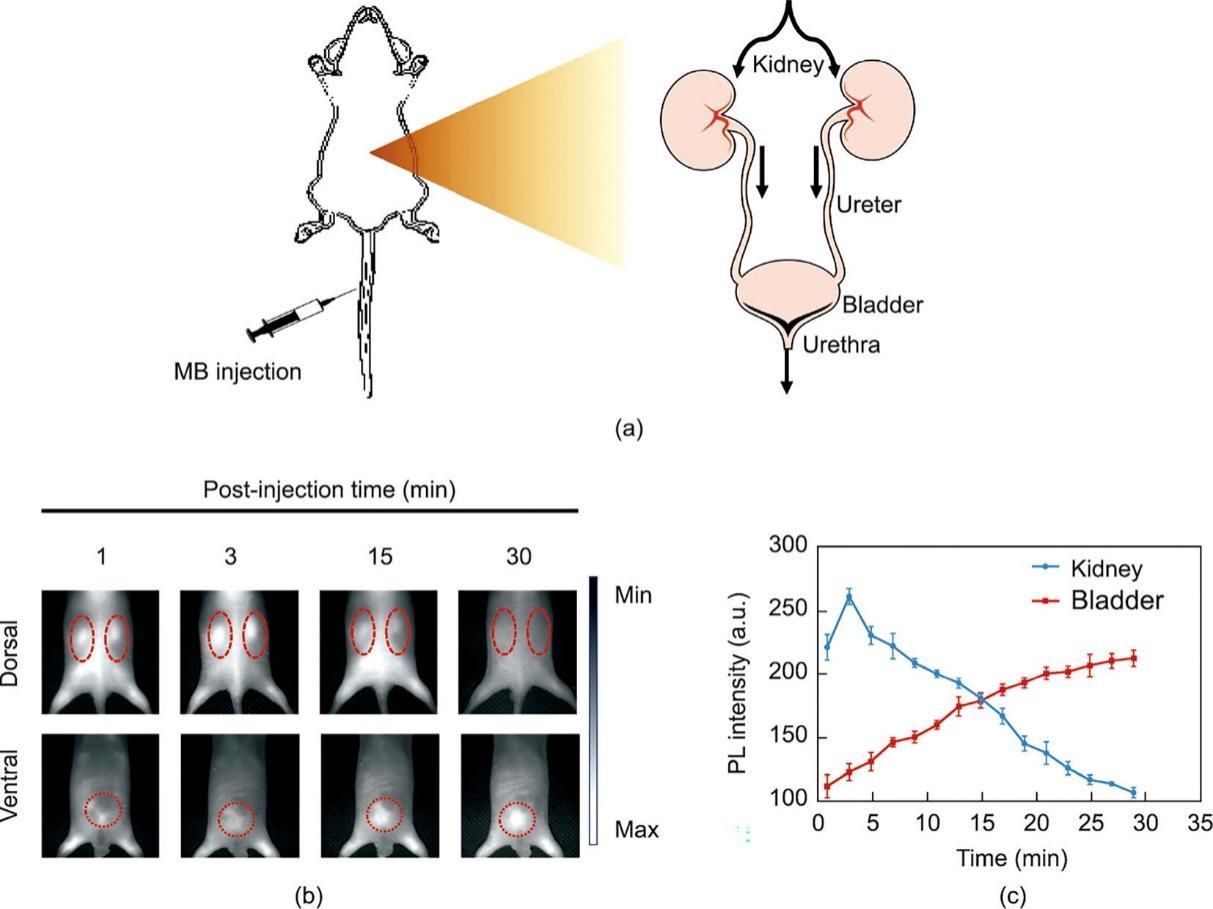
在进行MB辅助排泄性尿路造影和功能成像实验之前,首先研究了它的体内代谢情况及体内稳定性。如附录A中图S5所示,NIR-II荧光信号主要位于静脉注射的小鼠的膀胱和胆囊MB(注射后30 min),表明MB可以通过肾脏和肝脏代谢,这与之前的研究报道[42‒43]一致。随后,在静脉注射MB后的不同时间点进行全身NIR-II荧光成像(背侧和腹侧)[图3(a)和(b)],结果显示肾脏信号在注射MB后3 min达到峰值,随后逐渐降低,而膀胱中的荧光信号随时间增加[图3(c)]。总之,MB显示了在泌尿系统实时NIR-II荧光可视化中的应用(包括结构和功能成像)潜力。
《图3》
图3 MB的肾脏清除率和体内稳定性研究。(a)MB通过泌尿系统的肾脏排泄示意图。(b)小鼠注射MB 1 min、3 min、15 min、30 min后的代表性NIR-II荧光图像。红色圆圈分别表示经背部的肾脏显影和经腹部的膀胱显影。成像在623 nm激发下完成,LED功率约为80 mW·cm-2,滤光片为1000 nm长通。(c)MB注射后肾脏和膀胱的NIR-II时间荧光强度曲线(TFIC)。数据为平均值± SD,n = 3个独立测量。
《3.4 基于MB的NIR-I和NIR-II排泄性尿路造影》
3.4 基于MB的NIR-I和NIR-II排泄性尿路造影
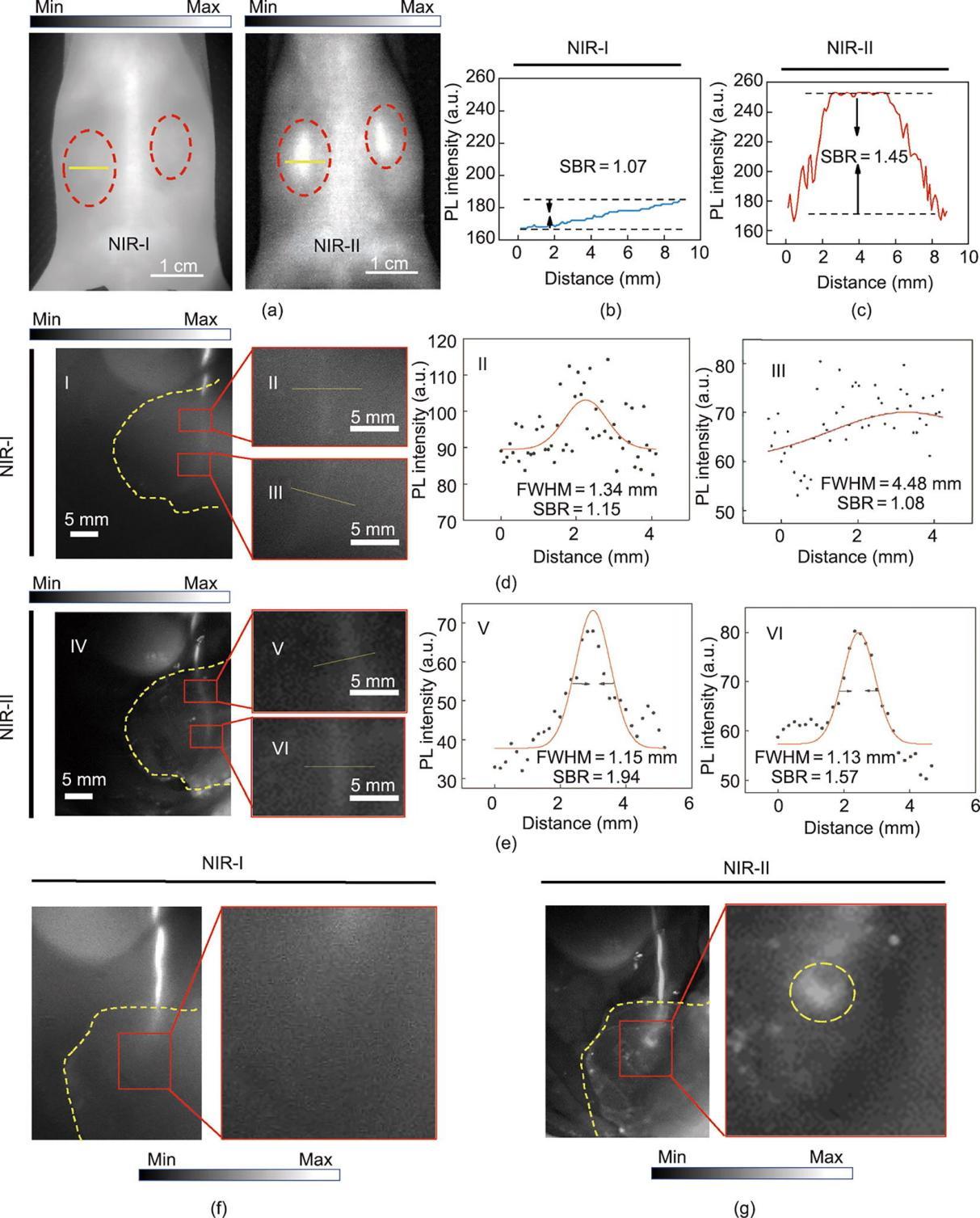
MB的NIR-II荧光拖尾和肾脏排泄性使其具有应用于NIR-II荧光排泄尿路造影的能力。首先在同一小鼠模型中使用NIR-I和NIR-II成像系统进行非侵入性排泄性肾脏成像,实验结果显示使用NIR-II成像比传统的NIR-I成像更具优势:与NIR-I窗口相比,NIR-II窗口中的成像实现了更高对比度的小鼠肾脏无创成像[图4(a)~(c)]。
《图4》
图4 基于MB的NIR-I和NIR-II排泄性尿路造影。(a)代表性肾脏NIR-I和NIR-II荧光成像图像(MB静脉注射量为0.01 mg∙g-1体重);(b)、(c)NIR-I及NIR-II两个成像窗口下的肾脏SBR分析(比例尺为1 cm);(d)、(e)静脉注射MB后在NIR-I和NIR-II窗口下被小鼠腹部组织覆盖的输尿管代表性成像图像,根据强度谱的两项高斯拟合计算NIR-I和NIR-II窗口输尿管成像的FWHM和SBR。左右侧列比例尺均为5 mm。(f)、(g)NIR-I窗口和NIR-II窗口下UUO模型输尿管成像图片,黄色圆圈表示梗阻点位置。
另外,输尿管损伤是泌尿外科手术的一种罕见但严重的并发症,且此类损伤的诊断常常被延迟[44‒46]。因此,早期识别输尿管对于避免输尿管损伤和保护肾功能至关重要。据报道,MB已被成功用于NIR-I窗口下术中输尿管导航[35,37]。因此,本文探究了NIR-II荧光成像相较于NIR-I荧光成像在输尿管识别中的可行性。当目标输尿管成像区域被小鼠腹部组织(厚度约1.5 mm)覆盖时,在NIR-I窗口中尽管可以看到输尿管,但其成像SBR相当低[图4(d)],而成像窗口切换至NIR-II时,成像背景噪声显著降低,整体空间分辨率明显提高[图4(e)]。随后,在小鼠模型上建立了急性输尿管梗阻模型,并在NIR-I和NIR-II成像窗口下识别输尿管病变。如图4(f)和(g)所示,输尿管结扎点在NIR-II窗口中具有良好的对比度,而NIR-I检测下几乎无法识别组织覆盖的特定结扎点。这些结果表明,与传统的NIR-I荧光成像相比,MB辅助NIR-II荧光成像是术中输尿管识别的更优选择,特别是对于输尿管被某些组织覆盖的患者。这种成像技术改进的实现非常简单,只需将术中导航系统中的成像相机从NIR-I相机切换到NIR-II相机即可。
《3.5 基于MB的NIR-II荧光活体肾功能成像》
3.5 基于MB的NIR-II荧光活体肾功能成像
肾功能成像通常需反映肾脏血流灌注和肾脏滤过功能两个方面的情况。由于经肾脏代谢是MB的主要代谢方式,且MB在肾脏中的荧光信号变化可以在无创前提下被NIR-II相机探测到,因此MB NIR-II荧光成像用于肾功能实时成像具有潜在可行性。为了证实以上推测,首先通过完全结扎小鼠左侧输尿管并同时保持右侧输尿管完整[图5(b)],建立UUO-3d和UUO-6d模型[图5(a)](随着时间的推移,单侧肾积水和肾灌注障碍逐渐加重)。对照组即假手术组不结扎输尿管,仅做开腹后关腹缝合。随后,对UUO-3d组、UUO-6d组和对照组进行NIR-II荧光成像,记录不同时间点的肾脏荧光信号[图5(c)]。结果如图5(d)和(f)所示,通过非侵入性MB NIR-II成像和肾脏时间荧光强度曲线(time-fluorescence intensity curves, TFIC)分析可以轻松区分UUO肾脏和正常肾脏:对照组LK和RK的信号变化无显著差异[图5(d)],而在UUO组中被结扎输尿管的LK与正常RK相比信号峰值显著降低[图5(g)]。相应地,与UUO组中的正常RK和假手术组中的肾脏相比,UUO组中被结扎输尿管的LK TFIC的峰值时间显著延迟[图5(h)]。此外,与UUO-3d组相比,UUO-6d组中LK信号显示出更长的峰值时间,表明其肾灌注障碍程度更重,这一结果与最终的肾组织病理分析一致[图5(i)](UUO-3d组肾小管表现出轻度至中度萎缩和扩张,提示轻度肾灌注障碍,而UUO-6d组肾小管损伤和皮质萎缩则更明显)。这些数据表明,MB辅助的NIR-II肾功能荧光成像不仅可以区分正常肾脏和灌注障碍肾脏,还可以反映灌注障碍的严重程度。
《图5》
图5 活体小鼠MB NIR-II荧光成像实时检测肾脏血流灌注。(a)假手术组和UUO组小鼠术后不同时间点的NIR-II荧光成像流程示意图。(b)左输尿管完全结扎且右输尿管保持完整的UUO模型建立示意图。(c)静脉注射MB溶液(静脉注射量为0.01 mg∙g-1体重)后不同时间点(波长:623 nm;功率密度:80 mW·cm-2;暴光时间:60 ms)的小鼠代表性全身(背侧)无创肾脏荧光成像图像。(d)~(f)假手术组、UUO-3d组和UUO-6d组肾脏TFIC。(g)、(h)基于UUO小鼠和假手术组肾TFICS的两个参数统计学分析,参数包括峰值(g)和峰值时间(h)。数据为平均值± SD。n = 3个独立测量。*p < 0.05,**p < 0.01,***p < 0.001。(i)假手术组、UUO-3d组、UUO-6d组肾脏病理分析(H&E染色,比例尺为100 μm)。R:右;L:左;NS:无统计学差异。
肾脏滤过功能分析同样是肾功能成像中不可或缺的一部分。BUN和Cre是用于评估总肾肾滤过功能的常用指标,但由于存在功能良好的对侧肾脏,它们都不是反应单侧肾滤过功能的理想指标。为了排除健侧肾脏的代偿干扰,通过右肾切除术建立孤立肾模型,用于研究MB辅助NIR-II实时成像以评估肾脏滤过功能的可行性。在URF组中LK受到不同程度的电凝损伤,但在对照组中保持完好[图6(a)]。同样地,在MB静脉注射后进行无创MB辅助NIR-II肾脏实时成像,利用TFIC分析单侧肾滤过功能(定义为30 min时的清除百分比= 30 min时的峰值强度/峰值 × 100 %)[图6(b)和(c)]。如图6(d)所示,与对照组相比,URF组在30 min时的MB清除百分比显著降低。为了比较MB的肾功能检测能力与临床方法,使用商业测定法测量了两组小鼠血液中的Cre和BUN。在URF组中观察到Cre和BUN显著升高,提示URF组孤立肾滤过功能障碍。这些数据与上述成像结果一致,表明通过MB NIR-II荧光成像无创检测肾脏滤过功能具有一定可行性。
《图6》
图6 活体小鼠MB NIR-II荧光成像实时检测肾脏滤过功能。(a)URF模型建立示意图,红色区域表示电凝损伤部位及程度。(b)静脉注射MB(静脉注射量:0.01 mg·g-1体重)后不同时间点(激发波长:623 nm;功率密度:80 mW·cm-2;曝光时间:60 ms)下对照组和URF组的代表性肾脏NIR-II荧光成像图像;(c)对照组和URF组肾脏TFIC;(d)对照组和URF组基于TFIC的肾脏30 min清除率统计分析,***p < 0.001。(e)对照组和URF组其他指标(Cre、BUN)体外肾功能检测,***p < 0.001。
尽管一些NIR-II染料如CH-1055-PEG、CDIR2、稀土纳米粒子和金纳米粒子已被报道具有NIR-II肾脏功能成像潜力[39,47‒51],但由于其毒性和药代动力学不明确,要实现真正的临床应用仍需投入大量研究工作。此外,上述材料即使用于动物模型实时成像,也存在激发激光功率密度过高的问题(CDIR2和CH-1055-PEG的功率密度均为300 mW·cm-2)[39,50],存在潜在的热损伤。然而,MB却可以在相对较低的激发功率密度(623 nm LED, 80 mW·cm-2)下实现清晰的NIR-II肾脏实时成像。同时由于MB在665 nm处的吸光度是623 nm处的1.85倍,因此MB有望于更低功率密度下在665 nm处的激光激发下实现清晰的MB NIR-II肾脏实时成像。
《4、 结论》
4、 结论
本研究首次探测了MB的NIR-II荧光拖尾,并探究了其在NIR-II荧光有创/无创尿路造影和肾功能无创NIR-II成像中的应用可行性。MB在NIR-II窗口中显示出比NIR-I窗口更高的SBR和更好的空间分辨率,表明在临床上使用MB荧光成像显然是更合适的检测窗口,而将传统的基于硅的检测相机切换到新兴的InGaAs相机即可改进目前的术前和术中荧光成像。同时,MB主要通过肾脏排泄,而MB辅助的NIR-II荧光成像的肾功能分析显示出与病理结果和临床诊断参数(Cre和BUN)一致。因此,基于MB的NIR-II荧光成像不仅在临床上泌尿系统的侵入性和非侵入性结构成像中具有巨大应用前景,在临床前肾功能研究中同样大有可为。













 京公网安备 11010502051620号
京公网安备 11010502051620号




