《1、 引言》
1、 引言
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是一种生殖和代谢性疾病,全世界约5%~10%的育龄期女性受影响。PCOS患者可罹患月经异常、多毛、胰岛素抵抗、代谢综合征和不孕症等[1]。由于无排卵或稀发排卵,高达80%的PCOS女性合并不孕症[2]。遗传因素在PCOS的发病中起着重要作用,这已被家族聚集性研究和双胞胎姐妹研究所证实[3]。目前,通过基于阵列的全基因组关联研究鉴别出与PCOS发病相关的候选基因超过200个,涉及性激素、胰岛素功能和钙信号、氧化应激和内噬作用等[4‒6]。
芳香化酶抑制剂和选择性雌激素受体调节剂被用作诱导排卵的一线治疗。然而,10%~40%的PCOS女性对这些药物治疗无应答[7‒8]。排卵应答差仍然是PCOS不孕妇女临床促排卵治疗面临的一个巨大挑战。目前,对于不孕症治疗失败的病因认知有限,也缺乏有效的筛查标志物或普遍适用的预测模型用以选择PCOS不孕症的治疗方案。
排卵应答可受到遗传和代谢因素以及胰岛素信号和类固醇合成所介导的某些临床特征共同影响[9]。在本研究中,我们旨在评估无排卵PCOS女性的遗传变异、代谢信号和临床特征。我们采用全外显子联合靶向单核苷酸多态性(single-nucleotide polymorphism, SNP)测序和全代谢组学技术,以期找出不孕症治疗中与排卵应答相关的重要的新遗传变异及其代谢信号特征。
《2、 材料和方法》
2、 材料和方法
《2.1 研究设计、人群和方案》
2.1 研究设计、人群和方案
本研究中使用的血液样本均来自PCOSAct研究,后者在2012年7月6日至2014年11月18日期间从27家医院(分中心)共招募1000名不孕PCOS女性,这些女性分别接受克罗米芬或安慰剂联合针灸或“假”针灸治疗[9‒10]。这些分中心在地理位置上位于中国南方和北方,数量分别为11个和10个。依据修订的鹿特丹标准,所有受试者均符合PCOS诊断标准,即月经稀发或闭经(月经周期分别大于35天和90天)和临床(中国人群:修订的Ferriman-Gallwey多毛评分≥5)/生化高雄[总睾酮水平(TT)>1.67 nmol∙L-1]表现,或多囊卵巢[一侧卵巢内见大于12个小卵泡(直径小于9 mm),或卵巢体积大于10 mL],或两者同时存在。该试验获伦理委员会批准,并在ClinicalTrials.gov (NCT01573858)和chictr.org.cn (ChiCTR-TRC-12002081)网站注册。
PCOSAct依据《赫尔辛基宣言》原则开展,并获得黑龙江中医药大学第一附属医院伦理委员会批准。该试验在获得伦理委员会批准后开展。受试者被告知研究的获益和风险,她们被允许在任何时候以任意理由自愿地停止参与研究。在PCOSAct研究中,所有受试者均提供了本研究使用血液样本的知情同意。
《2.2 全外显子联合靶向SNP测序》
2.2 全外显子联合靶向SNP测序
采用Flexi基因DNA试剂盒提取DNA,根据制造商的使用说明进行操作。采用琼脂糖凝胶电泳法测定样品的完整性、浓度和纯度。纯化的基因组DNA(大于0.4 µg)用于构建文库,并根据Dynege制造商手册(http://www.dynege.com/),使用QuarXeq人类全外显子组1.0 plus 200 K SNPs试剂盒进行蛋白质编码序列富集。样品通过Illumina NGS系统进行测序。原始数据依据gatk4-germline-snps-indels工作流程进行处理。简而言之,我们使用基因组分析工具包(GATK)软件v4.1.2.0将多对输入的原始数据(FASTQ文件)转换为一个未映射的BAM文件。保留SNP和观测值的质量控制参数如下:SNP缺失<0.05(样本删除前),观测值缺失<0.02,常染色体杂合度偏差(Fhet < 0.2),SNP缺失<0.02(样本删除后),病例和对照间SNP缺失的差异<0.02,以及SNP的哈迪-温伯格平衡检验(p > 1×10-6)。采用血缘同源方法计算亲缘关系,每一配对的相关个体之一(pi_hat > 0.2)均被踢除。具有统计学显著性的变异被进一步通过独立基因分型实验验证。
《2.3 代谢组学分析》
2.3 代谢组学分析
采用超高效液相色谱(ultra performance liquid chromatography, UPLC)法测定血清代谢谱,并输入Progenesis QI软件(Waters, USA)进行数据预处理。对峰进行匹配、提取和归一化后,对离子进行归一化。根据排卵结果对所有离子进行严格的层次聚类和判别分析。采用稀疏偏最小二乘分析确定各离子对聚类的贡献值。基于归一化数据,采用t检验对组间差异进行检测。选择组间比较具有统计学显著性的离子作为候选离子,进行元素匹配、二次鉴定。使用人类代谢组数据库(HMDB)和代谢分析网站估计可能贡献(该离子)的代谢物。基于Masslynx软件系统的质量片段软件,输入获得的化合物和二次质谱数据,通过热解质谱数据和化学结构裂解可能性数据,证实代谢物的有效性。基因和基因组京都百科全书(KEGG)用于分析代谢通路。与变异/突变相关的显著代谢物被认为是组成排卵的代谢信号,并通过针对二十烷小体的定量液相色谱/串联质谱(LC-MS/MS)方法进行验证(附录A中的S1节)。
《2.4 机器学习和预测模型》
2.4 机器学习和预测模型
PCOSAct在27家医院开展,包括中医院和西医院。共从中医院和西医院分别招募612名和367名患者。中医院和西医院的受试者之间所有临床结局均无显著差异。在机器学习中,来自中医院的受试者数据被用作训练集和内部验证集,而来自西医院的受试者数据则用作外部验证集。我们基于选择的特征构建了排卵预测模型,包括纳入或不纳入多基因风险评分(polygenic risk score, PRS)和风险基因型及相关联的代谢物特征以及它们的组合。首先采用线性回归(linear regression, LR)模型预测排卵,然后将其与不同算法的结果进行比较,包括支持向量机(support vector machine, SVM)、K-最邻近(K-nearest neighbor, KNN)、随机森林(random forest, RF)、梯度增强决策树(gradient boosted decision tree, GBDT)和神经网络(neural network, NN)等。在训练中,采用留一交叉验证测试法进行模型参数剪枝。模型训练结束后,分别进行内部验证和外部验证。所有模型都会生成0到1区间并呈正态分布的排卵概率。我们将概率小于0.5的受试者划分为低排卵概率者;否则,受试者被划分为高排卵概率者。我们使用R语言“caret”包进行训练和预测任务,将LR、SVM、KNN、RF、GBFT和NN模型的模型参数分别设置为“bayesglm”“svmLinear”“KNN”“rf”“avNN”“gbm”和“avNNet”。我们使用受试者工作特征(ROC)曲线[曲线下面积(AUC)]、准确性、敏感性、特异性、阳性预测值(PPV)、阴性预测值(NPV)、F1评分、Cohen´s Kappa系数(Kappa)和Brier评分来评估模型的预测性能。我们使用R语言“caret”包中的“varImp”函数计算特征的重要性。
《2.5 统计分析》
2.5 统计分析
对于常见变异关联分析,使用Rapid imputation for COnsortias PIpeLIne (RICOPILI)软件进行标准质量控制、数据填补和统计分析[11]。基因型推断采用Eagle v2.3.5 [11]中嵌入的预分期/逐步填补法和使用Minimicac3 [12]软件进行,后者使用1000个三阶段基因作为参照[13]。对常见变异分析,全基因组显著性阈值设置为5.0×10-8。使用EIGENST RAT v8 [14]软件结合研究样本和第三个国际人类基因组单体型图项目样本生成主成分。对罕见变异分析,使用GATK锁定高质量变异并标记为PASS。使用变异效应预测器(Ensembl variant effect predictor, VEP)对变异进行注释。罕见致病变异(最小等位基因频率< 0.01)被定义为Sorting Intolerant From Tolerant (SIFT)评分<0.05和Polymorphism Phenotyping v2 (PolyPhen-2) > 0.8,或Combined Annotation-Dependent Depletion (CADD) > 20。使用RVTESTS对致病变异进行单一变异检验和负担检验[15],统计显著性水平分别设为5.13×10-7 (0.05/97453)和2.97×10-6 (0.05/16804)。所有这些变异与排卵的遗传关联性统计分析都纳入治疗措施进行校正,包括针灸。
临床数据的连续变量采用平均值[标准差(standard deviation, SD)]描述,分类变量采用频率(%)描述。两组间差异比较采用Mann-Whitney-U检验或χ2检验,多组间差异比较采用Kruskal-Wallis检验。采用Kaplan-Meier曲线评估首次排卵时间与风险基因型之间的关联性,并计算平均排卵时间。采用Spearman´s分析代谢物与生化参数之间的相关性。使用深度机器学习算法中的逻辑构建排卵预测模型,并进行验证(附录A中的S1节)。双尾p值小于0.05,被定义为具有统计显著性,所有统计学分析均使用R3.6.1版本完成。
《3、 结果》
3、 结果
《3.1 研究人群特征》
3.1 研究人群特征
共979份和936份血样本可分别用于基因组测序和代谢组学分析(附录A中的图S1)。受试者的基线人口学特征在克罗米芬组和安慰剂组之间无显著差异。接受克罗米芬治疗的受试者的排卵率(90.8% vs. 66.0%, p < 0.001)、受孕率(42.6% vs. 21.6%, p < 0.001)、临床妊娠率(29.1% vs. 15.1%, p < 0.001)和活产率(27.3% vs. 14.3%, p < 0.001)显著高于接受安慰剂治疗者(表1)。
《表1》
表1 基线人口学特征[数值用均值(标准差,SD)表示,除非另有说明]
| Characteristics | Clomiphene ( | Placebo ( | Total ( | |
|---|---|---|---|---|
| Age (years) | 27.97 (3.36) | 27.86 (3.25) | 27.91 (3.31) | 0.50 |
| Height (cm) | 161.20 (5.07) | 161.22 (5.15) | 161.21 (5.11) | 0.43 |
| Weight (kg) | 62.71 (11.95) | 63.47 (12.96) | 63.09 (12.47) | 0.43 |
| BMI (kg·m-2) | 24.06 (4.06) | 24.36 (4.46) | 24.21 (4.26) | 0.42 |
| Waist circumference (cm) | 85.17 (11.29) | 85.63 (11.78) | 85.40 (11.53) | 0.57 |
| Hip circumference (cm) | 98.11 (8.78) | 98.73 (8.55) | 98.42 (8.67) | 0.30 |
| Mean menstrual cycle per year | 6.17 (1.98) | 6.21 (2.19) | 6.19 (2.09) | 0.78 |
| Mean menstrual interval (day) | 70.16 (46.67) | 68.86 (39.44) | 69.51 (43.17) | 0.76 |
| Infertility duration (month) | 23.77 (17.67) | 24.04 (17.63) | 23.91 (17.64) | 0.76 |
| Pause (beats per minute) | 75.95 (5.99) | 76.19 (6.50) | 76.07 (6.25) | 0.71 |
| Systolic blood pressure (mmHg) | 112.26 (9.64) | 112.27 (9.17) | 112.26 (9.40) | 0.82 |
| Diastolic blood pressure (mmHg) | 74.82 (7.97) | 74.78 (7.77) | 74.80 (7.87) | 0.88 |
| Modified F‒G score | 2.96 (2.57) | 3.11 (3.00) | 3.03 (2.80) | 0.95 |
| Acne score | 0.42 (0.75) | 0.46 (0.78) | 0.44 (0.76) | 0.38 |
| Acanthosis score | 1.20 (0.46) | 1.21 (0.48) | 1.21 (0.47) | 0.70 |
| Left ovary antral follicle count | 11.88 (2.83) | 12.19 (3.18) | 12.04 (3.01) | 0.06 |
| Right ovary antral follicle count | 11.93 (2.67) | 12.24 (2.95) | 12.08 (2.82) | 0.05 |
| Polycystic ovary morphology ( | 426 (87.3%) | 440 (89.6%) | 866 (88.5%) | 0.30 |
| LH (IU·L-1) | 10.30 (6.08) | 10.69 (5.80) | 10.50 (5.94) | 0.14 |
| Follicle stimulating hormone (IU·L-1) | 6.12 (1.66) | 6.07 (1.66) | 6.10 (1.66) | 0.47 |
| Estradiol (pmol·L-1) | 284.32 (370.86) | 255.31 (254.55) | 269.83 (318.29) | 0.95 |
| Progesterone (nmol·L-1) | 2.52 (4.68) | 2.65 (5.50) | 2.58 (5.10) | 0.99 |
| TT (nmol·L-1) | 1.67 (0.66) | 1.66 (0.64) | 1.66 (0.65) | 0.96 |
| Free testosterone (pmol·L-1) | 2.28 (0.81) | 2.30 (0.88) | 2.29 (0.84) | 0.91 |
| Sex hormone binding globulin (nmol·L-1) | 43.37 (29.48) | 41.92 (31.51) | 42.65 (30.50) | 0.09 |
| AMH (ng·mL-1) | 12.00 (6.63) | 11.97 (6.09) | 11.99 (6.36) | 0.73 |
| FAI | 5.53% (4.04%) | 6.17% (4.78%) | 5.85% (4.43%) | 0.16 |
| Fasting insulin (pmol·L-1) | 96.50 (94.18) | 95.82 (82.50) | 96.16 (88.51) | 0.44 |
| Glucose (mmol·L-1) | 4.98 (0.94) | 5.11 (1.02) | 5.05 (0.98) | 0.10 |
| Total cholesterol (mmol·L-1) | 4.69 (1.12) | 4.80 (1.05) | 4.74 (1.09) | 0.06 |
| Triglyceride (mmol·L-1) | 1.53 (0.85) | 1.61 (0.96) | 1.57 (0.91) | 0.37 |
| High-density lipoprotein (mmol·L-1) | 1.28 (0.39) | 1.28 (0.36) | 1.28 (0.37) | 0.80 |
| Low-density lipoprotein (mmol·L-1) | 2.94 (0.90) | 3.00 (0.85) | 2.97 (0.88) | 0.14 |
| Fertility outcomes after treatment ( | ||||
| Ovulation | 443 (90.8%) | 324 (66.0%) | 767 (78.3%) | < 0.001 |
| Conception | 208 (42.6%) | 106 (21.6%) | 314 (32.1%) | < 0.001 |
| Clinical Pregnancy | 142 (29.1%) | 74 (15.1%) | 216 (22.1%) | < 0.001 |
| Live birth | 133 (27.3%) | 70 (14.3%) | 203 (20.7%) | < 0.001 |
| Pregnancy loss | 71 (34.8%) | 35 (33.3%) | 106 (34.3%) | 0.80 |
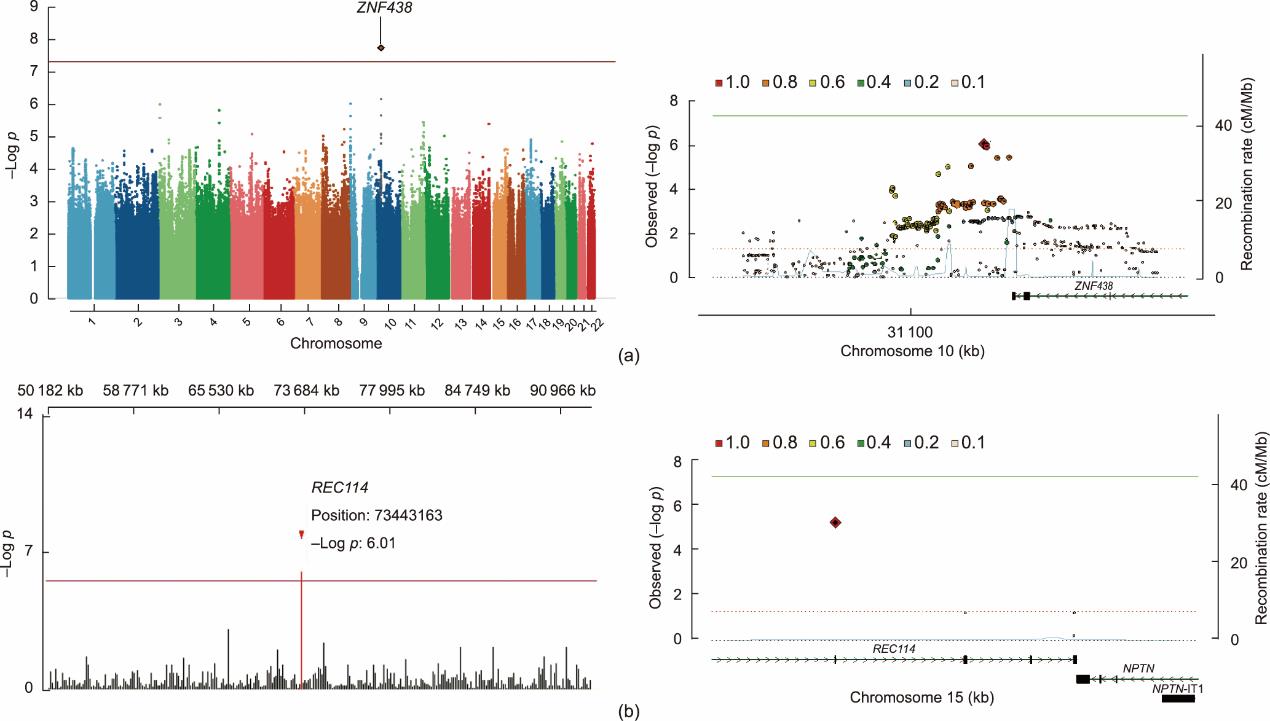
本研究样本的遗传背景与中国汉族和日本人群一致,但显著异于欧洲和非洲人群(附录A中的图S2)。在全部研究女性中发现两个与排卵显著相关的位点,即位于ZNF438 10p11.23位点的一个常见变异rs2994652 [A等位基因比值比(OR)=1.96, 95% CI = 1.55~2.49,逻辑回归校正p = 2.47×10-8]和REC114的一个罕见变异rs182542888(pVal101Leu, OR = 11.52, 95% CI = 3.08~43.05,评分检验p = 5.79×10-6)(图1、附录A中的图S3和表S1至表S3)。ZNF438的另两个常见变异rs57718262(p = 2.84×10-7)和rs34486207(p = 1.16×10-6)则分别与克罗米芬组和安慰剂组的排卵显著相关(附录A中的图S4、图S5、表S1)。在全部研究女性和接受克罗米芬治疗女性中,如果携带任一REC114风险等位基因和ZNF438 rs2994652风险等位基因,观察到的无排卵风险可分别升高1.96倍和2.47倍(附录A中的表S4)。这些变异与其他妊娠结局的关联性未达到全基因组显著性。
《图1》
图1 进行促排卵治疗的多囊卵巢综合征患者与排卵显著相关的SNP。(a)常见突变ZNF438 rs2994652的总体曼哈顿图(左)和位点区域(右,10p11.23)。(b)罕见突变REC114 rs182542888的总体曼哈顿图(左,染色体15:50~100 Mb)和位点区域(右,15q24.1)。这两种变异都与排卵显著相关。在曼哈顿图中,变异用基因名称表示。对于位点区域,连锁不平衡值是通过来自Trans-Omics for Precision Medicine(TOPMed)填补后合并意大利和西班牙数据集所得到的基因类型进行计算获得。以hg19为参考绘制基因组的位置。重组率以厘米(cm)/百万碱基对(Mb)表示。图中点显示基因的名称和位置;转录链用箭头表示。基因由内含子和外显子区域代表。每一组中的红色菱形区域代表与相应结局最相关的突变。NPTN:神经降解素基因;IT1:内含子转录本1。附录A中的图S3提供了详细的分位数-分位数(QQ)图和功能突变。表S2和表S3为详细的突变信息。
《3.2 遗传变异对第一次排卵时间的影响》
3.2 遗传变异对第一次排卵时间的影响
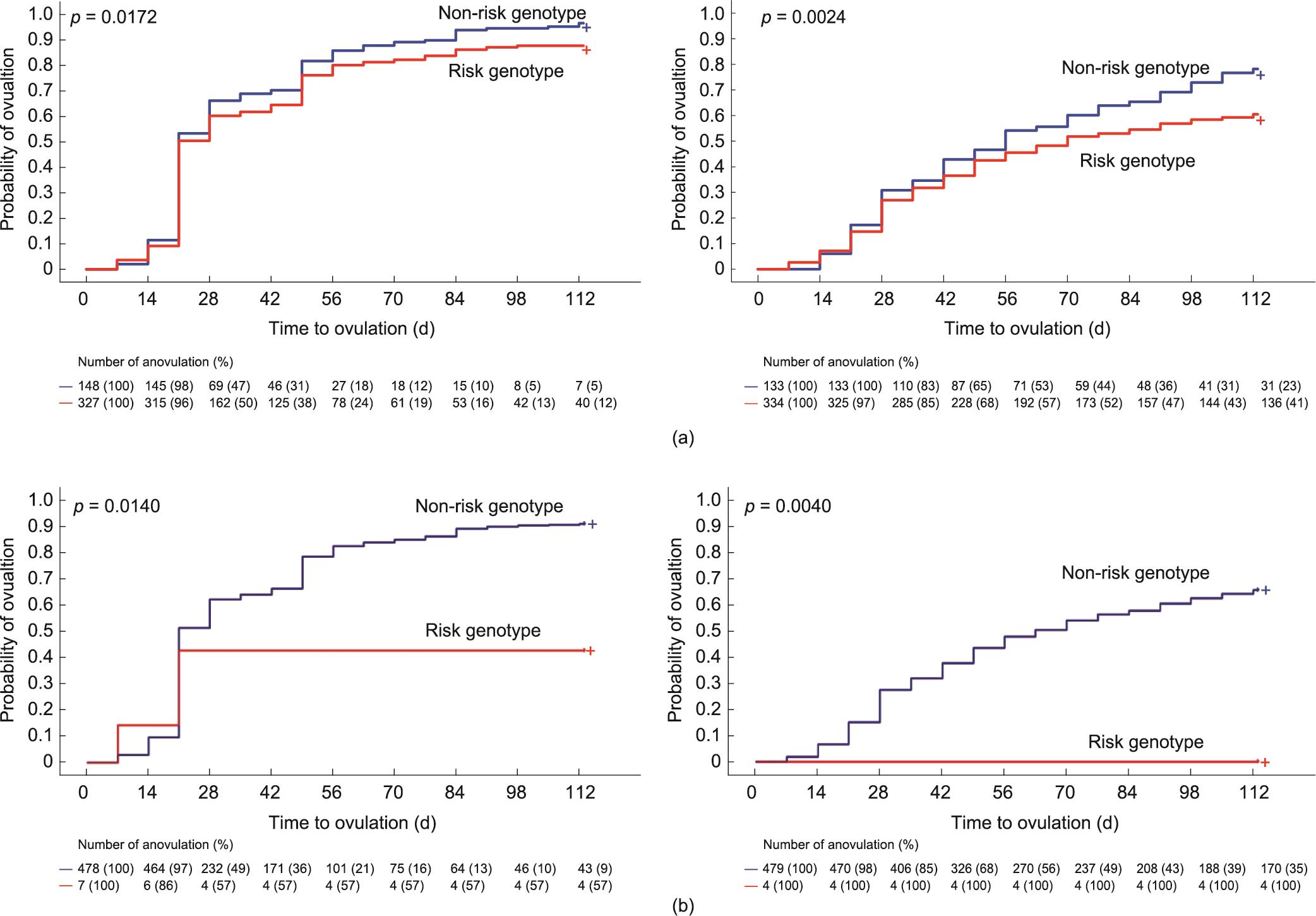
携带ZNF438 rs2994652 [图2(a)]或REC114 rs182542888 [图2(b)]等位基因的女性的第一次排卵时间显著延长,平均排卵时间在全部研究女性中分别为56.7天vs. 49.0天和78.1vs. 68.6天,在接受克罗米芬治疗女性中分别为42.0天vs. 36.1天和71.6天vs. 39.5天,在安慰剂治疗者分别71.1天vs. 63.5天和113.0天vs. 68.9天。对于携带ZNF438 rs34486207和rs57718262的女性也是如此(附录A中的图S6)。
《图2》
图2 突变与排卵时间的Kaplan-Meier曲线。克罗米芬(左)或安慰剂(右)治疗后,不同突变导致的风险基因型(红色)与无风险基因型(蓝色)的排卵概率。与非风险基因型者相比,携带ZNF438 rs2994652(a)和REC114 rs182542888(b)突变的女性在克罗米芬组(均值分别为42.0天vs.36.1天和71.6天vs. 39.5天)和安慰剂组(均值分别为71.1天vs.63.5天和113.0天vs.68.9天)均表现出排卵时间显著延长。
《3.3 ZNF438蛋白表达与临床特征》
3.3 ZNF438蛋白表达与临床特征
在所有研究女性、克罗米芬组及安慰剂组中,与无排卵女性相比较,排卵女性有着更低的体重指数(BMI)、总睾酮(TT)、抗苗勒管激素(anti-Müllerian hormone, AMH)、游离雄激素指数(free androgen index, FAI)及rs2994652和rs182542888频率和更多月经周期性及更高激素结合球蛋白(sex hormone-binding globulin, SHBG)水平(附录A中的表S5)。对接受克罗米芬治疗女性,与无排卵者相比,排卵女性有着更低的收缩压、黑棘皮症评分、空腹胰岛素和甘油三酯,而接受安慰剂治疗的排卵女性的促黄体生成素(luteinizing hormone, LH)水平更低。与健康对照组相比,ZNF438和REC114蛋白表达水平在PCOS女性的卵巢中均降低(附录A中的图S7)。
《3.4 代谢组学特征》
3.4 代谢组学特征
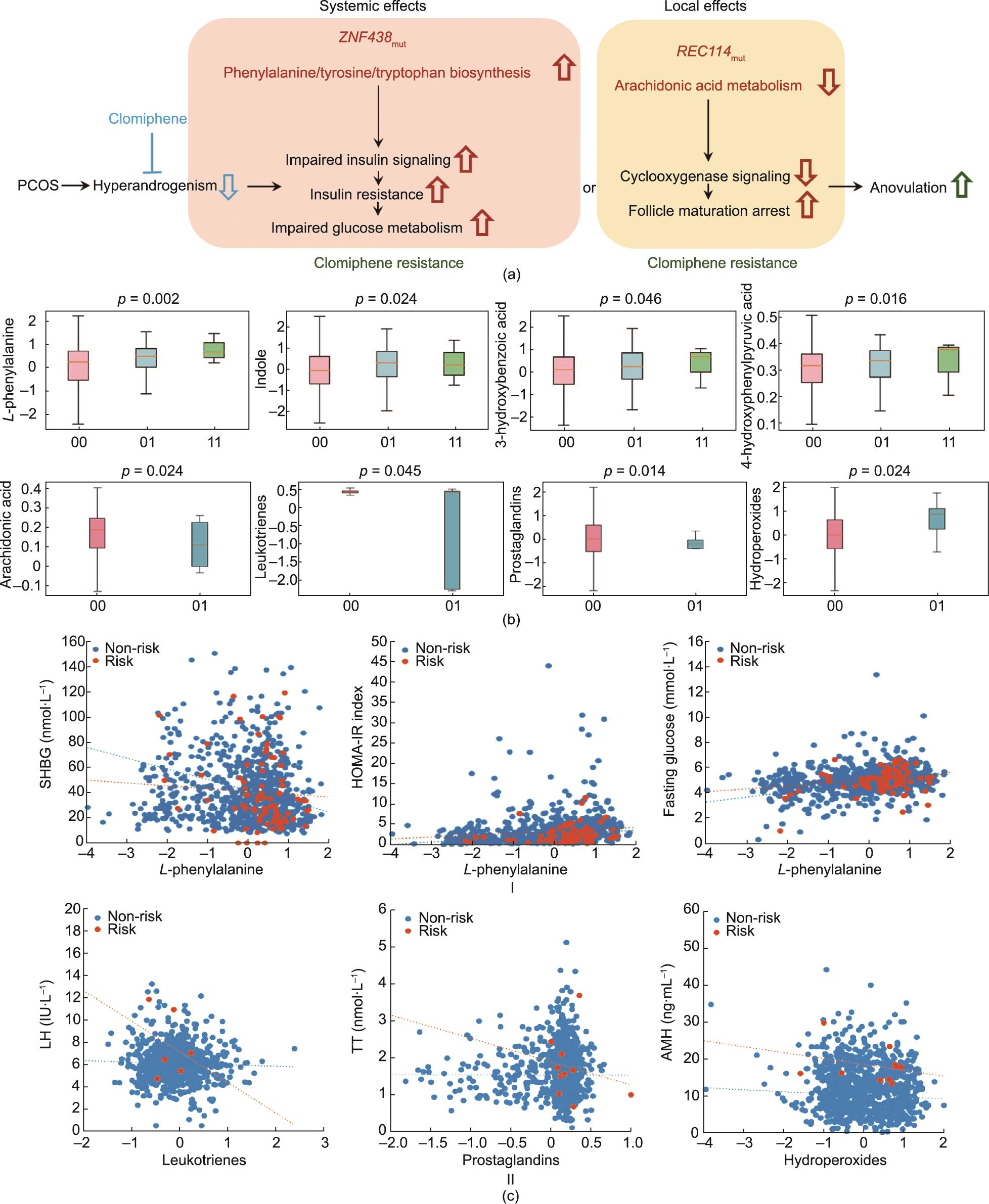
在聚类分析中根据排卵应答鉴别出一组基线代谢物(附录A中的图S8)。基于rs2994652和rs182542888等位基因,这些代谢物被富集到苯丙氨酸/酪氨酸/色氨酸生物合成途径(hsa00400)和花生四烯酸代谢途径(hsa00590)(附录A中的图S9至图S11)。携带ZNF438突变的女性,血清L-苯丙氨酸、4-羟基苯丙酮酸、吲哚和3-羟基苯甲酸等代谢产物水平显著升高。携带REC114突变的女性,血清花生四烯酸、白三烯和前列腺素等代谢产物水平显著降低,而氢过氧化物等水平则显著升高(图3)。在携带ZNF438突变女性中,L-苯丙氨酸与稳态模型评估(HOMA-IR; r = 0.219, p = 0.049)的胰岛素抵抗指数和空腹血糖(r = 0.326, p = 0.003)水平呈正相关,而与SHBG(r = -0.268, p = 0.015)呈负相关。在携带REC114突变的女性中,白三烯、前列腺素和氢过氧化物等分别与LH (r = -0.761, p = 0.011)、TT(r = -0.709, p = 0.022)和AMH(r = -0.507, p = 0.013)水平呈负相关。
《图3》
图3 在多囊卵巢综合征中ZNF438和REC114突变的代谢影响。(a)ZNF438和REC114风险突变(ZNF438mut和REC114mut)与多囊卵巢综合征的克罗米芬抵抗机制和整体排卵效应。(b)代谢组学筛出与ZNF438mut和REC114mut [00:野生型(粉色);01:杂合型(蓝色);11:纯合子(绿色)]相关的重要代谢物定量水平(归一化对数转换浓度),分别为苯丙氨酸/酪氨酸/色氨酸生物合成途径(L-苯丙氨酸)及花生四烯酸代谢(花生四烯酸)。箱线图显示的是中位数、四分位数(第一和第三)以及第5和第95个百分位数;p值来自混合线性模型。代谢组学特征和重要代谢途径详见附录A中的图S8至图S12。(c)I:ZNF438风险基因型(橙色)和无风险基因型(蓝色)中L-苯丙氨酸浓度(归一化对数变换浓度)与SHBG、血糖水平以及胰岛素抵抗稳态模型评估(HOMA-IR)指数的相关性(SHBG:无风险型,r =-0.088, p = 0.012;风险型,r =-0.268, p = 0.015。血糖:无风险型,r = 0.246, p = 0;风险型,r = 0.326, p = 0.003。HOMA-IR:无风险型,r = 0.128, p = 0;风险型,r = 0.219, p = 0.049)。II:REC114风险基因(橙色)和无风险(蓝色)基因型中白三烯、前列腺素和过氧化氢浓度(归一化对数转换浓度)分别与LH、TT和AMH的相关性(白三烯:无风险型,r = -0.082,p = 0.014;风险型,r = -0.761,p = 0.011。前列腺素:无风险型,r = -0.033,p = 0.325;风险型,r = -0.709,p = 0.022。过氧化氢:无风险型,r = -0.076,p = 0.022;风险型,r = -0.507,p = 0.013)。r表示Spearman等级相关系数;p值来自混合线性模型。
《3.5 机器学习创建预测模型》
3.5 机器学习创建预测模型
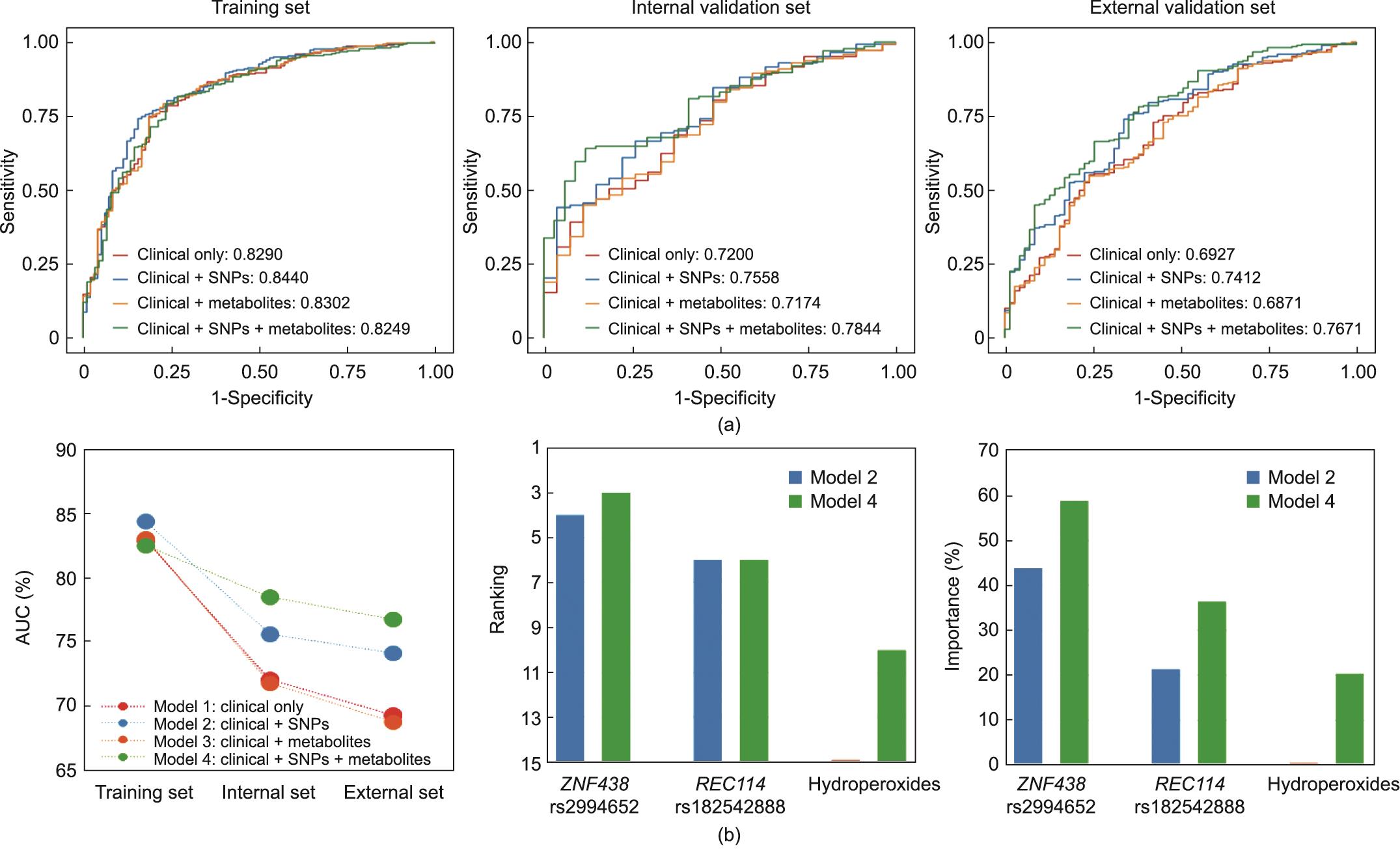
筛选的临床特征被纳入机器学习算法用以预测排卵(附录A中的图S12)。嵌合风险基因型及其相关代谢物的逻辑回归模型比只纳入风险基因型或其相关代谢物的回归模型表现更好(图4),外部验证的AUC为0.77,PPV为0.84,Kappa系数为0.29(附录A中的表S6)。预测模型中的重要特征包括治疗措施、AMH、rs2994652、每年月经周期数、BMI、rs182542888、黑棘皮症评分、吸烟、改良Ferriman-Gallwey (FG)评分、氢过氧化物和月经周期天数。这些特征与机器学习算法中的其他模型结果一致(附录A中的图S12)。
《图4》
图4 排卵预测。(a)预测多囊卵巢综合征患者治疗后排卵的不同测试数据集。结合临床特征、显著风险基因型(SNPs、ZNF438 rs2994652和REC114 rs182542888)构成的遗传因素、相关代谢产物(L-苯丙氨酸、花生四烯酸、白三烯、前列腺素和过氧化氢)组成的代谢特征,使用逻辑回归算法区分排卵和无排卵所获得的AUC范围从0.6927(95%可信区间,0.676~0.7955)到0.7671(95%可信区间,0.7059~0.8283)。(b)不同模型的比较,包括AUCs、排序和筛选特征的重要性[风险基因型(ZNF438 rs2994652和REC114 rs182542888)和代谢特征(过氧化氢)]。就AUC、排序和筛选特征的重要性方面而言,风险基因型和代谢特征组合模型增加了预测效能。该模型与其他深度机器学习算法构建的排卵预测模型的比较见图S12,每个模型的具体参数值见表S6。
《4、 讨论》
4、 讨论
ZNF438的一个常见变异位点rs2994652和REC114的一个罕见变异rs182542888被发现与PCOS女性诱导排卵后的无排卵应答在全基因组水平上显著相关。携带这两个基因变异/突变的PCOS女性接受克罗米芬治疗的无排卵风险增加和平均首次排卵时间延长。此外,携带ZNF438变异的PCOS女性的L-苯丙氨酸显著升高,并与HOMA-IR和空腹胰岛素呈正相关,而携带REC114变异者的花生四烯酸水平显著降低,并与TT、AMH和LH水平呈负相关。REC114和ZNF438变异参与PCOS中胰岛素抵抗和雄激素过多的临床表现,这些导致了不孕症治疗中的无排卵应答以及失败。
ZNF438基因位于10p11.2,其在健康成年女性的卵巢中呈高表达[16]。ZNF438蛋白属于Krüppel Cys2His2(C2H2)锌指蛋白(ZNF)家族,后者与代谢紊乱性疾病相关,包括肥胖症、高脂血症、心血管疾病[17]等。PCOS女性的外周血和滤泡液中均发现升高的苯丙氨酸[18‒19],但在携带ZNF438变异PCOS女性中其水平显著升高,并与HOMA-IR指数呈正相关。苯丙氨酸/酪氨酸/色氨酸生物合成通路已被证实通过胰岛素受体底物磷酸化参与PCOS中的胰岛素信号传导缺陷过程。胰岛素抵抗被认为是PCOS的关键病理特征之一,不仅参与卵巢的无排卵,还参与系统性代谢疾病,如肥胖症、高脂血症、代谢综合征和非酒精性脂肪肝病等[20]。除更高的ZNF438变异频率,我们发现接受克罗米芬治疗的PCOS女性中,无排卵者也有着更高的腰围、收缩压、甘油三酯水平和空腹胰岛素水平,这些都是代谢综合征的主要参数。因此,继发于ZNF438突变的卵巢和外周组织的胰岛素抵抗,通过苯丙氨酸生物合成通路进一步导致排卵应答差和代谢紊乱。
REC114基因位于15p11.2,为减数分裂[21]的DNA双链断裂形成过程所必需,并在卵母细胞成熟和胚胎发育停滞中发挥作用[22]。REC114在许多细胞过程中发挥着启动子和增强子的作用,如免疫反应、炎症和增殖等。在本研究中,对于携带REC114突变的PCOS女性,我们发现其前列腺素的水平下降并与TT呈负相关,而氢过氧化物的水平增加并与AMH水平呈负相关。卵泡内升高的前列腺素E2(prostaglandin E2, PGE2)介导了排卵的关键事件,包括排卵过程中的卵丘扩大、卵泡破裂和卵子释放[23]。REC114变异可能与LH排卵峰后诱导的卵子减数分裂恢复失败有关,而花生四烯酸水平下降低可诱发卵泡成熟障碍[24],这些可能刺激窦卵泡的颗粒和卵泡膜层产生更多的AMH和睾酮。此外,与健康对照组相比较,PCOS女性的前列腺素水平如PGE2显著降低,在暴露于雄激素后出现下降,但胰岛素水平并无显著变化[25]。因此,有理由相信REC114突变通过花生四烯酸代谢通路不仅可能参与排卵失败,并且加重卵巢雄激素状态。
目前,在不孕症治疗前识别(促排卵治疗)无排卵应答的女性仍缺乏有效方法。各种临床的、内分泌的和卵巢超声影像学的特征都被尝试用作卵巢应答的预测因子。然而,某些生物标志物如FAI并不能被准确测定,这也限制了它们在临床的应用[26]。此外,AMH作为卵巢储备功能的标记物,当血清水平大于7.0 ng∙mL-1时,其对排卵的预测能力也不佳,而这种情况(AMH >7.0 ng∙mL-1)在PCOS女性中经常发生[27]。最近,在使用两个独立的PCOS队列进行的交叉验证的预测排卵研究中[27‒28],发现BMI、不孕症病程、胰岛素和血糖水平以及高雄激素血症被一致地筛选为预测因子。基于其灵活性、定量性和融合不同类型数据的优势[29],我们利用机器学习算法嵌入遗传和代谢因素构建了排卵预测模型。其次,在纳入风险基因型和相关代谢物后模型的预测性能也得到改善。除治疗措施外,BMI、黑棘皮症评分、mF-G评分、AMH、ZNF438和REC114风险基因型被筛选为预测排卵的关键特征。AMH和改良的FG评分(一个高雄激素血症的指标)与REC114突变相关,而BMI、黑棘皮症评分和收缩压与ZNF438突变介导的胰岛素抵抗相关。因此,REC114和ZNF438突变及它们相关的临床特征为阐明中国汉族PCOS女性对促排卵治疗的应答提供思路。在临床实践中,基因检测在精确医学背景下变得普通,尤其是对于癌症和一些退行性疾病。FSH受体(Follicle-stimulating hormone receptor, FSHR)SNPs已被尝试用作卵巢对促排卵治疗应答的预测因子,尽管它应用于临床的潜力很小。基于我们的发现,使用二代测序或聚合酶链反应(PCR)进行基因分型的靶标基因测序将是一种非常快速和廉价的检测[30],这将为未来不孕症定制个性化治疗提供帮助。
在本研究中,基于PCOS女性进行促排卵治疗的队列,我们旨在找出对促排卵治疗应答的遗传因素。令人惊讶的是,在全基因组水平的常见变异和罕见变异分析中,新的风险基因ZNF438和REC114被发现,而非PCOS的致病候选基因,如FSHR等。鉴别出的风险基因型及其代谢物参与胰岛素信号和雄激素生物合成以及排卵过程,并与克罗米芬治疗无关,这些对其他促排卵治疗有着更广泛的意义。然而,我们的研究仍有局限性。首先,我们研究的样本量相对较小。然而,它是基于一项随机临床试验的患者干预队列,并使用全外显子组和靶向SNP进行测序,这与PCOS个体和健康个体之间的病例对照遗传学研究不同。其次,该研究结果可能只适用于中国汉族PCOS女性。更大样本的队列和不同的研究人群可能会识别出其他的相关变异和基于人群的变异,并可进一步验证本文发现的结果。再次,这种疾病的临床特征广和缺乏潜在的重要预测因子可能是预测性能改善微小的原因。此外,这也意味着与临床特征相比,遗传和代谢因子在预测临床结局方面的作用有限,如FSHR多态性[31]。
《5、 结论》
5、 结论
综上所述,ZNF438和REC114这两个新的基因突变及L-苯丙氨酸和花生四烯酸这两个新的代谢物,参与了不孕症治疗失败过程。这些发现有助于更好地理解PCOS的发病机制,并有助于制定个性化的PCOS女性不孕症治疗方案。














 京公网安备 11010502051620号
京公网安备 11010502051620号




