《1、 引言》
1、 引言
天然气主要由甲烷(CH4)组成,在未来几十年将占全球能源需求的四分之一[1‒3]。然而,低品质天然气中的CH4浓度较低,与二氧化碳(CO2)浓度基本相当,无法满足工业应用的需求[4‒6]。因此,在运输过程中,必须去除CO2以提高燃烧效率并防止设备和管道腐蚀[7‒13]。目前,成熟的CO2去除工业技术是胺吸收法,但由于其需要巨大的能量投入进行吸收剂再生,并且容易受氧化和热降解的影响,因此成本昂贵[14‒17]。
基于吸附剂的吸附分离技术已被提出作为一种备选技术,其吸附剂再生能耗较低、效率较高且操作更为便捷[18‒30]。然而,尽管很多吸附剂表现出卓越的热力学选择性[31‒34],但是多孔吸附剂如沸石和氨基功能化的硅胶材料仍然显示出较高的CO2吸附焓。相反,如果吸附剂具有疏水性且表现出显著的动力学选择性,基于扩散速率差异的动力学分离方式更为优选。例如,碳分子筛可以基于动力学分离来净化天然气,其CO2的吸附热仅为10.9 kJ·mol‒1 [35,36]。然而,通过碳化工艺来精确控制碳吸附剂的微孔结构以调控CO2/CH4的动力学选择性仍然具有挑战性[37‒39]。
多功能金属有机框架(MOF)材料由于其结构多样性和可调孔径的特性,可被视为满足动力学分离严格前提的理想多孔吸附剂[40‒54]。例如,Lee等[55]在同构的锌柱撑轮桨型MOFs中通过控制孔径和晶体的晶面形态,成功实现了丙烯/丙烷的高效动力学分离。类似地,Lyndon等[56]提出了一种混合配体策略,用于精准调控具有柔性特征的孔道(直径约3 Å),以促进乙烯的动力学扩散。最近,Kitagawa团队[57]报道了一种铜(Cu)基MOF,其中框架结构内的分子翻转运动提供了动力学门控功能,可实现氧/氩和乙烯/乙烷的高效分离。然而,迄今为止,鲜有研究致力于构建用于CO2/CH4的动力学分离的MOFs,这在一定程度上是因为制备具有亚埃级精度的孔道具有挑战性,同时也因为CO2(3.3 Å)和CH4(3.8 Å)的动力学直径非常接近。
本文中,基于Cu(hfipbb)(H2hfipbb)0.5 [简称为CuFMOF-a,其中,H2hfipbb为4,4′-(六氟异丙基亚甲基)双(苯甲酸)] MOFs材料,我们报道了一种溶剂导向的微孔调控策略,并应用于CO2/CH4的动力学分离。CuFMOF-a具有周期性扩张和收缩的孔隙结构,瓶颈尺寸为3.2 Å × 3.5 Å,阻碍了CH4的扩散。它的衍生物CuFMOF·CH3OH(简称CuFMOF-c)具有类似的孔表面且孔隙尺寸增加了0.2 Å,促进了CO2的扩散并且仍能有效阻碍CH4的扩散,实现了创纪录的CO2/CH4动力学分离选择性。CuFMOF·DMF(简称CuFMOF-b;DMF:N,N-二甲基甲酰胺)的孔隙尺寸进一步增加了0.2 Å,进一步促进了CO2和CH4的扩散,却减弱了CO2/CH4的动力学分离性能。此外,CuFMOF-c表现出适中的CO2/CH4的热力学分离选择性;因此,协同的平衡-动力学效应增强了CO2/CH4气体混合物的高效分离。巨正则蒙特卡洛(GCMC)和分子动力学(MD)模拟进一步证明了孔隙尺寸调控对于动力学分离的关键作用。
《2、 实验》
2、 实验
《2.1 实验原料》
2.1 实验原料
有机配体4,4′-(六氟异丙基亚甲基)-双(苯甲酸)(H2hfipbb,98%纯度)购置于TCI公司(中国)。氯化铜二水合物(CuCl2·2H2O,99.99%纯度)和硝酸铜三水合物(CuNO3·3H2O,99%纯度)分别从阿拉丁公司(中国)和麦克林公司(中国)购得。二氧化碳(99.999%)、甲烷(99.999%)、氦气(99.999%)以及混合气体CH4/CO2(50/50,体积比)均由今工有限公司(中国)定制。所有化学品均从商业渠道获得,并未经进一步纯化,直接使用。
《2.2 CuFMOF-a的制备》
2.2 CuFMOF-a的制备
CuFMOF-a的合成遵循Li等[58]之前报道的方法。过量的H2hfipbb (729 mg, 1.86 mmol)与Cu(NO3)2·3H2O (145 mg, 0.60 mmol)和30 mL去离子水在150 ℃下加热12 h,得到蓝色柱状晶体。冷却至室温后,将产物用N,N-二甲基甲酰胺(DMF)洗涤,以去除多余的H2fipbb;然后用去离子水洗涤,最后在空气中干燥。
《2.3 CuFMOF-b的制备》
2.3 CuFMOF-b的制备
将H2hfipbb (235.4 mg, 0.6 mmol)和Cu(NO3)2·3H2O (145 mg, 0.60 mmol)溶解在DMF (36 mL)和去离子水(12 mL)的混合溶液中。将溶液在65 ℃的高压反应釜中加热48 h,以得到蓝色晶体。产品用DMF (30 mL)洗涤三次,然后用甲醇(30 mL)洗涤三次,最后在室温下干燥。
《2.4 CuFMOF-c的制备》
2.4 CuFMOF-c的制备
将H2hfipbb (117.7 mg, 0.3 mmol)和CuCl2·2H2O (51.2 mg, 0.3 mmol)溶解在DMF (14 mL)和甲醇(14 mL)的混合溶液中,并添加0.1 mol·L-1的HCl溶液(0.7 mL)以酸化溶液。将溶液在80 ℃的高压反应釜加热24 h,以得到蓝色花瓣状晶体。产品用DMF (30 mL)洗涤三次,然后用甲醇(30 mL)洗涤三次,最后在室温下干燥。
《2.5 气体吸附测试》
2.5 气体吸附测试
为了去除材料中的客体溶剂分子,将CuFMOF-c样品(约300 mg)在气体吸附测试前在120 ℃下真空脱气处理24 h。CO2和CH4吸附等温线使用Micromeritics ASAP 2460仪器(Micromeritics Instrument Corp.,美国)进行测量。CuFMOF·CH3OH和CuFMOF的Brunauer-Emmett-Teller (BET)比表面积通过在195 K下进行CO2吸附-脱附等温线测定后进行计算。
《2.6 吸附动力学测试》
2.6 吸附动力学测试
吸附动力学曲线是在智能重量分析仪(IGA001,英国Hiden公司)上测量的,该仪器采用重量分析技术,在不同操作条件下准确测量了气体吸附作为时间函数的瞬时吸附量。每次测试中,约使用120 mg的MOF样品,将其装填到样品篮中,然后在进行动态气体吸附测量之前在393 K下抽真空脱气处理8 h。吸附动力学测试是通过在给定温度下在100 mbar(1 mbar=100 Pa)条件下测量质量变化来进行的,通过在样品室中引入目标气体,将压力从0 mbar升至100 mbar,升压速率为200 mbar∙min-1。吸附动力学数据在不同温度(从278 K到318 K)下收集。每次测试后,将样品室重新填充气体至1000 mbar,并且替换新样品以进行下一次测试。实验中所使用的气体(CH4、CO2和He)均为超高纯度气体(99.999%)。
《2.7 固定床穿透及脱附实验》
2.7 固定床穿透及脱附实验
CO2/CH4(50/50,体积比)混合气体的固定床穿透实验在流速约2.5 mL∙min-1(298 K, 1.01 bar)下进行。将活化后的MOF颗粒(CuFMOF-a, 1.317 g; CuFMOF-b, 1.053 g; CuFMOF-c, 1.172 g)装入直径为4.6 mm、长度为100 mm的不锈钢柱中,在氮(N2)气氛下进行进一步活化。在每次穿透实验结束后,在298 K条件下,将20 mL∙min-1的氦气流通入不锈钢柱中进行30 min的活化再生。基于质量平衡,可以确定气体吸附容量如下:
(1)
式中,
《2.8 密度泛函理论计算》
2.8 密度泛函理论计算
本文使用Materials Studio的CASTEP模块进行了第一性原理密度泛函理论(DFT)计算。对于所有的结构几何优化计算,采用了Vanderbilt型超软赝势和Perdew-Burke-Ernzerhof (PBE)交换相关的广义梯度近似(GGA)。截断能量为544 eV,3×3×2 k点网格足以使总能在每原子0.05 MeV内收敛。优化后的结构与实验确定的配位网络的晶体结构一致。
《2.9 巨正则蒙特卡洛和分子动力学模拟》
2.9 巨正则蒙特卡洛和分子动力学模拟
本文使用巨正则蒙特卡洛(grand canonical Monte Carlo, GCMC)[59]和分子动力学(molecular dynamics, MD)分别对CuFMOF-a、CuFMOF-b和CuFMOF-c中的CO2和CH4进行吸附和扩散模拟。所有模拟均使用刚性的MOF结构,在室温下进行。所有模拟均采用了2×2×2的晶体学单胞。假设MOF是刚性的,极大地减少了为这些模拟定义原子间势能的复杂性,同时提高了计算效率。甲烷被建模为球形Lennard-Jones (LJ)粒子[60],而二氧化碳则基于EPM2模型[61]被建模为刚性的三位点分子,并且具有LJ势和原子电荷的全原子模型可近似表示CO2的四极矩。实验吸附等温线(图S1)与模拟吸附等温线(图S2)的比较表明,模拟吸附数据略高于实验吸附数据。然而,在理想情况下,由于存在单元缺陷和其他问题,理论数据将略高于实际数据。因此,这些参数在模拟二氧化碳和甲烷的吸附方面效果良好,表明使用的参数是合理的。
本文采用Lorentz-Berthelot混合规则,对框架原子使用通用力场(UFF)[62]来计算吸附剂-MOF LJ交互作用参数。MOF骨架中的原子电荷是通过使用Materials Studio软件包中的Accelrys DMol3模块进行色散校正的密度泛函理论(DFT-D)计算来确定的。DFT计算采用GGA和PBE以及双数值加极化(DNP)基组进行。计算中包括了半经验的色散校正,以考虑范德瓦尔斯相互作用。几何优化使用了4.0 Å的截断半径和2×2×2 k点网格,并在计算中使用了精准的收敛容限。我们使用MD计算了CO2的自扩散系数。MD计算是基于Nose-Hoover恒温器[63]中进行了20 ns的时间尺度进行的,其初始状态是基于GCMC结果创建的。自扩散系数的计算基于Einstein方程:
(2)
式中,c是吸附剂分子的浓度;d是系统空间的维度;Nm是系统中分子的数量;
《3、 结果与讨论》
3、 结果与讨论
《3.1 材料合成及表征》
3.1 材料合成及表征
基于先前报道的方法[58]成功合成了CuFMOF-a。单晶X射线衍射分析表明,通过将羧酸hfipbb2-配体连接到六连接节点的顶部位置,进一步扩展得到了CuFMOF-a的三维(3D)骨架结构[图1(a)]。这些材料的hfipbb2-配体的每个弯曲形状都呈现螺旋延伸,以连接上下层,构建了一个周期性展开和收缩通道横截面的结构[图1(b)]。因此,孔道结构为由迭代的笼状空间相互连接的狭窄瓶颈结构。
《图1》
图1 材料合成过程及结构的示意图。材料沿b轴方向的一维孔道:(a)CuFMOF-a;(c)CuFMOF-b;(e)CuFMOF-c。弯曲hfipbb2-配体的二面角及Connolly表面表示的材料的瓶颈尺寸:(b)CuFMOF-a;(d)CuFMOF-b;(f)CuFMOF-c。为了更清楚阐述材料结构,结构中氢原子被省略。不同的原子用不同颜色表示:Cu(绿色)、F(黄色)、C(灰色)、O(红色)、N(蓝色)。
CuFMOF-a的孔径尺寸为3.5 Å,略大于CO2的动力学直径(3.3 Å)但小于CH4的动力学直径(3.8 Å)。由于CuFMOF-a合成过程中所使用的有机配体在水中的溶解度相当低,因此我们添加了DMF以溶解该配体。令人惊讶的是,由此获得了一种新型MOF晶体,称为CuFMOF-b。与母体CuFMOF-a的结构不同的是,CuFMOF-b中的轮桨型铜原子充当四连接节点,连接平面内两个弯曲配体的四个氧原子,而节点的顶部位置连接DMF分子,形成了bc平面中的单层网络[见图1(c)、附录A中的表S1]。
有趣的是,CuFMOF-b的手性孔道由缠绕的左旋螺旋双链形成,而CuFMOF-a的手性孔道则由缠绕的右旋螺旋双链形成。值得注意的是,CuFMOF-a中V形构建单元hfipbb2-的弯曲角度(72.8°)略大于CuFMOF-b (71.8°),这是由于铜正方锥形配位结构中顶部连接基团不同而导致的[图1(b)、(d)],因此CuFMOF-b具有稍大的瓶颈尺寸,孔径为3.9 Å。类似地,通过将水替换为甲醇作为溶剂,首次制备了具有异构孔表面的另一种MOF,命名为CuFMOF-c [图1(e)、表S1]。根据单晶分析结果,合成得到的CuFMOF-c为Pccn空间群,具有由缠绕的左旋螺旋双链形成的异构手性孔道结构,类似于CuFMOF-b,其弯曲角度较小,瓶颈尺寸缩小到3.7 Å [图1(f)]。这种变化可能源自铜原子轴向位置的不同配位溶剂分子,从而影响MOF层的超分子排列。为进一步证明协同溶剂分子在调控异构孔道结构中的作用,对活化后的MOFs进行了单晶X射线衍射测试。结果发现,在120 ℃真空中活化24 h后,溶剂分子仍然牢固地与铜原子协同配位(附录A中的表S2)。
通过195 K下CO2的吸附-脱附测试表征了材料的超微孔结构,其吸附曲线呈现典型的微孔特征,其在相对压力0~0.01范围内的吸附量急剧增加(附录A中的图S3)。值得注意的是,CuFMOF-b和CuFMOF-c在相对压力从0.7到0.8时等温线急剧上升可能是由于MOFs间的颗粒聚集引起的。计算得出CuFMOF-a、CuFMOF-b和CuFMOF-c的BET比表面积分别为56.4 m2∙g‒1、126.4 m2∙g‒1和82.6 m2∙g‒1。
《3.2 静态吸附测试及吸附动力学测试》
3.2 静态吸附测试及吸附动力学测试
基于材料合适的孔径尺寸及发达的孔隙率,对CO2和CH4的吸附等温线进行了测试[图2(a)、附录A中的图S1]。如图2(a)所示,CuFMOF-c在298 K和100 kPa下表现出最高的CO2吸附量,为0.93 mmol·g‒1,超过了CuFMOF (0.64 mmol·g‒1)和CuFMOF-b (0.80 mmol·g‒1),与BET比表面积的大小顺序一致。此外,从CuFMOF-c到CuFMOF-a,其对CH4的吸附量从0.58 mmol∙g‒1降至0.31 mmol∙g‒1,均低于CO2的吸附量,表明CH4分子与MOF结构之间的亲和性较弱。CuFMOF-a、CuFMOF-b和CuFMOF-c对CO2/CH4的Henry系数选择性分别为5.0、3.2和2.9,略低于5A(Sinopec)沸石(7.8)[64]和BF-CMS (5.2) [35]。通过使用Clausius-Clapeyron方程并基于Langmuir-Freundlich模型对278 K、298 K和318 K下收集的单组分吸附等温线进行拟合,计算了等量吸附热(Qst)(附录A中的图S2、表S3至表S5)。其中,CuFMOF-c在吸附量接近零覆盖时具有适度的CO2和CH4的Qst值,分别为21.97 kJ∙mol-1和17.66 kJ∙mol-1,表明其易于活化再生并在实际节能应用中具有巨大潜力
《图2》
图2 (a)CuFMOF-a(蓝色)、CuFMOF-c(红色)和CuFMOF-b(绿色)在298 K下对CO2和CH4的单组分吸附等温线;实线代表通过朗缪尔方程拟合得到的曲线,实心点和实心圆代表实验数据。(b)、(c)在不同时间尺度下,CuFMOF-a(蓝色)、CuFMOF-c(红色)和CuFMOF-b(绿色)在298 K和100 mbar下对CO2和CH4的气体吸附动力学曲线。(d)不同吸附剂在CO2/CH4上的性能比较。(e)在298 K和1 bar条件下,以2.5 mL∙min-1的流速对CO2/CH4二元混合物(50/50, V/V)的固定床穿透曲线。
精巧的孔道结构使得这些MOFs在CO2/CH4动力学分离方面也具有巨大的应用潜力。为此,在从278 K到318 K的各种温度下测量了CH4和CO2的吸附量随时间变化的动力学吸附等温线[图2(b)、(c)和附录A中的图S4]。如预期一致,在整个温度范围内,所有MOFs对CO2的扩散速率明显快于CH4。在298 K和100 mbar下,CO2在CuFMOF-b和CuFMOF-c中的吸附在5 min内达到平衡[图2(b)]。相比之下,CuFMOF-a由于其较窄的孔径,在相同条件下直到30 min才达到平衡,CO2的扩散速率最低。至于CH4的扩散,CuFMOF-b由于其瓶颈处具有进一步增大的孔径,表现出最快的扩散速率。对于CuFMOF-a和CuFMOF-c而言,即使在60 min后,它们对CH4的吸附量仍未达到平衡状态。因此,CO2和CH4在CuFMOF-c中的扩散行为差异最大。
为了更好地定量比较扩散速率差异,采用了经典的微孔扩散模型[65]来量化动力学选择性。通过计算CO2和CH4的扩散时间常数(Dc/rc2),可以得到动力学选择性(附录A中的表S6、表S7)。CuFMOF-a具有最小的孔径尺寸,在CO2和CH4的吸附动力学上表现出细微的差异。在298 K下,CuFMOF-a中CO2和CH4的扩散时间常数分别为0.195 × 10-3 s-1和1.215 × 10-5 s-1,CO2/CH4的动力学选择性仅为16.1,因为不仅CH4在从一个中心笼子通过瓶颈扩散到另一个相邻中心笼子时受到限制,而且由于孔径太窄,CO2的扩散也受到限制。具有最大孔径尺寸的CuFMOF-b对CO2/CH4的动力学选择性达到36.1,在298 K时CH4的扩散时间常数大幅增加到7.31 × 10-5 s-1,CO2的扩散时间常数略微增加到2.64 × 10-3 s-1。值得注意的是,CuFMOF-c在298 K时的CO2和CH4的扩散时间常数分别为1.803 × 10-3 s-1和1.795 × 10-5 s-1,从而实现了高达100.5的CO2/CH4动力学选择性。这些结果可以通过狭窄瓶颈的尺寸变化来定性解释,狭窄的瓶颈有助于较小的CO2分子扩散,同时也为较大尺寸的CH4分子的扩散设置了屏障。与CuFMOF-a和CuFMOF-b相比,CuFMOF-c中的孔径(3.7 Å)是CO2和CH4动力学分离的最佳孔径,其尺寸略小于CH4的动力学直径,使得CO2可以自由扩散且有效抑制了CH4的扩散,从而实现了高CO2/CH4动力学选择性。这些结果表明,通过溶剂替代进行MOFs孔径调控是一种有前景的实现动力学分离的策略。
值得注意的是,气体扩散速率随着温度降低而逐渐减小,CH4的扩散速率受温度影响显著大于CO2。当温度进一步降低至278 K时,在CuFMOF-c上获得了非常高的CO2/CH4动力学选择性(273.5),明显高于其他报道的动力学选择性吸附剂,如CMS-3K (1.1) [66]、CMS-T3A (91.7) [67]、BF-CMS (180) [35]和5A沸石(3.6)[64],仅次于CMS-3A (537.3) [35](表S7)。使用Arrhenius方程计算了CO2和CH4的扩散活化能(请参阅附录A)。与CO2相比,CH4显著更高的扩散活化能进一步证明了这些MOFs对CO2相对于CH4的高动力学选择性(附录A中的表S8)。此外,进一步计算和比较了平衡-动力学综合选择性[68]。如图2(d)和表S7所示,CuFMOF-c具有非常高的综合选择性(64.2),超越了大多数报道的吸附剂,甚至与商业碳分子筛如CMS-3A (64.9) [35]和BF-CMS (69.8) [35]等相媲美,进一步表明了CuFMOF-c在CO2/CH4分离中的巨大潜力。
《3.3 固定床穿透实验及材料稳定性测试》
3.3 固定床穿透实验及材料稳定性测试
为了进一步考察材料用于CO2/CH4实际分离过程的潜力,进行了瞬时固定床穿透实验。CH4在1 min∙g-1时间内便从CuFMOF-c的吸附柱中流出,而CO2则保留到10 min∙g-1。CO2在CuFMOF-b和CuFMOF-a的吸附柱中保留时间更短,分别为7 min∙g-1和5 min∙g-1,而CH4的保留时间均不到1 min∙g-1。CuFMOF-a、CuFMOF-b和CuFMOF-c对CO2的动态吸附量分别为0.50 mmol∙g-1、0.58 mmol∙g-1和0.76 mmol∙g-1,与静态吸附测试结果较为吻合[图2(e)]。此外,通过固定床穿透实验可以获得高纯度的CH4(> 99%),CuFMOF-a、CuFMOF-b和CuFMOF-c对高纯CH4的产率分别为0.22 mmol∙g-1、0.18 mmol∙g-1和0.24 mmol∙g-1。
并且在5次固定床循环穿透实验后,CO2的动态吸附吸附量没有明显的下降[附录A中的图S5(a)~(c)],表明材料在CO2/CH4分离方面具有出色的可循环性。在穿透实验结束后,使用氦气吹扫吸附柱后得到了相应的解吸曲线[图S5(d)~(f)],表明材料可以在温和的条件下活化再生。
吸附剂的稳定性同样值得关注,为此通过热重分析(TGA)手段对材料的热稳定性进行了考察(附录A中的图S6)。CuFMOF-a、CuFMOF-b和CuFMOF-c在温度分别达到563 K、548 K和488 K之前都具有优异的热稳定性。此外,对不同条件下处理的材料进行了粉末X射线衍射(PXRD)测试(附录A中的图S7)。将MOFs浸泡在水中24 h或在空气中暴露一个月后,材料的晶型仍能保持,证实了材料具有良好的结构稳定性。
《3.4 巨正则蒙特卡洛和分子动力学模拟》
3.4 巨正则蒙特卡洛和分子动力学模拟
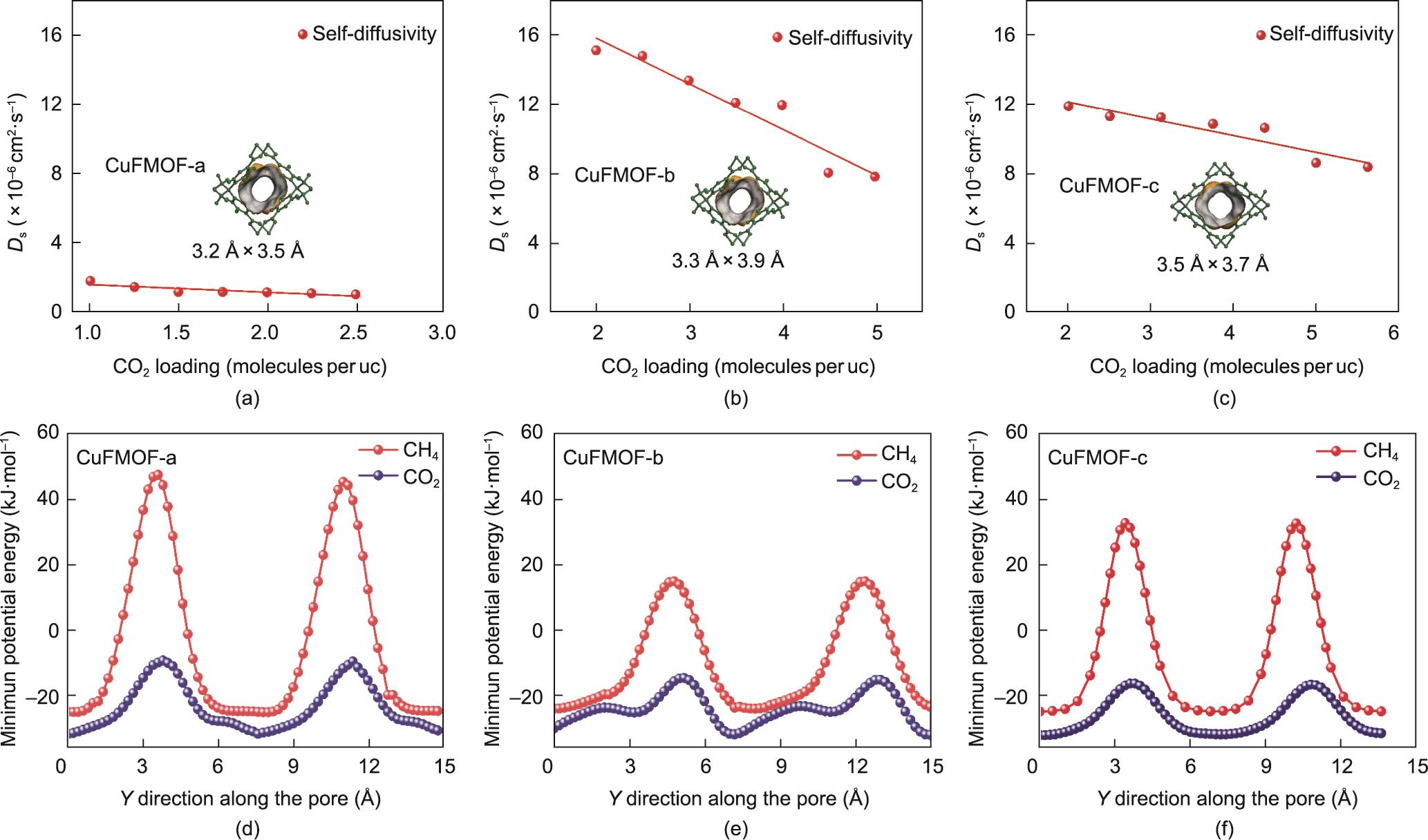
为了从结构上阐释CO2和CH4在材料的一维(1D)通道中扩散,进行了GCMC和MD模拟。GCMC模拟的吸附等温线(附录A中的图S8)与实验结果相吻合。如图3(a)~(c)所示,当每个晶胞中含有两个气体分子时,CuFMOF-a、CuFMOF-c和CuFMOF-b中CO2的自扩散系数分别为1.2 × 10‒6 cm2·s‒1、11.9 × 10‒6 cm2·s‒1和15.1 × 10‒6 cm2·s‒1,与从动力吸附测试中获得的CO2扩散速率的顺序一致。值得注意的是,随着气体分子负载量的增加,CO2的自扩散系数会减小。然而,CH4不能在纳秒时间尺度内通过MD计算所使用的相邻笼子之间的狭窄瓶颈,这与Sholl等[69]的研究结果一致。
《图3》
图3 (a)~(c)在298 K下,CO2在CuFMOF-a(a)、CuFMOF-b(b)和CuFMOF-c(c)中的自扩散。(d)~(e)CH4(红色)和CO2(蓝色)在CuFMOF-a(d)、CuFMOF-b(e)和CuFMOF-c(f)中沿着一维孔道轴向扩散的最小势能。
当一个分子沿着材料的一维通道移动时,CO2和CH4的最小势能差异[图3(d)~(f)]是导致它们扩散速率不同的内在原因。最低能量出现在宽敞的笼子中心,那里是主要容纳CH4和CO2分子的空间(附录A中的图S9)。在CuFMOF-a中,CH4和CO2的扩散能垒分别高达69.8 kJ∙mol-1和22.4 kJ∙mol-1 [图3(d)],表明气体分子在CuFMOF-a中的扩散速率很低。随着孔径的增大,在CuFMOF-c中,CH4和CO2的扩散能垒降低到55.6 kJ∙mol-1和15.4 kJ∙mol-1 [图3(f)]。至于CuFMOF-b,由于其具有最大的孔径,CH4和CO2的扩散能垒仅为38.4 kJ∙mol-1和16.7 kJ∙mol-1 [图3(e)],表明气体分子可以容易地通过通道。然而,在CuFMOF-b中CH4和CO2扩散行为的微小差异导致其CO2/CH4的动力学选择性较低。因此,CuFMOF-c具有最适合CO2和CH4动力学分离的孔径。
《3.5 密度泛函理论计算》
3.5 密度泛函理论计算
为了进一步深入了解气体分子与材料之间的相互作用,分析了当一个刚性气体分子沿着一维通道移动时,CO2和CH4在最大和最小能量位置与骨架的相互作用(图4和附录A中的图S10、图S11)。在CuFMOF-c宽敞笼状空间的中心,CO2分子与MOF骨架的相互作用主要为弱的O-‒H+偶极-偶极相互作用(C‒H…O),作用力键长为3.07~3.08 Å [图4(c)]。此外,CH4分子与富含π电子的芳香环一侧形成C‒H…π键,距离芳香环侧的距离为3.31 Å [图4(e)]。然而,在将CH4和CO2移动到沿b轴方向连接两个笼子的狭窄瓶颈时存在很大的能垒。在这个狭窄的位置,CO2被更强的C‒H…O键约束,距离范围为2.45~3.08 Å [图4(d)]。由于CH4的分子尺寸与瓶颈结构的孔径尺寸相当,CH4被4个周围对称芳香环形成的C‒H…π相互作用牢牢束缚,其键长范围为3.11~3.22 Å [图4(f)],这形成了很大的空间位阻,从而抑制了CH4的扩散。如图S10、图S11所示,类似的现象也发生在CuFMOF-a和CuFMOF-b中。这些结果与扩散能垒的计算结果一致,进一步证明了孔径调控对于扩散的重要性。
《图4》
图4 CO2分子(a)和CH4分子(b)通过一维通道扩散的示意图。CO2和CH4在CuFMOF-c中孔笼中心及瓶颈处的结合位点,对应于最低势能图中的最低点和最高点。为了方便阐述,不同连接位点的颜色不同:Cu(绿色)、F(黄色)、C(灰色)、O(红色)。
《4、 结论》
4、 结论
总而言之,本文报道了一种客体溶剂导向策略,实现了在水热合成过程中对MOFs几何结构的微调,从而在材料一维孔道瓶颈处产生了微妙的差异。得益于精巧的孔隙结构,材料实现了在宽泛的温度范围内对CO2和CH4的高效动力学分离。材料周期性收缩和扩张的孔结构可以允许CO2的进入,但严重阻碍了CH4的扩散。CuFMOF-c上实现了超高的动力选择性和平衡-动力学综合选择性,超越了大多数性能优异的吸附剂。此项工作不仅提出了调节材料结构的新策略,还进一步证实了适当的孔隙大小是高效动力分离的关键,为尺寸相当和结构相似的其他气体混合物的动力分离提供了重要参考。
CIF data for CuFMOF-a (CCDC number: 232689).
CIF data for CuFMOF-b (CCDC number: 1872560).
CIF data for CuFMOF-c (CCDC number: 2004270).
















 京公网安备 11010502051620号
京公网安备 11010502051620号




