《1、 引言》
1、 引言
莫西沙星(moxifloxacin)是第四代氟喹诺酮类广谱抗生素,被广泛应用于治疗传染性细菌疾病[1]。与其他工艺路线相比,通过脂肪酶催化对外消旋N-乙酰-哌啶-2,3-二甲酸二甲酯[cis-(±)-1]进行立体选择性拆分,从而获得合成莫西沙星的重要手性中间体(S,S)-2,8-二氮杂双环壬烷的路线(图1)更受欢迎[2‒4]。目前,市面上和学术界已经存在许多具有底物广谱性的脂肪酶,如德国Novagen公司生产的商品化脂肪酶Novozym®435和著名的南极假丝酵母来源脂肪酶B(CALB)。然而这些脂肪酶只针对特定底物具有高催化活性和高立体选择性,其应用范围受到了限制。例如,在对cis-(±)-1的催化中,这些脂肪酶的立体选择性低、酶用量大,导致生产成本增加[5‒6]。因此,在生物转化中筛选得到具有高立体选择性和高催化活性的脂肪酶是十分必要的。
《图1》
图1 脂肪酶法拆分cis-(±)-1制备莫西沙星重要手性中间体路线示意图。
之前报道了以2,3-吡啶二甲酸为初始原料,通过高压加氢、酒石酸分解等步骤的化学拆分法,以手性原料为起始材料的手性合成法,以及将手性基团加入手性试剂中的不对称合成法[2,7‒8]。然而这些方法都有共同的问题,如效率低下、原始材料价格高昂和需要使用金属催化剂等缺点。与化学拆分法相比,利用脂肪酶拆分生产(2S,3R)-N-乙酰-哌啶-2,3-二甲酸二甲酯[(2S,3R)-1]具有经济性高、选择性好、光学纯度高、副产物少、反应条件温和等优点[2]。Ramesh等[2]报道了当cis-(±)-1浓度为80 g·L-1时,40 g·L-1的液体CALB(Addzyme® CALB;5000 TBU,1 TBU表示每克固定化酶在40 oC和pH值为7.5条件下每分钟释放1 μmol丁酸)可在16 h内将底物完全拆分。近日,Shen等[9]报道了一个脂肪酶CALB的突变体(I189K),能够催化更高浓度的底物,减少了酶用量以及缩短了反应时间。具体来说,1 mol·L-1(243.26 g·L-1)的cis-(±)-1可以在5 h内被0.1 g·L-1的CALB突变体I189K完全拆分,其中突变体的比酶活为34.28 U·mg-1,为目前报道的最高值。与1 mol·L-1底物相比,更高浓度的底物2 mol·L-1(486.52 g·L-1)的水解时间需要延长到8 h,且酶用量需要提高到原来的8倍。CALB-I189K在35 ℃下的半衰期为58 h,且在50 ℃下,24 h时完全失去活性[9]。CALB突变体的热不稳定性和高底物浓度下的酶活性抑制,使得CALB突变体较难应对剧烈的工业催化环境,限制了脂肪酶CALB的大规模工业化应用。
酶工程可以被分为三大类:定向进化、半理性设计和理性设计[10‒11]。定向进化和理性设计的结合构成了半理性设计,这是一种构建“小而精”和高质量突变文库的有效策略[12‒13]。理性设计是基于对蛋白质三维结构和催化机理深入细致的了解,蛋白质的结晶体结构是必须的[14]。在之前的工作中,分析了上千种对晶体结构脂肪酶理性设计没有用的脂肪酶的晶体结构。例如,丝孢堆黑粉菌(SRL)来源的脂肪酶具有高热稳定性和pH值稳定性,在pH值为3~11时稳定性较好,72 h后残余酶活性仍超过75%,并且在60 ℃下的半衰期达到238 h [15]。另外,通过酶工程获得了许多具有优越工业特性的CALB突变体,尤其是盖子结构,该结构位于与底物结合有关的酶催化位点。值得注意的是,之前的大多数研究都集中在提高脂肪酶对各种底物的立体选择性和稳定性上[16‒19]。野生型SRL对cis-(±)-1表现出高稳定性和高立体选择性;然而,活性太低是限制因素。因此,可以利用理性设计和定点突变结合的方式对野生型脂肪酶SRL进行改造,以此获得更高酶活性的突变体,从而应用于莫西沙星关键手性中间体的工业化生产。
《2、 实验材料与方法》
2、 实验材料与方法
《2.1 质粒、菌株、化学试剂》
2.1 质粒、菌株、化学试剂
重组质粒pET22b-SRL和pPICZα-A-SRL均由之前实验构建得到[15]。克隆宿主为大肠杆菌DH5α(美国Invitrogen公司);表达宿主Pichia pastoris X-33和大肠杆菌 Rosetta(DE3)(德国Novagen公司)用于SRL及其突变体的表达。对应的抗生素ZeocinTM、对硝基苯酚、对硝基苯基(p-NP)酯(C2~C16)购自上海阿拉丁生化科技股份有限公司。其他的化学试剂均为分析级且可以通过购买获取。
《2.2 细胞培养和表达》
2.2 细胞培养和表达
大肠杆菌Rosetta(DE3)/pET22b-SRL培养在96深孔板中。首先在LB培养基(5 g·L-1酵母提取物、10 g·L-1蛋白胨、5 g·L-1酵母粉、10 g·L-1 NaCl)中,氨苄霉素(Amp)和氯霉素(Cm)抗性终浓度分别为100 mg·L-1和20 mg·L-1,按照5 μL的接种量于37 ℃下,180 r·min-1振荡培养5 h,然后加入终浓度为0.1 mmol·L-1的异丙基β-D-硫代半乳糖苷(IPTG),在22 ℃,180 r·mim-1条件下培养12 h。结束后,于4 ℃、6000 g下离心15 min收集湿菌体(型号:Eppendorf 5810R)。重组质粒pPICZα-A-SRL在毕赤酵母X-33中进行表达,培养基为含有终浓度为100 μg·mL-1 Zeocin抗性的YPD培养基(酵母提取物10 g·L-1、蛋白胨20 g·L-1、葡萄糖20 g·L-1,pH值7.0)。将该培养基置于30 ℃下培养三天,并每隔12 h添加甲醇(体积分数为1%)进行诱导。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测SRL的表达情况。
《2.3 同源建模和结构分析》
2.3 同源建模和结构分析
SRL的三级结构以CALB晶体结构1TCA为模板,利用SWISS-MODEL(https://swissmodel. expasy. org/)进行同源建模[20],并对模型进行能量优化,然后通过PROCHECK程序进行可靠性评估。采用AutoDock 4.2进行分子对接,研究分子相互作用[21]。用VMD 1.8.6对4 Å范围内的盐桥进行模拟[22]。然后用AutoDock Vina(https://vina.scripps.edu/)[23]研究SRL突变体和配体之间的相互作用,利用PyMol 2.1软件(https://www.pymol.org)进行绘图。
《2.4 高通量筛选高活性SRL突变体》
2.4 高通量筛选高活性SRL突变体
高通量筛选SRL突变体方法已在之前报道过[9]。简要步骤如下:离心后弃去96深孔板中的上清,加入400 μL Tris-HCl缓冲液(5 mmol·L-1, pH = 8.5)重悬菌体。水解反应在300 μL透明96孔板中进行,反应体系(220 μL)如下:100 μL重悬菌液、20 μL pH指示剂(0.5 mg·L-1溴百里酚蓝溶于5 mmol·L-1 Tris-HCl缓冲液,pH = 8.5)和100 μL底物溶液[100 mmol·L-1 CaCl2和20 g·L-1 (2R,3S)-1或者(2S,3R)-1溶于5 mmol·L-1 Tris-HCl缓冲液,pH = 8.5]。首先将底物溶液和pH指示剂分别加入96孔板中,再加入菌液混匀,将96孔板静置于37 ℃下,开始水解反应。通过颜色变化初步筛选具有高活性和高立体选择性的正向突变体,并进一步通过高效液相色谱(HPLC)分析验证。
《2.5 定点饱和突变和组合突变》
2.5 定点饱和突变和组合突变
利用易错聚合酶链反应(PCR)分别对脂肪酶SRL的第145、149、154、156和159号位点进行饱和突变,建立饱和突变文库。利用附录A表S1中的引物,以pPICZα-A-SRL质粒为模版,具体PCR混合体系(50 μL)为:Pfu Turbo DNA polymerase(2.5 U);dNTP混合液10 mmol·L-1;模板DNA 10 ng,2 × Pfu Buffer;剩余体系由双蒸馏水ddH2O补足。PCR程序为:98 ℃预变性1 min,1个循环;98 ℃变性30 s,61 ℃退火30 s,72 ℃延伸7 min,共三个循环;98 ℃变性30 s,61 ℃退火30 s,72 ℃延伸7 min,共三个循环;98 ℃变性30 s,61 ℃退火30 s,72 ℃延伸5 min,共15个循环;然后72 ℃总延伸5 min,1个循环。然后用Dpn I消除模板和回收后,将扩增的PCR产物连接到pET22b (+)载体中,再化转入大肠杆菌Rosetta(DE3)。正向定点饱和突变体的组合突变是通过定点饱和突变的方式得到的,另外通过DNA测序的方式对突变体进行验证。
《2.6 利用His-tag标签对脂肪酶SRL进行蛋白纯化》
2.6 利用His-tag标签对脂肪酶SRL进行蛋白纯化
脂肪酶SRL及其突变体均在2 L摇瓶中进行细胞培养(400 mL的YPD培养基、终浓度为100 μg·mL-1的博拉霉素)表达。SRL的湿菌体用离心机10 000 g、4 ℃下离心20 min得到,然后使用镍柱(5 mL, Bio-Scale Mini Nuvia™ IMAC Cartridges)进行纯化。纯化流程为:首先用缓冲液A(50 mmol·L-1磷酸钠缓冲液含0.3 mol·L-1 NaCl,pH = 8.0)平衡柱子;然后用缓冲液B(50 mmol·L-1磷酸钠缓冲液含0.3 mmol·L-1 NaCl和30 mmol·L-1咪唑,pH = 8.0)冲洗层析柱,洗脱不带Hig-tag标签的杂蛋白;再用缓冲液C(缓冲液A加500 mmol·L-1咪唑)洗脱目的蛋白;最后将纯化后的酶放在20 mmol·L-1的磷酸钠缓冲溶液(pH = 7.0)中进行透析,结束后放在-80 ℃冰箱保存备用。纯化后的酶通过SDS-PAGE进行跑胶验证,并用BCA蛋白测定试剂盒(江苏凯基生物技术股份有限公司)进行蛋白含量检测。
《2.7 酶活性测定方法》
2.7 酶活性测定方法
通过酶催化50 mmol·L-1的cis-(±)-1底物,水解成(2R,3S)-1的反应速率,计算酶活性。反应体系(1 mL)如下:磷酸钠缓冲液(100 mmol·L-1, pH = 7.0),50 mmol·L-1的底物cis-(±)-1,10 μg纯酶,于35 ℃,800 r·min-1条件下反应30 min,加入30 μL、6 mol·L-1 HCl终止反应,取500 μL反应液用1 mL乙酸乙酯萃取,取200 μL有机相在25 ℃下挥干,再加入1 mL流动相进行溶解和一定量无水硫酸钠进行干燥。用HPLC检测转化率及立体选择性。酶活单位(U)定义为:在pH = 7.0、35 ℃条件下,每分钟水解1 μmol (2R,3S)-1所需酶量定义为一个酶活单位。
《2.8 脂肪酶SRL及其突变体的表征》
2.8 脂肪酶SRL及其突变体的表征
(1)pH值和温度对酶活性和稳定性的影响。考察了不同pH值(5.0~10.0)和不同反应温度(35~60 ℃)对SRL及其突变体酶活性和稳定性的影响。其中所有的不同pH值缓冲液的浓度均为100 mmol·L-1,包括柠檬酸钠缓冲液(pH = 5.0、5.5和6.0)、磷酸钠缓冲液(pH = 6.0、6.5、7.0、7.5和8.0)、Tris-HCl缓冲液(pH = 8.0、8.5和9.0)和碳酸氢钠缓冲液(pH = 9.0、9.5和10.0)。以cis-(±)-1为底物,反应温度为35 ℃。将纯酶置于不同pH值的缓冲液(100 mmol·L-1, pH = 5.0~10.0)中,在35 ℃保温3 h后,检测残余酶活性,以未进行温浴的脂肪酶酶活性作为对照,设定为100%。另外用磷酸钠缓冲液(100 mmol·L-1, pH = 7.0)进行温度稳定性分析。将纯酶置于磷酸钠缓冲液(100 mmol·L-1, pH = 6.0)50 ℃下保温0~96 h,定时取样,在35 ℃下测定残余酶活性,检测最佳SRL正向突变体在60 ℃下的温度稳定性。
(2)动力学参数测定。纯酶的动力学参数通过以cis-(±)-1为底物,按照酶活性测定方法,测定不同底物浓度(2~200 mmol·L-1)下的初始反应速率得到。采用OriginPro 8.0软件中米氏常数方程式进行非线性拟合,得到动力学参数米氏常数Km和最大反应速率Vmax,再根据酶浓度(E),利用公式计算得到酶的转化数kcat。
(3)圆二色谱分析稳定性。进一步考察了温度对SRL及其突变体稳定性的影响,利用圆二色光谱仪ChirascanTM V100(英国Applied Photophysics公司)测定SRL及其突变体在不同温度下二级结构的变化。将检测纯酶置于磷酸钠缓冲液(20 mmol·L-1, pH = 7.0),蛋白浓度为0.1 mg·mL-1,在30~90 ℃的温度范围内以1 ℃·min-1的速率升温,收集180~260 nm波长范围内的圆二色光谱数据,采用Global 3分析软件进行数据处理及分析。
《2.9 高效液相色谱法检测产量》
2.9 高效液相色谱法检测产量
高效液相色谱仪为日本Shimadzu UFLC系统,搭配SPD-20A UV检测器。检测条件[15]为:手性色谱柱Chiralpak® IG(ϕ4.6 × 250 mm, 5 μm;日本Daicel公司);流动相为正己烷与乙醇的混合液(二者体积比为6∶4),流速为1.0 mL·min-1,检测波长为220 nm,柱温为30 ℃,进样量为10 μL。在上述检测条件下(2R,3S)-1和(2S,3R)-1保留时间分别为11.6 min和14.7 min。对所有的样品均检测两次。
《2.10 SRL及其突变体拆分-(±)-1实验》
2.10 SRL及其突变体拆分-(±)-1实验
考察SRL及其突变体拆分cis-(±)-1的能力以及底物浓度对拆分进程的影响。反应体系(30 mL)如下:100 mmol·L-1、pH = 7.0的磷酸钠缓冲液中含有1.0 mol·L-1、1.5 mol·L-1、2.0 mol·L-1底物cis-(±)-1,0.1 g·L-1的纯酶,于35 ℃下进行反应,反应过程中通过自动流加2 mol·L-1 NaOH以维持反应体系的pH值(为7.0),定时取样,HPLC测定转化率及立体选择性。
《2.11 约束分子动力学模拟》
2.11 约束分子动力学模拟
根据Cai等[12]给出的方法对野生型SRL及其突变体进行分子动力学模拟。使用GROMACS软件5.1版本[24]和Amber99SB-ILDN力场[25],在323 K下进行20 ns的模拟。所有系统均溶解在三点水模型(TIP3P)中,将距每个脂肪酶边缘的最小距离设为1 nm,并加入生理浓度(154 mmol·L-1)的氯化钠溶液以中和该系统。能量最小化并达到平衡后,在等温-等压条件下(35 ℃、1 bar)对每个系统进行了20 ns的模拟,积分步长为0.002 ps。使用GROMACS软件计算均方根偏差(RMSD)及其他参数,研究酶的热稳定性。
《2.12 数据统计与分析》
2.12 数据统计与分析
通过Excel 2011(美国微软公司)进行数据统计和分析;通过SAS程序8.1版本进行方差分析。所有酶实验的测定和分析均不少于三次。
《3、 结果与讨论》
3、 结果与讨论
《3.1 野生型SRL和CALB的结构比较》
3.1 野生型SRL和CALB的结构比较
基于结构模拟分析,并通过理性设计提高酶的热稳定性和催化活性是一种常用的蛋白质改造方法。然而,蛋白质的晶体结构复杂且需要耗费大量时间去获得和分析[14]。数据库中蛋白质信息的大规模扩增,是一种免费而有价值的资源,可以用来满足蛋白质工程领域的研究人员对蛋白质结构预测的需求[26]。首先,对野生型SRL和CALB进行结构比较研究,以了解SRL的结构与功能关系,用于后期用来提高SRL酶活性的酶工程。
SRL的三维结构模型是以Uppenberg等[27]解析得到的CALB晶体结构(PDB: 1TCA)为模板进行模拟得到的,其中SRL氨基酸序列与CALB具有较高的序列一致性,达到了73.5%。SRL的三维结构模型如图2和图3所示,可以分析并确定SRL的催化三联体为D192-H230-S110,氧阴离子孔由T46和Q111构成,另外还有三对二硫键(C28—C70、C222—C264、C299—C317),这些功能结构与CALB保持一致。SRL具有典型的α/β水解酶折叠结构,具有由α螺旋包围的9条β链组成的中心β折叠。总的来看,SRL与CALB在催化功能上具有很高的相似性,然而关键结构域存在明显差异,也可能导致催化活性的差异。SRL和CALB对底物cis-(±)-1的酶活性分别为0.04 U·mL-1和0.12 U·mL-1。
《图2》
图2 脂肪酶SRL三维结构模型图。(a)同源模型SRL(青色)和CALB(1TCA,灰色)的结构覆盖。SRL中的催化三元组Ser110-Asp192-His230用洋红色表示,氧阴离子孔(T46和Q111)用黄色表示,SRL中的环6用橙色表示,α10用绿色表示。(b)和(c)分别代表预测的SRL和CALB的分子表面。
《图3》
图3 CALB和野生型SRL(SRL_WT)之间的氨基酸序列比对。基于先前报道的CALB结构(PDB: 1TCA; CALB_1TCA)描述了二级结构元素和残基。催化三联体(SRL中的S110、D192和H230)用红星表示,氧阴离子孔(SRL的T46和Q111)用绿色圆圈表示,三对二硫键(SRL内的C28—C70、C222—C264和C299—C317)分别编号为1、2和3。SRL中环6(144~157)和螺旋α10(283~293)中的残基封闭在蓝色方框中。SRL中含有SSM的残基(L145、L149、L154、S156和V159),用蓝色三角形表示。使用ESPript在线软件进行排列对齐。
在前期对CALB的突变研究中,构建了189和190位点的单点饱和突变文库,其中酶活性最高的正向突变体CALB-I189K的比酶活是野生型CALB的286倍[9]。基于CALB与SRL的序列和结构的相似性,假设在对SRL的194和195位点进行突变会有类似的影响。对SRL相应的位点I194和V195进行定点突变,构建突变体SRL-I194A、SRL-I194R、SRL-I194K、SRL-I194N/V195L、SRL-I194H/V195L和SRL-I194Y/V195L。如表1所示,6个突变体与野生型SRL相比对底物cis-(±)-1催化活性都有不同程度的提高,并且都保持严格的立体选择性。其中最优突变体SRL-I194N/V195L的比酶活达到10.20 U·mg-1,是野生型SRL的255倍;但突变体SRL-I189N/V190L的催化活性仅为CALB-I189K的1/3,还具有很大的改造潜力。其余突变体的比酶活与CALB对应的突变体相比都明显降低[9]。有趣的是,相应的氨基酸残基的突变对SRL酶活性影响与对CALB酶活性影响相比具有较大的差异,呈现不同的规律。例如,CALB最优突变体CALB-I189K与野生型相比,比酶活提高286倍;而SRL-I194K比酶活仅为0.72 U·mg-1,与野生型相比,比酶活仅提高18倍。Cen等[28]报道了一种具有Cys-His-Asp催化三联体的高活性半胱氨酸脂肪酶。此外,其他的突变,如W104V/ A281Y/A282Y/V149G,可以在4-硝基苯酯水解中表现出比野生型CALB高40倍的催化效率,并且耐受高浓度底物。Stauch等[29]报道了CALB结构(PDB: 5A71)中的两个独立的蛋白单体A和B。在单体B中的氨基酸残基Leu140~Leu147中,发生了显著的构象变化,形成了一个未展开的环。在SRL的相应区域,构象被预测为一个环,该区域位于活性口袋的入口,作为一个盖子,控制底物的进入和产物的释放。因此,环6中的氨基酸残基可能对SRL的催化活性有显著的影响,为进一步的蛋白质工程提供了方向。
《3.2 基于理性设计和组合突变的SRL的位点饱和突变》
3.2 基于理性设计和组合突变的SRL的位点饱和突变
尽管在环6的氨基酸残基已缩小到了14个,但是进一步利用在线服务网站HotSpot Wizard进行蛋白质热点分析(见附录A中的图S1),缩小突变文库[30]。首先以SRL-I194N/V195L(V6)为模板,选择了L145、L149、L154/S156和V159位点进行定点饱和突变。从4个构建的饱和突变文库中筛选出1600个突变体,在L145位点和L154/S156位点分别有两个和三个正向突变,经初筛和复筛得到正向突变株,并经基因测序验证分析,去除重复突变(见表2和附录A中的图S2)。结果表明,L149和V159位点没有筛选得到正向突变体。突变体V7、V8、V10和V11分别是L145N、L145V、L154G和S156H的三位点突变体,而V9是四位点突变体。通过比色筛选法比较酶活性,其中三位点突变体V10的酶活性最高,甚至高于四位点突变体V9,说明突变L154G的显著性意义。此外,突变体V7(L145N)和V8(L145V)的比酶活均高于突变体V11(S156H)。另外基于亲本V6(SRL-I194N/ V195L)构建了L145N和L154G(V12)以及L145V和L154G(V13)的组合突变体。突变体V7~V13用于后续的酶学性质研究。
《表2》
表2 纯化的野生型SRL及其突变体的比活性、对映体选择性和动力学参数
| Methodology | Lipase | Mutation | Spec EA (U·mg-1) | Rel EA (%) | |||||
|---|---|---|---|---|---|---|---|---|---|
| Rational design | V0 | wild-type | 0.04 ± 0.10 | 100 | > 200 | ND | ND | ND | ND |
| V6 | I194N/V195L | 10.20 ± 0.10 | 25 500 | > 200 | 386.7 ± 74.7 | 63.0 ± 9.6 | 2175.0 ± 330.6 | 5.6 | |
| SSM | V7 | I194N/V195L/L145N | 21.50 ± 0.20 | 53 750 | > 200 | 231.9 ± 29.5 | 101.2 ± 9.0 | 3493.7 ± 311.2 | 15.0 |
| V8 | I194N/V195L/L145V | 27.00 ± 0.60 | 67 500 | > 200 | 183.0 ± 21.7 | 122.3 ± 9.5 | 4224.2 ± 329.5 | 23.0 | |
| V9 | I194N/V195L/L154G/S156H | 28.20 ± 0.30 | 70 500 | > 200 | 191.2 ± 20.4 | 125.5 ± 8.6 | 4506.8 ± 321.1 | 23.6 | |
| V10 | I194N/V195L/L154G | 30.30 ± 0.20 | 75 750 | > 200 | 133.5 ± 17.7 | 101.4 ± 8.1 | 3503.7 ± 279.8 | 26.2 | |
| V11 | I194N/V195L/S156H | 11.30 ± 0.20 | 28 250 | > 200 | 362.2 ± 43.1 | 67.1 ± 8.3 | 2249.3 ± 310.4 | 6.2 | |
| Combinatorial mutagenesis | V12 | I194N/V195L/L145N/L154G | 55.40 ± 4.20 | 138 500 | > 200 | 150.2 ± 20.6 | 180.7 ± 15.4 | 6240.3 ± 531.6 | 41.5 |
| V13 | I194N/V195L/L145V/L154G | 87.80 ± 6.20 | 219 500 | > 200 | 95.5 ± 13.0 | 238.4 ± 17.4 | 8233.3 ± 602.0 | 86.2 |
《3.3 SRL及其突变体的酶学性质表征》
3.3 SRL及其突变体的酶学性质表征
《3.3.1. 酶活性检测》
3.3.1. 酶活性检测
通过高效液相色谱检测野生型SRL(V0)和对应的8个突变体(V6, V7~V13)纯酶对底物cis-(±)-1的水解活性及立体选择性(见附录A中的图S3和图S4)。如表2所示,三位点突变体V7(SRL-I194N/V195L/L145N)和V8(SRL-I194N/V195L/L145V)比酶活分别达到21.5 U·mg-1和27.0 U·mg-1,是V6(SRL-I194N/V195L)的2.1倍和2.6倍;V10(I194N/V195L/L154G)的比酶活是三位点突变体中最高的,达到30.3 U·mg-1,是V6(SRL-I194N/V195L)的三倍、野生型V0的757倍。为了更好地分析,对四位点突变体V13(SRL-I194N/V195L/L145V/L154G)进行研究,结果表明该突变体对底物cis-(±)-1的比酶活达到87.8 U·mg-1,是V6的8.6倍、野生型V0的2195倍、CALB-I189K(34.3 U·mg-1)的2.6倍[9]。突变体V11(S156H)与亲本V6具有相似的酶活性,而L154G号位点的另一个突变体V9却比V11的活性更高。对四位点突变体(V13)和三位点突变体(V8)的酶活性进行对比,结果表明V13的比酶活比V8提高3.3倍。进一步比较V11和V9、V13和V8,发现154位点残基对于酶活性具有重要意义。所有SRL突变体均对底物cis-(±)-1具有严格的立体选择性,对应选择性大于200。
《3.3.2. 动力学参数》
3.3.2. 动力学参数
SRL突变体的动力学参数如表2所示。由于野生型SRL的酶活性极低,因此无法测定其动力学参数。结果表明SRL突变体对底物cis-(±)-1的亲和力与野生型SRL明显不同,这与194位点和195位点的氨基酸残基突变有关。这两个位点位于底物结合口袋,与底物直接接触。从Km值观察,突变体V13对底物cis-(±)-1的亲和力是最强的,V13(SRL-I194N/V195L/L145V/L154G)的Vmax明显提高,由V6(SRL-I194N/V195L)的63.0 μmol·(mg·min)-1提高至238.4 μmol·(mg·min)-1,其转化数kcat是亲本的3.8倍。kcat/Km的数值体现了酶的催化效率,最优突变体V13(SRL-I194N/V195L/L145V/L154G)的kcat/Km值分别是亲本V6(SRL-I194N/V195L)的15.4倍,是CALB最优突变体CALB-I189K的1.4倍。而突变体V9和V11包括S156位点突变,对酶活性的增强没有显著影响,因此,本研究没有对V9和V11进行进一步的实验。
《3.3.3. pH值和温度对突变体活性及稳定性的影响》
3.3.3. pH值和温度对突变体活性及稳定性的影响
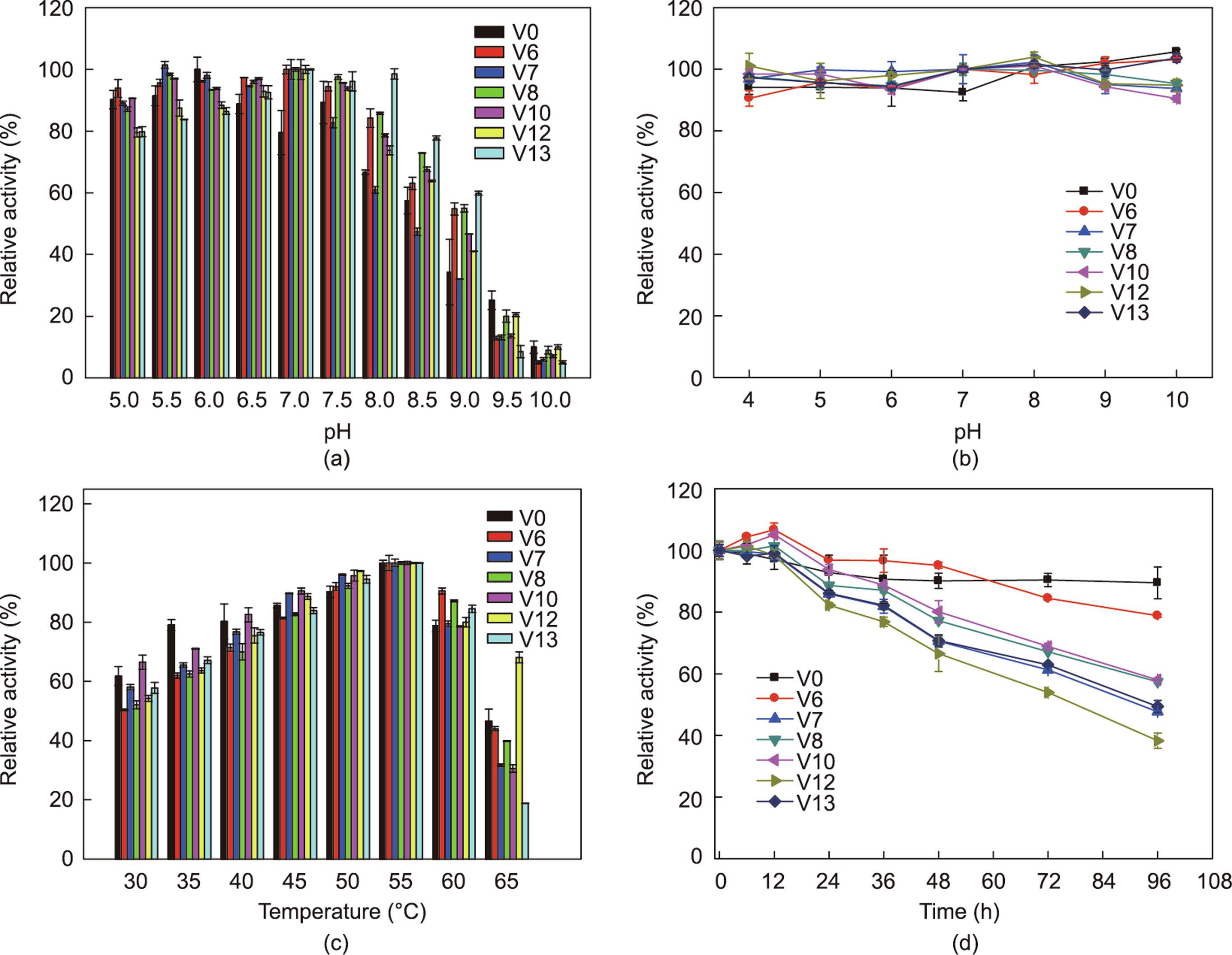
由于突变体表面的整体电荷变化,突变体的最佳温度和pH值也会发生变化[9,12]。因此必须在35 ℃的不同pH值缓冲液(pH = 5~10)中确定温度和pH值对SRL突变体活性和稳定性的影响。在35 ℃反应温度下,测定不同pH值(5~10)缓冲溶液中野生型SRL及其突变体的催化活性,得出最适pH值。所有SRL突变体的最适pH值都由5.5变化到7.0 [图4(a)]。许多微生物脂肪酶具有耐热性(在温度高于70 ℃时具有最佳活性)和碱稳定性(在pH值大于9时具有最佳活性)[31],而SRL及其突变体表现出独特的酸稳定性。基于CALB突变体,在底物结合口袋进行酶工程改造后,最适pH值向碱性环境发生了迁移[9]。而通过引入极性氨基酸,在194位点的天冬酰胺和195位点的亮氨酸,可能会改变活性口袋附近的静电势。除突变体V6(SRL-I194N/V195L)外,其余突变体的催化反应pH值适应范围相比野生型SRL更宽,其中最优突变体V13(SRL-I194N/V195L/L145V/L154G)在pH = 5.0~9.0时具有60%以上的相对活性。对SRL及其突变体的pH值稳定性考察结果如图4(b)所示,SRL及突变体在pH = 4.0~10.0时具有极好的稳定性;在不同pH值下,35 ℃保温6 h后,保留90%以上的初始酶活性,说明在194、195、145、154位点引入突变点对SRL高pH值稳定性的特性影响不大。
《图4》
图4 pH值和温度对SRL(V0)及其变体(V6、V7、V8、V10、V12、V13)的酶活性和稳定性的影响。(a)pH值对酶活性的影响;(b)野生型SRL和突变体的pH值稳定性;(c)温度对酶活性的影响;(d)野生型SRL和变体在50 ℃下的热稳定性。
所有突变体的最适温度均与野生型SRL一致,为55 ℃ [图4(c)]。当反应温度上升到65 ℃时,除了突变体V12(I194N/V195L/L145N/L154G),其余所有突变体的催化活性均有所下降。在温度稳定性方面,所有突变体的温度稳定性与野生型SRL相比都有所降低。当在50 ℃、pH = 7.0的磷酸钠缓冲液中温浴96 h后,野生型SRL保留90%左右的初始酶活性,半衰期达到597.5 h;突变体V6(SRL-I194N/V195L)能够保留40%左右的初始酶活性,半衰期下降为249.3 h。而引入更多的氨基酸突变的突变体V7、V8、V10、V13的半衰期更短,分别为91.8 h、115.1 h、110.2 h、92.5 h [图4(d)]。另外考察了突变体V13(SRL-I194N/V195L/L145V/L154G)在60 ℃下的稳定性,在60 ℃下酶活性下降明显,保温9 h后保留23%左右的初始酶活性,半衰期仅为4.1 h(见附录A中的图S5)。与CALB突变体相比,突变体I189R的最适反应温度从45 ℃下降到40 ℃ [9],而SRL突变体保持了与野生型SRL相同的温度。综合以上结果发现,突变点的引入能够明显提高酶的催化活性,但是对酶的热稳定性有较大的影响,酶活性与稳定性处于一个此消彼长的动态平衡中。
《3.3.4. 热稳定性分析》
3.3.4. 热稳定性分析
为了进一步分析突变对SRL热稳定性的影响,对SRL及其突变体进行了圆二色谱分析。如图5所示,在192 nm波长附近的正值肩峰谱带以及在222 nm和208 nm波长处的两个负值肩峰谱带是蛋白质的α螺旋结构的特征肩峰谱带[32]。野生型SRL在30~60 ℃下α螺旋结构没有明显变化,而所有突变体在温度升高的过程中结构有较大的变形,α螺旋结构明显减少。如图5(d)所示,野生型SRL的Tm值为74.3 ℃,而突变体V6的Tm值下降了10 ℃,为63.5 ℃(图6)。这一结果与V6的热稳定性一致,说明I194N和V195L两个突变对所有突变体的热稳定性有较大的影响。而在145位点和154位点(V7、V8、V10、V12和V13)引入更多突变后,Tm值比V6的Tm值降低了约2 ℃;然而,三位点(V7、V8、V10)和四位点(V12、V13)突变体具有相似的Tm值。
《图5》
图5 野生型SRL及其突变体在30 ℃(a)、40 ℃(b)、50 ℃(c)和60 ℃(d)上的圆二色谱图。
《图6》
图6 野生型SRL及其突变体的热稳定性曲线。
《3.4 SRL及四位点突变体V13催化拆分-(±)-1》
3.4 SRL及四位点突变体V13催化拆分-(±)-1
为了验证最优突变体V13(SRL-I194N/V195L/L145V/L154G)水解拆分cis-(±)-1的能力,考察了野生型SRL和突变体V13(SRL-I194N/V195L/L145V/L154G)对1.0~2.0 mol·L-1的底物cis-(±)-1的反应进程(图7)。突变体V13(SRL-I194N/V195L/L145V/L154G)的反应速率非常快,2 h后转化率达到49.9%,E > 200,明显高于突变体CALB-I189K的反应速率,突变体CALB-I189K需要反应5 h转化率才能达到49.9% [9]。而野生型SRL在反应2 h后,转化率仅为0.2% [图7(a)]。根据Xu等[16]的结论,认为CALB结合口袋189位点和190位点的氨基酸残基具有立体选择性意义,4种突变体可以合成所有可能的立体异构体。四位点突变体V13(SRL-I194N/V195L/L145V/L154G)不仅明显提高了SRL在高浓度底物下的催化效率,而且保留了SRL的严格立体选择性。另外,继续考察了突变体V13(SRL-I194N/V195L/L145V/L154G)的催化反应进程。如图7(b)所示,在保持用酶量为0.1 g·L-1不变的情况下,将底物浓度提高至1.5 mol·L-1后,反应6 h,转化率达到49.9%,继续提高底物浓度至2 mol·L-1,水解反应前期速率基本与底物浓度为1 mol·L-1时保持一致。随着反应的进行,水解速率逐渐降低,反应进行20 h时,转化率达到49.7%。因此可以推测与CALB突变体类似,高底物浓度对酶的结构具有破坏作用,但是突变体V13相比于突变体CALB-I189K具有更高的催化活性及底物耐受能力,这可能与突变体V13具有更高的结构稳定性有关[9]。上述结果表明突变体V13同时具备了高催化活性、高立体选择性和高稳定性的特点,是工业化拆分cis-(±)-1理想的生物催化剂。
《图7》
图7 使用野生型SRL和四位点突变体V13(SRL-I194N/V195L/L145V/L154G)纯酶催化cis-(±)-1的催化曲线。(a)1 mol∙L-1底物与野生型SRL(0.1 g∙L-1)和V13(SRL-I194N/V195L/L145V/L154G)(0.1 g∙L-1);(b)1.0~2.0 mol∙L-1底物V13(SRL-I194N/V195L/L145V/L154G)(0.1 g∙L-1)。反应于35 ℃下进行,反应过程中通过自动流加2 mol∙L-1 NaOH维持反应体系的pH值(为7.0)。
《3.5 SRL及其突变体的分子模拟分析》
3.5 SRL及其突变体的分子模拟分析
以CALB晶体结构1TCA为模型,通过Modeller 9.18同源建模,分别构建了野生型SRL和突变体V6、V8、V10和V13的三维结构模型。如附录A中的图S6所示,在分子动力学模拟过程中,RMSD反应了蛋白质结构中碳骨架在整个模拟过程中的振动情况,研究发现SRL及其突变体在分子动力学模拟进行到5 ns后基本处于平衡状态,表明酶分子在溶剂盒子中处于稳定状态,可以用于后续的分析。
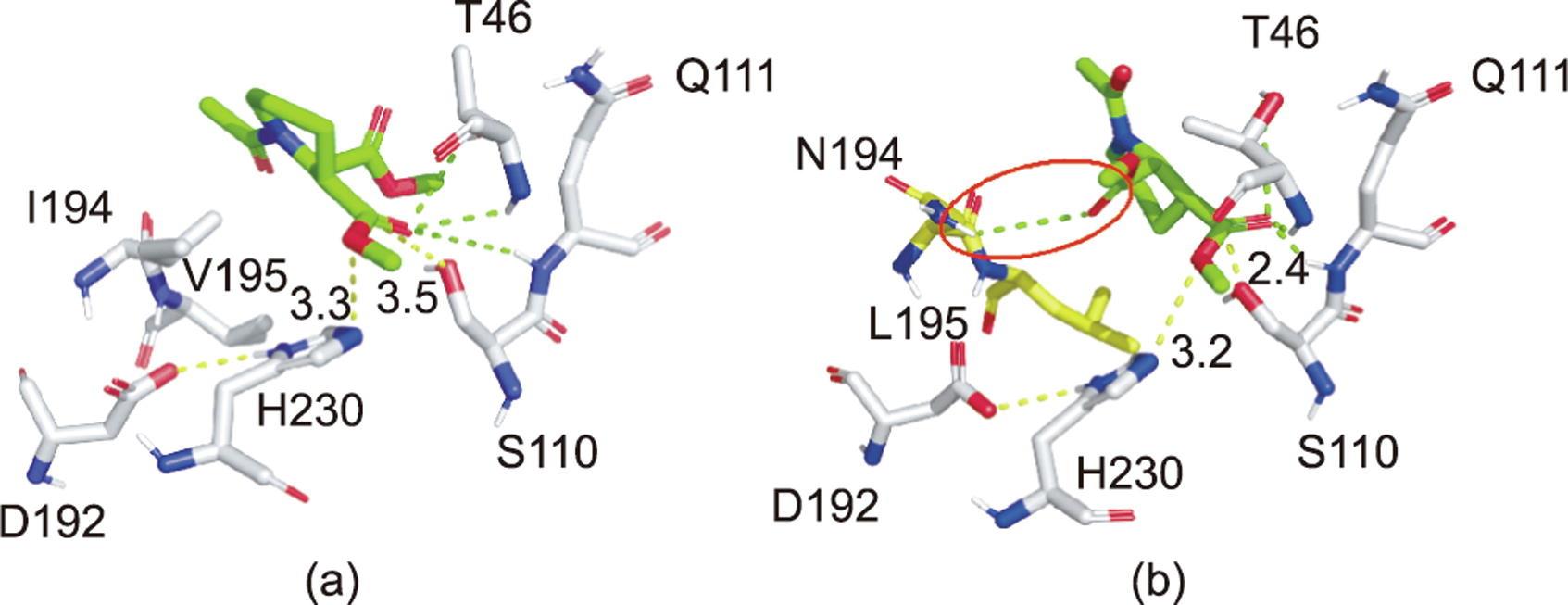
突变体SRL-I194N/V195L(V6)催化活性口袋的形状与野生型SRL(V0)相比发生变化,底物在催化活性口袋中的结合位置上发生移动。突变体V6和野生型SRL的催化口袋形状也有所不同。CALB的催化机理从20世纪90年代开始得到解释,直到2010年以后酶分子晶体结构研究才取得了重要进展[33]。在CALB中,通过将处于194位的具有较大空间位阻和疏水性的异亮氨酸残基突变为具有较小空间位阻和亲水性的天冬酰胺残基,不仅降低了与底物分子结合的阻碍,而且在N194的酰氨基与底物2号位酯键的酰基形成氢键,从而对底物产生一个明显的固定作用力,使得底物分子在催化活性口袋中处于更容易被水解的状态。这主要体现在催化亲核进攻的S110的氧原子与底物酰基碳原子之间的距离r(O—C)以及H230的氮原子与底物醇基氧之间的距离r(N—O)。如图8(a)、(b)所示,突变体V6中r(O—C)和r(N—O)的距离是酶活性提升的原因。Stauch等[29]在CALB 5A71中报道了类似的结果。r(O—C)距离的缩短有利于四面体过渡态的形成和来自110位丝氨酸残基中氧阴离子对底物(2R,3S)-1的亲核攻击。底物酰基氧与氧阴离子空穴之间的距离越短,越有利于形成氢键,越能够使使底物稳定地形成四面体过渡态,越有利于催化反应。
《图8》
图8 (2R,3S)-1(绿色)与野生型SRL(a)和突变体SRL-I194N/V195L(b)的活性位点的分子对接模拟图。催化三联体D192-H230-S110用红色表示,氧阴离子孔用蓝色表示,野生型CALB中的残基用橙色表示(I194、V195),突变后的残基用黄色表示。对于氧阴离子的相互作用和稳定的H键用绿色虚线表示。在(2R,3S)-1的碳基功能上,催化三联体中丝氨酸的有效亲核攻击的距离用黄色虚线标记。
如图9所示,对于突变体SRL-I194N/V195L/L145V(V8)、SRL-I194N/V195L/L154(V10)和GSRL-I194N/V195L/L145V/L154G(V13)催化活性的进一步提升,推测可能与脂肪酶盖子结构的移动相关。一般脂肪酶催化过程中存在“界面激活”作用[34‒35],然而由α5螺旋构成的CALB盖子结构较小,且与酯酶相似,能够水解很多水溶性底物,因此CALB一直被认为缺乏“界面激活”作用[36]。但是近期研究人员发现和证明了CALB的α5螺旋盖子结构具有很大的柔性,在催化过程中会发生惊人的构象变化[37]。Zhou等[29,36]通过长时间分子动力学模拟发现,α5螺旋上的D145与β8片层上R309之间形成的盐桥相互作用,以及α5螺旋上的疏水性残基L144、L147与α6螺旋上的W155之间的疏水相互作用能够稳定盖子结构处于“打开”状态,而α5螺旋上疏水性残基P143、L144、L147和V149与α10螺旋上疏水性残基V286和K290的疏水性侧链之间的相互作用使得盖子结构处于“关闭”状态。另外,α12螺旋上A282,L278和I189所在环区之间的疏水性相互作用会增强α6与α10螺旋之间的疏水作用。与CALB相比,SRL的螺旋盖子区域具有更开放的构象;因此,在β8薄片上形成含有氨基酸R314的盐桥是很困难的。假设V13中145位点和154位点的突变残基位于灵活的环6上,亮氨酸分别变为缬氨酸和甘氨酸,那么环6和α10螺旋上的氨基酸残基为配体的结合提供了合适的碰撞。
《图9》
图9 (2R,3S)-1(绿色)与SRL突变体的活性位点的分子对接模拟图。(a)SRL-I194N/V195L(V6);(b)SRL-I194N/V195L/L145V (V8);(c)SRL-I194N/V195L/L154G(V10);(d)SRL-I194N/V195L/L145V/L154G(V13)。催化三联体D192-H230-S110用红色表示,氧阴离子孔用蓝色表示,残留物N194和L195用黄色表示,环6用紫色表示,α10螺旋用橙色表示,α7螺旋用黄色表示。SRL-I194N/V195L中的残基为灰色(L145、L154),突变的残基为青色。相互作用和氧阴离子稳定的H键用灰色虚线表示。V291和L149的距离用黑色虚线标记。
《4、 总结与展望》
4、 总结与展望
本研究通过定点饱和突变、定点突变和组合突变等方法,以增强SRL对cis-(±)-1的酶活性,达到87.81 U·mg-1。并揭示了位于SRL的145和154位点的两个关键氨基酸残基的相关盖子构象,并确定在环6的底物结合口袋附件,两个关键氨基酸残基的适当改变可以改变盖子结构的状态,从而增强酶活性。本文以脂肪酶法立体选择性拆分制备莫西沙星手性中间体为目标,得到了可用于工业化生产的的脂肪酶,并对酶活性相关的关键氨基酸进行了研究。可以通过进一步的工作,如结晶,对SRL及其突变体进行更深入的结构见解,并开发固定化技术,以增强稳定性、可重复使用性,使得后续产品更容易分离,以达到工业化应用水平。




















 京公网安备 11010502051620号
京公网安备 11010502051620号




