《1、 引言》
1、 引言
Rett综合征是一种进行性神经发育障碍,主要发生在女性儿童中,发病率为1/15 000~1/10 000。大多数患有Rett综合征的儿童寿命较短,且伴随着一系列症状,如语言能力低下、生长迟缓、自主活动能力下降、共济失调、严重的社交障碍和手部刻板动作等[1]。目前,由于缺乏有效的治疗方法来改善患者的认知和行为,Rett综合征的有效治疗面临巨大的挑战。使用脑源性神经营养因子(BDNF)或胰岛素样生长因子1(IGF-1)可以缓解Rett综合征的一些症状,然而,这些药物面临是否可以有效地跨越血脑屏障的问题[2‒4]。有研究采用物理治疗手段,如海马穹窿深部脑电刺激(DBS)[5]和深部脑磁刺激(DMS)[6],可以缓解Rett综合征模型小鼠的症状。DMS可促进海马神经发生和突触的可塑性,增强海马神经元活性。在Rett小鼠模型中,DMS可以缓解焦虑相关行为,显著延长小鼠的寿命[6]。DBS可以恢复Rett模型小鼠的活体海马新生神经元的发生,增强条件恐惧记忆和空间记忆能力。然而,DBS是一种介入性操作,需要外科手术和精确定位。此外,DBS对Rett模型小鼠的社会行为、运动能力、运动协调能力和生长发育未表现出较好的改善作用[5]。
针灸是中国传统医学中的治疗手段,通过用针灸针对特定穴位进行刺激治疗疾病。针灸被世界各国广泛地应用于缓解疼痛。而且,针灸还可用于治疗其他疾病,包括运动障碍、压力性尿失禁和免疫炎症性疾病[7‒10]。电针刺激(EAS)是一种利用电针装置输出脉冲电流,作用于中医穴位和经络来加强刺激的技术。EAS可通过受体或神经递质介导的免疫反应,发挥很好的镇痛和抗炎作用[11‒12]。EAS还可以通过刺激神经营养因子和神经递质的表达来改善神经退行性疾病(如阿尔茨海默病和帕金森病)的记忆和运动行为能力[13‒15]。有研究报道,EAS通过上调催产素(OXT)和精氨酸加压素(AVP)水平——这两种激素与哺乳动物社会行为密切相关,能改善孤独症儿童和实验大鼠的社交行为[16‒17]。然而,EAS是否可以用于治疗其他神经发育性疾病仍然不清楚。在这项工作中,我们用EAS治疗Rett模型大鼠,并研究了社交激素、功能蛋白的表达、大脑不同区域的神经活动和行为,从而揭示EAS激活的大脑区域与相关行为变化之间的关系,以及EAS对Rett模型大鼠行为能力的恢复作用。
《2、 实验部分》
2、 实验部分
根据以前的研究[18],制备4~5周龄雄性Mecp2-/y和野生型(WT)SD大鼠。雄性大鼠Rett综合征的典型症状出现相对较早,如存活时间短、运动能力下降和社交能力下降。因此,在本研究中,选用雄性Mecp2-/y Rett综合征模型大鼠,其同龄雄性WT大鼠被用作对照。将大鼠轻轻固定在大鼠固定器中[见附录A中的图S1(a)],让其脚伸直并用医用胶带固定。使用电刺激仪(苏州医疗器械厂Hwato SDZ-V神经和肌肉刺激器),以脉冲宽度为0.2 ms、频率为2 Hz:10 Hz [疏波:密集波,见附录A中的图S1(b)]的疏密波对大鼠穴位进行电针刺激。根据参考文献[19‒20],将针灸针(长13 mm,直径为0.25 mm)插入神门穴(HT 7)、涌泉穴(KI 1)和百会穴(GV 20),针刺深度为3 mm。电针刺激双侧HT 7和KI 1,GV 20留针处理。Mecp2-/y大鼠和WT大鼠每次刺激20 min,每周电针刺激6次,连续4周。对照组的WT和Mecp2-/y大鼠也被轻轻固定在大鼠固定器中,不进行电针刺激。
在条件恐惧记忆测试的前一周,参考之前的方法进行旷场实验、滚轮测试[19,21]和三箱社交[22]行为测试。在每次实验之前,将大鼠放到行为测试室适应至少30 min。详细的实验细节见附录A。检测完行为数据后,进行大鼠解剖,取大鼠脑组织,使用冷冻切片机制备厚度为40 μm脑片(Leica CM1950, Leica Biosystems, Germany)[24]。室温下脑切片在含0.25% Triton X-100的5%牛血清蛋白(BSA)中孵育1 h [5]。然后,将切片与抗c-Fos多克隆抗体(ab190289,兔抗,1:5000;Abcam,英国)或神经元前体细胞的微管相关蛋白抗体(Doublecortin,DCX;4604S,兔多克隆抗体1:400;Cell Signaling Technology,美国)和5-溴-2´-脱氧尿苷抗体(BrdU;小鼠单克隆,5292S,1:140;Cell Signaling Technology,美国)在4 ℃下共孵育24 h。次日,清洗脑片后,脑片与二抗(ab150077和ab150116,Alexa Fluor 488和594,1:500;Abcam)在室温下共孵育2 h,然后用4´, 6-二氨基-2-苯基吲哚(DAPI;1:1000,碧云天生物技术有限公司,中国)对细胞核进行15 min复染。使用共焦显微镜(Leica Microsystems,德国)获取图像,并通过Image J软件进行分析。
《3、 结果与讨论》
3、 结果与讨论
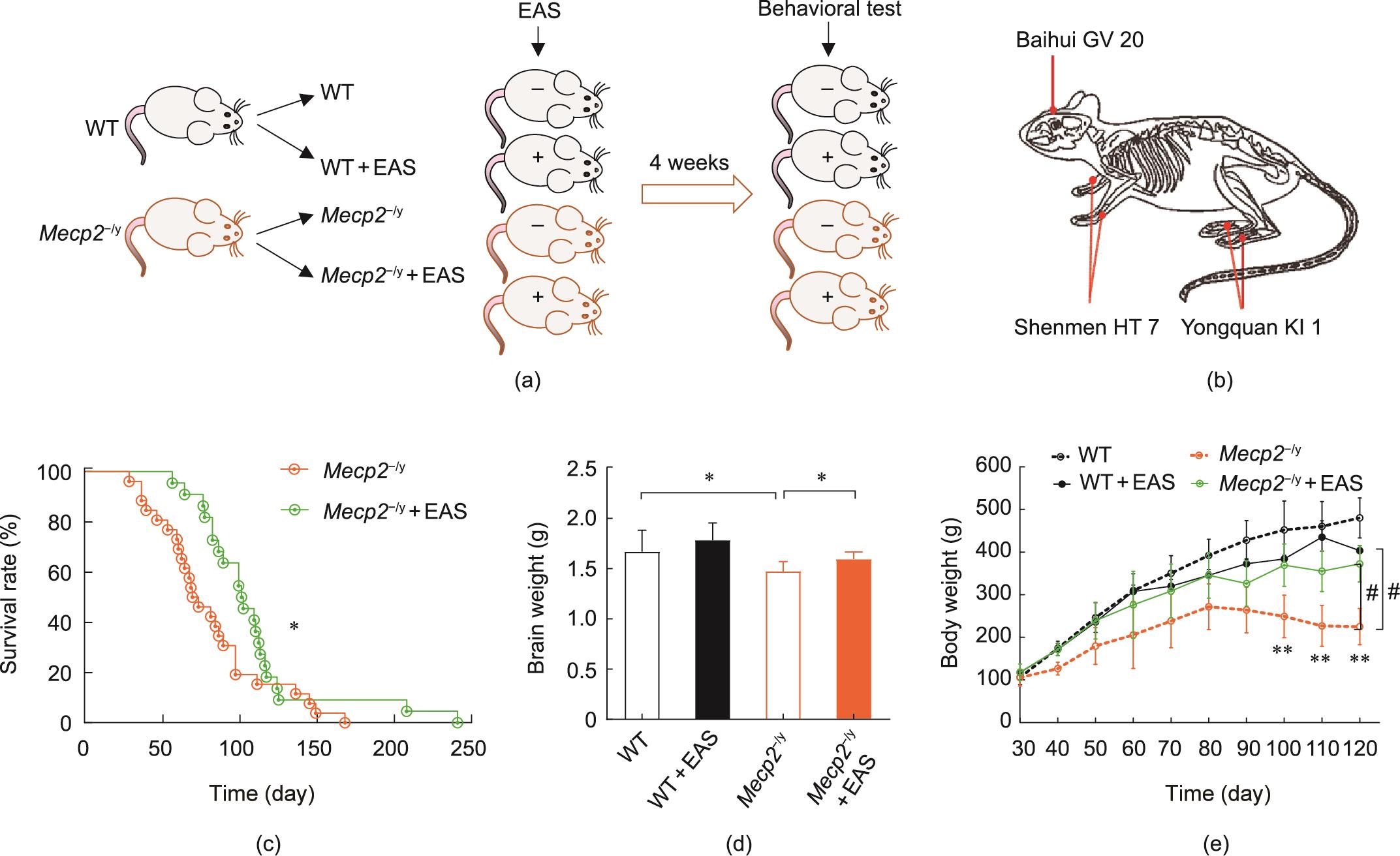
我们首先研究了EAS是否可以延长Rett大鼠的生存期,因为大多数Rett儿童的特点是生存期比较短[1]。中枢神经系统神经元甲基CpG结合蛋白2(MeCP2)缺乏可导致啮齿动物出现Rett样表型[1,25]。因此,使用具有Mecp2基因突变(Mecp2-/y)的4~5周龄大鼠在神门(HT 7)、涌泉(KI 1)和百会(GV 20)穴位进行电针刺激(Mecp2/y+EAS)治疗,每天20 min,持续4周[图1(a)和(b)以及图S1(b)]。根据之前的方法对穴位进行定位[19‒20]。此外,用4~5周龄的同窝雄性WT和Mecp2-/y大鼠作为对照,除了不进行EAS外,进行相同的处理。值得一提的是,EAS治疗的Mecp2/y大鼠的生存期(中位生存期:102天)比Mecp2/y大鼠(中位生存期:71天)延长了近44% [图1(c)]。即EAS使Mecp2/y大鼠的中位生存期提高到102天,EAS处理的Mecp2/y大鼠的最长生存时间可达到240天。生长迟缓也是Mecp2/y的一个典型的病理学特征,导致体重和脑重量降低。我们发现,穴位EAS还增加了Mecp2/y大鼠的体重和脑重量[图1(d)和(e)]。在30日龄时,WT大鼠[(106.25±17.65) g]和Mecp2/y大鼠[(105.33±19.50) g]的体重没有差异。到60日龄时,Mecp2/y大鼠的体重[(205.7±78.6) g]增长比WT大鼠[(309.6±39.6) g]慢,EAS处理的Mecp2/y大鼠的体重[(276.3±78.6) g]明显高于Mecp2/y大鼠。120日龄时,Mecp2/y大鼠的体重[(225.0±42.5) g]不及WT大鼠[(480.3±46.7) g]体重的一半,WT组和Mecp2/y组之间存在显著差异(P < 0.01)。然而,EAS处理的Mecp2/y大鼠的体重比Mecp2/y大鼠增加了近60%,表明EAS改善了Mecp2/y大鼠的生长发育。
《图1》
图1 EAS可增加Mecp2-/y大鼠的生存期和体重。(a)实验设计流程图;(b)穴位的选择和定位;(c)Mecp2-/y大鼠的生存期(n = 26;中位生存期:71天)和EAS治疗的Mecp2-/y大鼠的生存期(n = 22;中位生存期:102天)(long-rank test, *P < 0.05, **P < 0.01);(d)脑重量(WT, n = 10; WT+EAS, n = 10; Mecp2-/y, n = 9; Mecp2-/y+EAS, n = 10),单因素方差分析(ANOVA; Bonferroni’s post-hoc)检验(*P < 0.05, **P < 0.01);(e)体重[平均值±标准误(SEM);* 与WT组相比,P < 0.05,** P < 0.01;# 与Mecp2-/y组相比,P < 0.05,## P < 0.01]。
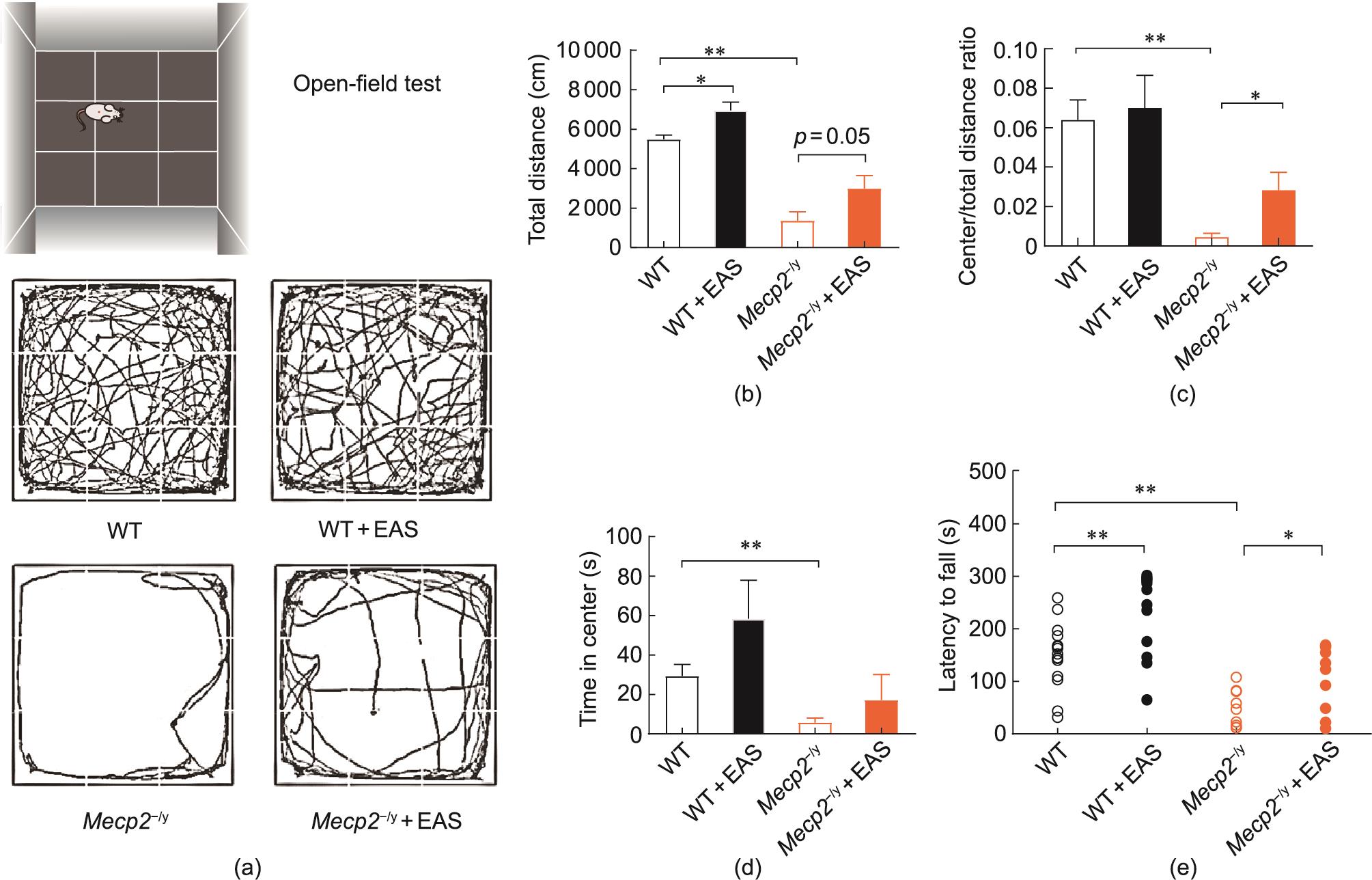
接下来,我们在Mecp2/y大鼠中通过旷场试验观察了EAS对运动活动的影响,并通过滚轮试验观察了EAS对运动协调能力的影响。先对Mecp2/y和WT大鼠进行10 min的旷场试验,用红外相机记录其运动轨迹。具有焦虑样行为的大鼠在中心的探索行为的时间会更少,行走距离更短[26]。如图2(a)~(d)所示,Mecp2/y大鼠在试验中的行走距离[(1363.0±447.6) cm]短于WT大鼠[(5482.0±214.1) cm] [图2(a)和(b)]。同时,Mecp2/y大鼠在中央区停留的时间较短[(5.78±2.27) s]、中央区距离/总距离的比率[图2(c)和(d)]小于WT大鼠[(29.32±5.99) s],表明Mecp2/y大鼠的运动能力下降,出现焦虑样行为。与Mecp2/y大鼠相比,EAS处理的Mecp2/y大鼠在旷场试验中行走的距离更长[(2989.0±668.1) cm],在中央停留的时间更长[(17.15±13.04) s]。因此,EAS改善了Mecp2/y大鼠的自主活动,主要表现为增加了总活动距离,尤其是增加了在中心区域的距离和时间。
《图2》
图2 EAS改善Mecp2-/y大鼠的运动和运动协调能力。(a)旷场试验中的活动痕迹;(b)在旷场试验中行走的总距离;(c)旷场试验中央区距离与总距之比;(d)旷场试验中央区的时间;(e)滚轮测试中大鼠掉落的潜伏期。所有数据均以平均值±SEM表示。WT,n = 10;WT+EAS,n = 10;Mecp2-/y,n = 9;Mecp2-/y+EAS,n = 10;单因素方差分析(Bonferroni’s post hoc)检验,*P < 0.05,**P < 0.01。
我们进一步测试了EAS对Mecp2/y大鼠运动协调能力的影响,将Mecp2/y和WT大鼠放置在转棒疲劳仪(5~40 r·min-1)的旋转棒上,并根据参考文献中的程序记录大鼠掉落的潜伏期[27]。如图2(e)所示,我们发现Mecp2/y大鼠从杆上掉落的潜伏期[(48.80±11.89) s]减少为WT大鼠的三分之一左右[(149.7±15.93) s]。而EAS治疗的Mecp2/y大鼠的潜伏期[(108.8±19.54) s]是Mecp2/y大鼠的两倍以上。同时,EAS处理的WT大鼠的潜伏期[(238.7±20.59) s]也明显高于未进行处理的WT大鼠。结果表明,EAS还能改善Mecp2/y大鼠的运动协调能力。
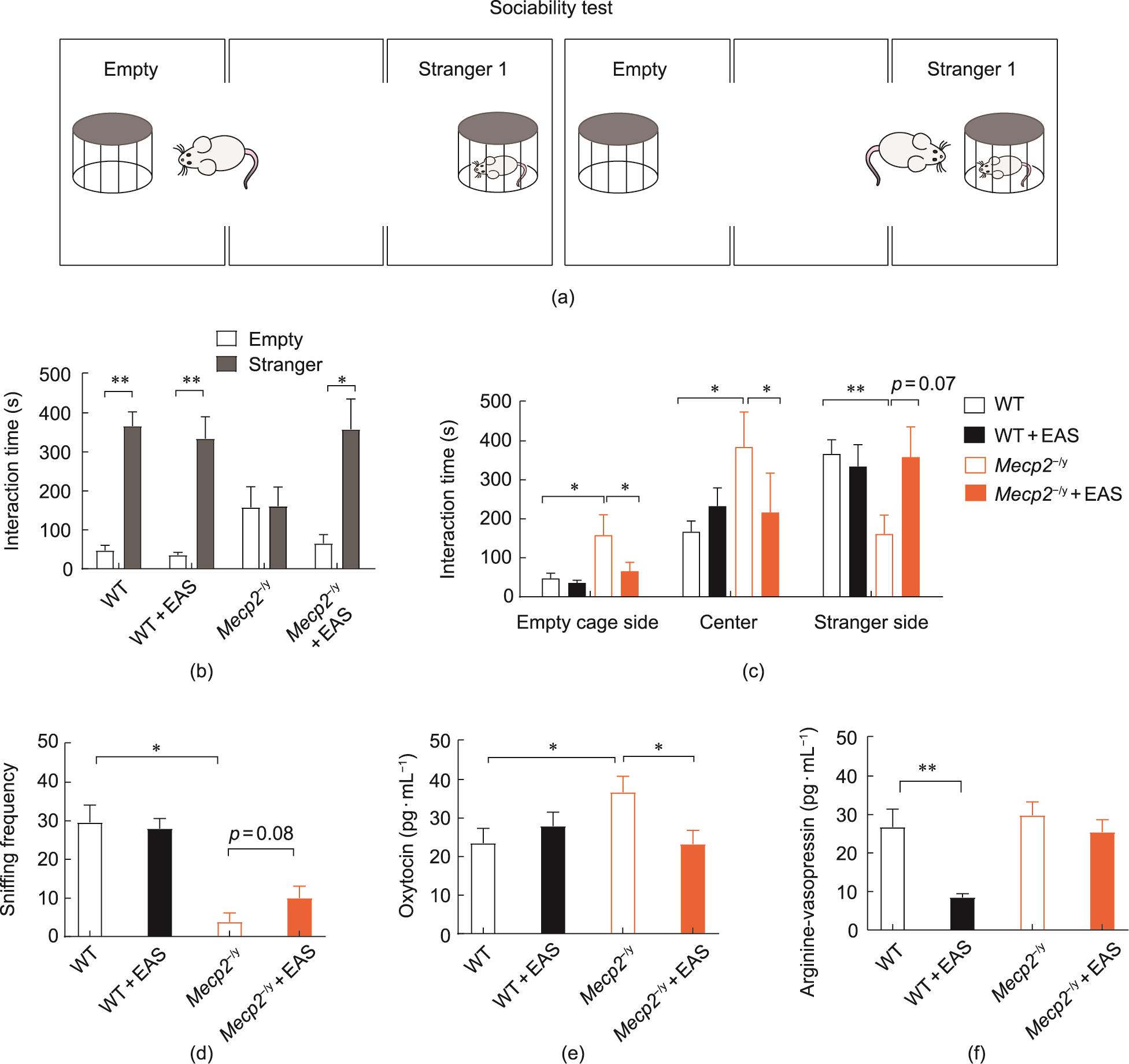
通过三箱社交试验,观察EAS是否会改善Mecp2/y大鼠的社交行为[22,28]。在环境适应阶段,将WT或Mecp2/y大鼠放置在三箱装置的中间室中,并在左右室的角落配备两个带栅栏的社交笼[图3(a)]。让老鼠自由探索10 min。接下来,一只陌生的老鼠被放在左侧的笼子里,而右侧的笼子仍然是空的,记录大鼠在每个室的停留时间和嗅闻次数。如图3(b)~(d)所示,WT大鼠在有陌生大鼠的活动室中花费的时间[(366.6±36.5) s]比在空的一侧花费的时间[(47.4±13.1) s]更多。然而Mecp2/y大鼠则更倾向于在中央室[(384.2±90.1) s]或空笼那边[(158.2±52.6) s]活动。Mecp2/y大鼠与不熟悉的大鼠的交流时间[(160.9±48.8) s]显著短于WT大鼠,对陌生大鼠的嗅闻频率(3.8±2.4)也显著低于WT组大鼠(29.6±4.5, P<0.05)。经过EAS处理的Mecp2/y大鼠和不熟悉的大鼠相互交流的时间[(358.3±78.0) s, P = 0.07]延长,相互交流频次(10.0±3.1, P = 0.08)也出现增加。这些结果表明,EAS能提高Mecp2/y大鼠的社交能力。然而,EAS对Mecp2/y大鼠的社交新奇性的偏好[附录A中的图S2(b)和(c)]没有明显的影响。
《图3》
图3 EAS可改善Mecp2-/y大鼠的社交行为。(a)三箱社交试验示意图;(b)与空白侧和陌生大鼠侧的交流时间(*P < 0.05,**P < 0.01;双侧t检验);(c)三箱社交试验中不同室中的相互交流时间;(d)与陌生大鼠的嗅闻频次(Kruskal-Wallis试验,*P < 0.05,**P < 0.01);(e)血清催产素水平;(f)血清精氨酸加压素水平。(c)、(e)、(f)单因素方差分析(Bonferroni’s post hoc)检验(*P < 0.05,**P < 0.01)。所有数据均以平均值±SEM表示。WT, n = 10; WT+EAS, n = 10; Mecp2-/y, n = 9; Mecp2-/y+EAS, n = 10。
中枢神经系统中的某些神经递质在调节哺乳动物的社会行为中起着重要作用。例如,加压素(AVP)和催产素(OXT)与自闭症谱系障碍患者的社会行为和认知密切相关[24,29‒30]。在之前的一项研究中发现,自闭症儿童的AVP和OXT水平较低[29‒30]。也有其他研究表明,血浆中高水平的OXT会导致焦虑和社交恐惧症。而在Mecp2/y大鼠中,我们发现Mecp2/y大鼠的OXT水平[(36.68±4.15) pg·mL-1]高于WT大鼠[(23.51±3.82)pg·mL-1; P<0.05]。经过EAS治疗的Mecp2/y大鼠血清OXT水平[(23.25±3.56) pg∙mL-1; P<0.05]则明显低于Mecp2/y大鼠[图3(e)]。WT大鼠和Mecp2/y大鼠的AVP水平没有明显差异,但EAS显著降低了WT大鼠的AVP水平,而对Mecp2/y大鼠的AVP水平没有明显的影响[图3(f)]。
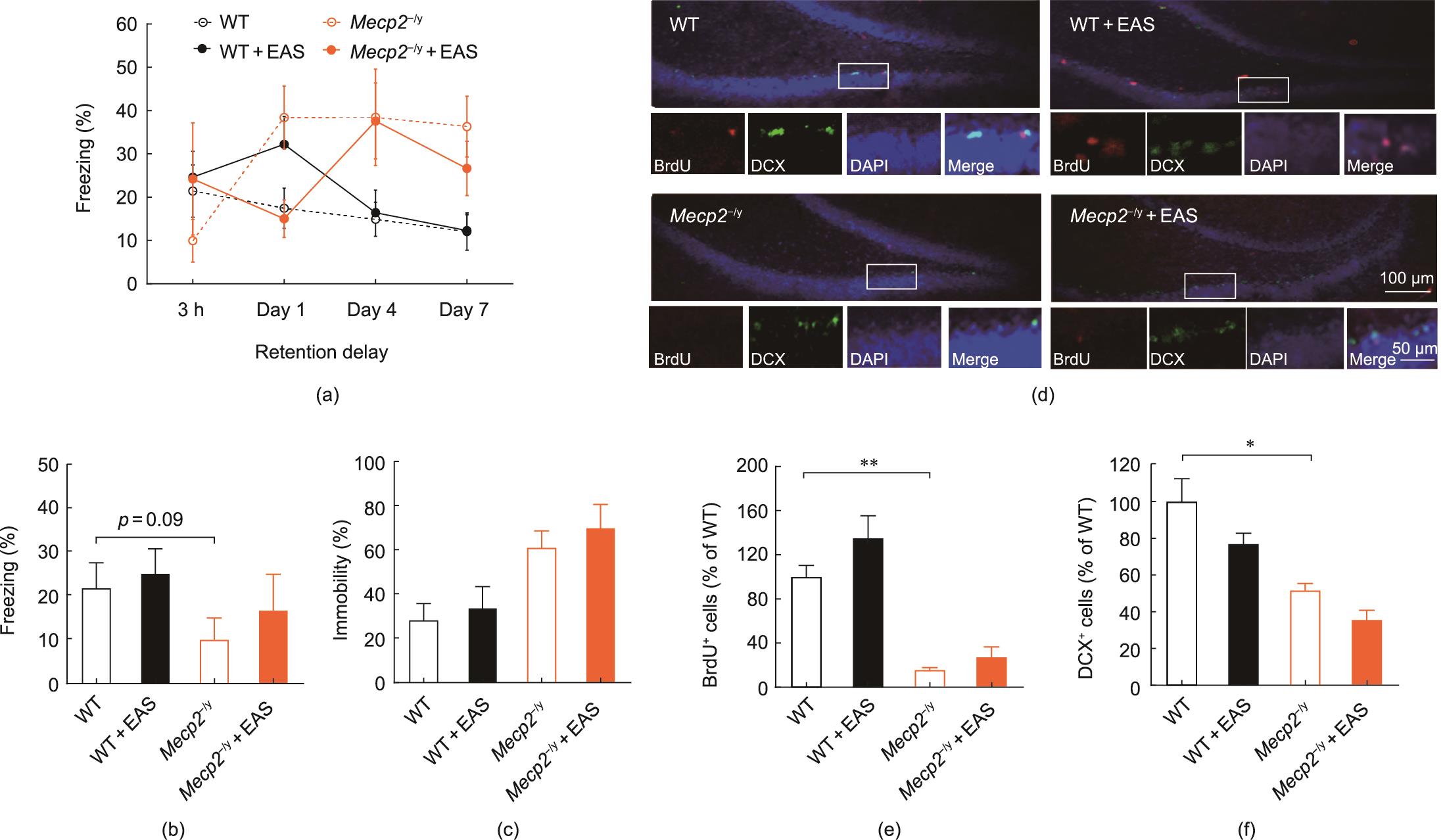
为了研究EAS是否会改善记忆能力,我们将老鼠放在条件恐惧箱中,以测试它们的条件恐惧记忆。EAS轻度增强了3 h的场景恐惧记忆(3 h: WT, 21.41%±6.04%; WT+EAS, 24.65%±5.94%; Mecp2-/y, 9.96%±4.92%; Mecp2-/y+EAS, 16.71%±8.11%)和条件恐惧记忆(3 h: WT, 28.03%±7.45%; WT+EAS, 33.08%±7.24%; Mecp2-/y, 0.77%±7.85%;Mecp2-/y+EAS, 69.39%±11.17%)。但在WT和Mecp2-/y大鼠中,治疗组和未治疗组之间没有显著的统计学差异[图4(a)~(c)]。由于海马是负责记忆的主要脑区,我们进一步计数脑部海马部位BrdU(标记新生细胞)和DCX(标记未成熟神经元)的阳性细胞,研究EAS对新生海马神经元的影响。在WT和WT+EAS组之间,或Mecp2-/y和Mecp2-/y+EAS组之间,BrdU+和DCX+细胞的数量没有明显变化[图4(d)~(f)和附录A中的图S3],表明EAS对Mecp2-/y大鼠的海马神经发生没有明显的作用。
《图4》
图4 EAS不能改善WT和Mecp2-/y大鼠的海马神经发生或条件恐惧记忆。(a)EAS对不同时间组恐惧记忆的影响;(b)3 h时场景恐惧记忆;(c)3 h条件恐惧记忆;(d)低倍(顶部;比例尺,100 μm)和高倍(底部;比例尺,50 μm)下BrdU和DCX细胞的免疫荧光图像,显示各组的BrdU+细胞(红色)、DCX+细胞(绿色)和融合(黄色);(e)BrdU+细胞数;(f)DCX+细胞的数量。所有数据均以平均值±SEM表示。(a)~(c)WT, n = 10; WT+EAS, n = 10; Mecp2-/y, n = 9; Mecp2-/y+EAS, n = 10。(d)~(f)n = 6。单因素方差分析(Bonferroni’s post hoc)检验,*P < 0.05,**P < 0.01。
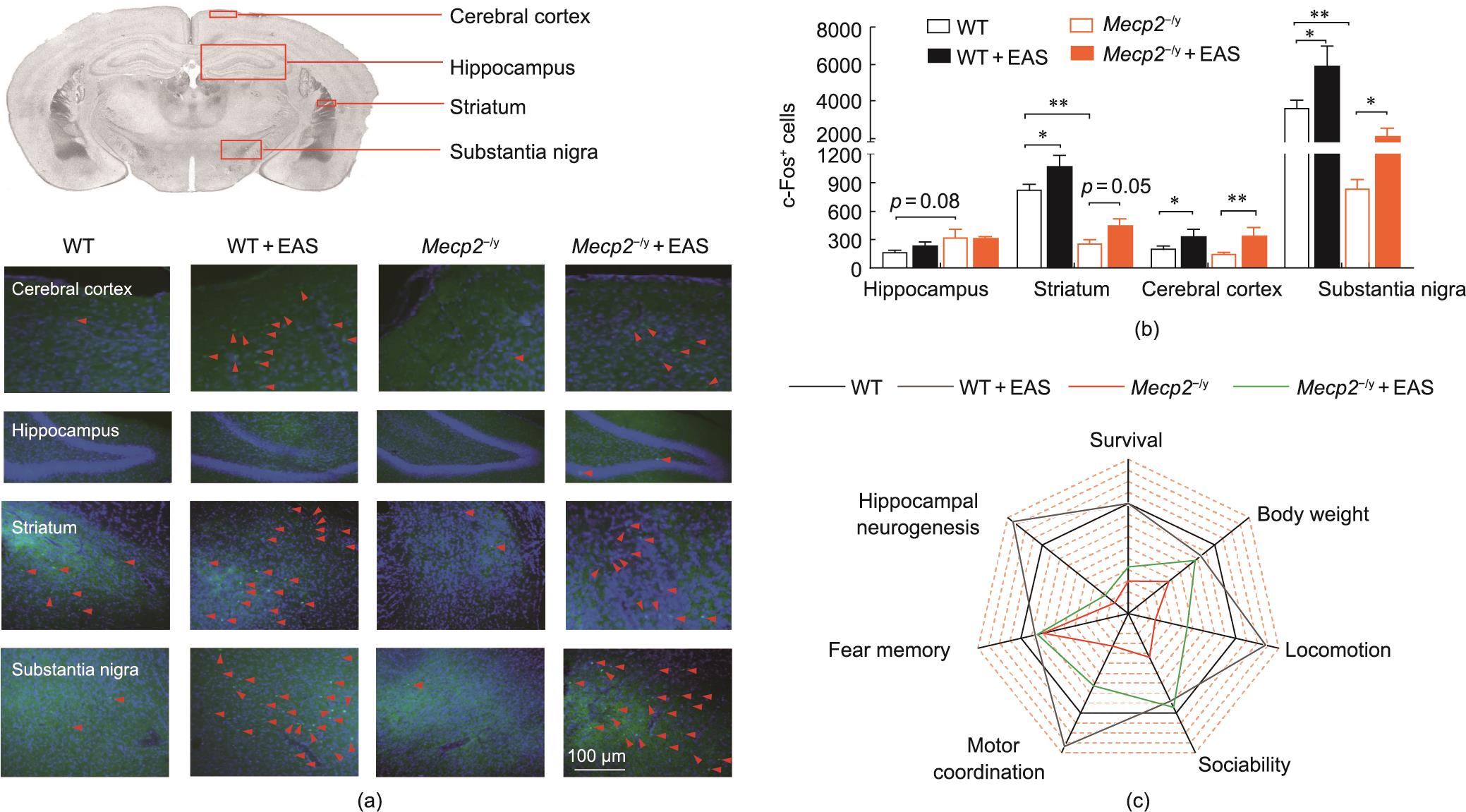
为了进一步研究EAS如何改善社会行为和运动功能,我们检测了脑部不同脑区c-Fos蛋白的表达以观察各脑区的激活情况。c-Fos蛋白是神经元激活的标志蛋白,在各种刺激下可以增强其蛋白表达,包括物理、化学和非致病性环境条件刺激等[32‒35]。我们通过量化免疫荧光图像中的c-Fos+细胞来评估大脑的激活[图5(a)和(b)、附录A中的图S4(a)~(d)]。与WT和Mecp2-/y大鼠(WT; 209.7±27.1; Mecp2-/y; 154.7±18.2)相比,EAS处理的WT和EAS处理的Mecp2-/y大鼠大脑皮层的c-Fos+细胞数量显著增加(WT+EAS; 336.7±78.9; Mecp2-/y+EAS, 336.3±96.2)。在纹状体脑区,EAS治疗组(WT+EAS, 1070.0±113.1; Mecp2-/y+EAS, 444.80±73.18)的WT或Mecp2-/y大鼠的c-Fos+细胞显著高于EAS未治疗组(WT, 825.7±51.2; Mecp2-/y, 273.20±34.09)。中脑黑质部位也得到了类似的结果(WT, 3551.0±408.7; WT+EAS, 5818±1044; Mecp2-/y, 839.5±93.1; Mecp2-/y+EAS, 2021.0±443.8)。这些结果表明,EAS可以促进大脑皮层、纹状体和中脑黑质的脑区神经元激活。然而,在海马区域,EAS并没有导致c-Fos+细胞数量的增加(WT, 177.0±17.6; WT+EAS, 244.7±28.3; Mecp2-/y, 329.00±78.85; Mecp2-/y+EAS, 323.3±10.9),这表明EAS刺激并没有引起海马部位的激活,海马作为记忆主要功能区没有反应,因此EAS没有出现显著的改善记忆的作用。
《图5》
图5 EAS诱导大脑皮层、海马、纹状体和黑质的神经元激活情况。(a)大脑皮质、海马、纹状体和黑质中c-Fos的免疫荧光图像;(b)海马、纹状体、大脑皮层和黑质中的c-Fos+细胞计数;(c)行为能力图。所有数据均以平均值±SEM表示。n = 6,单因素方差分析(Bonferroni’s post hoc)检验,*P < 0.05,**P < 0.01。
Rett综合征作为一种儿童进行性神经发育障碍,会出现包括语言退化在内的一系列症状,如视力低下、生长迟缓、自主活动能力下降、共济失调、严重的社交障碍以及手部的刻板动作等[1]。Mecp2基因突变的小鼠和大鼠表现出了Rett综合征的特征性症状[21,36‒38]。在本研究中,我们研究了EAS针刺对Mecp2-/y大鼠病理症状的影响。大鼠和小鼠会因为缺乏MeCP2而出现寿命显著缩短[3,18],在我们的实验也观察到了这一点。我们发现,特定穴位(HT 7、KI 1和GV 20)的EAS显著改善了Mecp2-/y大鼠的运动能力、运动协调能力和社交行为能力[图5(c)]。特别是使Mecp2-/y大鼠的中位生存期延长了44%。Mecp2-/y大鼠的中位生存期仅为71天。而经过EAS治疗的Mecp2-/y大鼠,中位生存期提高至102天,最长生存期为240天,表明EAS确实对Rett综合征大鼠模型产生了积极的作用。EAS为治疗Rett综合征提供了一种安全有效的方法,无需考虑手术或血脑屏障等问题。
EAS是一种电刺激,将针灸针插入远离中枢神经系统(即大脑和脊髓)的穴位,某些穴位的刺激效应可以在体内长距离传导,引起大脑的特定区域出现反应。相比于DBS,EAS是治疗脑部疾病的一种安全的方法,因为它不会因手术对大脑造成直接损伤。此外,EAS的远端操作大大降低了脑部手术不准确操作的错误概率,使EAS的普及成为可能。最重要的是,EAS对行为能力的显著改善和寿命的延长,使其成为Rett综合征治疗的有效手段。我们发现EAS通过激活相关的大脑区域来改善运动功能和社交行为。c-Fos被作为神经元激活的标志,因为其表达通常对各种物理、化学和非致病性环境条件刺激作出反应[32‒35]。EAS增加了WT和Mecp2-/y大鼠与运动、社会行为相关区域的大脑激活,包括大脑皮层、纹体和中脑黑质。
然而,使用单一的治疗策略来缓解Rett综合征的所有症状是一个巨大的挑战,我们发现EAS对恐惧记忆的作用并不明显。EAS刺激后,海马区c-Fos表达仅有低水平的增加、海马区激活不明显,是EAS 没有明显改善记忆能力的主要原因。众所周知,海马是记忆的主要功能区,而纹状体和黑质是运动的主要功能区[24,35],这很好地解释了为什么EAS改善了社交和运动能力,而不是记忆力。在之前的一项研究中,在Rett模型小鼠脑穹窿部位植入电极,对Rett小鼠进行电刺激,可以恢复条件恐惧记忆和空间记忆。然而,它并没有改善其他行为能力,如Rett小鼠的运动能力、运动协调能力、社交行为能力和体重[5]。根据DBS和EAS的作用特点,DBS与EAS联合应用可能改善Rett综合征大鼠的社交、运动和记忆能力。此外,为了使恢复Rett综合征病理改变的作用更明显,选择更多的穴位也值得进一步研究。
《4、 结论与展望》
4、 结论与展望
总之,特定穴位(HT 7、KI 1和GV 20)的EAS显著改善Mecp2-/y大鼠的运动能力、运动协调能力和社交行为能力。EAS增加了WT和Mecp2-/y大鼠脑区的激活,包括大脑皮层、纹状体和中脑黑质部位与运动和社会行为相关的区域。EAS为Mecp2-/y的治疗提供了一种安全有效的方法。我们还设想,EAS与其他疗法(如DBS和DMS)的结合可能会更好地改善Rett综合征大鼠的社交、运动和记忆能力。













 京公网安备 11010502051620号
京公网安备 11010502051620号




