《1 前言》
1 前言
先天性心脏病(CHD)约占出生缺陷疾病的 1/3[1] ,在足月活产新生儿中发病率为0.8 %[2] ,发病率呈逐年上升趋势,是目前婴幼儿死亡的首要原因。 CHD的病因目前认为与遗传、环境及遗传-环境因素相互作用三个方面有关。由于不同地区的生活环境和生活方式存在差异,因此在特定的区域内开展CHD的主要危险因素的研究是目前迫切而重要的任务,具有重要的临床及流行病学意义。本文采取病例对照研究的方法,研究正常妊娠妇女及CHD 胎儿母亲头发锑元素含量的相关数据及孕期环境因素暴露情况,探讨先天性心脏病与环境因素的关系,为预防CHD的发生提供依据。
《2 对象与方法》
2 对象与方法
《2.1 研究对象》
2.1 研究对象
选择2010年3月—2011年12月在福建省妇幼保健院进行产前检查并最终分娩或引产的孕妇作为研究对象。病例组的纳入标准:在福建省妇幼保健院超声心动图检查显示胎儿患有 CHD 的孕妇。 a. Ⅰ类,间隔缺损,包括房间隔缺损、室间隔缺损、房室间隔缺损、心内膜垫缺损、单心房;b. Ⅱ类,圆锥动脉干畸形,包括大动脉转位、法洛氏四联症、永存动脉干、右室双出口;c. Ⅲ类,右侧梗阻性畸形,包括肺动脉(瓣)狭窄、肺动脉闭锁、三尖瓣闭锁、右心发育不良、三尖瓣下移畸形、Ebstein’s 综合征; d. Ⅳ类,左侧梗阻性畸形,包括主动脉(瓣)狭窄、主动脉缩窄、左心发育不良(综合征)、主动脉弓离断; e. Ⅴ类,静脉回流异常,包括总的和部分的肺静脉异位引流、其他静脉回流异常;f. Ⅵ类,其他,包括心脏异位、心肌纤维化增生、右位主动脉弓、卵圆孔早闭、单心室等其他心脏结构畸形。CHD引产儿经孕妇及其家属同意后行心脏局部解剖确诊,活产儿经新生儿超声心动图检查确诊。对照组纳入标准:怀孕年龄与病例组孕妇相差不超过1岁、怀孕孕周与病例组孕妇相差不超过3周的孕妇;经超声心动图检查及专科医师评估未发现胎儿先天畸形;出生后新生儿随访至半年未发现任何先天畸形。病例组及对照组共同排除标准:双胎或多胎妊娠孕妇,患有下列基础疾病(先天性心脏病及其他遗传性疾病、糖尿病、高血压病、痛风、皮质醇增多症等)的孕妇,怀孕期间至采样时有染发、烫发等毛发处理的孕妇。若同样匹配条件的对照组孕妇超过1个,选择孕周最接近者。所有孕妇及家属需了解本项目,愿意配合本课题调查研究,并签署知情同意书。
《2.2 研究方法》
2.2 研究方法
2.2.1 样品采集
使用消毒不锈钢剪刀于调查日采集孕妇脑后枕部区域靠近发根部位的头发,长约 5~10 cm,重约2 g,封存,送交中国科学院上海营养所检测。
2.2.2 样品处理和测定
头发样本用温水浸泡10 min后用中性洗涤剂去 污,去离子水及超纯水(Sartorius 公司 Arium 61316 纯水系统处理)冲洗,置于 60 ℃烘箱 24 h 烘干;取100 μg头发样本在180 ℃下进行微波消解,后加入5 mL超纯级硝酸,置于加热板上加热至基本干燥,后用2 %硝酸稀释至2 mL,稀释后的样本4 ℃保存;通过微量雾化器进行样本采集,采用电感耦合等离子体质谱仪(美国Agilent 7500cx ICP-MS仪器)检测,内标溶液采用 SPEX CertiPrep 公司内含 33 种元素的多元素标准液,元素浓度均设定为 1 000 μg/mL。
2.2.3 问卷调查
由本课题统一培训的专业调查员对纳入本研究的孕妇进行问卷调查,填写由“973”课题中国出生缺陷监测中心、全国妇幼卫生监测办公室设计的《孕前及孕期环境与遗传因素交互作用调查表》,内容包括居住环境、不良孕史、饮食习惯等。
2.2.4 质控措施
对参与本研究的专业人员进行统一培训,严格按照纳入及排除标准选择研究对象。在头发微量元素检测方面:由专业检测机构进行检测。在问卷调查方面:在首次调查 1 个月后,随机抽取 14 名被调查对象以同样的调查表进行二次调查,由统一培训的专业人员进行双人平行录入数据并进行逻辑检错。
2.2.5 统计学分析
使用Epidata 3.1软件双向平行数据录入,并进行逻辑检错,使用 SPSS 19.0 统计软件进行数据分析,对暴露指标进行统一编码,将定性和等级资料进行数量化处理。应用配对秩和检验、单因素 Logistic回归和多因素Logistic回归分析CHD的影响因素,计算各影响因素的相对危险度的比值比(OR)、95 % 可信区间(CI)、P 值,所有P 值均表示双侧概率。
《3 结果》
3 结果
《3.1 研究对象的基本情况》
3.1 研究对象的基本情况
共募集到69例先天性心脏病病例。病例组孕妇平均年龄为(27.4±3.9)岁,对照组孕妇平均年龄为 (27.4±4.1)岁,经检验两组年龄差异无统计学意义 (P=0.933)。简单型 CHD,即单纯一种心脏畸形 9 例,占13.0 %;复杂型CHD,即合并两种或两种以上心脏畸形60例,占87.0 %。
《3.2 微量元素测定》
3.2 微量元素测定
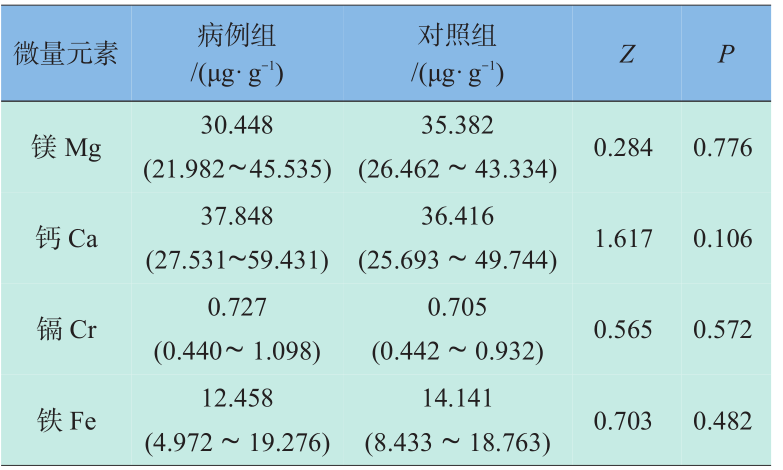
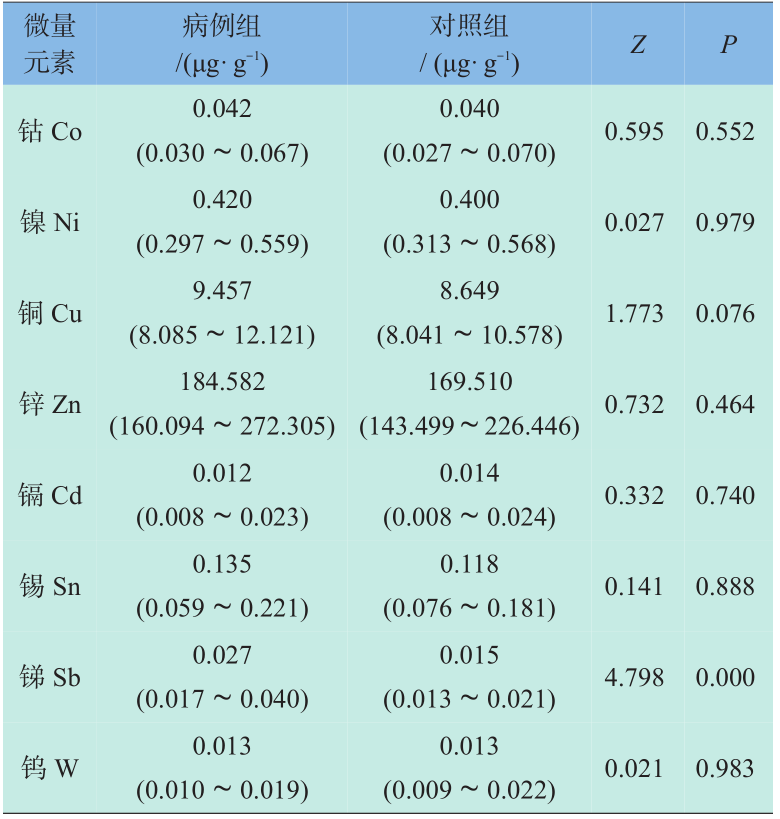
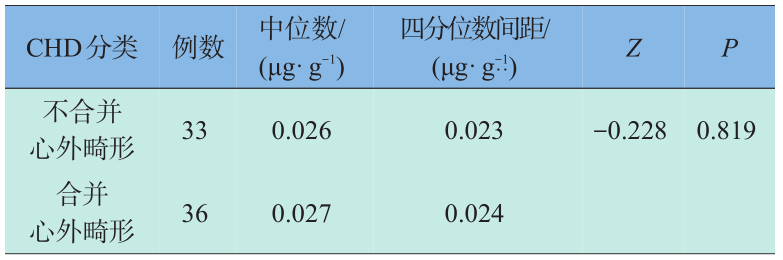
表1资料显示出在所分析的12种元素中,锑元素在病例组孕妇头发中的含量高于对照组孕妇,配对秩和检验结果有统计学意义(P<0.05)。其余元素含量在两组之间的差别无统计学意义。CHD按是否合并心外畸形分为两类,不同类型CHD孕妇发铝含量见表2。CHD按心脏畸形复杂程度及是否合并心外畸形分为两类,不同类型CHD孕妇发锑含量见表3。
《表1》
表1 CHD病例组和对照组微量元素配对秩和检验
Table 1 Comparison of the trace elements changes between the CHD patients and control group by paired signed-rank test
《表2》
表2 不同心脏畸形复杂程度孕妇发锑含量比较秩和检验
Table 2 Comparison of hair antinomy between the different complexities of cardiac malformation groups by compared signed-rank test

《表3》
表3 CHD是否合并心外畸形孕妇发锑含量比较秩和检验
Table 3 Comparison of hair antinomy between the combined and uncombined extracardiac malformation CHD groups by compared signed-rank test
《3.3 单因素分析》
3.3 单因素分析
变量赋值详见表4。调查表资料单因素分析结果(P<0.05)见表5。
《表4》
表4 单因素分析变量赋值
Table 4 The variable assignments of single factor analysis



《表5》
表5 CHD调查表问卷资料条件Logistic单因素分析结果
Table 5 The Logistic univariate analysis results of CHD survey questionnaires

《3.4 多因素分析》
3.4 多因素分析
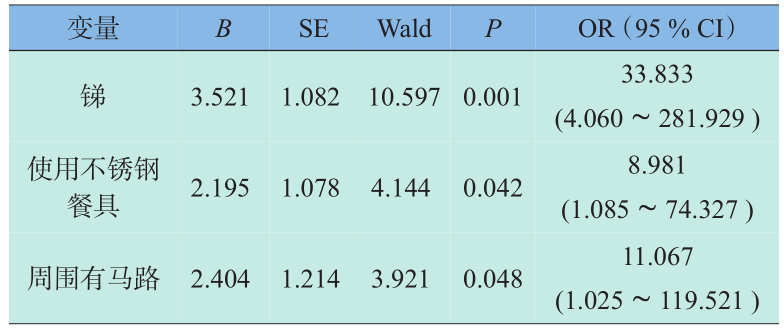
为综合评价锑元素和其他危险因素对CHD发生的影响,消除混杂作用,将调查表资料单因素分析结果中两组差异有显著性意义的孕期食用奶制品、食用坚果、居住环境周围有工厂、丈夫吸烟、接触化学毒物、先兆流产等变量引入多因素条件 Logistic回归模型。表6是多因素条件Logistic回归(逐步向后回归Wald)得到的结果。孕妇发锑含量偏高(OR=33.833)、居所周围50 m有马路(OR=11.067)、孕期使用不锈钢餐具(OR=8.981)是先天性心脏病的危险因素,保留在多因素模型中。
《表6》
表6 CHD条件Logistic多因素逐步分析结果
Table 6 The multivariate stepwise Logistic analysis results of the CHD
注:B 为回归系数和截距;SE为标准误
《4 讨论》
4 讨论
胚胎发育研究表明,心脏形成开始于胚胎期第 2周,约第4周起循环作用,至第8周房室间隔完全形成,即怀孕后前3个月是胎儿心脏发育的关键时期[3] 。在此阶段,多种高危因素均可导致CHD的发生。目前关于孕妇锑暴露与子代CHD关联性的报道未见,本研究结果表明,病例组孕妇发锑含量显著高于对照组孕妇(P=0.000)。单因素Logistic回归分析和多因素 Logistic 回归分析结果均表明,孕妇发锑含量高的子代发生CHD的风险增加,孕妇发锑含量升高是子代发生CHD的可能危险因素。不合并心外畸形的CHD与合并心外畸形的CHD孕妇发锑含量差异无统计学意义(P=0.819),这说明同浓度的锑含量可以导致胚胎心脏发育毒性。本研究还发现,简单型与复杂型CHD孕妇发锑含量差异无统计学意义(P=0.09),这说明胎儿心脏畸形的复杂程度及是否合并心外畸形与孕妇发锑含量无关,但这尚需扩大样本量以进一步证实。综上所述,本研究首次提出孕妇发锑含量升高可能与子代CHD的发生有关。
锑是元素周期表中第ⅤA族有色重金属元素,其化学性质与砷相似,为人类非需要微量元素。人类活动如燃烧化石燃料、军事活动、矿产的开采与冶炼、垃圾燃烧、道路交通、市政废水、使用锑化合物的工业活动(如半导体生产、塑料生产、电脑晶片生产等)都可导致锑进入环境。靠近公路的空气锑的浓度较高,可通过呼吸进入人体[4] 。锑是一种具有潜在毒性和致癌性的元素,大量的锑进入地表环境中,不仅造成地表环境的重金属污染,还对动植物体产生毒害[5] ,甚至危害人体健康,其毒性表现为 Sb( 0 ) > Sb(Ⅲ) > Sb(Ⅴ) [6] 。
根据实验结果,CHD病例组的孕妇发锑含量高于对照组,目前锑的毒性机制尚未完全明确,其与 CHD的研究尚少见。一项研究表明,锑在人体内可与巯基结合,抑制琥珀酸氧化酶等的活性,破坏细胞内离子平衡,使细胞内缺钾,引起体内代谢紊乱,导致多系统、多脏器损害[7] 。锑可以通过呼吸、饮食或皮肤等暴露途径进入人或动物体内[8] ,在人体各组织中的含量水平有所不同,以骨骼中的含量最高,其次是人发,而血液中的含量最低。目前人发锑质量浓度尚未设立参考值,其估算的浓度上限可能为 0.1 μg/g[9] 。锑及其化合物已被美国国家环保局列为优先污染物[10] ,三价锑被国际癌症研究机构 (IARC)分类为人类可疑基因毒性剂,大量的锑不仅造成地表环境的重金属污染,而且对动植物体产生毒害[6] 。锑引起CHD可能是通过基因毒性及氧化应激的毒性作用。在哺乳动物试验中,三氧化二锑证明有基因毒性,重复染毒三氧化二锑 21 d 后,小鼠骨髓细胞染色体发生突变[11] ;Sehaumloffel等采用体外培养实验研究了三氯化锑对 V79 细胞和人体淋巴细胞的基因毒性,结果均为阳性[12] 。在动物试验中,三价锑对新生的小鼠的心肌细胞有氧化应激和毒性作用[13,14] 。五价锑引起小鼠心脏、脾、脑的重要蛋白质羰基化,超氧化物歧化酶和过氧化氢酶的活动失衡,产生活性氧和氮化物导致其毒副作用[15] 。
在多因素回归分析中,居所周围有马路及使用不锈钢餐具被认为是与CHD发生相关的潜在危险因素。有研究表明,孕早期居室距离马路<50 m会增加暴露于受汽车废气所污染的空气的机会,而汽车废气中所含的一氧化碳对孕妇有不良影响[16] 。机动车制动磨损尘埃和垃圾焚烧灰尘使得靠近公路的空气锑的浓度较高[17] ,可通过呼吸进入人体[18] 。日本东京和欧洲某些城市大气颗粒物中,锑已取代铅成为最富集的重金属元素[19] 。因此居所附近有马路也可能与孕妇毛发锑元素含量增高有一定关系。不锈钢中加入锑元素可以提高抗腐蚀能力[20] ,故锑元素可能从餐具内渗出而被过度摄入[21] 。
因此,重视孕妇孕期前后的生活环境及个人习惯,避免过多的锑暴露,对预防和降低胎儿CHD的发生有重要意义。锑元素含量增加与CHD有关联,具体机制尚未明确,需要进一步研究引起其升高的高危因素,为预防CHD提供依据。














 京公网安备 11010502051620号
京公网安备 11010502051620号




