动物体细胞核移植技术虽然在绵羊
小鼠是一种最为常用的实验动物。最早的胚胎细胞核移植后代是在小鼠上获得的
《1 材料与方法》
1 材料与方法
《1.1 显微操作工具的制作》
1.1 显微操作工具的制作
在STA法的研究试验中, 选用了其他3种方法——A法、B法、C法作对比试验。
STA法显微操作工具的制作:固定管先以手工拉制, 然后在微煅烧仪 (CIT Alcatel, France) 上拉成外径约90 μm, 内径约为20 μm的微管;去核针用毛细玻璃管在拉针仪 (PN-30, NARISHIGA, Japan) 上拉制成细部长约0.8 mm, 末端有尖的玻璃针。
为作比较, 另拉制以下操作工具:外径25 μm 的平口管 (A法用) ;外径25 μm末端用磨针仪 (NARISHIGA, Japan) 磨成45°角并拉尖的斜口管 (B法用) ;与B法相似, 但外径10 μm末端拉尖的斜口管用于C法。
《1.2 卵母细胞的收集》
1.2 卵母细胞的收集
超数排卵:7~12周龄的雌性昆明白系小鼠, 隔日腹腔注射PMSG和hCG (宁波激素制品厂各10 IU/只。于hCG注射后13~14 h, 收集卵丘卵母细胞复合体 (COCs) , COCs移入含有0.1 %透明质酸酶的HEPES-CZB中, 在37 ℃的恒温台上处理3~5 min, 脱除卵母细胞周围的卵丘细胞, 脱除卵丘细胞后的卵母细胞即用于去核操作。
《1.3 表面张力辅助去核 (STA) 》
1.3 表面张力辅助去核 (STA)
去核显微操作是在ϕ35 mm培养皿的盖中进行的, 一滴约40 μL的含5 μg/mL 细胞松弛素CB HEPES-CZB用作去核的操作滴。操作滴上覆盖石蜡油后置于装备有显微操作系统的倒置显微镜的载物台上。首先将一组 (10~15枚) 小鼠卵母细胞移入操作滴并停留10 min, 当显微镜放大200倍时, 可以看到细胞核区呈半透明状。细胞核的去除:在固定管的协助下, 调整卵母细胞的位置, 使细胞核处于时钟12的位置 (图1-A) 。用微针在细胞核上方的透明带上穿刺 (图1-B) , 然后使微针在固定管上往复摩擦, 使核上方形成一个破口 (图1-C) 。重新吸住卵母细胞使破口处于时钟3的位置 (图1-D) 。移动载物台, 使溶液的边缘缓慢向卵母细胞靠近, 在卵母细胞接近溶液边缘移动的过程中, 细胞核可以被表面张力挤出透明带 (图1-E) 。退下固定管后透明带封闭, 将核质体和卵母细胞分开。
《图1》
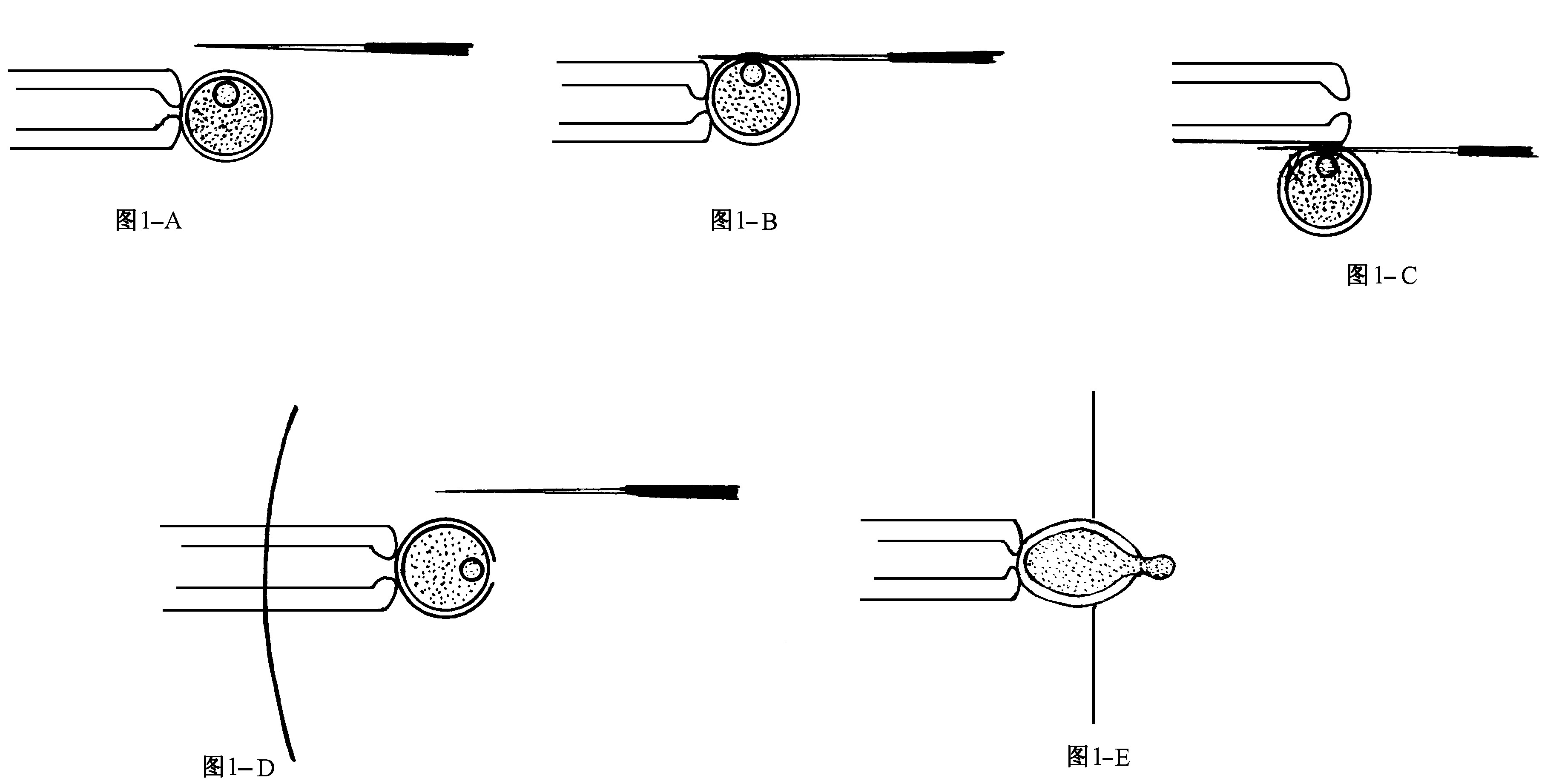
图1 (A—E) 小鼠卵母细胞表面张力辅助法去核示意图 Fig.1 (A—E) . Oocyte encleating with surface tension assisted method in mouse
《1.4 其他几种去核方法》
1.4 其他几种去核方法
方法A参考 王敏康 的方法
为避免第一极体的存在影响供体细胞和受体胞质的融合, 采用以下方法处理卵母细胞:a.带有已经退化的极体卵母细胞去核后直接用于核移植实验;b.细胞核紧邻第一极体, 在第一极体上方的透明带上开口, 用表面张力先挤出第一极体, 再挤出其下的细胞核;c.细胞核与第一极体的夹角小于90°, 在细胞核和第一极体上方的透明带上各开一小口, 先用表面张力挤出第一极体, 再调整卵母细胞的位置, 挤出细胞核。细胞核与第一极体的夹角大于90°, 这部分卵母细胞不用于核移植实验。
《1.5 去核效率的检验》
1.5 去核效率的检验
测量每组去核得到的核质体的直径, 计算平均值, 并根据球体的体积公式:v=4/3πr3 (r为核质体球体半径) 计算其占卵母细胞体积的比例, 以此作为去核时的胞质损失率。记录每组去核操作的时间, 计算操作每枚卵母细胞的平均时间。一部分核质体, 用含有5 μg/mL Hochest33342染色剂的CZB溶液处理15 min, 在荧光显微镜下观察, 根据观察到的含有DNA的核质体数占去核卵母细胞数的比例, 计算去核的准确率。
《1.6 核供体细胞的准备》
1.6 核供体细胞的准备
成纤维细胞的培养参考Ogura等
《1.7 细胞核移植 (克隆) 》
1.7 细胞核移植 (克隆)
以STA法去核的卵母细胞应用于克隆实验。用25 μm的注射微管将一个直径15~20 μm的成纤维细胞通过透明带上的豁口, 移入到去核卵母细胞的卵周隙。使用的融合仪 (KEFA450, 中国) 在0.3 mol/L的甘露醇 (加1 mg/mL的BSA) 的融合液中, 以交流10 V, 1.5 MHz作用6~8 s, 再以直流1 400 V/cm, 10 μs电刺激一次, 然后移入含有10 mol/L 牛磺酸CZB中, 置于二氧化碳培养箱中培养。40 min后未融合的再次给予相同条件的处理。
《1.8 孤雌激活和胚胎培养》
1.8 孤雌激活和胚胎培养
受体卵胞质和核供体细胞, 在融合后1~2 h, 以含有5 μg/mLCB的激活液 (10 mol/L的SrCl2-CZB) 中处理3 h;移入含有5 μg/ml CB的CZB中继续培养5 h, 最后转入含10 mol/L 牛磺酸的CZB中培养。
《2 结果》
2 结果
《2.1 几种去核效果的比较》
2.1 几种去核效果的比较
a.在操作时间上, A法的操作时间 (3 min/枚) 显著长于STA (1.33 min/枚) 、B (1.30 min/枚) 和C法 (1.41 min/枚) , 后三种方法没有显著差异;b.在去核的细胞质损失量上, C法造成的细胞质损失达28.4 %, 显著高于其它三种方法 (5 %) ;c.在去核的准确率上, C法 (35.3 %) 显著低于其它三法 (95 %以上) (表1) 。STA法去除的细胞核见图 (见图2、图3) 。
表1 小鼠卵母细胞几种去核方法效果的比较 Table 1 Comparison of the enucleating methods in mouse
《表1》
| 方法 | 卵母细胞数 | 去核效率 | |||
| 时间/ min | 核质体直径/μm | 胞质损失量/ % | 准确率/ % | ||
| STA法 | 88 | 1.33a | 29.5±4.32a | 5.01a | 85/88 (96.6) a |
| A法 | 75 | 3.12b | 28.6±4.23a | 4.57a | 72/75 (96.0) a |
| B法 | 79 | 1.30a | 28.4±5.36a | 4.47a | 76/79 (96.2) a |
| C法 | 68 | 1.41a | 52.6±12.83b | 28.4b | 24/68 (35.3) b |
注:a, b, 差异显著 (P<0.01) 。
《2.2 克隆效果》
2.2 克隆效果
实验共移植234枚小鼠耳成纤维细胞到去核卵母细胞质的卵周隙中, 经电融合处理, 共融合178枚 (76.1 %) , 有152枚 (85.4 %) 融合后的重组胚形成原核。其中有88枚 (49.4 %) 重组胚卵裂, 并形成2-细胞。
《3 讨论》
3 讨论
去核效率的提高将是提高核移植技术整体效率的重要环节。一种好的去核技术应准确、简单、快速, 减少对卵母细胞的刺激, 并保证尽量减少去核造成的细胞质损失。在大动物, 几乎所有克隆成功者都是以电融合介导的核移植技术生产的。尽管已经有了几例克隆小鼠成功的报道, 但在去核方法上仍有待改进。在一些报道中
《图2》
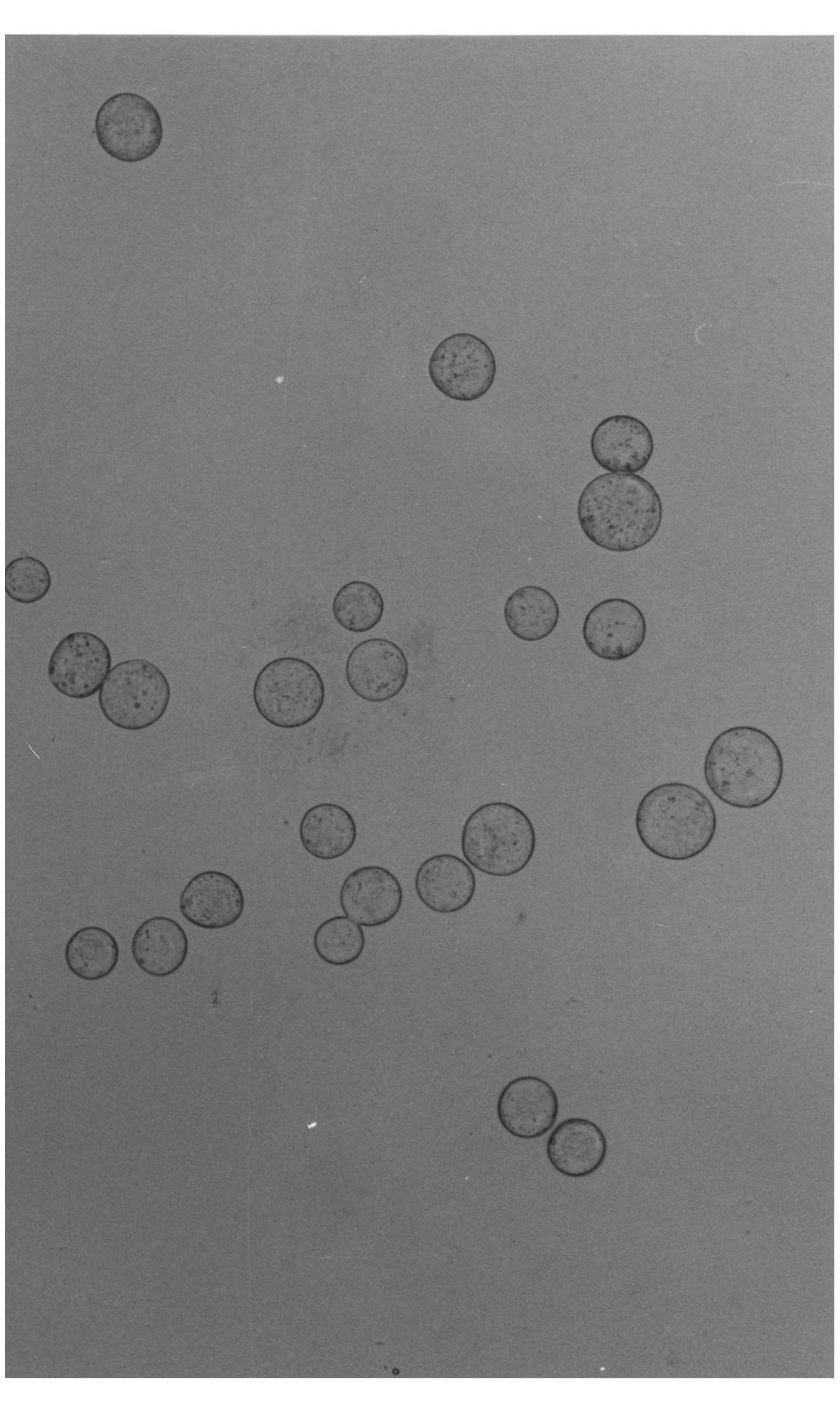
图2 普通显微镜下观察到的STA法去除的细胞核质体 Fig.2 Karyoplasts obtained with STA method under common microscope
《图3》
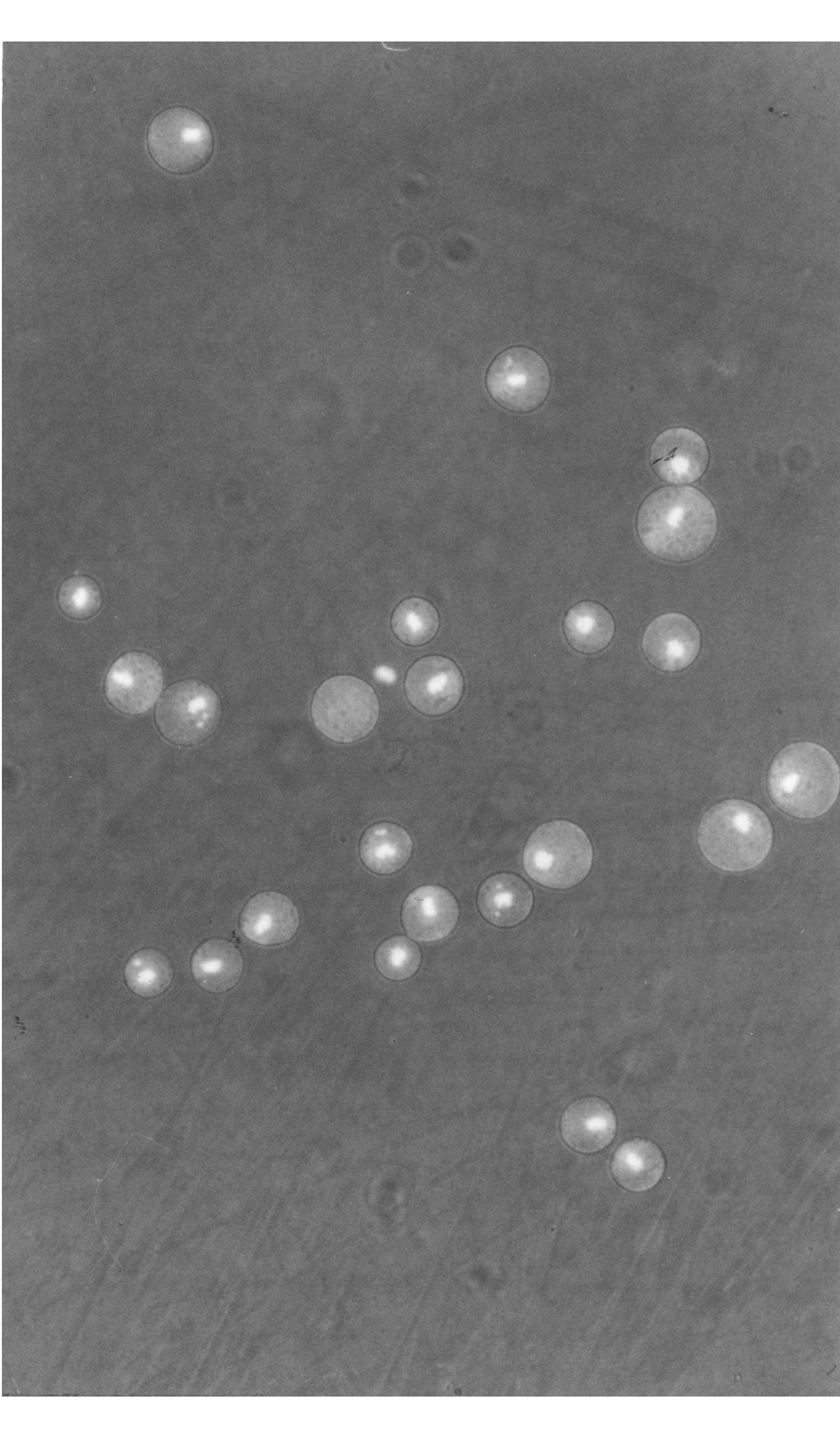
图3 经Hoechst33342染色后在荧光显微镜下观察到的发光的细胞核 Fig.3 Karyoplasts dyed with Hoechst33342 glowed under fluorescent microscope
方式核移植成功的
多数研究表明
有研究表明, 在去核过程中尽量减少细胞质的损失, 有益于提高核移植重组胚的囊胚发育率
本实验中, A法的操作时间显著长于STA、B 和C法。这主要是因为A法在去核的过程中需要更换微针, 并需要两次定位细胞核的位置。值得一提的是, STA法去核的过程非常简单, 这就使得其操作时间显著少于A法。














 京公网安备 11010502051620号
京公网安备 11010502051620号




