《1 前言》
1 前言
神经肽Y(NPY)属于胰多肽家族,此家族还包括多肽 YY(PYY)、胰多肽(PP)和多肽 Y(PY)等, NPY 与由 G 蛋白偶联受体构成的 Y 受体家族密切相关[1] 。并且NPY与生物体的生长发育以及生活行为有很大的关系[2] ,尤其是动物的摄食,是一种内源性的促进摄食的非常保守的神经递质。NPY 第一次在猪的脑部分离提取出来[3] ,之后相继在哺乳动物、鸟类、两栖动物和鱼中被鉴定检测出来[4,5] 。
NPY在心血管功能、生殖及应激和免疫反应中都发挥着生理效应[6~12] ,其最重要的作用是促进摄食,这不仅在哺乳动物、鸟类和两栖动物中得到证明[13~15] ,在鱼类中同样得到了证明[16] ,由此可推断出 NPY能够反映各物种的摄食情况。
起初,NPY在硬骨鱼类中的功能仅是作为促垂体激素释放激素来研究的[17~20] ,直至1998年,开始进行 NPY 在鱼类摄食和能量平衡上的研究。Silverstein等[21] 对大鳞大麻哈鱼和银大麻哈鱼进行2~3周的饥饿实验后导致其下丘脑中的NPY相似信使核糖核酸(mRNA)的表达量升高。López-Patiño 等[22] 对金鱼进行了研究,证明NPY可促进金鱼的摄食。之后,该观点相继在斑点叉尾鮰[16] 、美洲拟鲽[23] 和大西洋鳕[24] 等中得到证明。
大菱鲆属于鲆科、菱鲆属,是原产于欧洲北海、波罗的海和地中海沿岸的一种名贵比目鱼,1992年由黄海水产研究所引进我国[25] 。大菱鲆耐低温、生长速度快、肉质鲜美,是重要的工厂化养殖经济鱼类之一。鱼类摄食一直是研究的重点内容,大菱鲆作为典型工厂化养殖鱼类,适宜的投喂不仅节约饵料,而且可避免过量的饵料对水质的污染。而NPY 作为控制摄食和能量平衡的相关基因,对其结构和表达特征的研究很有必要。
本文以大菱鲆作为研究对象,克隆出NPY的全长互补脱氧核糖核酸(cDNA)序列并对其结构进行分析;同时进行NPY的组织特异性表达,并对大菱鲆进行饥饿和再投喂实验,从而研究NPY在摄食调控中的表达情况。本文为进一步研究NPY基因和大菱鲆摄食的关系奠定了基础,同时为进一步阐明鱼类摄食调控的分子机理提供了理论依据,并且建立了一个可用来研究大菱鲆摄食的分子方法,以此为基础在分子水平上研究鱼类最适于摄食的环境因素并研发可促进大菱鲆摄食和生长的相关技术与产品。
《2 材料与方法》
2 材料与方法
《2.1 材料与试剂》
2.1 材料与试剂
本文所用的健康大菱鲆取自烟台天源水产有限公司。克隆及组织表达所用大菱鲆的平均体重为(553.35±5.15)g,平均体长为(32.50±1.31)cm。活体带回实验室后,采用乙醚对其进行麻醉,置于冰上进行解剖,迅速分离脑组织各部分和肝脏等各组织,用 RNAstore 样本保存液保存后,在 4 ℃的冰箱中保存12 h后,放入80 ℃的冰箱中长期保存。
饥饿和再投喂实验所用的大菱鲆为60日龄稚鱼 ,平均体重为(5.5±0.02) g ,平均体长为(2.6±0.5)cm,养殖水温为 15 ℃,正常光照,每天 7点和17点各投喂1次微颗粒饲料,实验前驯养2周。
《2.2 方法》
2.2 方法
2.2.1 克隆策略和引物设计
利用美国国立生物技术信息中心(NCBI)GenBank数据库中已有的大西洋鳕鱼、点带石斑鱼、牙鲆和美洲拟鲽等鱼类的NPY序列保守区域,并结合 Primer Primer 5.0,设计出扩增核心片段的一对引物 F1和R1。并根据所得的核心片段设计5′末端快速扩增技术(RACE)所用的特异引物 GSP1 和进行巢式聚合酶链式反应(PCR)的引物NGSP1;用同样的方法设计出 3′RACE 所用的特异引物 GSP2 和巢式引物NGSP2。
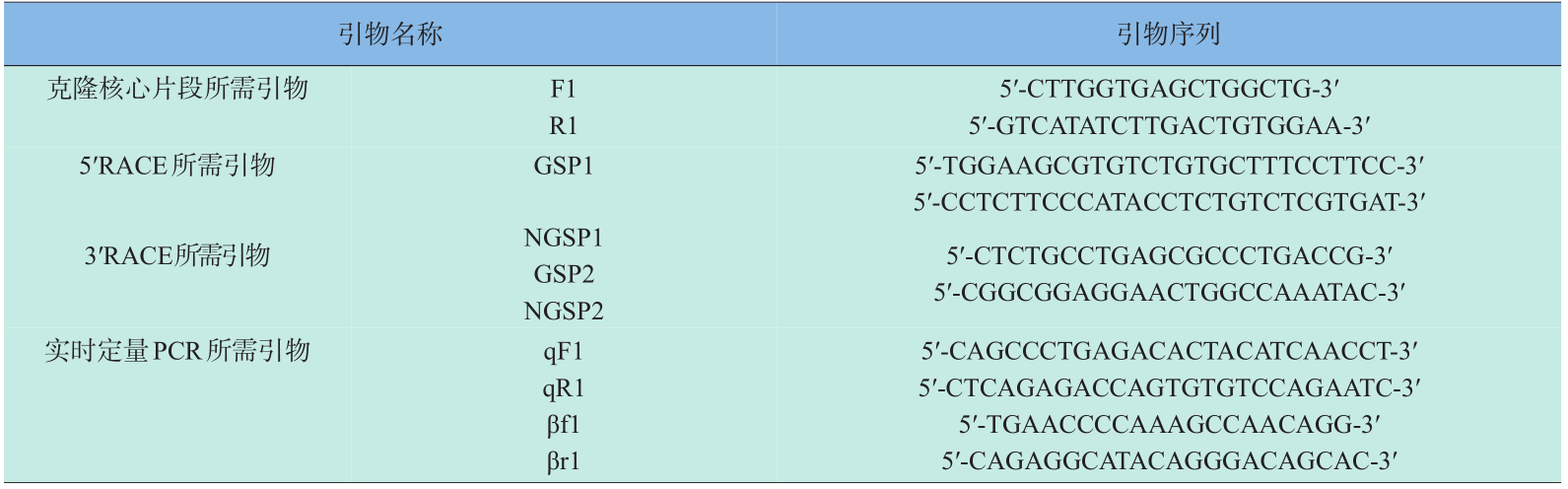
将所得到全长 cDNA 序列设计用于实时定量 PCR 的特异引物(qF1 和 qR1),并根据大菱鲆内参基因β-actin的基因序列设计引物(βf1和βr1),用于表达分析。所有引物由铂尚生物技术(上海)有限公司合成。以上引物具体序列见表1。
《表1》
表1 用于大菱鲆NPY基因克隆和实时定量PCR的引物序列
Table 1 Nucleotide sequences of the primers for cloning and real-time PCR of NPY in turbot
2.2.2 大菱鲆NPY基因的克隆
使用TRIzol Reagent(Ambion)从大菱鲆下丘脑中提取出总RNA。使用超微量紫外分光光度计测定RNA的浓度,并用 1.2 % 的琼脂糖凝胶电泳确定总RNA的完整性,利用Thermo Scientific RevertAid First Strand cDNA Synthesis Kit(Thermo)进行反转录合成cDNA第一链。使用引物F1和R1进行中间片段的扩增,PCR程序为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸45 s,运行35个循环;72 ℃延伸10 min。使用普通琼脂糖凝胶DNA 回收试剂盒(天根生化科技(北京)有限公司)对扩增所得片段进行分离纯化,送到北京六合华大基因科技股份有限公司进行测序。使用 SMARTer™ RACE cDNA Amplification Kit(Clonetech)进行 5′RACE和3′RACE,反应程序如下:94 ℃变性30 s, 68 ℃退火30 s,进行25个循环;72 ℃延伸3 min。进行巢式PCR后获得目的片段,经胶回收后,克隆到 pMD™ 18-T Vector(TaKaRa)上,进行菌落PCR验证后,对阳性克隆进行测序。
2.2.3 序列分析
使用DNAman 6.0对开放阅读框(ORF)进行分析并推导出氨基酸序列,利用 ProtParam 工具(http://www.expasy.org/tools/protparam.html)预测 NPY蛋白的基本理化性质,运用SignalP 4.1(http:// www.cbs.dtu.dk/services/SignalP/)对所推导出的氨基酸序列进行信号肽预测。运用ClustalX 1.83对不同物种的 NPY 氨基酸序列进行同源性比对,并用 DNAstar 中的 MegAlign 计算同源性,用 MEGA4.0 通过最大似然法构建NPY的系统进化树。
2.2.4 大菱鲆NPY基因组织特异性表达
从大菱鲆的前脑、中脑、后脑、延髓、下丘脑、垂体、腮、心脏、肝脏、头肾、肾、脾脏、肌肉、胃、肠及胆囊 等 16 个组 织,使用 TaKaRa MiniBEST Universal RNA Extraction Kit 提取总 RNA,使用用于实时定量 PCR的反转录试剂盒TaKaRa PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)进行反转录,产物稀释 25 倍后参照 TaKaRa SYBR® Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)说明书进行实时定量PCR。使用两步法,反应程序如下:95 ℃预 变性30 s;95 ℃变性5 s,62 ℃退火26 s,40个循环。反应结束进行溶解曲线分析以确定对目的片段是否进行特异性扩增。对每个样品设置 3 个平行实验,NPY 基因和内参基因β-actin 使用相同的模版量。
2.2.5 大菱鲆的饥饿和再投喂实验
实验用鱼进行2周的驯养后,最后一次投喂后进行饥饿实验,共分为两组,第一组在喂食中(0 h)及喂食后 2 h、4 h、6 h、8 h、12 h、18 h、24 h、48 h 和 72 h进行取样,饥饿72 h后再次投喂并且于投喂中(0 h)和喂食后2 h进行取样;第二组在饥饿48 h后进行再投喂,并同样在投喂中(0 h)和喂食后2 h进行取样(在喂食中取样时允许在喂食15 min后再取样)。取大菱鲆的下丘脑,实时定量PCR的方法如第2.2.4节所述。
2.2.6 数据分析
所得的Ct值通过2-ΔΔCt法计算NPY基因的相对表达量,并且使用 SPSS18.0 的 one-way ANOVA 进行差异显著性分析((P<0.05 为差异显著,P>0.05 为差异不显著)。
《3 结果》
3 结果
《3.1 大菱鲆NPY基因全长cDNA序列分析及结构特征》
3.1 大菱鲆NPY基因全长cDNA序列分析及结构特征
采用PCR技术获得NPY基因的核心片段,再通过RACE方法得到两端序列,进行拼接后得到的全长 cDNA 序列经 tblastx 分析确认为大菱鲆 NPY 序列 。大菱鲆 NPY 基因 cDNA 全长 729 bp,含有 70 bp 的5′非翻译区(5′-UTR)和359 bp的3′非翻译区(3′-UTR),其中 3′-UTR 含有加尾信号 ATTAAA 及PolyA尾。ORF长300 bp,编码含99个氨基酸的蛋白质,N端28个氨基酸为信号肽,信号肽后是由 36个氨基酸组成的NPY成熟肽,后接蛋白质水解加工位点 Gly-Lys-Arg,剩余 32 个氨基酸为 NPY 的羧基末端旁侧肽段(CPON)(见图1)。NPY蛋白的分子质量为 11 301.9 Da,等电点 pI 为 5.26,分子式为 C516H799N131O150S2,脂肪系数(AI)为101.52,总平均输水指数(GRAVY)为- 0.284,不稳定系数(Ⅱ)为 79.96,推断此 NPY 蛋白不稳定。NPY 蛋白的二级结构由 48.48 %的α-螺旋、45.45 %的无规卷曲、 3.03 %的延伸链和3.03 %的β转角组成。
使用 DNAstar 软件对大菱鲆 NPY 蛋白与其他物种的同源性进行比较,结果显示大菱鲆NPY与其他物种的同源性在 53.9 %~98 %,其中与牙鲆的同源性最高,为98 %。使用ClustalX 18.3对序列进行比对,比对结果如图2所示。进一步使用MEGA4.0 构建 NPY 蛋白的系统进化树(见图 3),根据所得进化树分析可知,大菱鲆NPY蛋白与鲽形目(牙鲆和美洲拟鲽)和鲈形目(欧洲狼鲈和黑棘鲷)等一同位于硬骨海水鱼类这一簇上,并且大菱鲆NPY蛋白与鲽形目(牙鲆和美洲拟鲽)基本处于同一分支;鲤形目(锦鲤和斑马鱼)和鲶形目(斑点叉尾鮰)处在硬骨淡水鱼类这一簇上;软骨鱼类(石纹电鳐)、两栖类(非洲爪蟾)、鸟类(红原鸡)及哺乳动物聚合为另一簇。大菱鲆NPY的分子进化地位与其生物学分类地位基本一致。
《图1》

图1 大菱鲆NPY的全长cDNA序列及所推导出的氨基酸序列
Fig. 1 The full-length cDNA sequence and deduced amino acid sequence of NPY from turbot
注:下划线标志序列中的信号肽;阴影标志NPY成熟肽;字符边框标志蛋白水解加工位点;*标志终止密码子;波浪线标志不稳定序列(ATTTTA)及多聚腺苷酸加尾信号(ATTAAA)
《图2》

图2 大菱鲆与其他物种NPY蛋白的氨基酸序列对比
Fig. 2 Contrast of the amino acid sequences of NPY from turbot and other species
注:小写字母为完全相同的序列,以阴影的颜色深度表示序列的同源程度,颜色越深表示序列同源性越高;本研究所克隆的大菱鲆NPY蛋白用“#”表示,缺口用“.”表示。
《图3》

图3 根据NPY氨基酸序列使用最大似然法构建的系统进化树
Fig. 3 Maximum-likelihood phylogenetic tree constructed with the amino acid sequences of NPY
《3.2 大菱鲆NPY基因的组织表达》
3.2 大菱鲆NPY基因的组织表达
采用实时定量PCR对大菱鲆16个组织中NPY 的表达量进行检测。结果显示,大菱鲆NPY基因分布广泛,在 16 个组织中均有不同程度的表达(见图4),在脑中的表达量相对较高,其中在下丘脑中的表达量最高,并与其他15个组织的表达差异显著(P < 0.05),在肌肉、胃、肠及胆囊中的表达量相对较低,而在垂体、腮、心脏、肝脏、肾脏及脾脏中的表达量最低。
《图4 》

图4 大菱鲆NPY基因的mRNA在不同组织中的表达
Fig. 4 Expression of NPY mRNA in different tissues of turbot
注:以NPY基因在肌肉中的表达量作为对照;不同字母表示各组织中的表达量差异显著(P < 0.05),所有数值用平均值±标准差(means±SE)表示
《3.3 饥饿与投喂策略对大菱鲆NPY基因的表达影响》
3.3 饥饿与投喂策略对大菱鲆NPY基因的表达影响
在饥饿实验及再投喂实验中,以饥饿实验开始时(0 h)NPY 基因的 mRNA 表达量作为对照,设为 1。饥饿实验的结果显示,在 0~4 h 内,随着实验的进行,mRNA 的表达量升高;在 4~8 h 内,随着饥饿时间的延长,mRNA表达量呈现下降的趋势;在8~ 48 h 内,NPY 基因的 mRNA 表达量又再次显著升高,并且远远超过饥饿实验前期(0~8 h)的mRNA表达量;然而在48~72 h内,NPY基因的mRNA表达量再次显著下降(见图5)。
《图5》
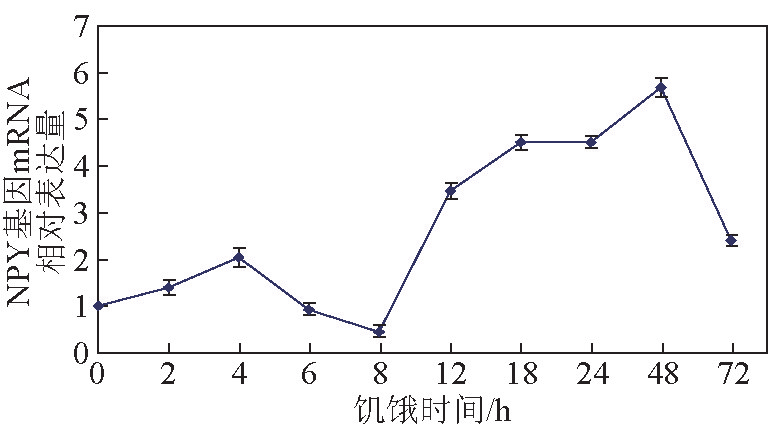
图5 饥饿对大菱鲆NPY基因的mRNA表达量的影响
Fig. 5 Effects of starvation on the expression of NPY mRNA in turbot
再投喂实验结果显示,饥饿48 h及72 h后再投喂,NPY基因的mRNA表达量相对于正常投喂组显著升高,但同时又于投喂 2 h 后呈现显著的下降趋势(见图6)。
《图6》

图6 饥饿后再投喂对大菱鲆NPY基因的 mRNA表达量的影响
Fig. 6 Effects of refeeding after starvation on the expression of NPY mRNA in turbot
注:不同字母表示各组织中的表达量差异显著(P < 0.05);所有数值用平均值±标准差(means±SE)表示
《4 讨论》
4 讨论
本文通过使用逆转录 PCR(RT-PCR)和 RACE 技术,从大菱鲆的脑组织中得到全长为 729 bp 的 NPY cDNA 序列,编码 99 个氨基酸组成的 NPY 蛋白,其中36个氨基酸组成NPY的成熟肽,这与其他物种的结果一致[3] 。大菱鲆NPY的氨基酸序列跟其他鱼类相比,表现出较高的同源性,特别是与同属于鲆鲽鱼类的牙鲆及美洲拟鲽的同源性高达97 %~ 98 %。并且根据所得进化树分析可知,大菱鲆NPY 蛋白位于硬骨海水鱼类这一分支上,与鲽形目(牙鲆和美洲拟鲽)和鲈形目(欧洲狼鲈和黑棘鲷)等的关系较近;与鲤形目(鲤鱼和斑马鱼)、鲶形目(斑点叉尾鮰)、软骨鱼类(石纹电鳐)、两栖类(非洲爪蟾)、鸟类(红原鸡)及哺乳动物的关系较远,这与同源性分析基本一致。在大菱鲆NPY成熟肽中不含半胱氨酸(C),只在信号肽第21个氨基酸位点上有一个半胱氨酸(C),并且在序列比对结果中,信号肽的第21个氨基酸位点上都为半胱氨酸(C)。比对结果显示,NPY 成熟肽的 36 个氨基酸中有 26 个高度保守,这说明NPY是一种进化十分保守的神经肽。
通过实时定量PCR技术研究发现,NPY基因在大菱鲆神经组织特别是下丘脑中的表达量较高,这与其他物种的研究结果一致。下丘脑外侧区(LHA)为摄食中枢(也称饥饿中枢),起着决定发动摄食活动的作用;腹内侧核(VMH)为饱食中枢,起着决定停止进食活动的作用[26] 。NPY 基因 mRNA 在下丘脑中的表达最高,说明NPY可能与摄食和能量平衡的调节有关。NPY 在神经组织中的表达量较高,在外周组织中也有表达,但不同物种间外周组织中NPY的表达量略有不同。在大菱鲆外周组织中NPY在肌肉、胃、肠及胆囊中的表达量相对于在垂体、腮、心脏、肝脏、肾脏及脾脏中的表达量较高,由此可推断在大菱鲆中NPY可能是脑-肠肽,这在其他鱼类中已得到相应的证明[24,27~29] 。在肾脏中也检测到了 NPY 的存在,由此可得出 NPY 有可能与大菱鲆的渗透调节有关。大菱鲆NPY基因在消化系统(胃和肠)中的表达是除中枢系统(脑部等)外表达量最高的,这与其他物种的研究结果相一致 [6] 。
饥饿实验中,随着饥饿的进行,NPY 的表达量显著变化(P<0.05),呈现先升高再降低,再显著升高并维持一段高水平表达后,再次下降的趋势,说明 NPY跟大菱鲆的摄食相关,并且饥饿只能暂时提高 NPY的表达量;在再投喂实验中,饥饿后再投喂会使NPY的表达量升高,并且饥饿时间越长,再投喂后NPY的表达水平越高,但是再投喂2 h后表达量还会再次下降至相似的水平,这都预示着NPY对摄食的调控可能是一种短期的调控机制。大菱鲆饥饿12 h后,NPY基因的表达水平开始显著上升;而金鱼饥饿72 h后,NPY基因的表达量才开始显著升高;鲶鱼则需要至少三周的时间,NPY基因的表达水平才会出现变化[16,21] ,这说明可能不同鱼类的耐饥饿程度及NPY的对摄食调节的强度不同。摄食 0 h后和摄食2 h后的NPY的表达量会发生显著变化,这说明可能NPY不参与摄食后的消化过程,只是起到了刺激食欲的作用。NPY 基因对饥饿的生理效应与其他摄食刺激因子相一致,如 Orexin[30] 、 AgRP[31] 和ghrelin[32] ,与其他摄食抑制因子的生理效应相反,例如CART[24,33] 和POMC[34,35] 。
这些结果表明,NPY 参与大菱鲆的摄食调控,并且可能起到促进摄食的作用。
《5 结语》
5 结语
本文首次克隆了大菱鲆的NPY基因并对其结构和表达特征进行了初步研究。大菱鲆NPY基因在神经组织中的表达水平较高,并且在下丘脑中有最大表达量,这与其他脊椎动物的实验结果相一致,但NPY在不同物种的外周组织中的表达量有所变化。在饥饿和再投喂实验中,初步得出大菱鲆 NPY是一种促进摄食的食欲刺激因子,与其他物种的研究结果相一致。但是,NPY促进摄食的相关分子机制还有待进一步研究。














 京公网安备 11010502051620号
京公网安备 11010502051620号




