《1 前言》
1 前言
硼中子俘获治疗 ( boron neutron capture therapy, BNCT)是一种安全、有效的二元化治疗肿瘤的方法[1] 。BNCT 通过肿瘤细胞内的核反应来摧毁癌细胞,通过口服或注射对乏氧肿瘤细胞和分裂间期细胞具有强亲和力的携带剂10B,以中子射线对其进行照射,中子与10B 结合后发生核反应,释放出具有短程杀伤作用的 α 粒子和7Li 粒子,从而杀死癌细胞[2] 。在国外,该项技术在治疗恶性脑胶质瘤[3 , 4] 、皮肤恶性黑色素瘤[5] 等方面已经取得了令人鼓舞的成果。将 BNCT 成功应用于其他肿瘤治疗的核心问题是如何使得含10B 的药物有选择性地在肿瘤组织内积聚。
脂质体是靶向给药系统的一种新剂型,具有被动靶向性、缓释性,组织亲和性以及低毒性等特点,是一种很好的药物靶向运载工具[6] 。叶酸受体大部分来源于上皮组织的恶性肿瘤,如卵巢癌、子宫内
膜癌、肾癌、乳腺癌、肺癌、结肠癌和鼻咽癌细胞中均有高度表达[7] 。目前常用的硼携带剂是巯基十二硼烷二钠盐 ( BSH ) 和对二羟基硼酰苯丙氨酸 ( BPA ),且已有报道将 BSH 和 BPA 制备成脂质体[8] ,但其包封率均较低,不足 20 %。本实验旨制备叶酸靶向的含硼脂质体,并对其制备处方和工艺条件进行了筛选和优化,为 BNCT 的研究与应用提供一个有效的靶向给药途径。
《2 仪器及试剂》
2 仪器及试剂
实验用到的仪器如下:AE200 分析天平(梅特勒-托利多仪器有限公司),UV—2450 紫外可见分光光度计(日本岛津公司),LC—10A 高效液相色谱仪(日本岛津公司);AgilentHC—C18 色谱 C18 柱(5 μm,250 mm ×4.6 mm)(日本岛津公司), XW—80A 旋涡混合器(上海医科大学仪器厂), RE—52AA 旋转蒸发器(上海振捷实验设备有限公司),GL—802A 微型台式真空泵(江苏海门其林贝尔仪器制造有限公司),PHS—3D 型 pH 计(上海精科),Nano—ZS 纳米粒度及 zeta 电位分析仪(马尔文,英国),SK1200H 超声波清洗器(上海科导超声仪器有限公司),TGL—16G 台式离心机(上海安亭科学仪器厂)。
实验用到的试剂如下:Folic acid - PEG - DSPE ( F - PEG - DSPE ,Nanocs);氢化大豆卵磷脂(HSPC,Avanti);胆固醇(Chol,Avanti);三氯甲烷(北京化工厂),经 CaH2 回流、蒸馏干燥;葡聚糖凝胶 G—25 ( Solarbio );4—羟基苯硼酸(HBA,北京普瑞东方化学技术有限公司)脂质体、2—噻吩硼酸(TBA,北京普瑞东方化学技术有限公司)脂质体; 4—叔丁基苯硼酸(BBA,北京普瑞东方化学技术有限公司);甲醇(色谱纯,DIKMA)。
《3 方法及结果》
3 方法及结果
《3.1 HBA 靶向脂质体的制备》
3.1 HBA 靶向脂质体的制备
采用复乳法制备 HBA靶向脂质体,精确称取不同量的 Folic acid - PEG - DSPE、磷脂、胆固醇置于茄形瓶中,加入适量三氯甲烷,使其完全溶解。将茄形瓶置于旋转蒸发仪上,室温下进行真空减压去除有机溶剂,使瓶壁上形成一层均匀的薄膜,然后加入一定量 HBA 溶液水化,涡旋振荡数分钟,转入超声波乳化器。超声一段时间后,再次将茄形瓶置 旋转蒸发仪上,室温下进行真空减压,即制得较均匀的 HBA 靶向脂质体悬浮液。采用聚碳酸酯膜进行挤压,膜的孔径分别为 0.8 、0.4 、0.2 μm,测平均粒径为(135 ± 10)nm,置于 4 ℃保存。
《3.2 TBA、BBA 靶向脂质体的制备》
3.2 TBA、BBA 靶向脂质体的制备
采用薄膜分散法制备 TBA、BBA 靶向脂质体,精确称取不同量的 Folic acid - PEG - DSPE、磷脂、胆固醇与 TBA 或 BBA 置于茄形瓶中,加入适量三氯甲烷,使其完全溶解。将茄形瓶置于旋转蒸发仪上,室温下进行真空减压去除有机溶剂,使瓶壁上形成一层均匀的薄膜,然后加入一定量磷酸盐缓冲液(PBS)溶液水化,涡旋振荡数分钟,转入超声波乳化器,超声一段时间即制得较均匀 TBA 或 BBA 靶向脂质体悬浮液。采用聚碳酸酯膜进行挤压,膜的孔径分别为 0.8 、0.4 、0.2 μm,测平均粒径分别为(109 ± 4)nm、(127 ± 6)nm,置于 4 ℃保存。
《3.3 HBA、TBA、BBA 最大吸收波长的测定》
3.3 HBA、TBA、BBA 最大吸收波长的测定
采用紫外分光光度法确定 HBA、TBA、BBA 的最大吸收波长。精密吸取 1 mg/mL 的 HBA、TBA、
BBA 溶液 1 mL , 定容至 50 mL,配成浓度为 20 μg/mL 的 HBA、TBA、BBA 溶液,置于石英吸收池中,以其溶剂为空白对照,在 190~400 nm 的波长范围内测定最大吸收波长,得出最大吸收波长分别为 234、238、225 nm,如图 1~3 所示。
《图1》
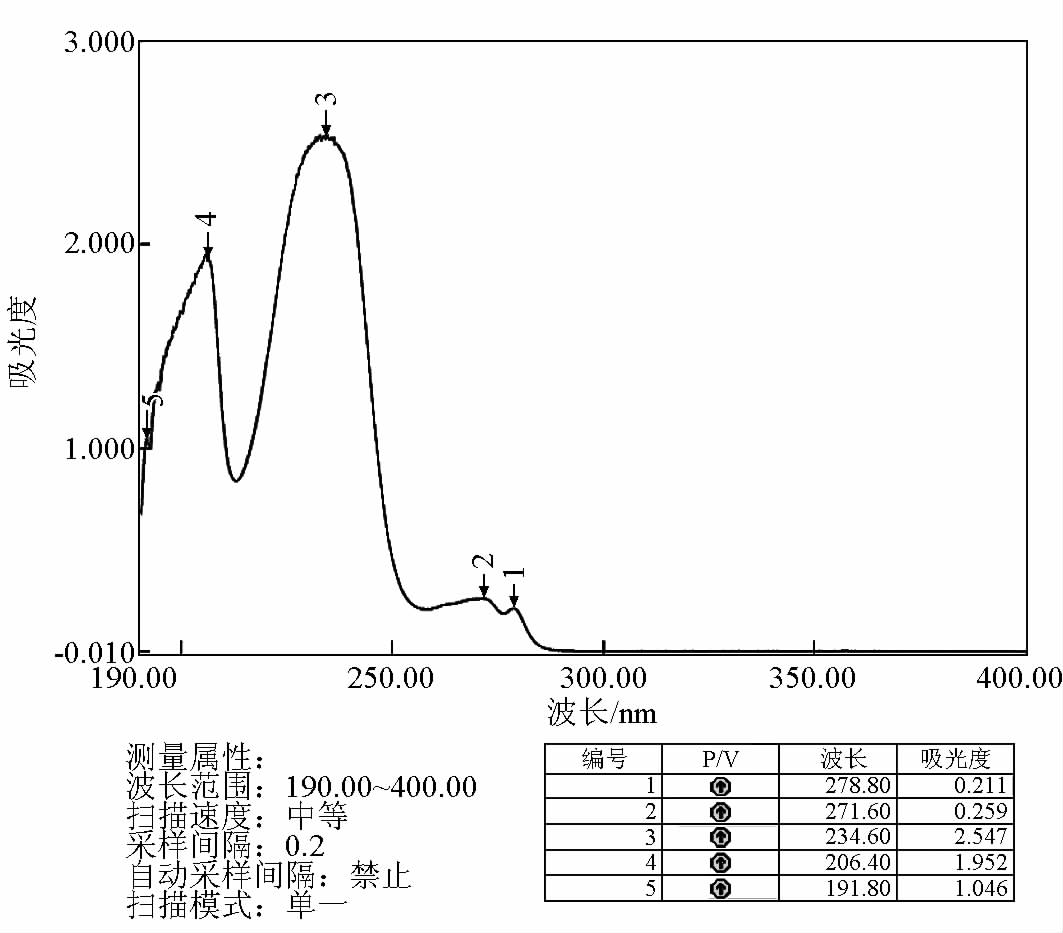
图1 紫外分光光度法测定 HBA 的吸收曲线
Fig.1 The absorption curve of HBA determinated by UV spectrophotometer
《图2》
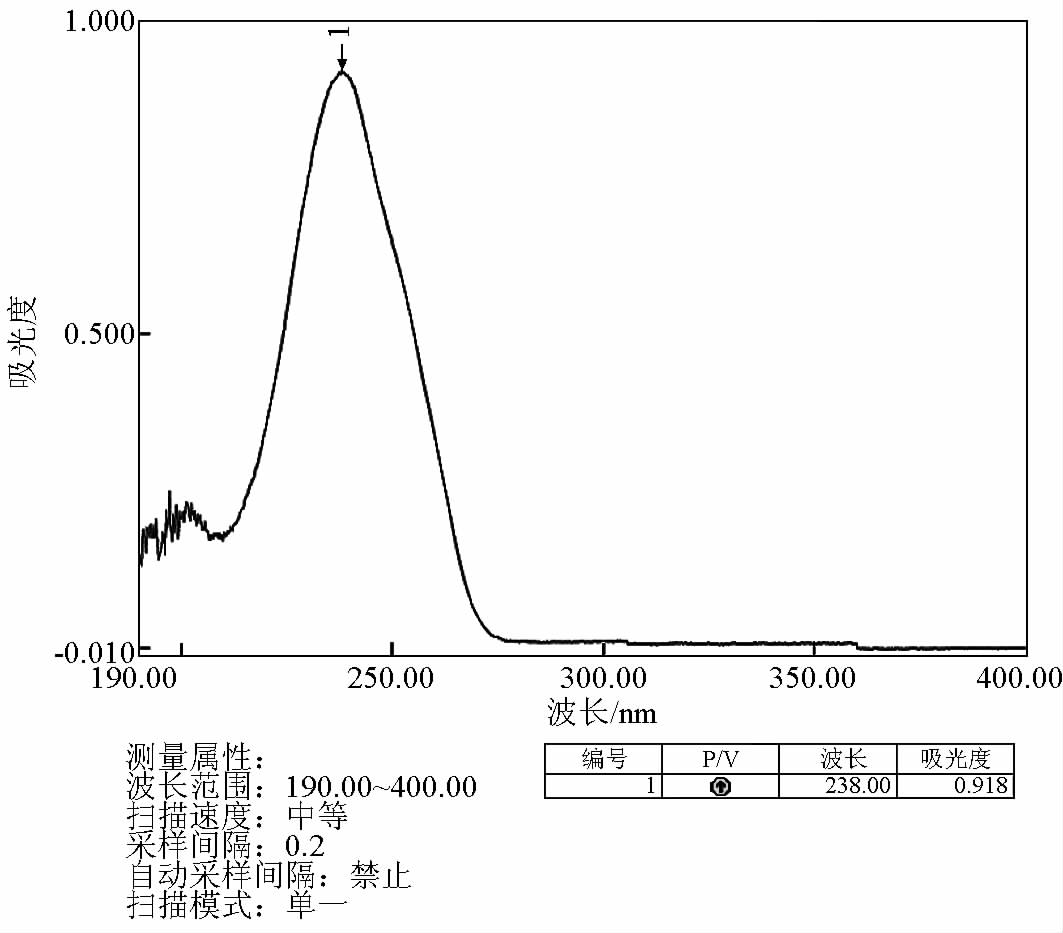
图2 紫外分光光度法测定 TBA 的吸收曲线
Fig.2 The absorption curve of TBA determinated by UV spectrophotometer
《图3》
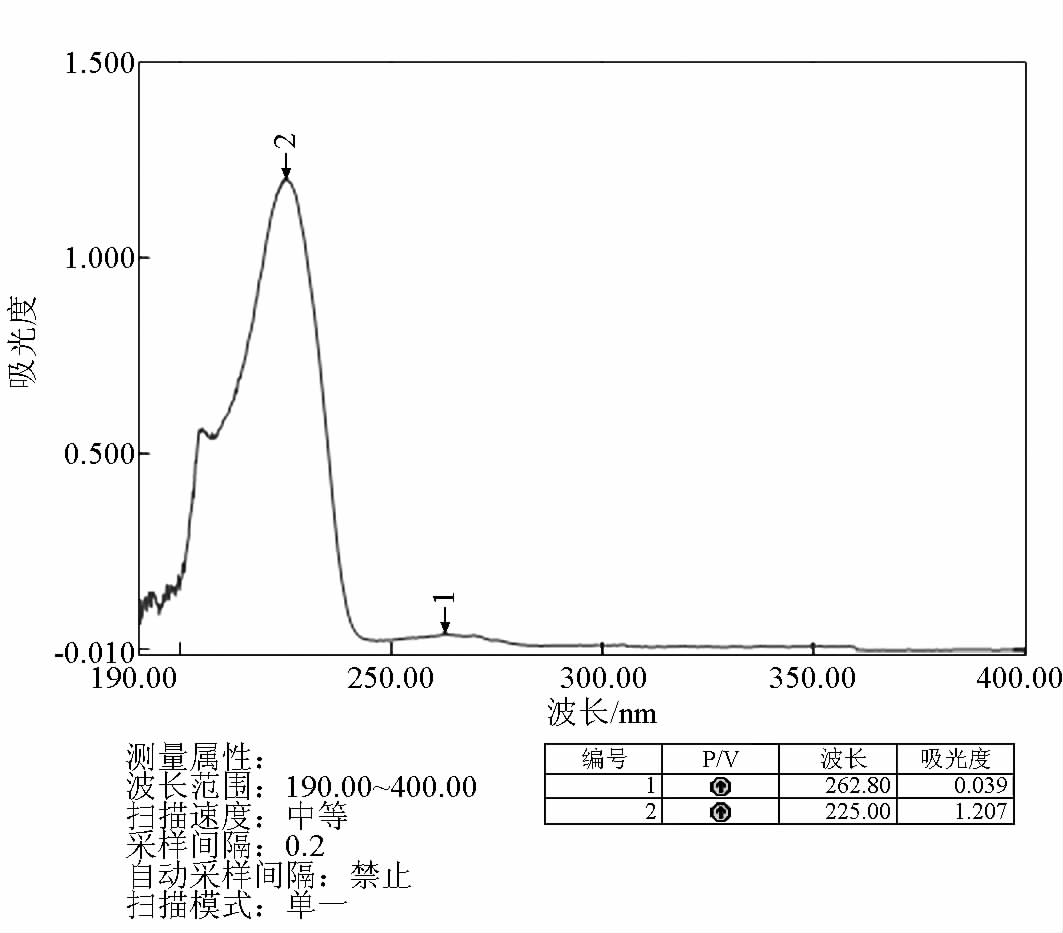
图3 紫外分光光度法测定 BBA 的吸收曲线
Fig.3 The absorption curve of BBA determinated by UV spectrophotometer
《3.4 HBA、TBA、BBA 色谱条件的选择》
3.4 HBA、TBA、BBA 色谱条件的选择
HBA 含量测定高效液相色谱 ( HPLC ) 法的色谱条件选择如下:色谱柱 AgilentHC—C18,甲醇∶水= 20∶80 为流动相,流速为 1.0 mL/min,紫外波长为234 nm,柱温为 28 ℃,进样量为 20 μL。在选定的色谱条件下,以 HBA 计算理论塔板数为 5 350,符合中国药典高效液相色谱分析方法的要求。
TBA 含量测定 HPLC 法的色谱条件选择如下:色谱柱 AgilentHC—C18,甲醇∶水=40∶60 为流动相,流速为 1.0 mL/min,紫外波长为 238 nm,柱温为 28 ℃,进样量为 20 μL。在选定的色谱条件下,以 TBA 计算理论塔板数为 2 581,符合中国药典高效液相色谱分析方法的要求。
BBA 含量测定 HPLC 法的色谱条件选择如下:色谱柱为 AgilentHC—C18,甲醇∶水=78∶22 为流动相,流速为 1.0 mL/min,紫外波长为 225 nm,柱温为 28 ℃,进样量为 20 μL。在选定的色谱条件下,以 BBA 计算理论塔板数为 3 315,符合中国药典高效液相色谱分析方法的要求。
《3.5 HBA、TBA、BBA 标准曲线的绘制》
3.5 HBA、TBA、BBA 标准曲线的绘制
精确称取 HBA 对照品 2.5 mg,置于 25 mL 容量瓶中,加蒸馏水溶解并稀释至刻度,摇匀,即得对照品溶液。精密量取对照品溶液 1.0 mL,分别置于 5、10、25、50、100 mL容量瓶中,加入甲醇稀释至刻度,摇匀。按上述色谱条件,每次进样 20 μL,记录数据。以峰面积(A)为纵坐标,以浓度(C, 1 μg/mL)为横坐标,进行回归计算,回归方程为 A = 96 060C - 3 310. 6,相关系数 r = 0. 999 9。结果表明,HBA 在 1 ~100 μg/mL 的浓度范围内具有良好的线性关系。
精确称取 TBA、BBA 对照品 2.5 mg,置于 25 mL 容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得对照品溶液。精密量取对照品溶液 1.0 mL,分别置 5、10、25、50、100 mL 容量瓶中,加入甲醇稀释至刻度,摇匀。按上述色谱条件,每次进样 20 μL,记录数据。以峰面积(A)为纵坐标,以浓度(C , 1 μg/mL)为横坐标,进行回归计算,回归方程分别 A = 108 018C - 158 413 、A = 86 782C - 20512,相关系数分别为 r = 0. 998 3、r = 0. 999 8。结果表明, TBA、BBA 在 1~100 μg/mL 的浓度范围内具有良好的线性关系。
《3.6 含量的测定》
3.6 含量的测定
精密吸取水化后 HBA、TBA、BBA 脂质体 0.5 mL,置于 5 mL 离心管 ( EP ) 管中,加入 0.1 mL triton—10 破乳,摇匀,作为供试液;并配制浓度为 10 μg/mL 的 HBA、TBA、BBA 作为对照品溶液,按外标法计算出供试品中 HBA、TBA、BBA 的含量。取上述溶液各 20 μL 进行分析,记录数据。含量按下式计算:含量 / (%) =脂质体中药物的量/总药量。
《3.7 包封率的测定》
3.7 包封率的测定
用高速离心法分离脂质体与游离药物。精密吸取 HBA、TBA、BBA 脂质体混悬液 0.5 mL,置于塑料小管中,8000 r/min 高速离心 20 min,取上清液进样测定,即得 0.5 mL 脂质体混悬液中游离药物(W游)。
精密吸取水化后 HBA、TBA、BBA 脂质体 0.5 mL,置于 5 mL EP 管中,加入 0.1 mL triton—10 破乳,摇匀,取样测定,即得 0.5 mL 脂质体混悬液中总药物量(W总 )。包封率=(W总 -W游 )/W总 × 100 %,测得 HBA、TBA、BBA 脂质体的包封率,见表 1。
《表1》
表1 同药脂比的脂质体 (n =3) 的平均含量及包封率
Table1 The average content and entrapment efficiency of liposomes with different drug to lipid ratio (n =3)

《4 结语》
4 结语
实验的目的是制备具有良好靶向性且包封率高的含硼脂质体,用于 BNCT 研究。磷脂分子形成脂质体时,两条疏水链指向双分子层内部,脂溶性药物可存在于其中;亲水基团在膜的内外两个表面上,磷脂双分子层构成一个封闭的小室,小室中水溶液被磷脂双分子层包围而独立,其中可容纳水溶性药物。这里所采用的含硼化合物 BBA,其分子量为 178. 12,具有良好的脂溶性,在将其制成脂质体的过程中,BBA 可存在于磷脂双分子层内部,获得较高的包封率。徐梁[9] 等将  和笼状物
和笼状物  分别包入脂质体,成功制备了胃癌免疫脂质体,为胃癌的硼中子俘获治疗提供了有效的治疗途径。脂质体作为药物载体的应用虽然具备了许多优点,但也存在一定的局限性,对于某些水溶性药物包封率较低,药物易从脂质体中渗漏,脂质体的稳定性差,均是脂质体工业化生产过程中亟待解决的问题。
分别包入脂质体,成功制备了胃癌免疫脂质体,为胃癌的硼中子俘获治疗提供了有效的治疗途径。脂质体作为药物载体的应用虽然具备了许多优点,但也存在一定的局限性,对于某些水溶性药物包封率较低,药物易从脂质体中渗漏,脂质体的稳定性差,均是脂质体工业化生产过程中亟待解决的问题。
许多肿瘤细胞(如乳腺癌细胞)的细胞膜表面都有一种特殊的蛋白质过度表达,这种蛋白质可特异地识别、结合叶酸,被称为叶酸受体(folate receptor,FR)。通过受体—配体特异性识别并结合,叶酸—药物载体通过内吞作用进入到这些肿瘤细胞,从而增强药物的靶向性[10] 。将 BBA 制备成叶酸靶向脂质体,但仍需进一步研究叶酸高表达的 MCF— 7 细胞对该靶向脂质体的摄取、内化及脂质体在细胞内的滞留与分布实验。实验成功制备了靶向硼脂质体,BBA叶酸靶向脂质体的包封率高达 94 %,为 BNCT 治疗乳腺癌提供了一种靶向给药途径。














 京公网安备 11010502051620号
京公网安备 11010502051620号




