《1 前言》
1 前言
氮化硅(Si3N4 )是一种完全致密的、高强度、高韧度的高级陶瓷材料,尤以其良好的高温性能得到广泛关注。高温下的Si3N4 具有高强度、高硬度、抗蠕变、抗氧化和抗热冲击等优良性能。合成氮化硅的主要途径有3种:金属级硅直接氮化法、四羧酸二酰亚胺合成法、碳热还原/氮化法。与其他两种合成方法相比,碳热还原/氮化法投入成本低、原材料无毒无害、尾气可循环利用、操作安全性高,使得关于此法的研究不断深入。
反应温度是影响碳热还原/氮化法合成氮化硅的主要因素之一。Ekelund 等[1] 通过对一氧化碳(CO)生成率的观察得出,在温度达到1 250 ℃时,二氧化硅(SiO2 )还原反应开始;当温度达到1 350 ℃时,SiO2 的还原速率达到最大。Liou等 [2] 报道了SiO2向Si3N4 转化(见反应式(1))的温度区间为1 350~1 475 ℃。当温度高于1 425 ℃时,SiO2 的转化率随温度的升高显著增大。他们认为这是由于在此温度区间,一氧化硅(SiO)生成的速度显著增加。这种解释与 Zhang 等[3] 提出的大量 SiO 在温度高于1 400 ℃以后生成的趋势一致。另外,Liou等 [2] 还发现在1 450 ℃时,SiO2 的还原速率在反应开始一段时间后降低。这是由于反应物表面被固相生成物覆盖,SiO2 的进一步的气-固相还原反应受到了阻碍。他们还指出,温度高于1 500 ℃以后碳化硅(SiC)将出现(见反应式(2)),并成为主要生成物。然而,Durham 等 [4] 研究发现,温度在 1 500~1 550 ℃时,SiO2 全部转化为α -Si3N4 ;当温度低于1 500 ℃时,仅有部分SiO2 转化为α -Si3N4 ,另一部分转化为Si2N2O;而β -SiC在温度高于1 600 ℃时才出现。

碳热还原/氮化法合成Si3N4 的临界温度一直是对此工艺研究的热点之一:在二氧化硅-碳-氮气的反应体系中,氮化硅的生成速率随着温度的升高而增大,直到温度高于一个临界值;随着温度继续升高,体系的产物则为SiC。从热力学角度分析,SiC在较高温度下比Si3N4 更稳定。Rahman等 [5] 指出,Si3N4 在 C 存在的较高温度反应体系中会转化为SiC。Licko等 [6] 对Si3N4 与SiC之间的转化进行热力学计算得出,在 1 个大气压的氮气气氛中 SiC 与Si3N4 之间达到平衡的温度为1 440 ℃,当温度高于这个边界值时Si3N4 开始向SiC转化。然而,文献报道的实验测得边界温度值并不一致,包括1 450 ℃ [7] 、1 500 ℃[8] 、1 510~1 550 ℃ [6] 、1 590 ℃ [9] 。
造成这些边界温度的差异的原因,可能来自于反应动力学差异 [7] 、反应系统中的杂质影响 [3,4,10~15] 、实验误差等。鉴于文献中温度对碳热还原/氮化法合成Si3N4 过程中相变影响的数据十分有限且存在分歧,现对该因素的影响做深入的研究。
《2 实验材料和方法》
2 实验材料和方法
实验采用非晶 SiO2 与石墨粉末按照 SiO2 ∶C=1∶4.5的摩尔比制成混合物。混合过程中添加质量分数为 0.3 %的分散剂。混合物装在模具中在20 kN的压力下压制成片。
碳热还原/氮化反应在氮气或氮气-氢气气氛中进行。气体流速通过 Brooks 质量流量计(Model 5850E,Brooks Instruments,Hatfield,PA)控制,出气中的CO、二氧化碳(CO2 )、甲烷(CH4 )浓度检测由红外 CO/CO2 /CH4 传感器(Advanced Optima Uras 14,ABB,Ladenburgh,德国)实现。程序升温实验中炉温以 3 ℃/min 的速度从1 300 ℃升到1 600 ℃,并在1 600 ℃下稳定1 h。连续监测并记录整个升温过程中的CO浓度。
反应后样品中的成分定性分析通过X射线衍射(Siemens D5000,Phillips X’pert Multipurpose X-Ray Diffraction System)完成。样品中氧和氮的含量由 LECO TC600 氮/氧分析仪测得,碳含量由LECO SC-444 DR 碳/硫分析仪测得。
SiO2 的还原率( )为还原的SiO2 中的氧占全部氧含量的百分比,氮化硅的生成率(
)为还原的SiO2 中的氧占全部氧含量的百分比,氮化硅的生成率( )为转化为Si3N4 的Si占全部硅含量的百分比,碳化硅的生成率(
)为转化为Si3N4 的Si占全部硅含量的百分比,碳化硅的生成率(  )为转化为 SiC 的 Si 占全部硅含量的百分比。样品反应前后的失重为重量差占初始重量的百分比。
)为转化为 SiC 的 Si 占全部硅含量的百分比。样品反应前后的失重为重量差占初始重量的百分比。
《3 结果与讨论》
3 结果与讨论
《3.1 程序升温下的碳热还原/氮化法合成氮化硅》
3.1 程序升温下的碳热还原/氮化法合成氮化硅
温度对碳热还原/碳化法合成氮化硅的影响通过程序升温过程获得初步分析。反应在氮气气氛中进行,气体流量为1 L/min。图1描述了程序升温过程中温度和出气中CO浓度随时间的变化情况。SiO2 的还原反应在温度达到 1 300 ℃之前已经开始。从1 300 ℃到1 450 ℃升温过程中,CO的产生率稳定在一个较低的水平;当温度高于1 450 ℃以后,CO产生率显著升高,说明SiO2 的还原率在此温度区间显著升高;当温度超过1 570 ℃以后,SiO2 的还原速率开始降低;反应温度在1 600 ℃下停留1 h,由于SiO2 逐渐耗尽,CO浓度下降。还原反应速率在温度高于1 570 ℃时降低是由于反应物表面被生产物覆盖,阻碍了内层反应物的进一步反应。这个反应现象与Liou等[2] 所观察到的结果一致。
《图1》
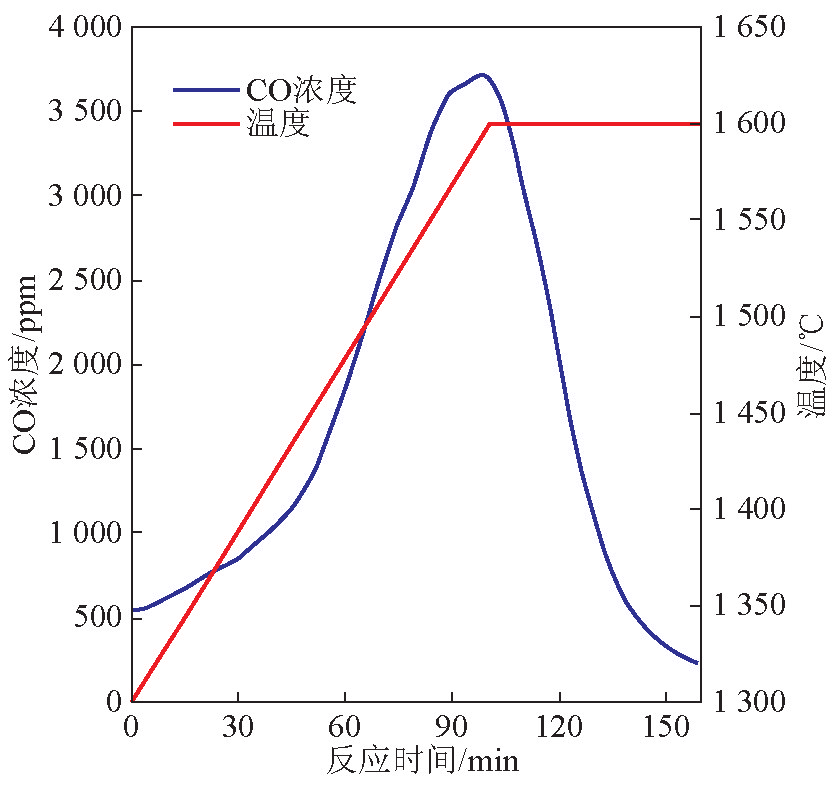
图1 二氧化硅的程序升温还原反应
Fig. 1 Temperature-programmed reduction of silica
注:1 ppm=10-6
《3.2 等温反应下的碳热还原/氮化法合成氮化硅》
3.2 等温反应下的碳热还原/氮化法合成氮化硅
温度对碳热还原/氮化法合成氮化硅的影响进一步分析通过等温反应实现。等温反应温度区间为1 425~1 500 ℃,反应在1个大气压下,N2 -H2 混合气氛(体积分数为10 %的H2 )中进行,气体流量为1 L /min。图2为不同温度下SiO2 的还原情况。与程序升温结果一致,SiO2 的还原速率随着温度升高而升高。当温度为1 425 ℃时,SiO2 完全转化的时间为7 h;温度在1 450 ℃时,SiO2 完全转化需要5 h;温度在1 475 ℃时,SiO2 完全转化时间为3 h;温度在1 500 ℃时,SiO2 完全转化时间为2 h。
《图2》
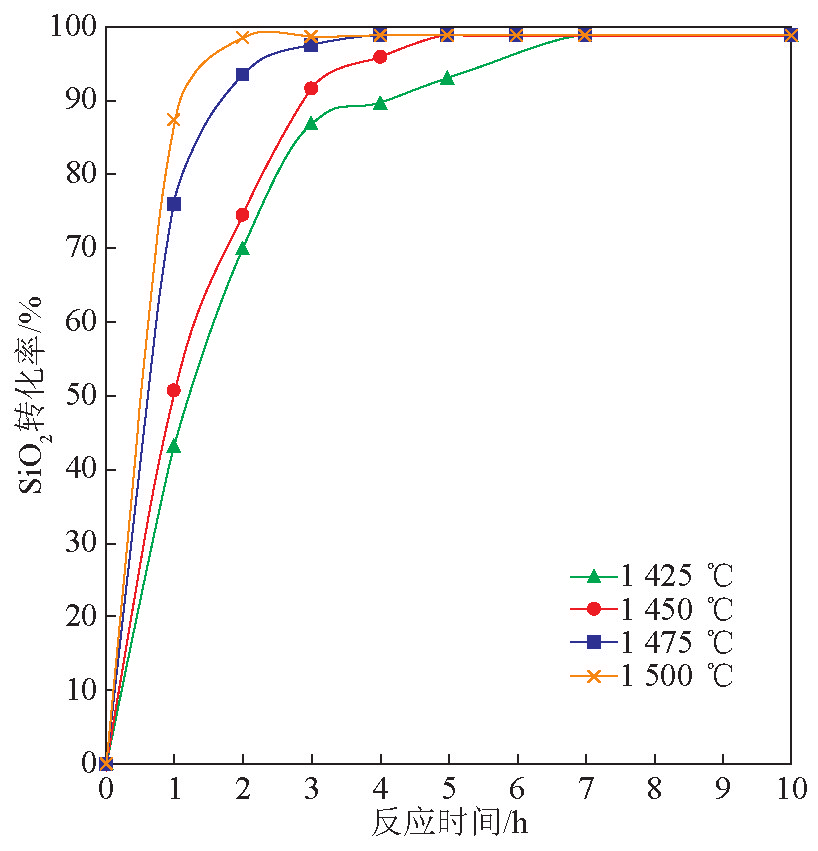
图2 温度对碳热还原/氮化反应中SiO2 转化率的影响
Fig. 2 Effect of temperature on SiO2 conversion rate in carbothermal reduction/nitridation
样品反应之前和不同温度下反应12 h后其中各相XRD分析结果见图3。反应前样品中非晶SiO2中混有少量晶体SiO2 。反应后的各个温度下的样品中主要是α -Si 3 N 4 、β -Si3N4 、β -SiC以及过量的石墨。生成的Si3N4 主要以α-Si3N4 形式存在。反应后碳峰(2θ = 26.50°)相对强度显著降低,碳的消耗主要来自于与氢气的反应。此外,还有可能是由于反应器不够致密,导致反应过程中少量空气进入反应器,其中的氧气使石墨消耗。同样的现象在空白实验中可见,空白实验中出气的CO浓度随着温度升高而升高。
《图3》

图3 不同温度下碳热还原/氮化反应后样品的XRD谱图
Fig. 3 XRD patterns of samples reacted at various temperatures
反应后样品的成分和重量损失如表1所示。根据反应式(1),当摩尔比C∶SiO = 4.5时,SiO2 完全转化为Si3N4 的失重理论值为32.7 %;根据反应式(2)同样的反应物完全转化为 SiC 的理论失重值为49.1 %。表1中实测不同温度下失重值均大于理论值,这是由于反应过程中部分气体生成物SiO、CO、CO2 、CH4 被气体带出反应器。表 1 中随温度从1 400 ℃升高到1 550 ℃,SiO损失( )从19.3 %升高到了28.6 %。碳含量(质量百分数)随温度升高而降低,这与图3中2θ= 26.50°处碳峰相对强度随温度升高显著降低的结果一致。
)从19.3 %升高到了28.6 %。碳含量(质量百分数)随温度升高而降低,这与图3中2θ= 26.50°处碳峰相对强度随温度升高显著降低的结果一致。
《表1》
表1 温度对碳热还原/氮化反应产物组分的影响
Table 1 Effect of temperature on the composition of product in carbothermal reduction/nitridation

经过12 h反应,各个温度下SiO2 的转化率接近100 %。各样品中氧的残余(小于质量分数0.7 %)来自于残余的SiO2 ,也可能来自于反应结束后样品从反应器中被取出时与空气中氧气的接触。
氮元素含量(N wt%)随着温度升高从22.8 %增大到31.7 %。然而,温度从1 400 ℃升到1 450 ℃,Si3N4 的生成率(  )从62.7 %增加到68.0 %;当温度高于1 450 ℃,
)从62.7 %增加到68.0 %;当温度高于1 450 ℃,  开始降低。
开始降低。  与氮元素含量趋势不一致主要是因为不同温度下反应前后样品失重情况各异造成样品总重量的变化。SiC在1 400 ℃下的生成率为16.9 %,图3中35.63°(2θ)处可观察到相对强度较高的β -SiC峰。SiC的生成率与Si3N4 相反,在1 450 ℃达到最低值后随着温度升高而增加。
与氮元素含量趋势不一致主要是因为不同温度下反应前后样品失重情况各异造成样品总重量的变化。SiC在1 400 ℃下的生成率为16.9 %,图3中35.63°(2θ)处可观察到相对强度较高的β -SiC峰。SiC的生成率与Si3N4 相反,在1 450 ℃达到最低值后随着温度升高而增加。
表1与图3中的结果与文献中关于边界温度的报道不一致。SiC 在 1 400 ℃下的生成率达到16.9 %,几乎与其在1 550 ℃下的生成率相等;而在1 550 ℃下仍有54.3 %的Si转化为Si3N4 。在当前的反应体系中,边界温度不明显;SiC的生成不可避免。根据热力学数据计算得反应温度区间内反应式(1)和反应式(2)的CO平衡分压对比见图4,由于反应在1个标准大气压下进行且气体中含10 vol%的氢气,所以反应式(1)的CO平衡分压计算中氮气的平衡分压取 0.9 个标准大气压。由图 4 可知,1 400 ℃时合成Si3N4 的平衡分压  仅比合成SiC的平衡分压
仅比合成SiC的平衡分压  高0.031 3个标准大气压,而在通常被认为是边界温度的1 450 ℃,
高0.031 3个标准大气压,而在通常被认为是边界温度的1 450 ℃, 较
较  仅高出0.028 1个标准大气压。在1 550 ℃下,尽管
仅高出0.028 1个标准大气压。在1 550 ℃下,尽管  =0.989 个标准大气压,比
=0.989 个标准大气压,比  =1.46 个标准大气压低,但生成Si3N4 的趋势仍很强。这里需要明确的是常压反应中的气体平衡分压不高于1个标准大气压,计算所得高于1个标准大气压的CO平衡分压从热 力 学 角 度 说 明 其 具 有 显 著 的 反 应 趋 势 。因 此 ,图 4对Si3N4 和SiC合成反应中CO平衡分压的对比解释了在1 400~1 550 ℃临界温度的不明显。
=1.46 个标准大气压低,但生成Si3N4 的趋势仍很强。这里需要明确的是常压反应中的气体平衡分压不高于1个标准大气压,计算所得高于1个标准大气压的CO平衡分压从热 力 学 角 度 说 明 其 具 有 显 著 的 反 应 趋 势 。因 此 ,图 4对Si3N4 和SiC合成反应中CO平衡分压的对比解释了在1 400~1 550 ℃临界温度的不明显。
《图4》
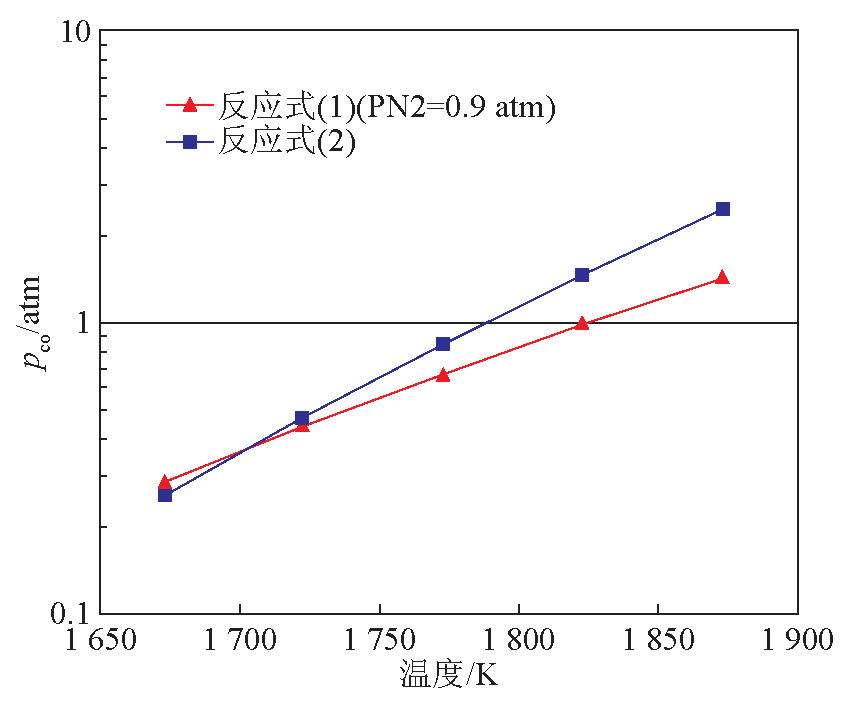
图4 氮化硅合成反应(反应式(1))和碳化硅合成反应(反应式(2))中CO平衡分压 [16]
Fig. 4 Equilibrium CO partial pressures vs. temperature in formation of Si3N4 (reaction (1)) and SiC (reaction (2)) [16]
注:1 atm≈101 kPa
SiO2 -C-N2 反应体系中边界温度不明显,SiC的合成在碳热还原/氮化法合成氮化硅的过程中不可避免。由此,需要通过进一步研究探索反应机理,优化温度及其他反应动力学参数提高 Si3N4 的选择性。
《4 结语》
4 结语
温度对碳热还原/氮化法合成氮化硅的影响总结如下。
1)SiO2 还原反应在1 300 ℃以下开始,速率随温度升高增大。
2)温度高于1 570 ℃时,速率因反应物表面被生成物覆盖而降低。
3)SiO2 -C-N2 反应体系中,由于合成Si3N4 和SiC的反应还原产物 CO 平衡分压差别小,选择生成Si3N4 或SiC的临界温度不明显。














 京公网安备 11010502051620号
京公网安备 11010502051620号




