新种的形成具有两种方式, 一是渐变式, 一是爆发式。渐变式是一种常见的新种形成方式, 但是这种方式需要很长很长的时间。爆发式主要指通过染色体加倍后形成新种
《1 鲫鲤F3-F10四倍体性的遗传学特性和四倍体性的证据》
1 鲫鲤F3-F10四倍体性的遗传学特性和四倍体性的证据
湘江野鲤 (Cyprinus carpio L) 和红鲫 (Carassius auratus red var.) 都是二倍体 (图1) 。红鲫的体色为红色, 无须;湘江野鲤的体色为灰色, 具有一对明显的吻须和一对明显的颌须。鲫鲤F1由红鲫 (♀) 和湘江野鲤 (♂) 杂交形成, 在F1中, 发现4.7%的雄性和44.3%的雌性是可育的
《图1》

Fig.1 The chromosomes of the diploid red crucian carp (2n=100) , bar=3 μm
鲫鲤F1-F2的体色为灰色, 其外形介于红鲫与湘江野鲤之间, 其两对须比湘江野鲤的须短;鲫鲤F3-F10的体色为灰色, 其外形相似于鲫鲤F1-F2, 但也显示一些差异, 如鲫鲤F3-F10的两对须比鲫鲤F1-F2更加退化, 一般肉眼观察不易发觉, 仅仅剩下须的基部。鲫鲤F3-F10的生长速度明显比F1-F2要慢。红鲫的脊椎骨的数目为28~29, 湘江野鲤的脊椎骨的数目为36~37, F3-F10的脊椎骨的数目介于它们的原始父母本之间, 为33~34;红鲫的侧线鳞数目为29, 湘江野鲤的侧线鳞数目为36~37, 鲫鲤F3-F10的侧线鳞数目位于它们两者之间, 为31~32;红鲫的下咽齿为1行, 湘江野鲤的下咽齿为3行, 鲫鲤F3-F10 的下咽齿介于两者之间为2行。
通过肾细胞直接制片法和淋巴细胞体外培养方法检测染色体数目和组型, 证明鲫鲤F3-F10的染色体数目为4n=200 (图2) , 组型为44m+68sm+44st+44;鲫鲤F1和 F2的染色体数目为2n=100, 组型为22m+34sm+22st+22t, 它们的原始亲本-红鲫和湘江野鲤是二倍体 (2n=100) , 其染色体组型也为 22m+34sm+22st+22t。日本白鲫的染色体数目为2n=100。用鲫鲤F3-F10为父本, 分别与作为母本的日本白鲫 (Carassius auratus cuvieri T. et S.) 和兴国红鲤 (Cyprinus carpio red var.) 等鲤鱼交配, 制备了鲫鱼型的三倍体-湘云鲫和鲤鱼型的三倍体-湘云鲤。湘云鲫 (图3) 和湘云鲤 (图4) 的染色体数目为3n=150
《图2》

图2异源四倍体鲫鲤染色体 (4n=200) , 短棒=3 μm
Fig.2 The chromosomes of the allotetraploid hybrid (4n=200) , bar=3 μm
《图3》

图3三倍体湘云鲫染色体 (3n=150) , 短棒=3 μm
Fig.3 The chromosomes of the triploid crucian carp (3n=150) , bar=3 μm
在四倍体鲫鲤精巢的染色体制片中, 处于第一次减数分裂中期的二价体的数目为100;在三倍体湘云鲫的精巢染色体制片中, 处于第一次减数分裂的二价体的染色体数目为50, 另有50个没有配对的单价体
流式细胞仪 (Cell Counter Analysis CCA-II) 检测红细胞的DNA含量表明四倍体鲫鲤的DNA含量分别是日本白鲫和湘云鲫的2倍和1.5倍, 肌肉的DNA含量分析也表明四倍体鲫鲤的DNA含量是日本白鲫的两倍
红细胞核大小的测量表明四倍体鲫鲤的红细胞核的体积分别为日本白鲫和湘云鲫的2倍和1.5倍
染色体数目、组型、DNA含量、红细胞核的大小等方面的实验结果一致验证了鲫鲤F3-F10的四倍体性 (4n=200) , 以鲫鲤F3-F10为父本分别与二倍体日本白鲫 (2n=100) 和鲤鱼 (2n=100) 交配产生的湘云鲫和湘云鲤的染色体数目分别都是3n=150, 反过来也证明了鲫鲤F3-F10的四倍体性。而湘江野鲤、红鲫、日本白鲫以及鲫鲤F1-F2都是二倍体 (2n=100) 。在鲤鱼中, 我们发现第一对两条亚中部染色体 (也是最长的染色体) 的长臂和短臂之比明显大于红鲫中第一对两条亚中部染色体的长臂和短臂之比。在鲫鲤F2的第一对两条亚中部染色体中, 一条染色体的长臂与短臂之比明显大于另一条, 前者来源于鲤鱼, 后者来源于红鲫;在鲫鲤F8中, 第一号四条亚中部染色体中, 有两条染色体的长臂与短臂之比明显大于另外两条, 前两条是来源鲤鱼, 后两条来源于红鲫, 这为证明鲫鲤四倍体是异源四倍体而不是同源染色体提供了证据
《2 鲫鲤四倍体鱼的生殖特性》
2 鲫鲤四倍体鱼的生殖特性
鲫鲤F3-F10生殖腺具有正常的发育过程, 在繁殖季节卵巢内具有大量充满卵黄的成熟卵子和一些体积较小的I时相和II时相初级卵母细胞, 用手挤鱼的腹部, 有成熟的卵子流出;卵子 (直径为0.17 cm) 的体积明显比日本白鲫 (直径为0.14 cm) 和红鲫 (直径为0.13 cm) 的要大。在繁殖季节, 用手挤雄性四倍体鲫鲤鱼的腹部, 有白色的成熟精液流出。其精巢内布满许多精巢小叶, 小叶中可见精原细胞、精子细胞和成熟的精子;精原细胞的旁边有支持细胞, 支持细胞的细胞质内可见明显的可能与激素合成有关的颗粒物质。四倍体鲫鲤产生的二倍体精子头部直径为2.40 μm, 而湘江野鲤和散鳞镜鲤产生的单倍体精子头部直径为1.90 μm, 前者的体积为后者的两倍。在透射电镜下观察, 二倍体精子和单倍体精子的结构基本相似, 两者都是由头部和尾部组成, 头部为圆形或椭圆型, 其内充满致密的核物质;尾部的前段部位有多个线粒体, 尾部的中央轴丝具有典型的9+2微管纤维结构。
异源四倍体鲫鲤产生的成熟卵子和精子结合后, 有正常的受精过程并且是单精受精, 胚胎有正常的胚胎发育过程。在21℃左右的水温情况下, 受精卵发育约80 h后脱膜。脱膜后的胚胎能发育为存活的后代
《3 四倍体鱼产生的原理》
3 四倍体鱼产生的原理
鲫鲤F2产出大、中、小直径分别为0.2、0.17、0.13 cm三种规格的卵子, 它们占的比例分别为50%, 35.9%, 和14.1%, 其中直径为0.17 cm的卵子与四倍体鲫鲤鱼产生的二倍体卵子的直径大小相等, 说明它们是二倍体卵子;直径为 0.13 cm的卵子与红鲫和日本白鲫产生的卵子的直径大小相近, 说明它们是单倍体。这两种卵子与鲫鲤F2产生的精液受精后能产生存活的个体;直径为 0.2 cm卵子与鲫鲤F2的精液受精后, 不能产生存活的个体。推测这种卵子为非整倍体。非整倍体配子是不能存活的
通过扫描电镜观察, 鲫鲤F2挤出的精液中主要是二倍体精子和单倍体精子, 其中二倍体精子占有48.75%, 还具有少量的非整倍体、四倍体及八倍体的精子
实验结果证明鲤鲫F2是二倍体 (2n=100) , 异源四倍体鲤鲫是从鲤鲫F3开始的。那么它们是怎样产生的?Cherfas等
《图5》
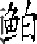
我们发现挤出的鲤鲫F2精液中有48.75%的二倍体精子, 挤出的卵子中有35.9%的二倍体卵子, 这两种二倍体配子受精就可产生四倍体。在鲫鲤F2的精巢中发现有具有两个核的精子细胞, 也为鲫鲤F2能产生二倍体配子提供了证据。我们把雄性四倍体鲫鲤产生的精液 (含二倍体精子) 与雌性鲫鲤F2卵子受精, 在后代中得到了四倍体 (4n=200) ;把二倍体雄性红鲫精液 (含单倍体精子) 与雌性鲫鲤F2的卵子受精, 在后代中获得了三倍体 (3n=150) 。这两个交配实验也说明二倍体鲫鲤F2能产生二倍体卵子。在鲤鲫F3中存在着雌雄都能育的四倍体个体, 它们自交产生四倍体后代, 使得四倍体鱼能代代相传, 并形成了一个稳定的四倍体鱼群体。由于在鲤鲫F2产生的卵子和精子都存在着多态性, 从理论上讲, 在F3中, 除能形成四倍体鱼外, 应当还能形成其它的如二倍体、三倍体、六倍体和其它倍性的鱼, 因此今后还有待对F3中的个体进行更全面的研究, 看是否存在其它有价值的多倍体鱼。
Cherfas等
从理论上讲, 如果卵子的第二次减数分裂过程受抑制导致第二极体不能排出, 也可以产生二倍体的配子。但是经过对F2产生的卵子和精子的受精细胞学过程观察, 证实有第二极体的排出。该现象支持了核内复制的学说。我们认为在本研究中第一极体或第二极体的抑制使配子的染色体加倍的可能性不大, 其原因还在于:不同体积的卵子出现在F2产生的卵子中。经过一次或多次的核内复制后, 早期卵母细胞的体积会明显增大, 不但DNA的含量增加, 而且细胞质内的内含物如卵黄也会增加, 最终使得整个卵子的体积增大。如果是第一或第二极体的抑制造成二倍体卵子的产生, 这样的二倍体卵子的体积应当不会有明显的增加。第一、第二极体抑制时, 其细胞质内的内含物包括卵黄都不会有明显的增加。第一极体或第二极体的保留, 对卵子的体积变化不会很明显。
我们认为这种特殊的二倍体配子的产生是与生殖腺中的内分泌调控受内外源激素的影响而发生改变, 造成生殖细胞发育出现紊乱有关。鲤鲫F2属于远缘杂交的后代, 它们的同源染色体的不协调性有可能造成生殖腺中内分泌调控发生改变使得有些生殖细胞的发育出现非正常的现象, 这些生殖细胞有可能在发育的早期进行核内复制从而导致二倍体及多倍体配子的产生。我们
《4 线粒体DNA的限制性内切酶分析》
4 线粒体DNA的限制性内切酶分析
通过九种限制性内切酶的酶切分析
表1四倍体鲫鲤 (F8) 、湘云鲫、红鲫、湘江野鲤、日本白鲫的遗传距离
Table 1 The genetic distance between each two kinds of fishes among tetraploid F8 hybrid, triploid crucian carp, red crucian carp, common carp and Japanese crucian carp
《表1》
| 红鲫 | 湘江野鲤 | 日本白鲫 | 湘云鲫 | |
四倍体鲫鲤 (F8) |
0.69 | 13.85 | 2.62 | 1.78 |
红鲫 |
14.32 | 1.63 | 0.91 | |
湘江野鲤 |
9.60 | 9.60 | ||
日本白鲫 |
0.62 |
从表1可知, 最大的遗传距离表现在红鲫与湘江野鲤之间, 这与这两种鱼在分类上分别属于不同的属 (分别属于鲫属和鲤属) 而表现出较远的亲缘关系是一致的。最小的遗传距离表现在湘云鲫和日本白鲫之间, 因为日本白鲫是湘云鲫的母本, 所以该结果是符合情理的。第二小的遗传距离表现在四倍体鲫鲤与红鲫之间, 这说明四倍体鲫鲤在线粒体遗传上是偏向于其原始母本——红鲫。这与线粒体的母系遗传的一般规律相一致。相反, 四倍体与其原始父本之间的遗传距离是第二大的。虽然四倍体鲫鲤与红鲫之间的遗传距离较小, 但是从线粒体的酶切位点来看, 它们之间还是存在差异, 说明在mtDNA结构上已发生了变化, 这为四倍体鲫鲤将发展成为作为一个新的四倍体新种在细胞质的遗传物质方面提供了证据。
《5 鲫鲤F3-F10的性别遗传机制》
5 鲫鲤F3-F10的性别遗传机制
关于四倍体鲫鲤的性别决定机制是一个非常有意义的话题, 目前我们正在用性反转结合雌核发育的方法对异源四倍体鲫鲤的性别遗传机制开展研究, 不久可以得到实验结果。如果异源四倍体鲫鲤的性别遗传机制为XXXX (♀) -XXYY (♂) , 从理论上讲, 雄性四倍体鱼最大有可能产生三种比例分别为XX∶4XY∶YY的精子, 但是实际上, XY的精子是否能产生?这种精子与XX的卵子结合产生的XXXY个体是否能存活?这些还待实验来证明。如果XXXY雄性个体存在, 它会打破雌性 (XXXX) 与雄性 (XXYY) 的1∶1的比例。在四倍体鲫鲤的第一次减数分裂的中期发现二价体数目为100, 该现象进一步验证了四倍体鲫鲤的体细胞染色体数目为4n=200, 另一方面也说明在减数分裂过程中, 同源染色体是两两配对, 而不是其它的形式。在随机检测的3225尾F10中, 有雄性1020尾, 雌性2102尾。雌性比雄性略多, 它们是否形成一定的固定遗传比例关系, 还有待今后作更全面的检测。
《6 鲫鲤F3-F10四倍体群体有可能形成一个新种》
6 鲫鲤F3-F10四倍体群体有可能形成一个新种
鲫鲤F3-F10与其原始父母本红鲫和湘江野鲤之间存在的主要差异总结于表2中。
Table 2 The main differences among the tetraploid hybrid, common carp and red crucian carp
《表2》
特性/鱼名 |
湘江野鲤 | 四倍体鲫鲤 | 红鲫 |
染色体数目 |
100 | 200 | 100 |
DNA含量 |
2n | 4n | 2n |
配子倍性 |
n | 2n | n |
侧线鳞数目 |
36, 37 | 31, 32 | 29 |
脊椎骨数目 |
36, 37 | 33, 34 | 28, 29 |
须的形态和数目 |
两对明显的须 | 只有须的 基部, 不明显 |
无须 |
体型和体色 |
体型修长, 灰色 | 两者之间, 灰色 | 体型圆短, 红色 |
下咽齿 |
3行 | 2行 | 1行 |
Otto
作为一个新种, 不但在表型上要有变化, 更主要的是在遗传基础物质上要发生根本的变化。鲫鲤F3-F10的染色体数目加倍为200, DNA含量为二倍体鱼 (日本白鲫等) 的两倍, 产生的是二倍体配子, 这些都说明其遗传物质已发生了根本变化;在表型上, 鲫鲤F3-F10与鲫鲤F1-F2及它们的原始父母本也产生了明显的变化, 如在脊椎骨、侧线鳞、下咽齿特征上等都发生了明显的变化。上述事实都说明鲫鲤F3-F10在遗传本质、外形特征等生物学特性方面都发生了质的变化, 为形成一个新种奠定了基础。
作为一个新的物种, 它应具备能够繁殖后代使得本种能够世世代代维持下去并形成较大规模的群体数量的能力。从异源四倍体鲫鲤性腺的显微和亚显微细胞学结构来看, 它们的精巢和卵巢都具有正常的发育过程, 能产生具有正常生殖功能的成熟二倍体精子和卵子。配子的二倍体性通过其父母本的四倍体性、配子的大小、与单倍体配子结合产生的三倍体个体的实验结果得到验证。目前我们已经繁殖了九代异源四倍体鲫鲤鱼 (F3-F11) , 其数量已超过5万尾, 从生产能力来讲, 生产几十万甚至几百万异源四倍体鲫鲤都没有问题, 只是受养殖的场地限制和防盗的安全性出发, 我们控制了一定数目而又充分保证传代和生产需要所需的数目。
作为一个新的物种, 它应当与其它种有生育 (生殖) 隔离的关系。在遗传学教材
总之, 异源四倍体鲫鲤在遗传特性 (染色体的加倍) 、生物学结构、可繁殖传代性、生育隔离等方面为将来形成一个新种奠定了基础。但是它们最终是否能成为一个新种, 还需把它们放置于自然环境中养殖, 看它们是否能在自然环境中生存和繁衍?目前, 异源四倍体鲫鲤鱼还是在人工控制下进行养殖。从目前的情况来看, 它们在自然界中生存和繁衍的可能性是很大的, 但这方面还需进行进一步的实验。
在植物中通过远源杂交来形成多倍体新种的例子已有报道
《7 四倍体化在生物进化上的意义》
7 四倍体化在生物进化上的意义
Ohno
染色体加倍后, 基因即增多。基因的增多为基因的变异和新基因的产生提供了基础。Muller
《8 异源四倍体鲫鲤的应用价值》
8 异源四倍体鲫鲤的应用价值
异源四倍体鲫鲤群体的形成填补了国内外在脊椎动物中没有发现直接形成异源四倍体群体的空白。研制异源四倍体鲫鲤在生产上的主要目的是为了制备不育三倍体鱼。不育三倍体鱼因其性腺不发育或发育不良, 有可能使得发育到性腺部位的能量转化到生长方面。三倍体湘云鲫 (鲤) 因其不育性不会出现一般二倍体鱼达到性成熟后生长速度变慢的现象。三倍体湘云鲫具有三种类型的性腺结构, 即卵巢型、精巢型和脂肪型, 它们都是不育的
三倍体湘云鲫和三倍体湘云鲤在生长速度、体型、肉质等方面已经显示了其优良的特点
无论在封闭式的池塘还是在开放式的江河、湖泊中放养湘云鲫和湘云鲤, 由于它们的不育性使得它们不会与任何鱼交配产生后代, 因而它们不会干扰自然界中的种质资源。不育三倍体鱼也是转基因鱼的理想载体, 它可以解决转基因鱼的生态安全问题。
有趣的是四倍体鲫鲤本身在生长速度方面并没有优势, 为了加快异源四倍体的生长速度, 我们与中国科学院水生生物研究所的朱作言领导的科研小组, 在转基因四倍体鱼方面开展了合作, 把草鱼的生长激素基因注射到异源四倍体鲫鲤的受精卵中获得了比对照组快3.1倍的转基因异源四倍体鲫鲤鱼
《注释》
注释
1 何晓晓.四倍体基因库及三倍体湘云鲫、湘云鲤染色体研究. 湖南师范大学硕士论文, 1999














 京公网安备 11010502051620号
京公网安备 11010502051620号




